第三章 第二节 醇 酚 第1课时--人教版高中化学选择性必修第三册教学课件(共24张PPT)
文档属性
| 名称 | 第三章 第二节 醇 酚 第1课时--人教版高中化学选择性必修第三册教学课件(共24张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 829.5KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-08 09:10:15 | ||
图片预览





文档简介
(共24张PPT)
第1课时 醇
第二节 醇 酚
化学
1.掌握醇的结构特征,认识醇的官能团与其性质之间的关系。通过实验探究,证实产物和反应机理。
2.掌握醇的化学性质,建立“结构决定性质,性质决定用途”的基本观念,形成基于官能团、化学键与反应类型认识有机化合物的一般思路。
3.感受醇的用途,学会从化学的视角认识生活,理解化学科学在合成分子和创造物质方面做出的贡献。
学习目标
重点:
乙醇的结构与性质的关系,认识乙醇的取代反应、消去反应、氧化反应。
难点:
乙醇的结构和重要性质。
学习重难点
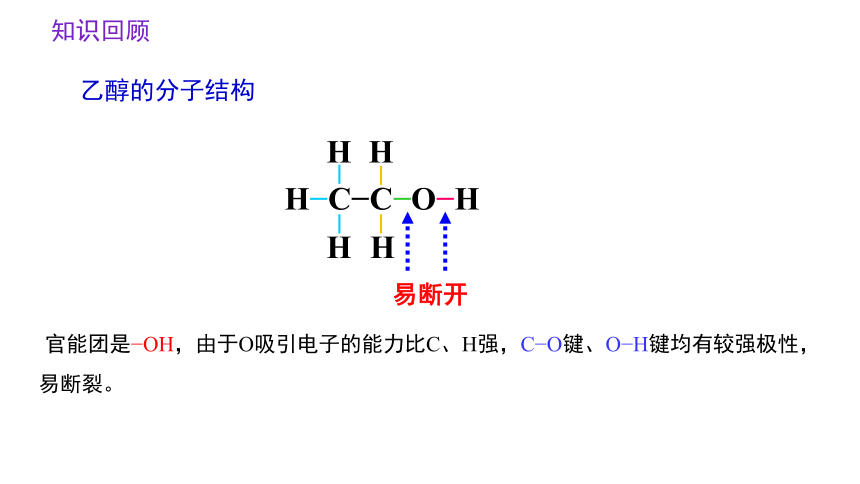
乙醇的分子结构
H C C O H
H
H
H
H
官能团是 OH,由于O吸引电子的能力比C、H强,C O键、O H键均有较强极性,易断裂。
易断开
知识回顾
2CH3CH2OH + 2Na 2CH3CH2ONa + H2↑
现象:先沉后浮,不熔、不游、不响,反应缓慢
思考:
1.乙醇是不是电解质?乙醇羟基上的氢原子与水中的氢原子相比,哪个更活泼?
2.写出乙二醇与金属钠反应的化学方程式。
乙醇的化学性质
知识回顾
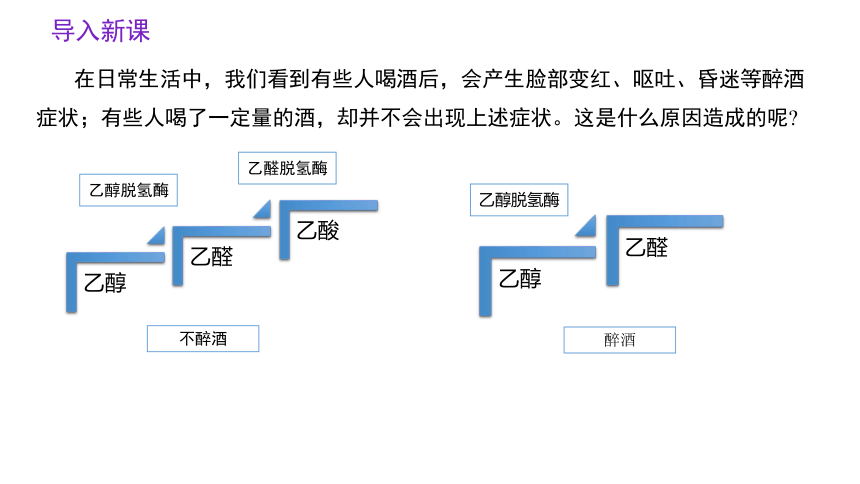
在日常生活中,我们看到有些人喝酒后,会产生脸部变红、呕吐、昏迷等醉酒症状;有些人喝了一定量的酒,却并不会出现上述症状。这是什么原因造成的呢
乙醛脱氢酶
乙醇脱氢酶
醉酒
乙醇脱氢酶
不醉酒
导入新课
课堂探究
环节一:认识醇及其物理性质
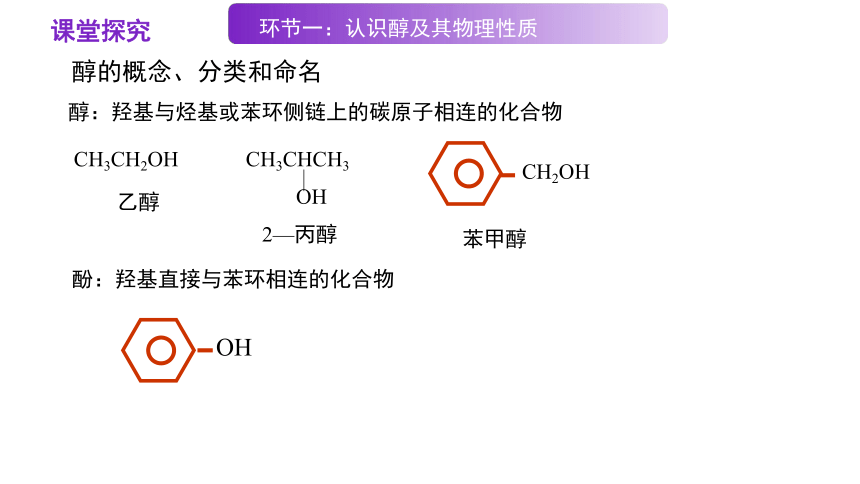
【问题1-1】根据羟基连接的碳原子的种类对下列物质进行分类。
CH3CH2OH
乙醇
醇:羟基与烃基或苯环侧链上的碳原子相连的化合物
CH3CH2OH
CH3CHCH3
OH
乙醇
2—丙醇
CH2OH
苯甲醇
酚:羟基直接与苯环相连的化合物
OH
课堂探究
醇的概念、分类和命名
环节一:认识醇及其物理性质
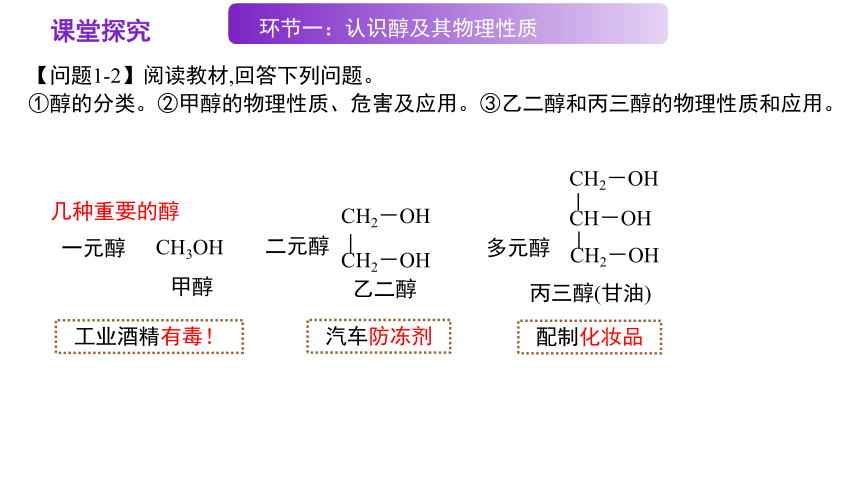
几种重要的醇
乙二醇
CH2-OH
CH2-OH
CH2-OH
CH-OH
CH2-OH
丙三醇(甘油)
一元醇
二元醇
多元醇
CH3OH
甲醇
工业酒精有毒!
汽车防冻剂
配制化妆品
课堂探究
【问题1-2】阅读教材,回答下列问题。
①醇的分类。②甲醇的物理性质、危害及应用。③乙二醇和丙三醇的物理性质和应用。
环节一:认识醇及其物理性质
甲醇(CH3OH)是无色、具有挥发性的液体,易溶于水,沸点为65℃。
甲醇有毒,误服会损伤视神经,甚至致人死亡。甲醇广泛应用于化工生产,也可作为车用燃料。
乙二醇和丙三醇都是无色、黏稠的液体,都易溶于水和乙醇,是重要的化工原料。
环节一:认识醇及其物理性质
课堂探究
【问题1-2】阅读教材,回答下列问题。
①醇的分类。②甲醇的物理性质、危害及应用。③乙二醇和丙三醇的物理性质和应用。
课堂探究
【问题1-3】饱和链状一元醇的通式。
CnH2n+1OH或CnH2n+2O
【问题1-4】以几种醇的熔点和沸点为例(见下表),同时结合烷烃的物理性质的变化规律,总结醇的物理性质,并分析原因。
名称 结构简式 相对分子质量 沸点/℃
甲醇 CH3OH 32 65
乙烷 CH3CH3 30 -89
乙醇 CH3CH2OH 46 78
丙烷 CH3CH2CH3 44 -42
正丙醇 CH3CH2CH2OH 60 97
正丁烷 CH3CH2CH2CH3 58 -0.5
环节一:认识醇及其物理性质
(1)相对分子质量相近的醇与烷烃:醇 > 烷烃
醇分子间形成了氢键使沸点升高!
(3)碳原子数相同的醇:羟基越多,沸点越高。
(2)饱和一元醇,随碳原子数增加,醇的沸点升高。
醇的物理性质特点
1. 沸点
课堂探究
环节一:认识醇及其物理性质
【问题1-5】根据表格数据,归纳饱和一元醇在水中的溶解度变化规律并解释原因。
课堂探究
物质 甲醇 乙醇 正丙醇 正丁醇 正戊醇 正己醇
水溶性 互溶 互溶 互溶 7.7 2.6 0.59
2.水溶性
(1)低级醇(如甲醇、乙醇、丙醇)与水任意比混溶。
(2)随碳原子数的增加,水溶性逐渐降低。
随-OH数的增多,水溶性提高。
烃基-憎水基
羟基-亲水基
环节一:认识醇及其物理性质
课堂探究
环节二:进一步认识醇的化学性质
1.置换反应:与活泼金属反应
2ROH+2Na → 2RONa+H2↑
CH3 CH2 OH+H Br CH3 CH2 Br+H2O
油状液体
乙醇与浓氢溴酸混合加热发生反应生成溴乙烷
反应通式:
卤素原子取代了羟基,羟基和氢结合生成水
R-OH +H-X→ R-X +H2O
2.取代反应:
酯化反应
CH3 COOH + H OC2H5 CH3COOC2H5 + H2O
酸脱羟基,醇脱氢,酯化反应能进行
浓硫酸
课堂探究
环节二:进一步认识醇的化学性质
——分子内脱水成烯
3.消去反应
浓H2SO4
170 ℃
CH2-CH2
H
OH
CH2=CH2↑ + H2O
迅速升温到170℃:
防止乙醇发生副反应生成乙醚
断键位置:
脱去 —OH 和与 —OH 相邻的碳原子上的H
思考: 溴乙烷与乙醇都能发生消去反应,它们有什么异同?
同:都是从一个分子内去掉一个小分子,都由单键生成双键
异:反应条件不同。溴乙烷:NaOH醇溶液,加热;
乙醇:浓H2SO4,170℃
思考:
1.浓硫酸的作用是什么?如何将乙醇和浓硫酸混合?
2.温度计水银球的位置在哪里?
3.反应过程中溶液为什么逐渐变黑?
4.反应过程中可能产生哪些杂质气体?
酒精与浓硫酸
(体积比约为1∶3)
C + 2 H2SO4 (浓) = CO2 + 2SO2 + 2H2O
△
记忆口诀:硫酸酒精3∶1,加热升温170 ℃,
为防暴沸加碎瓷,气用排水来收集。
课堂探究
5.若将混合溶液所得气体直接通入酸性KMnO4溶液中,溶液褪色,能否说明所得气体为乙烯?
环节二:进一步认识醇的化学性质
分子间脱水成醚
C2H5 OH + HO C2H5 C2H5 O C2H5 + H2O
浓H2SO4
140 ℃
一个醇脱羟基,另一个醇脱羟基氢
——取代反应
4.氧化反应
(1)燃烧
C2H5OH+3O2 2CO2+3H2O
点燃
乙醇汽油由90%的普通汽油与10%的燃料乙醇调和而成。
焊接银器、铜器时,表面会生成发黑的氧化膜
【思考】这是何原理?
课堂探究
环节二:进一步认识醇的化学性质
2CH3CH2OH+O2 2CH3CHO+2H2O
加热
H―C―C―O
―
H
H
H
H―C―C―O―H
H
H
H
H
Cu / Ag
2 + O2 2 +2H2O
Cu
△
—
醛基
(脱去两个氢)
4.氧化反应
课堂探究
环节二:进一步认识醇的化学性质
CH3CH2OH
CH3COOH
酸性K2Cr2O7
或 酸性KMnO4
(乙酸)
酸性K2Cr2O7溶液
橙色
Cr3+
灰绿色
酒驾
乙醇
乙醛
乙酸
CH3CH2OH CH3CHO CH3COOH
氧化
氧化
4.氧化反应
课堂探究
环节二:进一步认识醇的化学性质
思考:(1)对比乙醇的氧化反应,在Cu或Ag催化下被氧气氧化和被酸性高锰酸钾(重铬酸钾)溶液氧化,得到的产物有何不同?
(2)对比乙醇和2-丙醇在Cu或Ag催化下被氧气氧化所得产物,发生断键的位置是哪里?
是不是所有的醇都可以在Cu或Ag的催化下被氧气氧化?
你能得出具有哪种结构的醇在Cu或Ag催化下被氧气氧化成醛,哪种结构的醇氧气被氧化成酮?
醇能否被氧化以及氧化产物的类别,取决于与羟基相连的C上H的个数
环节二:进一步认识醇的化学性质
R CH2OH
R1 CH R2
OH
2~3个H
伯醇
1个H
仲醇
无H
叔醇
R1 C R2
OH
R3
R CHO
R COOH
KMnO4(H+)或
K2Cr2O7(H+)
Cu、O2
KMnO4(H+)或
K2Cr2O7(H+)
Cu、O2
R1 C R2
O
不可被催化氧化
环节二:进一步认识醇的化学性质
②
①
④
③
⑤
H―C―C―O―H
H
H
H
H
反应 断键位置
分子间脱水
与HX反应
②④
②
①③
①②
与金属Na反应
消去反应
催化氧化
①
课堂小结
布置作业
整理学案。
完成学案中的素养专练。
谢谢大家
第1课时 醇
第二节 醇 酚
化学
1.掌握醇的结构特征,认识醇的官能团与其性质之间的关系。通过实验探究,证实产物和反应机理。
2.掌握醇的化学性质,建立“结构决定性质,性质决定用途”的基本观念,形成基于官能团、化学键与反应类型认识有机化合物的一般思路。
3.感受醇的用途,学会从化学的视角认识生活,理解化学科学在合成分子和创造物质方面做出的贡献。
学习目标
重点:
乙醇的结构与性质的关系,认识乙醇的取代反应、消去反应、氧化反应。
难点:
乙醇的结构和重要性质。
学习重难点
乙醇的分子结构
H C C O H
H
H
H
H
官能团是 OH,由于O吸引电子的能力比C、H强,C O键、O H键均有较强极性,易断裂。
易断开
知识回顾
2CH3CH2OH + 2Na 2CH3CH2ONa + H2↑
现象:先沉后浮,不熔、不游、不响,反应缓慢
思考:
1.乙醇是不是电解质?乙醇羟基上的氢原子与水中的氢原子相比,哪个更活泼?
2.写出乙二醇与金属钠反应的化学方程式。
乙醇的化学性质
知识回顾
在日常生活中,我们看到有些人喝酒后,会产生脸部变红、呕吐、昏迷等醉酒症状;有些人喝了一定量的酒,却并不会出现上述症状。这是什么原因造成的呢
乙醛脱氢酶
乙醇脱氢酶
醉酒
乙醇脱氢酶
不醉酒
导入新课
课堂探究
环节一:认识醇及其物理性质
【问题1-1】根据羟基连接的碳原子的种类对下列物质进行分类。
CH3CH2OH
乙醇
醇:羟基与烃基或苯环侧链上的碳原子相连的化合物
CH3CH2OH
CH3CHCH3
OH
乙醇
2—丙醇
CH2OH
苯甲醇
酚:羟基直接与苯环相连的化合物
OH
课堂探究
醇的概念、分类和命名
环节一:认识醇及其物理性质
几种重要的醇
乙二醇
CH2-OH
CH2-OH
CH2-OH
CH-OH
CH2-OH
丙三醇(甘油)
一元醇
二元醇
多元醇
CH3OH
甲醇
工业酒精有毒!
汽车防冻剂
配制化妆品
课堂探究
【问题1-2】阅读教材,回答下列问题。
①醇的分类。②甲醇的物理性质、危害及应用。③乙二醇和丙三醇的物理性质和应用。
环节一:认识醇及其物理性质
甲醇(CH3OH)是无色、具有挥发性的液体,易溶于水,沸点为65℃。
甲醇有毒,误服会损伤视神经,甚至致人死亡。甲醇广泛应用于化工生产,也可作为车用燃料。
乙二醇和丙三醇都是无色、黏稠的液体,都易溶于水和乙醇,是重要的化工原料。
环节一:认识醇及其物理性质
课堂探究
【问题1-2】阅读教材,回答下列问题。
①醇的分类。②甲醇的物理性质、危害及应用。③乙二醇和丙三醇的物理性质和应用。
课堂探究
【问题1-3】饱和链状一元醇的通式。
CnH2n+1OH或CnH2n+2O
【问题1-4】以几种醇的熔点和沸点为例(见下表),同时结合烷烃的物理性质的变化规律,总结醇的物理性质,并分析原因。
名称 结构简式 相对分子质量 沸点/℃
甲醇 CH3OH 32 65
乙烷 CH3CH3 30 -89
乙醇 CH3CH2OH 46 78
丙烷 CH3CH2CH3 44 -42
正丙醇 CH3CH2CH2OH 60 97
正丁烷 CH3CH2CH2CH3 58 -0.5
环节一:认识醇及其物理性质
(1)相对分子质量相近的醇与烷烃:醇 > 烷烃
醇分子间形成了氢键使沸点升高!
(3)碳原子数相同的醇:羟基越多,沸点越高。
(2)饱和一元醇,随碳原子数增加,醇的沸点升高。
醇的物理性质特点
1. 沸点
课堂探究
环节一:认识醇及其物理性质
【问题1-5】根据表格数据,归纳饱和一元醇在水中的溶解度变化规律并解释原因。
课堂探究
物质 甲醇 乙醇 正丙醇 正丁醇 正戊醇 正己醇
水溶性 互溶 互溶 互溶 7.7 2.6 0.59
2.水溶性
(1)低级醇(如甲醇、乙醇、丙醇)与水任意比混溶。
(2)随碳原子数的增加,水溶性逐渐降低。
随-OH数的增多,水溶性提高。
烃基-憎水基
羟基-亲水基
环节一:认识醇及其物理性质
课堂探究
环节二:进一步认识醇的化学性质
1.置换反应:与活泼金属反应
2ROH+2Na → 2RONa+H2↑
CH3 CH2 OH+H Br CH3 CH2 Br+H2O
油状液体
乙醇与浓氢溴酸混合加热发生反应生成溴乙烷
反应通式:
卤素原子取代了羟基,羟基和氢结合生成水
R-OH +H-X→ R-X +H2O
2.取代反应:
酯化反应
CH3 COOH + H OC2H5 CH3COOC2H5 + H2O
酸脱羟基,醇脱氢,酯化反应能进行
浓硫酸
课堂探究
环节二:进一步认识醇的化学性质
——分子内脱水成烯
3.消去反应
浓H2SO4
170 ℃
CH2-CH2
H
OH
CH2=CH2↑ + H2O
迅速升温到170℃:
防止乙醇发生副反应生成乙醚
断键位置:
脱去 —OH 和与 —OH 相邻的碳原子上的H
思考: 溴乙烷与乙醇都能发生消去反应,它们有什么异同?
同:都是从一个分子内去掉一个小分子,都由单键生成双键
异:反应条件不同。溴乙烷:NaOH醇溶液,加热;
乙醇:浓H2SO4,170℃
思考:
1.浓硫酸的作用是什么?如何将乙醇和浓硫酸混合?
2.温度计水银球的位置在哪里?
3.反应过程中溶液为什么逐渐变黑?
4.反应过程中可能产生哪些杂质气体?
酒精与浓硫酸
(体积比约为1∶3)
C + 2 H2SO4 (浓) = CO2 + 2SO2 + 2H2O
△
记忆口诀:硫酸酒精3∶1,加热升温170 ℃,
为防暴沸加碎瓷,气用排水来收集。
课堂探究
5.若将混合溶液所得气体直接通入酸性KMnO4溶液中,溶液褪色,能否说明所得气体为乙烯?
环节二:进一步认识醇的化学性质
分子间脱水成醚
C2H5 OH + HO C2H5 C2H5 O C2H5 + H2O
浓H2SO4
140 ℃
一个醇脱羟基,另一个醇脱羟基氢
——取代反应
4.氧化反应
(1)燃烧
C2H5OH+3O2 2CO2+3H2O
点燃
乙醇汽油由90%的普通汽油与10%的燃料乙醇调和而成。
焊接银器、铜器时,表面会生成发黑的氧化膜
【思考】这是何原理?
课堂探究
环节二:进一步认识醇的化学性质
2CH3CH2OH+O2 2CH3CHO+2H2O
加热
H―C―C―O
―
H
H
H
H―C―C―O―H
H
H
H
H
Cu / Ag
2 + O2 2 +2H2O
Cu
△
—
醛基
(脱去两个氢)
4.氧化反应
课堂探究
环节二:进一步认识醇的化学性质
CH3CH2OH
CH3COOH
酸性K2Cr2O7
或 酸性KMnO4
(乙酸)
酸性K2Cr2O7溶液
橙色
Cr3+
灰绿色
酒驾
乙醇
乙醛
乙酸
CH3CH2OH CH3CHO CH3COOH
氧化
氧化
4.氧化反应
课堂探究
环节二:进一步认识醇的化学性质
思考:(1)对比乙醇的氧化反应,在Cu或Ag催化下被氧气氧化和被酸性高锰酸钾(重铬酸钾)溶液氧化,得到的产物有何不同?
(2)对比乙醇和2-丙醇在Cu或Ag催化下被氧气氧化所得产物,发生断键的位置是哪里?
是不是所有的醇都可以在Cu或Ag的催化下被氧气氧化?
你能得出具有哪种结构的醇在Cu或Ag催化下被氧气氧化成醛,哪种结构的醇氧气被氧化成酮?
醇能否被氧化以及氧化产物的类别,取决于与羟基相连的C上H的个数
环节二:进一步认识醇的化学性质
R CH2OH
R1 CH R2
OH
2~3个H
伯醇
1个H
仲醇
无H
叔醇
R1 C R2
OH
R3
R CHO
R COOH
KMnO4(H+)或
K2Cr2O7(H+)
Cu、O2
KMnO4(H+)或
K2Cr2O7(H+)
Cu、O2
R1 C R2
O
不可被催化氧化
环节二:进一步认识醇的化学性质
②
①
④
③
⑤
H―C―C―O―H
H
H
H
H
反应 断键位置
分子间脱水
与HX反应
②④
②
①③
①②
与金属Na反应
消去反应
催化氧化
①
课堂小结
布置作业
整理学案。
完成学案中的素养专练。
谢谢大家
