第三章 第一节 卤代烃--人教版高中化学选择性必修第三册教学课件(共23张PPT)
文档属性
| 名称 | 第三章 第一节 卤代烃--人教版高中化学选择性必修第三册教学课件(共23张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.9MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-08 09:10:15 | ||
图片预览




文档简介
(共23张PPT)
第1课时 卤代烃
第一节 卤代烃
化学
1.通过结构的角度对溴乙烷的化学性质进行预测,深化“组成和结构决定性质”的观念,培养“宏观辨识与微观探析”的化学学科核心素养。
2.通过实验探究1-溴丙烷消去反应的产物,加强“基团之间存在相互影响”的观念,建立有机认知模型,培养“科学探究与创新意识”的化学学科核心素养。
3.通过溴乙烷取代反应和消去反应的对比和归纳,形成“化学反应可以调控”的观念,培养“科学态度与社会责任”的化学学科核心素养。
学习目标
重点:
溴乙烷的分子结构特点和主要化学性质。
难点:
卤代烃发生取代反应和消去反应的基本规律。
学习重难点
C2H5
O H
+ Na
H
O H
+ Na
H C
O H
+ Na
=
O
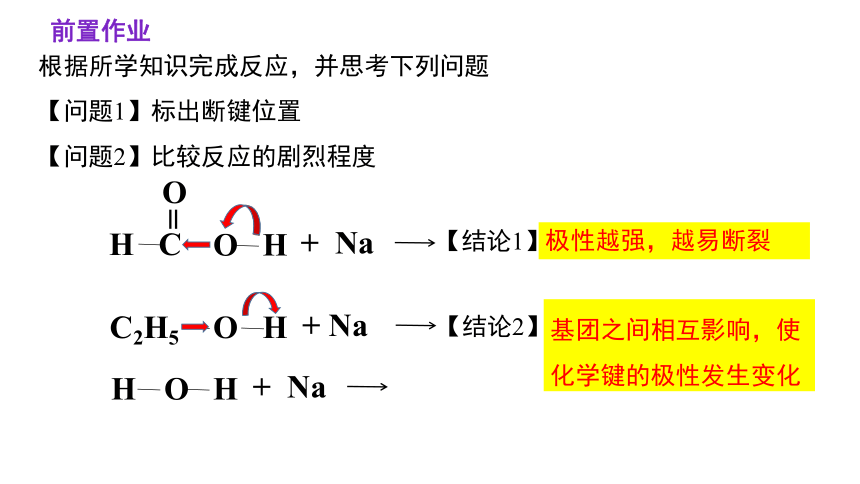
根据所学知识完成反应,并思考下列问题
【问题1】标出断键位置
【问题2】比较反应的剧烈程度
前置作业
极性越强,越易断裂
【结论1】
基团之间相互影响,使化学键的极性发生变化
【结论2】
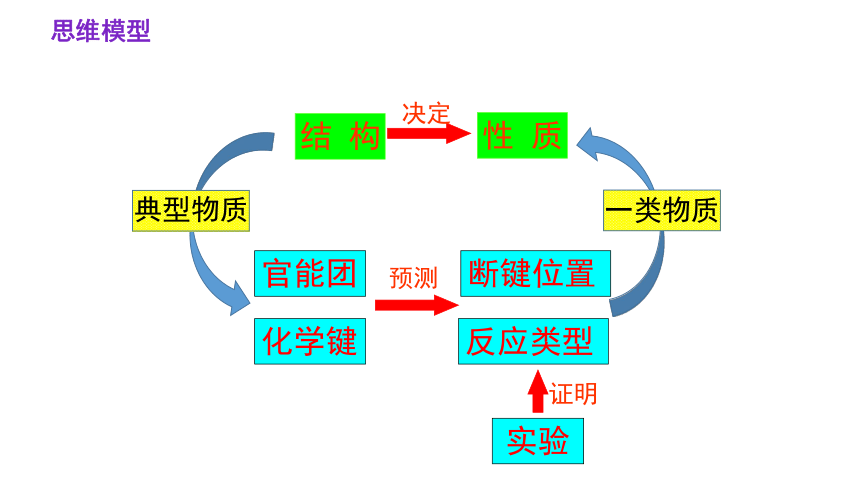
结 构
官能团
化学键
断键位置
反应类型
实验
证明
预测
典型物质
决定
性 质
一类物质
思维模型
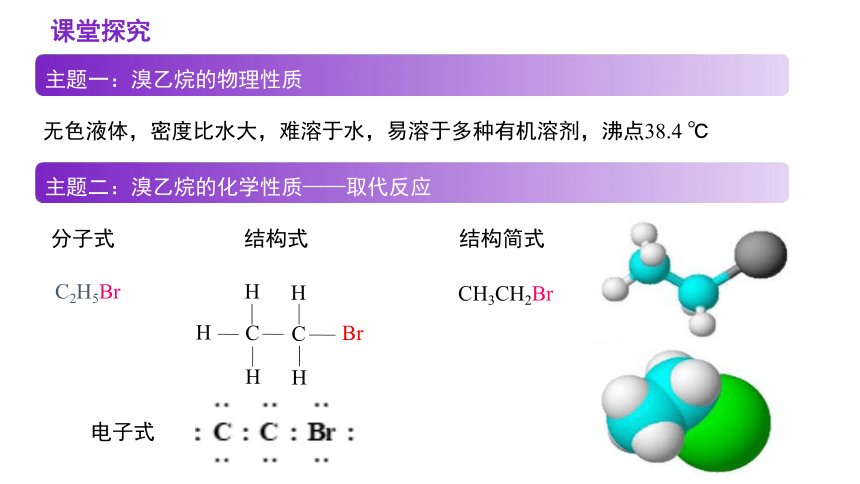
无色液体,密度比水大,难溶于水,易溶于多种有机溶剂,沸点38.4 ℃
分子式 结构式 结构简式
C2H5Br
C
C
H
H
H
H
Br
H
CH3CH2Br
课堂探究
主题一:溴乙烷的物理性质
主题二:溴乙烷的化学性质——取代反应
电子式
C
C
H
H
H
H
Br
H
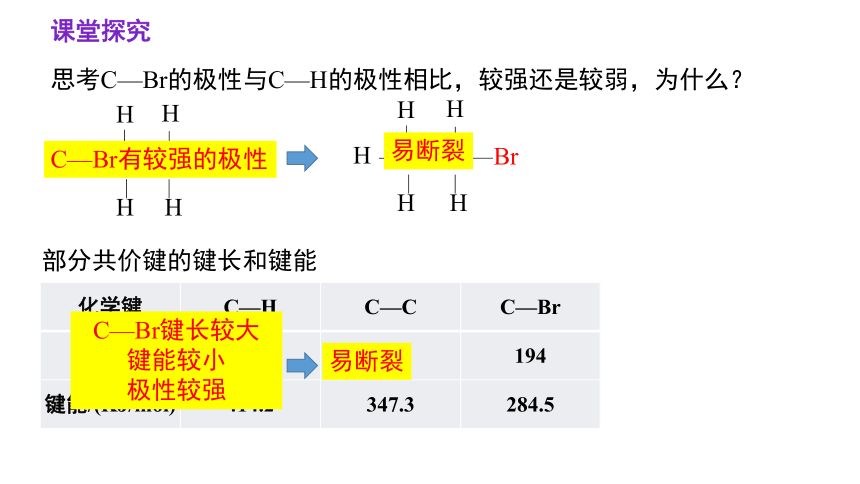
思考C—Br的极性与C—H的极性相比,较强还是较弱,为什么?
易断裂
C
C
H
H
H
H
H
H
部分共价键的键长和键能
化学键 C—H C—C C—Br
键长/pm 110 154 194
键能/(KJ/mol) 414.2 347.3 284.5
C—Br有较强的极性
C—Br键长较大
键能较小
极性较强
易断裂
课堂探究
如何检验溴乙烷中的溴元素?
实验方案:取少量溴乙烷于试管中,加入少量硝酸银溶液,振荡。
实验结论:溴乙烷为非电解质,无法电离出溴离子。
课堂探究
[实验演示]
C
C
H
H
H
H
Br
H
+
OH-
C
C
H
H
H
H
OH
H
δ+
δ-
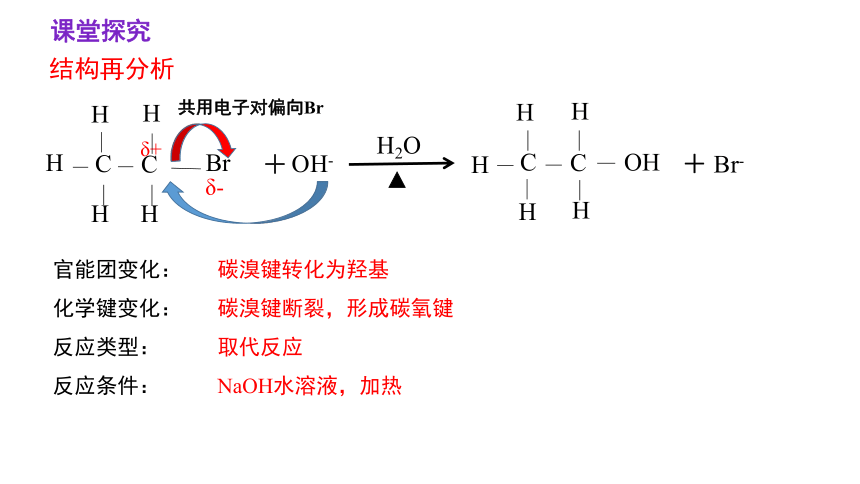
结构再分析
共用电子对偏向Br
+
Br-
官能团变化:
化学键变化:
反应类型:
反应条件:
H2O
碳溴键转化为羟基
碳溴键断裂,形成碳氧键
取代反应
NaOH水溶液,加热
课堂探究
官能团转化:碳溴键→羟基
化学键变化:C—Br断裂,形成C—O
反应条件:NaOH水溶液,加热
取代反应
H2O
反应实质:溴乙烷中C—Br键断裂,使溴原子被其他原子或原子团取代,生成负离子而离去。
实验再探究(小组活动)方案2:
实验结论:
溴乙烷中存在溴元素,且在碱性条件下发生取代反应
课堂探究
由于溴原子的吸电子作用,使C—H的极性增强,在强碱的乙醇溶液加热的条件下能够发生断裂。
C
C
H
H
H
H
Br
H
共用电子对偏向碳
C
C
H
C
H
H
Br
H
H
H
H
课堂探究
主题三:溴乙烷的化学性质——消去反应
【模型探究】依据化学键理论,结合1-溴丙烷的球棍模型,推测若C—H和C—Br同时断裂,可能生成哪些有机物,写出其结构简式。(小组活动,2 min)
C
C
H
C
H
H
Br
H
H
H
H
3 2 1
CH3—CH2= CH2
情况1
情况2
CH2 CH2
CH2
情况3
CH3CH2 CH=CHCH2CH3
情况.....
课堂探究
大量实验证明:在饱和NaOH乙醇溶液共热的条件下,主要产物为丙烯。
实验步骤:按左图连接好实验装置,并检验装置的气密性。向圆底烧瓶中加入2.0 g NaOH和15 mL无水乙醇,搅拌。再向其中加入5 mL 1-溴丙烷和几片碎瓷片,微热。
【实验操作】
课堂探究
问题1.为什么气体要在通入酸性高锰酸钾溶液前先通入盛水的试管?起什么作用?
问题2.能说明常温下使酸性高锰酸钾溶液褪色的气体不是环丙烷或3-己烯吗?(已知:①环丙烷不能使酸性高锰酸钾褪色;② 3-己烯沸点:67 ℃)
实验讨论:
因为挥发出的乙醇也能使酸性高锰酸钾溶液褪色,干扰乙烯的检验。目的是除去乙烯中的乙醇。
能
课堂探究
CH3CH2=CH2↑ + NaBr + H2O
醇
+ NaOH
CH3CH
CH2
Br
H
碳溴键转化为碳碳双键
C—Br、C—H断裂,形成C==C
NaOH醇溶液,加热
官能团变化:
化学键变化:
反应条件:
消去反应
反应类型:
有机化合物在一定条件下,从一个分子中脱去一个或几个小分子(如H2O、HX等),而生成含不饱和键的化合物的反应。
课堂探究
2.注意
(1)消去反应的前提——邻碳有氢
思考:下列物质能否都发生消去反应?如果能写出产物;如果不能写出产物。
(2)消去反应的产物——含不饱和键
课堂探究
CH3Cl CH3CHCHBrCH3 H3C—C—CH2Cl
CH3
CH3
CH3
取代反应 消去反应
反应物
反应 条件
断键
生成物
结论 CH3CH2Br
NaOH水溶液、
加热
NaOH醇溶液、
加热
C-Br
C-Br,邻碳C-H
CH3CH2OH、NaBr
CH2=CH2 、
NaBr、H2O
溴乙烷和NaOH在不同条件下发生不同类型的反应
CH3CH2Br
化学反应可以通过改变反应条件进行调控
课堂小结
写出每一步需要的试剂和反应条件
CH2=CH2 CH3CH2—Br CH3CH2—OH
⑤
①
②
③
④
与HBr加成
消去反应
取代反应
与水加成
消去反应
醇
卤代烃
水解
烯烃
消去
加成
醛
酸
酯
课堂练习
问题1:根据数据,归纳以上物质物理性质的递变规律。
问题2:试从结构的角度分析沸点的递变规律。
(2)卤代烃的密度随碳原子数增加而降低。
(1)卤代烷的沸点随分子中碳原子数的增加而升高。碳原子数相同的卤代烷,沸点则是:RI>RBr>RCl>RF。
这些物质的固体均为分子晶体
2.物理性质
1.分类:
(1)根据分子中所含卤素原子的不同,
(2)根据分子中卤原子的数目不同
课堂探究
氟利昂(freon),有CCl3F、CCl2F2等,对臭氧层的破坏作用。
课堂探究
结 构
官能团
化学键
断键位置
反应类型
实验
证明
预测
典型物质
决定
性 质
一类物质
思维模型
布置作业
预习下节学案。
完成学案素养专练。
谢谢大家
第1课时 卤代烃
第一节 卤代烃
化学
1.通过结构的角度对溴乙烷的化学性质进行预测,深化“组成和结构决定性质”的观念,培养“宏观辨识与微观探析”的化学学科核心素养。
2.通过实验探究1-溴丙烷消去反应的产物,加强“基团之间存在相互影响”的观念,建立有机认知模型,培养“科学探究与创新意识”的化学学科核心素养。
3.通过溴乙烷取代反应和消去反应的对比和归纳,形成“化学反应可以调控”的观念,培养“科学态度与社会责任”的化学学科核心素养。
学习目标
重点:
溴乙烷的分子结构特点和主要化学性质。
难点:
卤代烃发生取代反应和消去反应的基本规律。
学习重难点
C2H5
O H
+ Na
H
O H
+ Na
H C
O H
+ Na
=
O
根据所学知识完成反应,并思考下列问题
【问题1】标出断键位置
【问题2】比较反应的剧烈程度
前置作业
极性越强,越易断裂
【结论1】
基团之间相互影响,使化学键的极性发生变化
【结论2】
结 构
官能团
化学键
断键位置
反应类型
实验
证明
预测
典型物质
决定
性 质
一类物质
思维模型
无色液体,密度比水大,难溶于水,易溶于多种有机溶剂,沸点38.4 ℃
分子式 结构式 结构简式
C2H5Br
C
C
H
H
H
H
Br
H
CH3CH2Br
课堂探究
主题一:溴乙烷的物理性质
主题二:溴乙烷的化学性质——取代反应
电子式
C
C
H
H
H
H
Br
H
思考C—Br的极性与C—H的极性相比,较强还是较弱,为什么?
易断裂
C
C
H
H
H
H
H
H
部分共价键的键长和键能
化学键 C—H C—C C—Br
键长/pm 110 154 194
键能/(KJ/mol) 414.2 347.3 284.5
C—Br有较强的极性
C—Br键长较大
键能较小
极性较强
易断裂
课堂探究
如何检验溴乙烷中的溴元素?
实验方案:取少量溴乙烷于试管中,加入少量硝酸银溶液,振荡。
实验结论:溴乙烷为非电解质,无法电离出溴离子。
课堂探究
[实验演示]
C
C
H
H
H
H
Br
H
+
OH-
C
C
H
H
H
H
OH
H
δ+
δ-
结构再分析
共用电子对偏向Br
+
Br-
官能团变化:
化学键变化:
反应类型:
反应条件:
H2O
碳溴键转化为羟基
碳溴键断裂,形成碳氧键
取代反应
NaOH水溶液,加热
课堂探究
官能团转化:碳溴键→羟基
化学键变化:C—Br断裂,形成C—O
反应条件:NaOH水溶液,加热
取代反应
H2O
反应实质:溴乙烷中C—Br键断裂,使溴原子被其他原子或原子团取代,生成负离子而离去。
实验再探究(小组活动)方案2:
实验结论:
溴乙烷中存在溴元素,且在碱性条件下发生取代反应
课堂探究
由于溴原子的吸电子作用,使C—H的极性增强,在强碱的乙醇溶液加热的条件下能够发生断裂。
C
C
H
H
H
H
Br
H
共用电子对偏向碳
C
C
H
C
H
H
Br
H
H
H
H
课堂探究
主题三:溴乙烷的化学性质——消去反应
【模型探究】依据化学键理论,结合1-溴丙烷的球棍模型,推测若C—H和C—Br同时断裂,可能生成哪些有机物,写出其结构简式。(小组活动,2 min)
C
C
H
C
H
H
Br
H
H
H
H
3 2 1
CH3—CH2= CH2
情况1
情况2
CH2 CH2
CH2
情况3
CH3CH2 CH=CHCH2CH3
情况.....
课堂探究
大量实验证明:在饱和NaOH乙醇溶液共热的条件下,主要产物为丙烯。
实验步骤:按左图连接好实验装置,并检验装置的气密性。向圆底烧瓶中加入2.0 g NaOH和15 mL无水乙醇,搅拌。再向其中加入5 mL 1-溴丙烷和几片碎瓷片,微热。
【实验操作】
课堂探究
问题1.为什么气体要在通入酸性高锰酸钾溶液前先通入盛水的试管?起什么作用?
问题2.能说明常温下使酸性高锰酸钾溶液褪色的气体不是环丙烷或3-己烯吗?(已知:①环丙烷不能使酸性高锰酸钾褪色;② 3-己烯沸点:67 ℃)
实验讨论:
因为挥发出的乙醇也能使酸性高锰酸钾溶液褪色,干扰乙烯的检验。目的是除去乙烯中的乙醇。
能
课堂探究
CH3CH2=CH2↑ + NaBr + H2O
醇
+ NaOH
CH3CH
CH2
Br
H
碳溴键转化为碳碳双键
C—Br、C—H断裂,形成C==C
NaOH醇溶液,加热
官能团变化:
化学键变化:
反应条件:
消去反应
反应类型:
有机化合物在一定条件下,从一个分子中脱去一个或几个小分子(如H2O、HX等),而生成含不饱和键的化合物的反应。
课堂探究
2.注意
(1)消去反应的前提——邻碳有氢
思考:下列物质能否都发生消去反应?如果能写出产物;如果不能写出产物。
(2)消去反应的产物——含不饱和键
课堂探究
CH3Cl CH3CHCHBrCH3 H3C—C—CH2Cl
CH3
CH3
CH3
取代反应 消去反应
反应物
反应 条件
断键
生成物
结论 CH3CH2Br
NaOH水溶液、
加热
NaOH醇溶液、
加热
C-Br
C-Br,邻碳C-H
CH3CH2OH、NaBr
CH2=CH2 、
NaBr、H2O
溴乙烷和NaOH在不同条件下发生不同类型的反应
CH3CH2Br
化学反应可以通过改变反应条件进行调控
课堂小结
写出每一步需要的试剂和反应条件
CH2=CH2 CH3CH2—Br CH3CH2—OH
⑤
①
②
③
④
与HBr加成
消去反应
取代反应
与水加成
消去反应
醇
卤代烃
水解
烯烃
消去
加成
醛
酸
酯
课堂练习
问题1:根据数据,归纳以上物质物理性质的递变规律。
问题2:试从结构的角度分析沸点的递变规律。
(2)卤代烃的密度随碳原子数增加而降低。
(1)卤代烷的沸点随分子中碳原子数的增加而升高。碳原子数相同的卤代烷,沸点则是:RI>RBr>RCl>RF。
这些物质的固体均为分子晶体
2.物理性质
1.分类:
(1)根据分子中所含卤素原子的不同,
(2)根据分子中卤原子的数目不同
课堂探究
氟利昂(freon),有CCl3F、CCl2F2等,对臭氧层的破坏作用。
课堂探究
结 构
官能团
化学键
断键位置
反应类型
实验
证明
预测
典型物质
决定
性 质
一类物质
思维模型
布置作业
预习下节学案。
完成学案素养专练。
谢谢大家
