第三章 实验活动1 乙酸乙酯的制备与性质--人教版高中化学选择性必修第三册教学课件(共22张PPT)
文档属性
| 名称 | 第三章 实验活动1 乙酸乙酯的制备与性质--人教版高中化学选择性必修第三册教学课件(共22张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 389.0KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-08 09:10:15 | ||
图片预览





文档简介
(共22张PPT)
乙酸乙酯的制备与性质
实验活动1
化学
1.通过对乙酸乙酯制备和水解实验现象的观察,理解其微观反应机理,能书写相关化学反应方程式,培养学生的宏观辨识与微观探析的核心素养。
2.通过自主设计实验方案,小组合作实验探究等活动培养学生科学探究能力和创新实践能力。
学习目标
3.通过探究问题,理解和掌握反应机理、实验注意事项以及从平衡和速率两个角度理解条件对化学反应的影响。
重点:
乙酸乙酯的制备及水解的反应原理。
难点:
实验设计和分析。
学习重难点
自主预习
1.实验室制取少量乙酸乙酯的装置如图所示,下列关于该实验的叙述错误的是( )
A.向试管a中先加入浓硫酸,然后边振荡试管边慢慢加入乙醇,再加入冰醋酸
B.试管b中导气管下端管口不能浸入液面的目的是防止实验过程中产生倒吸现象
C.实验时加热试管a的目的之一是及时将乙酸乙酯蒸出,使平衡向生成乙酸乙酯的方向移动
D.饱和Na2CO3溶液可以降低乙酸乙酯的溶解度,并吸收蒸出的乙酸和乙醇
A
自主预习
解析 乙醇的密度小于浓硫酸的,为防止浓硫酸溶解放热,造成液体飞溅,向试管a中先加入乙醇,然后边振荡试管边慢慢加入浓硫酸,再加入冰醋酸,故A错误;因乙酸、乙醇均易溶于水,则试管b中导气管下端管口不能浸入液面,原因是防止实验过程中装置气压减小,发生倒吸现象,故B正确;该反应为可逆反应,实验时加热试管a的目的是及时将乙酸乙酯蒸出并增大反应速率,乙酸乙酯蒸出,化学平衡正向移动,故C正确;实验时试管b中饱和Na2CO3溶液的作用是吸收乙醇、中和乙酸及降低乙酸乙酯的溶解度便于分层,然后分液可分离出乙酸乙酯,故D正确。
自主预习
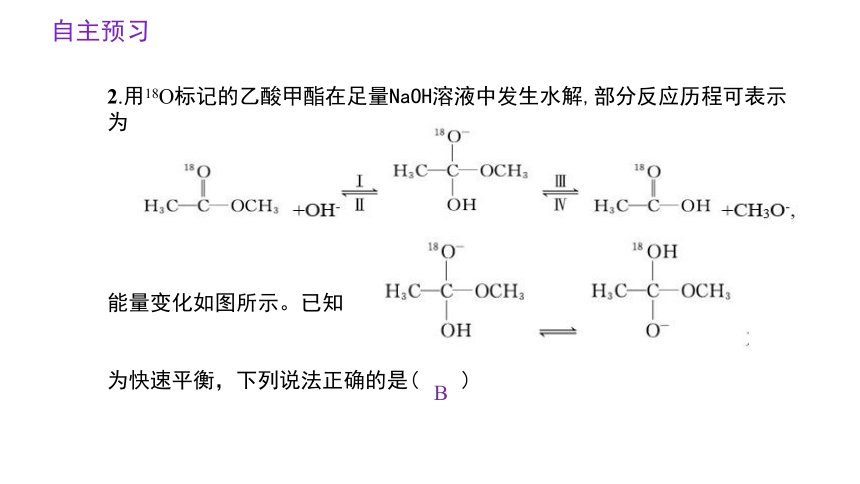
2.用18O标记的乙酸甲酯在足量NaOH溶液中发生水解,部分反应历程可表示为
能量变化如图所示。已知
为快速平衡,下列说法正确的是( )
B
自主预习
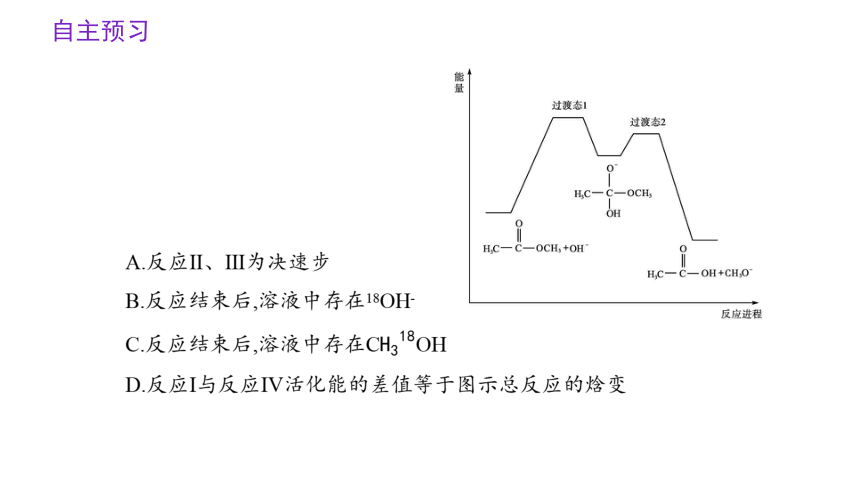
A.反应Ⅱ、Ⅲ为决速步
B.反应结束后,溶液中存在18OH-
C.反应结束后,溶液中存在COH
D.反应Ⅰ与反应Ⅳ活化能的差值等于图示总反应的焓变
自主预习
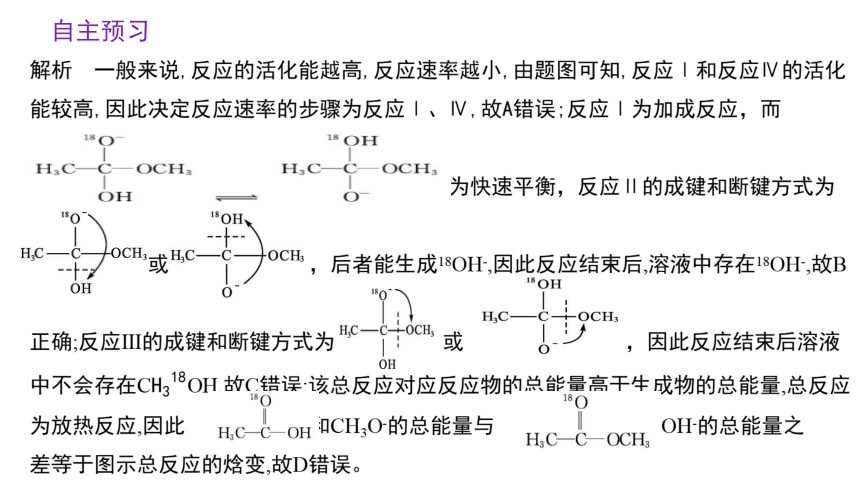
解析 一般来说,反应的活化能越高,反应速率越小,由题图可知,反应Ⅰ和反应Ⅳ的活化能较高,因此决定反应速率的步骤为反应Ⅰ、Ⅳ,故A错误;反应Ⅰ为加成反应,而
为快速平衡,反应Ⅱ的成键和断键方式为
或 ,后者能生成18OH-,因此反应结束后,溶液中存在18OH-,故B
正确;反应Ⅲ的成键和断键方式为 或 ,因此反应结束后溶液中不会存在COH,故C错误;该总反应对应反应物的总能量高于生成物的总能量,总反应为放热反应,因此 和CH3O-的总能量与 和OH-的总能量之
差等于图示总反应的焓变,故D错误。
课堂探究
导入新课
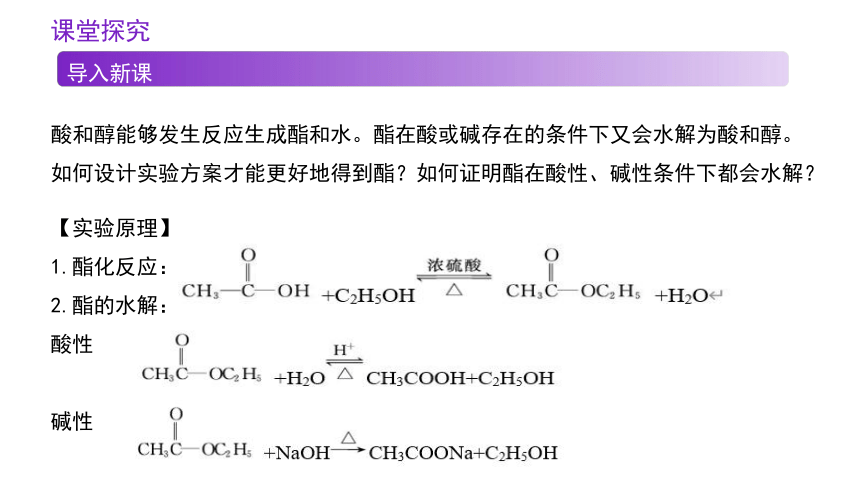
酸和醇能够发生反应生成酯和水。酯在酸或碱存在的条件下又会水解为酸和醇。如何设计实验方案才能更好地得到酯?如何证明酯在酸性、碱性条件下都会水解?
【实验原理】
1.酯化反应:
2.酯的水解:
酸性
碱性
课堂探究
一、乙酸乙酯的制备
实验安全注意事项:
1.穿戴实验服、护目镜、手套。
2.浓硫酸具有腐蚀性和强脱水性,注意添加次序,先加入乙醇,再缓慢加入浓硫酸,边加边搅拌,冷却后再加入乙酸。
3.需使用碎瓷片防暴沸,试管倾斜约45°,以增大受热面积,减少液体剧烈沸腾。
课堂探究
一、乙酸乙酯的制备
实验操作:
①按照实验装置图连接实验装置,检查装置气密性。
②在一支试管中加入2 mL乙醇,然后边振荡试管边慢慢加入0.5 mL 浓硫酸和2 mL乙酸,再加入几片碎瓷片。在另一支试管中加入3 mL饱和碳酸钠溶液。
③用小火加热试管里的混合物,将产生的蒸汽经导管通到饱和碳酸钠溶液的上方约0.5 cm处,注意观察试管内的变化。反应一段时间后,取下盛有碳酸钠溶液的试管,并停止加热。
④振荡盛有Na2CO3溶液的试管,静置。待溶液分层后,观察上层的油状液体,并注意闻气味。
课堂探究
一、乙酸乙酯的制备
问题探究:
(1)在试管中加入碎瓷片的目的是什么
(2)饱和碳酸钠溶液的作用是什么
(3)吸收乙酸乙酯能否用NaOH溶液代替Na2CO3溶液 为什么
(4)反应的温度为什么不能过低,也不能过高
防止暴沸。
吸收乙醇、中和乙酸、降低乙酸乙酯的溶解度。
不能,乙酸乙酯在NaOH溶液中可以水解。
反应的温度过低,反应速率小,酯化反应不完全;反应的温度过高,乙酸和乙醇溶液挥发,也易发生醇的脱水和氧化等副反应。
课堂探究
一、乙酸乙酯的制备
问题探究:
(5)在制备乙酸乙酯的实验装置中,浓硫酸的作用是什么?长导管的作用又是什么?
浓硫酸起到催化剂和吸水剂的作用。作为催化剂,它可以加快酯化反应的速率;作为吸水剂,它吸收反应生成的水,促使平衡正向移动,提高乙酸乙酯的产率。长导管的作用一是导气,将反应生成的乙酸乙酯蒸汽导出;二是冷凝,使蒸汽在长导管中冷却,有利于乙酸乙酯的收集。
课堂探究
一、乙酸乙酯的制备
问题探究:
(6)在组装实验装置时,添加试剂的顺序是怎样的?为什么要这样操作?
先加入乙醇,再缓慢加入浓硫酸,边加边搅拌,冷却后再加入乙酸。原因是浓硫酸的密度比乙醇的大,且稀释时会放出大量热,若先加浓硫酸,后加乙醇,易造成液体飞溅。冷却后再加乙酸,可减少乙酸的挥发损失。
课堂探究
一、乙酸乙酯的制备
问题探究:
(7)实验结束后振荡盛有碳酸钠溶液的试管,你观察到什么现象?如何解释?
可以观察到溶液出现分层现象,上层为无色透明的油状液体(乙酸乙酯),下层为水溶液。并且在振荡过程中会有气泡产生。产生气泡是因为碳酸钠溶液会与挥发出来的乙酸发生反应,释放出二氧化碳气体。
课堂探究
二、乙酸乙酯的水解
1.实验目的:设计实验方案,完成乙酸乙酯在酸性和碱性条件下的水解。
2.实验用品:
试管、试管夹、烧杯、量筒、胶头滴管、玻璃导管、乳胶管、橡胶管、铁架台、酒精灯、火柴、秒表、碎瓷片。
乙酸乙酯、蒸馏水、3mol/L硫酸溶液,6mol/L氢氧化钠溶液。
课堂探究
二、乙酸乙酯的水解
实验操作:在A、B、C三支试管里各加入6滴乙酸乙酯。再向A试管里加入5.5 mL蒸馏水;向B试管里加入0.5 mL 3 mol·L-1硫酸溶液和5.0 mL蒸馏水;向C试管里加入0.5 mL 6 mol·L-1氢氧化钠溶液和5.0 mL蒸馏水。振荡均匀后,把三支试管都放入70~80 ℃的水浴里加热。比较试管里乙酸乙酯气味消失的快慢。
课堂探究
二、乙酸乙酯的水解
问题探究:
1. 如何比较酯在不同条件下水解速率的大小
乙酸乙酯气味消失的时间;乙酸乙酯液体消失的快慢。
在酸性条件下,酯的水解反应速率较慢,且水解程度较小,因为稀硫酸只起到催化作用,水解反应是可逆的;在碱性条件下,酯的水解反应速率快,且水解程度大,这是因为氢氧化钠与水解生成的乙酸发生中和反应,使水解平衡正向移动,促进了酯的水解。
2.对实验结果进行分析:
课堂探究
二、乙酸乙酯的水解
(1)温度:升高温度,水解反应速率加快。因为温度升高,分子能量增大,活化分子百分数增加,有效碰撞次数增多(速率角度).
(2)酸碱度:碱性条件下,酯的水解程度大;酸性条件下,酯的水解程度相对较小(平衡角度)。
3.对影响酯水解反应的因素进行总结:
课堂小结
总结
探究性实验思路
变化观念与平衡思想
理论学习与实际操作
认知模型
布置作业
完成学案中的素养专练。
谢谢大家
乙酸乙酯的制备与性质
实验活动1
化学
1.通过对乙酸乙酯制备和水解实验现象的观察,理解其微观反应机理,能书写相关化学反应方程式,培养学生的宏观辨识与微观探析的核心素养。
2.通过自主设计实验方案,小组合作实验探究等活动培养学生科学探究能力和创新实践能力。
学习目标
3.通过探究问题,理解和掌握反应机理、实验注意事项以及从平衡和速率两个角度理解条件对化学反应的影响。
重点:
乙酸乙酯的制备及水解的反应原理。
难点:
实验设计和分析。
学习重难点
自主预习
1.实验室制取少量乙酸乙酯的装置如图所示,下列关于该实验的叙述错误的是( )
A.向试管a中先加入浓硫酸,然后边振荡试管边慢慢加入乙醇,再加入冰醋酸
B.试管b中导气管下端管口不能浸入液面的目的是防止实验过程中产生倒吸现象
C.实验时加热试管a的目的之一是及时将乙酸乙酯蒸出,使平衡向生成乙酸乙酯的方向移动
D.饱和Na2CO3溶液可以降低乙酸乙酯的溶解度,并吸收蒸出的乙酸和乙醇
A
自主预习
解析 乙醇的密度小于浓硫酸的,为防止浓硫酸溶解放热,造成液体飞溅,向试管a中先加入乙醇,然后边振荡试管边慢慢加入浓硫酸,再加入冰醋酸,故A错误;因乙酸、乙醇均易溶于水,则试管b中导气管下端管口不能浸入液面,原因是防止实验过程中装置气压减小,发生倒吸现象,故B正确;该反应为可逆反应,实验时加热试管a的目的是及时将乙酸乙酯蒸出并增大反应速率,乙酸乙酯蒸出,化学平衡正向移动,故C正确;实验时试管b中饱和Na2CO3溶液的作用是吸收乙醇、中和乙酸及降低乙酸乙酯的溶解度便于分层,然后分液可分离出乙酸乙酯,故D正确。
自主预习
2.用18O标记的乙酸甲酯在足量NaOH溶液中发生水解,部分反应历程可表示为
能量变化如图所示。已知
为快速平衡,下列说法正确的是( )
B
自主预习
A.反应Ⅱ、Ⅲ为决速步
B.反应结束后,溶液中存在18OH-
C.反应结束后,溶液中存在COH
D.反应Ⅰ与反应Ⅳ活化能的差值等于图示总反应的焓变
自主预习
解析 一般来说,反应的活化能越高,反应速率越小,由题图可知,反应Ⅰ和反应Ⅳ的活化能较高,因此决定反应速率的步骤为反应Ⅰ、Ⅳ,故A错误;反应Ⅰ为加成反应,而
为快速平衡,反应Ⅱ的成键和断键方式为
或 ,后者能生成18OH-,因此反应结束后,溶液中存在18OH-,故B
正确;反应Ⅲ的成键和断键方式为 或 ,因此反应结束后溶液中不会存在COH,故C错误;该总反应对应反应物的总能量高于生成物的总能量,总反应为放热反应,因此 和CH3O-的总能量与 和OH-的总能量之
差等于图示总反应的焓变,故D错误。
课堂探究
导入新课
酸和醇能够发生反应生成酯和水。酯在酸或碱存在的条件下又会水解为酸和醇。如何设计实验方案才能更好地得到酯?如何证明酯在酸性、碱性条件下都会水解?
【实验原理】
1.酯化反应:
2.酯的水解:
酸性
碱性
课堂探究
一、乙酸乙酯的制备
实验安全注意事项:
1.穿戴实验服、护目镜、手套。
2.浓硫酸具有腐蚀性和强脱水性,注意添加次序,先加入乙醇,再缓慢加入浓硫酸,边加边搅拌,冷却后再加入乙酸。
3.需使用碎瓷片防暴沸,试管倾斜约45°,以增大受热面积,减少液体剧烈沸腾。
课堂探究
一、乙酸乙酯的制备
实验操作:
①按照实验装置图连接实验装置,检查装置气密性。
②在一支试管中加入2 mL乙醇,然后边振荡试管边慢慢加入0.5 mL 浓硫酸和2 mL乙酸,再加入几片碎瓷片。在另一支试管中加入3 mL饱和碳酸钠溶液。
③用小火加热试管里的混合物,将产生的蒸汽经导管通到饱和碳酸钠溶液的上方约0.5 cm处,注意观察试管内的变化。反应一段时间后,取下盛有碳酸钠溶液的试管,并停止加热。
④振荡盛有Na2CO3溶液的试管,静置。待溶液分层后,观察上层的油状液体,并注意闻气味。
课堂探究
一、乙酸乙酯的制备
问题探究:
(1)在试管中加入碎瓷片的目的是什么
(2)饱和碳酸钠溶液的作用是什么
(3)吸收乙酸乙酯能否用NaOH溶液代替Na2CO3溶液 为什么
(4)反应的温度为什么不能过低,也不能过高
防止暴沸。
吸收乙醇、中和乙酸、降低乙酸乙酯的溶解度。
不能,乙酸乙酯在NaOH溶液中可以水解。
反应的温度过低,反应速率小,酯化反应不完全;反应的温度过高,乙酸和乙醇溶液挥发,也易发生醇的脱水和氧化等副反应。
课堂探究
一、乙酸乙酯的制备
问题探究:
(5)在制备乙酸乙酯的实验装置中,浓硫酸的作用是什么?长导管的作用又是什么?
浓硫酸起到催化剂和吸水剂的作用。作为催化剂,它可以加快酯化反应的速率;作为吸水剂,它吸收反应生成的水,促使平衡正向移动,提高乙酸乙酯的产率。长导管的作用一是导气,将反应生成的乙酸乙酯蒸汽导出;二是冷凝,使蒸汽在长导管中冷却,有利于乙酸乙酯的收集。
课堂探究
一、乙酸乙酯的制备
问题探究:
(6)在组装实验装置时,添加试剂的顺序是怎样的?为什么要这样操作?
先加入乙醇,再缓慢加入浓硫酸,边加边搅拌,冷却后再加入乙酸。原因是浓硫酸的密度比乙醇的大,且稀释时会放出大量热,若先加浓硫酸,后加乙醇,易造成液体飞溅。冷却后再加乙酸,可减少乙酸的挥发损失。
课堂探究
一、乙酸乙酯的制备
问题探究:
(7)实验结束后振荡盛有碳酸钠溶液的试管,你观察到什么现象?如何解释?
可以观察到溶液出现分层现象,上层为无色透明的油状液体(乙酸乙酯),下层为水溶液。并且在振荡过程中会有气泡产生。产生气泡是因为碳酸钠溶液会与挥发出来的乙酸发生反应,释放出二氧化碳气体。
课堂探究
二、乙酸乙酯的水解
1.实验目的:设计实验方案,完成乙酸乙酯在酸性和碱性条件下的水解。
2.实验用品:
试管、试管夹、烧杯、量筒、胶头滴管、玻璃导管、乳胶管、橡胶管、铁架台、酒精灯、火柴、秒表、碎瓷片。
乙酸乙酯、蒸馏水、3mol/L硫酸溶液,6mol/L氢氧化钠溶液。
课堂探究
二、乙酸乙酯的水解
实验操作:在A、B、C三支试管里各加入6滴乙酸乙酯。再向A试管里加入5.5 mL蒸馏水;向B试管里加入0.5 mL 3 mol·L-1硫酸溶液和5.0 mL蒸馏水;向C试管里加入0.5 mL 6 mol·L-1氢氧化钠溶液和5.0 mL蒸馏水。振荡均匀后,把三支试管都放入70~80 ℃的水浴里加热。比较试管里乙酸乙酯气味消失的快慢。
课堂探究
二、乙酸乙酯的水解
问题探究:
1. 如何比较酯在不同条件下水解速率的大小
乙酸乙酯气味消失的时间;乙酸乙酯液体消失的快慢。
在酸性条件下,酯的水解反应速率较慢,且水解程度较小,因为稀硫酸只起到催化作用,水解反应是可逆的;在碱性条件下,酯的水解反应速率快,且水解程度大,这是因为氢氧化钠与水解生成的乙酸发生中和反应,使水解平衡正向移动,促进了酯的水解。
2.对实验结果进行分析:
课堂探究
二、乙酸乙酯的水解
(1)温度:升高温度,水解反应速率加快。因为温度升高,分子能量增大,活化分子百分数增加,有效碰撞次数增多(速率角度).
(2)酸碱度:碱性条件下,酯的水解程度大;酸性条件下,酯的水解程度相对较小(平衡角度)。
3.对影响酯水解反应的因素进行总结:
课堂小结
总结
探究性实验思路
变化观念与平衡思想
理论学习与实际操作
认知模型
布置作业
完成学案中的素养专练。
谢谢大家
