第四章 第一节 糖类 第2课时--人教版高中化学选择性必修第三册教学课件(共26张PPT)
文档属性
| 名称 | 第四章 第一节 糖类 第2课时--人教版高中化学选择性必修第三册教学课件(共26张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 18.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-08 00:00:00 | ||
图片预览







文档简介
(共26张PPT)
第2课时 二糖 多糖
第一节 糖类
化学
1.通过自主学习、总结归纳、对比分析等方法,认识常见二糖、多糖的组成、结构、性质、用途。
2.通过设计并实施二糖性质探究实验以及淀粉水解程度判断实验,培养实验设计、操作和观察分析能力,发展学生证据推理与模型认知、科学探究与创新意识的核心素养。
学习目标
3.理论联系实际,认识二糖的用途,以及淀粉、纤维素在人体内的重要生理功能,体会学科价值,升华科学精神与社会责任。
学习重难点
重点:
二糖和多糖的结构与性质。
难点:
设计合理的实验方案判断淀粉的水解程度。
生活中的二糖和多糖
导入新课
这些食品中的 "糖" 有什么不同?让我们来探究一下二糖和多糖的神奇奥秘吧
课堂探究
一、二糖
【学习任务1】实验探究二糖的性质。
【实验设计1】麦芽糖和蔗糖是生活中最常见的二糖,它们是否是还原性糖?设计实验证明。
课堂探究
一、二糖
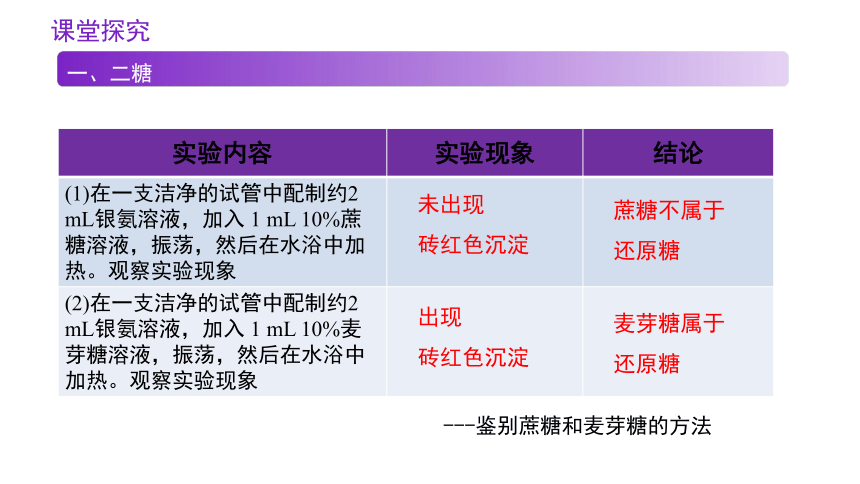
实验内容 实验现象 结论
(1)在一支洁净的试管中配制约2 mL银氨溶液,加入 1 mL 10%蔗糖溶液,振荡,然后在水浴中加热。观察实验现象
(2)在一支洁净的试管中配制约2 mL银氨溶液,加入 1 mL 10%麦芽糖溶液,振荡,然后在水浴中加热。观察实验现象
未出现
砖红色沉淀
出现
砖红色沉淀
蔗糖不属于还原糖
麦芽糖属于还原糖
---鉴别蔗糖和麦芽糖的方法
课堂探究
一、二糖
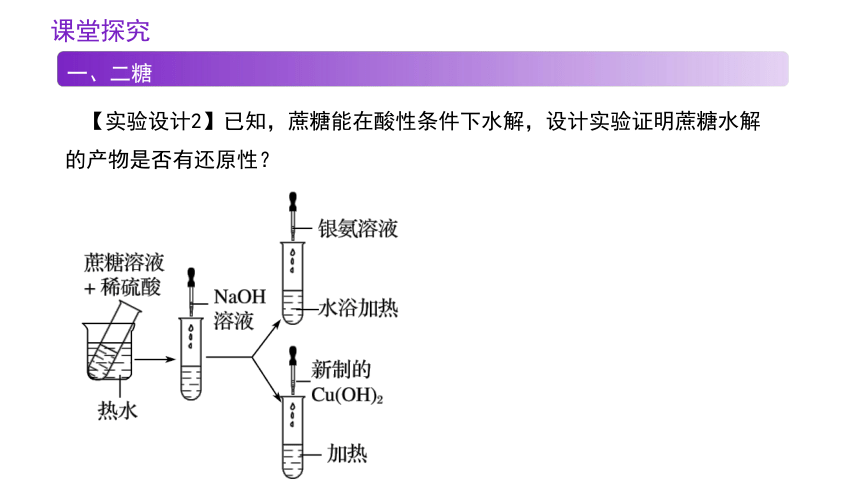
【实验设计2】已知,蔗糖能在酸性条件下水解,设计实验证明蔗糖水解的产物是否有还原性?
课堂探究
一、二糖
某同学向蔗糖溶液中滴加几滴稀硫酸,加热几分钟,然后加入银氨溶液,水浴加热,不能发生银镜反应,请分析该同学失误之处: ________
______________________________________________________________________。
银镜反应要在碱性条件下进行,故应先在蔗糖水解液中加入碱性溶液中和作催化剂的稀硫酸
保证糖类还原性实验成功的注意事项:
1.蔗糖的水解实验需要用水浴加热;
2.检验蔗糖的水解产物是否具有还原性时,一定要先加NaOH溶液中和作催化剂的稀硫酸至溶液呈碱性后,再加入新制的Cu(OH)2,否则实验会失败。
课堂探究
一、二糖
【学习任务2】阅读教材,结合实验总结蔗糖、麦芽糖在自然界中的分布和性质,二者的联系和区别。
1.存在:蔗糖是最常用的甜味剂,也是自然界中分布最广的一种二糖,存在于大多数植物体中,在甘蔗和甜菜中含量最丰富,常见食糖的主要成分都是蔗糖——白糖、红糖、冰糖;麦芽糖主要存在于发芽的谷粒和麦芽中,是淀粉水解过程中的一种中间产物,使用含淀粉酶的麦芽作用于淀粉可制得饴糖,其主要成分为麦芽糖。
课堂探究
一、二糖
2.物理性质:纯净的蔗糖为无色晶体,熔点为186℃,易溶于水;麦芽糖有甜味,但甜度不及蔗糖。
3.化学性质:
在酸或酶的作用下,蔗糖可水解生成葡萄糖和果糖。
酸或酶
C12H22O11+H2O
C6H12O6+ C6H12O6
蔗糖
葡萄糖
果糖
课堂探究
一、二糖
在酸或酶的作用下,麦芽糖可水解生成葡萄糖。
酸或酶
C12H22O11+H2O
2C6H12O6
麦芽糖
葡萄糖
4.关系:二者都为二糖,互为同分异构体。
课堂探究
一、二糖
(1)纯净的麦芽糖是白色晶体,易溶于水,有甜味( )
(2)蔗糖能发生银镜反应( )
(3)1 mol麦芽糖水解得到1 mol葡萄糖和1 mol果糖( )
(4)麦芽糖和蔗糖互为同分异构体( )
(5)麦芽糖和蔗糖的分子式相同,它们水解产物的分子式不相同( )
(6)用新制的Cu(OH)2可鉴别麦芽糖和蔗糖( )
√
评价任务1
×
×
√
×
√
课堂探究
二、多糖
淀粉是食物的一种重要成分,也是重要的工业原料。
1.以淀粉或淀粉水解生成的葡萄糖等为原料---发酵
燃料乙醇、白酒、食醋、味精,以及氨基酸、抗生素等药物。
2.淀粉酯化
可用于生产食品添加剂、表面活性剂和可降解塑料等。
课堂探究
二、多糖
3.纤维素的用途
(1)棉和麻的纤维大量用于纺织工业。
(2)一些富含纤维素的物质,如木材、秸秆等是造纸的原料。
(3)纤维素用来制造纤维素硝酸酯、纤维素乙酸酯和黏胶纤维。
课堂探究
二、多糖
【学习任务4】阅读教材,结合刚才的用途,总结淀粉和纤维素的区别和联系。
1.淀粉和纤维素是最重要的多糖,它们都是由大量葡萄糖单元相互连接组成的,属于天然有机高分子。
2.淀粉的相对分子质量可达到几十万,纤维素可达到几百万。
3.淀粉和纤维素的分子式可以表示为(C6H10O5)n,其中的葡萄糖单元中一般仍有三个羟基,所以也可表示为[C6H7O2(OH)3]n。
4.淀粉和纤维素分子中所包含的葡萄糖单元数目,即n值不同,因此不属于同分异构体。
课堂探究
二、多糖
【学习任务5】阅读教材,总结淀粉在自然界中的分布和性质。
1.存在
淀粉是绿色植物光合作用的产物,是植物储存营养物质的一种形式,在种子、块根和块茎中含量丰富,谷类和薯类含淀粉较多。
2.结构
天然淀粉中有直链淀粉和支链淀粉,支链淀粉含量很高的一些谷物,如糯米、糯玉米等有比较黏的口感。
3.物理性质
白色粉末,无甜味,不溶于冷水。热水中部分溶解,形成胶状的淀粉糊。
课堂探究
二、多糖
(1)淀粉的特征反应:遇碘单质变蓝,可以利用该性质检验淀粉或碘单质.
(2)淀粉不能被银氨溶液和氢氧化铜等弱氧化剂氧化,属于非还原糖。
(3)淀粉分子的葡萄糖单元中存在醇羟基,可以发生酯化反应。
(4)淀粉在酸或酶的作用下水解,最终生成葡萄糖。
酸或酶
(C6H10O5)n+nH2O
nC6H12O6
4.化学性质
课堂探究
二、多糖
【学习任务6】设计实验探究淀粉水解程度的判断(即淀粉未水解、部分水解、完全水解)。
现象 B
碘水
淀粉
溶液
水解液
中和液
现象 A
稀硫酸
微热
NaOH溶液
银氨溶液
加热
情况分类 现象 A 现象 B 结论
① 未出现银镜 溶液变成蓝色 淀粉尚未水解
② 出现银镜 溶液变成蓝色 淀粉部分水解
③ 出现银镜 溶液变成蓝色 淀粉完全水解
课堂探究
二、多糖
【学习任务7】阅读教材,总结纤维素的化学性质。
①纤维素的化学性质与淀粉的类似,在酸或酶的作用下水解,最终生成葡萄糖。
能够发生酯化反应。
②纤维素不能被银氨溶液和氢氧化铜等弱氧化剂氧化,属于非还原糖。
酸或酶
(C6H10O5)n+nH2O
nC6H12O6
纤维素在人体内不能水解,因为人体内没有纤维素酶,因此不能作为人类的能量来源。但适当摄入粗纤维食品,可以刺激肠道蠕动,助消化。
课堂探究
二、多糖
(C6H10O5)n
纤维素
含有羟基
纤维素硝酸酯——硝酸纤维
纤维素醋酸酯——醋酸纤维
黏胶纤维
化学处理
长纤维——人造丝
短纤维——人造棉
课堂练习
B
1.淀粉经过下列变化:淀粉→单糖→酒精→乙烯→……→草酸(HOOC—COOH)。在该变化过程中,下列反应类型一定没有发生的是( )
①加成反应 ②氧化反应 ③还原反应 ④消去反应 ⑤取代反应 ⑥水解反应 ⑦酯化反应 ⑧加聚反应
A.①③④ B.⑦⑧ C.④⑤⑥ D.①④⑥
课堂练习
C
2.某同学进行蔗糖的水解实验,并检验水解产物是否含有葡萄糖。他的操作如下:取少量蔗糖加适量水配成溶液;在蔗糖溶液中加入3~5滴稀硫酸;将混合液煮沸几分钟,冷却;在冷却后的溶液中加入银氨溶液,水浴加热。实验结果没有银镜产生。其原因是( )
A.蔗糖尚未水解
B.加热时间不够
C.煮沸后的溶液中没有加碱中和作催化剂的酸
D.蔗糖水解的产物中没有葡萄糖
课堂练习
C
3.通过实验来验证淀粉水解可生成还原糖包括下列操作过程,这些操作过程正确的顺序是( )
①取少量淀粉加水制成溶液 ②加热煮沸 ③加入碱液至溶液呈碱性 ④加入新制Cu(OH)2 ⑤加入几滴稀硫酸 ⑥再加热
A.①②⑤⑥④③ B.①⑤②④⑥③
C.①⑤②③④⑥ D.①⑥④⑤③②
课堂小结
布置作业
1.完成学案中的素养专练。
2.收集各种食品标签,分析其中二糖 / 多糖的成分,结合所学知识撰写《家庭食品糖分分析报告》。
谢谢大家
第2课时 二糖 多糖
第一节 糖类
化学
1.通过自主学习、总结归纳、对比分析等方法,认识常见二糖、多糖的组成、结构、性质、用途。
2.通过设计并实施二糖性质探究实验以及淀粉水解程度判断实验,培养实验设计、操作和观察分析能力,发展学生证据推理与模型认知、科学探究与创新意识的核心素养。
学习目标
3.理论联系实际,认识二糖的用途,以及淀粉、纤维素在人体内的重要生理功能,体会学科价值,升华科学精神与社会责任。
学习重难点
重点:
二糖和多糖的结构与性质。
难点:
设计合理的实验方案判断淀粉的水解程度。
生活中的二糖和多糖
导入新课
这些食品中的 "糖" 有什么不同?让我们来探究一下二糖和多糖的神奇奥秘吧
课堂探究
一、二糖
【学习任务1】实验探究二糖的性质。
【实验设计1】麦芽糖和蔗糖是生活中最常见的二糖,它们是否是还原性糖?设计实验证明。
课堂探究
一、二糖
实验内容 实验现象 结论
(1)在一支洁净的试管中配制约2 mL银氨溶液,加入 1 mL 10%蔗糖溶液,振荡,然后在水浴中加热。观察实验现象
(2)在一支洁净的试管中配制约2 mL银氨溶液,加入 1 mL 10%麦芽糖溶液,振荡,然后在水浴中加热。观察实验现象
未出现
砖红色沉淀
出现
砖红色沉淀
蔗糖不属于还原糖
麦芽糖属于还原糖
---鉴别蔗糖和麦芽糖的方法
课堂探究
一、二糖
【实验设计2】已知,蔗糖能在酸性条件下水解,设计实验证明蔗糖水解的产物是否有还原性?
课堂探究
一、二糖
某同学向蔗糖溶液中滴加几滴稀硫酸,加热几分钟,然后加入银氨溶液,水浴加热,不能发生银镜反应,请分析该同学失误之处: ________
______________________________________________________________________。
银镜反应要在碱性条件下进行,故应先在蔗糖水解液中加入碱性溶液中和作催化剂的稀硫酸
保证糖类还原性实验成功的注意事项:
1.蔗糖的水解实验需要用水浴加热;
2.检验蔗糖的水解产物是否具有还原性时,一定要先加NaOH溶液中和作催化剂的稀硫酸至溶液呈碱性后,再加入新制的Cu(OH)2,否则实验会失败。
课堂探究
一、二糖
【学习任务2】阅读教材,结合实验总结蔗糖、麦芽糖在自然界中的分布和性质,二者的联系和区别。
1.存在:蔗糖是最常用的甜味剂,也是自然界中分布最广的一种二糖,存在于大多数植物体中,在甘蔗和甜菜中含量最丰富,常见食糖的主要成分都是蔗糖——白糖、红糖、冰糖;麦芽糖主要存在于发芽的谷粒和麦芽中,是淀粉水解过程中的一种中间产物,使用含淀粉酶的麦芽作用于淀粉可制得饴糖,其主要成分为麦芽糖。
课堂探究
一、二糖
2.物理性质:纯净的蔗糖为无色晶体,熔点为186℃,易溶于水;麦芽糖有甜味,但甜度不及蔗糖。
3.化学性质:
在酸或酶的作用下,蔗糖可水解生成葡萄糖和果糖。
酸或酶
C12H22O11+H2O
C6H12O6+ C6H12O6
蔗糖
葡萄糖
果糖
课堂探究
一、二糖
在酸或酶的作用下,麦芽糖可水解生成葡萄糖。
酸或酶
C12H22O11+H2O
2C6H12O6
麦芽糖
葡萄糖
4.关系:二者都为二糖,互为同分异构体。
课堂探究
一、二糖
(1)纯净的麦芽糖是白色晶体,易溶于水,有甜味( )
(2)蔗糖能发生银镜反应( )
(3)1 mol麦芽糖水解得到1 mol葡萄糖和1 mol果糖( )
(4)麦芽糖和蔗糖互为同分异构体( )
(5)麦芽糖和蔗糖的分子式相同,它们水解产物的分子式不相同( )
(6)用新制的Cu(OH)2可鉴别麦芽糖和蔗糖( )
√
评价任务1
×
×
√
×
√
课堂探究
二、多糖
淀粉是食物的一种重要成分,也是重要的工业原料。
1.以淀粉或淀粉水解生成的葡萄糖等为原料---发酵
燃料乙醇、白酒、食醋、味精,以及氨基酸、抗生素等药物。
2.淀粉酯化
可用于生产食品添加剂、表面活性剂和可降解塑料等。
课堂探究
二、多糖
3.纤维素的用途
(1)棉和麻的纤维大量用于纺织工业。
(2)一些富含纤维素的物质,如木材、秸秆等是造纸的原料。
(3)纤维素用来制造纤维素硝酸酯、纤维素乙酸酯和黏胶纤维。
课堂探究
二、多糖
【学习任务4】阅读教材,结合刚才的用途,总结淀粉和纤维素的区别和联系。
1.淀粉和纤维素是最重要的多糖,它们都是由大量葡萄糖单元相互连接组成的,属于天然有机高分子。
2.淀粉的相对分子质量可达到几十万,纤维素可达到几百万。
3.淀粉和纤维素的分子式可以表示为(C6H10O5)n,其中的葡萄糖单元中一般仍有三个羟基,所以也可表示为[C6H7O2(OH)3]n。
4.淀粉和纤维素分子中所包含的葡萄糖单元数目,即n值不同,因此不属于同分异构体。
课堂探究
二、多糖
【学习任务5】阅读教材,总结淀粉在自然界中的分布和性质。
1.存在
淀粉是绿色植物光合作用的产物,是植物储存营养物质的一种形式,在种子、块根和块茎中含量丰富,谷类和薯类含淀粉较多。
2.结构
天然淀粉中有直链淀粉和支链淀粉,支链淀粉含量很高的一些谷物,如糯米、糯玉米等有比较黏的口感。
3.物理性质
白色粉末,无甜味,不溶于冷水。热水中部分溶解,形成胶状的淀粉糊。
课堂探究
二、多糖
(1)淀粉的特征反应:遇碘单质变蓝,可以利用该性质检验淀粉或碘单质.
(2)淀粉不能被银氨溶液和氢氧化铜等弱氧化剂氧化,属于非还原糖。
(3)淀粉分子的葡萄糖单元中存在醇羟基,可以发生酯化反应。
(4)淀粉在酸或酶的作用下水解,最终生成葡萄糖。
酸或酶
(C6H10O5)n+nH2O
nC6H12O6
4.化学性质
课堂探究
二、多糖
【学习任务6】设计实验探究淀粉水解程度的判断(即淀粉未水解、部分水解、完全水解)。
现象 B
碘水
淀粉
溶液
水解液
中和液
现象 A
稀硫酸
微热
NaOH溶液
银氨溶液
加热
情况分类 现象 A 现象 B 结论
① 未出现银镜 溶液变成蓝色 淀粉尚未水解
② 出现银镜 溶液变成蓝色 淀粉部分水解
③ 出现银镜 溶液变成蓝色 淀粉完全水解
课堂探究
二、多糖
【学习任务7】阅读教材,总结纤维素的化学性质。
①纤维素的化学性质与淀粉的类似,在酸或酶的作用下水解,最终生成葡萄糖。
能够发生酯化反应。
②纤维素不能被银氨溶液和氢氧化铜等弱氧化剂氧化,属于非还原糖。
酸或酶
(C6H10O5)n+nH2O
nC6H12O6
纤维素在人体内不能水解,因为人体内没有纤维素酶,因此不能作为人类的能量来源。但适当摄入粗纤维食品,可以刺激肠道蠕动,助消化。
课堂探究
二、多糖
(C6H10O5)n
纤维素
含有羟基
纤维素硝酸酯——硝酸纤维
纤维素醋酸酯——醋酸纤维
黏胶纤维
化学处理
长纤维——人造丝
短纤维——人造棉
课堂练习
B
1.淀粉经过下列变化:淀粉→单糖→酒精→乙烯→……→草酸(HOOC—COOH)。在该变化过程中,下列反应类型一定没有发生的是( )
①加成反应 ②氧化反应 ③还原反应 ④消去反应 ⑤取代反应 ⑥水解反应 ⑦酯化反应 ⑧加聚反应
A.①③④ B.⑦⑧ C.④⑤⑥ D.①④⑥
课堂练习
C
2.某同学进行蔗糖的水解实验,并检验水解产物是否含有葡萄糖。他的操作如下:取少量蔗糖加适量水配成溶液;在蔗糖溶液中加入3~5滴稀硫酸;将混合液煮沸几分钟,冷却;在冷却后的溶液中加入银氨溶液,水浴加热。实验结果没有银镜产生。其原因是( )
A.蔗糖尚未水解
B.加热时间不够
C.煮沸后的溶液中没有加碱中和作催化剂的酸
D.蔗糖水解的产物中没有葡萄糖
课堂练习
C
3.通过实验来验证淀粉水解可生成还原糖包括下列操作过程,这些操作过程正确的顺序是( )
①取少量淀粉加水制成溶液 ②加热煮沸 ③加入碱液至溶液呈碱性 ④加入新制Cu(OH)2 ⑤加入几滴稀硫酸 ⑥再加热
A.①②⑤⑥④③ B.①⑤②④⑥③
C.①⑤②③④⑥ D.①⑥④⑤③②
课堂小结
布置作业
1.完成学案中的素养专练。
2.收集各种食品标签,分析其中二糖 / 多糖的成分,结合所学知识撰写《家庭食品糖分分析报告》。
谢谢大家
