5.2.2 氨气 课件(共20张PPT) 人教版(2019)必修二
文档属性
| 名称 | 5.2.2 氨气 课件(共20张PPT) 人教版(2019)必修二 |  | |
| 格式 | pptx | ||
| 文件大小 | 8.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-06 22:28:10 | ||
图片预览








文档简介
(共20张PPT)
第五章 化工生产中的重要非金属元素
第二节 氮及其化合物
第2课时 氨气 铵盐
弗里茨·哈伯
合成氨是人类科学技术发展史上的一项重大成就,在很大程度上解决了地球上因粮食不足而导致的饥饿问题,是化学和技术对社会发展与进步的巨大贡献。
我们经常在城市的广场上看到美丽的喷泉,那么你知道,在实验室里也可以形成美丽的喷泉吗?这一节课,我们就来学习一种可以形成喷泉的物质---NH3 。
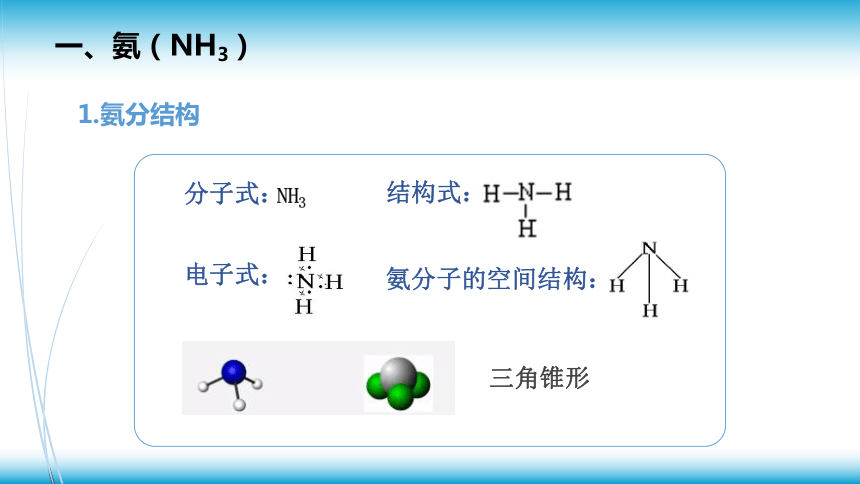
一、氨(NH3)
1.氨分结构
电子式:
结构式:
氨分子的空间结构:
三角锥形
分子式:
NH3
颜色、状态 气味 密度 特性 溶解性
2.物理性质
无色气体
刺激性
比空气小
易液化
一、氨(NH3)
极易溶于水1体积水能
溶解 700 体积的氨气
氨气
氨很容易液化,液化时放热。液氨汽化时要吸收大量的热,使周围温度急剧降低。因此,液氨可用作制冷剂
液氨
现象:
烧杯里的液体由玻璃管进入烧瓶,形成喷泉;烧瓶中的液体呈红色。
在干燥的圆底烧瓶里充满NH3,用带有玻璃
管和胶头滴管(预先吸入水)的橡胶塞塞紧瓶口。
倒置烧瓶,使玻璃管插入盛有水的烧杯中
(预先在水里滴入少量酚酞溶液)。
打开弹簧夹,挤压胶头滴管,使水进入烧瓶。
喷泉实验
【实验5-6】
结论:
氨极易溶于水;水溶液显碱性。
一、氨(NH3)
1.烧瓶内为什么会形成喷泉?
氨气极易溶于水。溶于水时,使烧瓶内压强急剧减小,
烧瓶内外形成较大压强差;大气压将水压入烧瓶。
想一想
还可以怎么引发喷泉实验?
2.若将NH3换为NO2,能否形成喷泉?
若能形成,则实验后液体能否充满烧瓶?
能,但不能充满烧瓶
3NO2+H2O==2HNO3+NO
一、氨(NH3)
喷泉是一种常见的自然现象,其产生的原因是存在压强差。常见能形成喷泉的物质组合
气体 吸收剂 原理
NH3 水 NH3、HCl均属于极易溶于水(常温下,NH3—1:700,HCl—1:500)
HCl CO2 NaOH溶液 三种气体均为酸性气体,均能与强碱溶液反应
SO2 Cl2 一、氨(NH3)
3.实验成败的关键是什么?
a.烧瓶要干燥;b.装置不漏气;c.气体应集满。
4.城市中常见的人造喷泉及火山爆发的原理与上述的原理一样吗?
相似点:都是利用内外压强差
不同点:前者压强小于大气压
后者压强大于大气压
想一想
一、氨(NH3)
(1)溶液变成红色说明了什么?
NH3·H2O NH4+ + OH-
NH3 + H2O NH3 H2O(一水合氨 )
氨水:
氨气溶于水形成的。氨水是混合物
氨溶于水溶液呈弱碱性
氨水的微粒:
NH3、
H2O、
NH3 H2O、
NH3 · H2O === NH3 ↑ + H2O
△
大部分NH3与水结合成 NH3·H2O,NH3·H2O中一小部分电离成NH4+和OH-。
OH- 、NH4+
、H+(极少量)
2.化学性质
一、氨(NH3)
用此来检验氨气的存在。
NH3·H2O是弱碱( ),为弱电解质,可以部分电离。
NH3·H2O能使酚酞溶液变红或者使紫色的石蕊试纸变蓝 。
氨水具有弱碱性,具有碱的通性
氨气溶于水时 (氨气的水溶液叫氨水),大部分的NH3分子与 H2O分子结合成NH3·H2O(一水合氨)。
一、氨(NH3)
思维启迪
名称 液氨 氨水
物质类别 纯净物 氢化物 非电解质 混合物
氨的水溶液
溶质为氨
粒子种类 NH3 NH3·H2O、NH3、H2O、
、OH-、H+
主要性质 不导电 不具有碱性 能导电
具有碱性
存在条件 常温常压下不存在 常温常压下可存在
液氨、氨水的区别
一、氨(NH3)
(2)氨跟酸的反应
——生成铵盐
沾有浓盐酸和浓氨水的玻璃棒靠近会产生大量白烟
NH3+HCl == NH4Cl
思考:浓氨水遇浓硫酸、浓硝酸也都会产生白烟吗?
2NH3 + H2SO4 = (NH4)2SO4
NH3+HNO3 = NH4NO3 (现象:白烟)
与挥发性酸反应才会有白烟
一、氨(NH3)
【应用】
管道工人用浓氨水检验氯气管道是否漏气,如
果管道某处漏气,会产生白烟,原理是什么
(已知2NH3+3Cl2====N2+6HCl)
提示:若氯气管道漏气,发生反应:
2NH3+3Cl2====N2+6HCl、
NH3+HCl====NH4Cl,产生的白烟是固体NH4Cl。
一、氨(NH3)
(3)氨跟氧气反应
催化剂
△
NH3+ O2 ===== NO+ H2O
氨的催化氧化是工业上制硝酸的基础。
— 氨的催化氧化
一、氨(NH3)
4.氨的用途和保存
硝酸
铵盐
纯碱
有机合成工业原料
用稀氨水治疗
蚊虫叮咬
消除
二氧化氮
的污染
吸收硫酸
生产中的
二氧化硫
制冷剂
2NH3+H2O+SO2===(NH4)2SO3
NH3+H2O+SO2===NH4HSO3
一、氨(NH3)
NH3
一、氨(NH3)
4.氨的用途和保存
氨水的保存方法:
氨水对许多金属有腐蚀作用,所以不能用金属容器盛装氨水。通常把氨水盛装在玻璃容器、橡皮袋、陶瓷坛或内涂沥青的铁桶里。
结构
物理性质
化学性质
氨的用途
喷泉实验
还原性
化肥、有机合成、制冷剂等
三角锥形
刺激性气味、极易溶于水、易液化
溶于水得氨水
与H+反应
课堂小结
氨的结构和性质
NH3+H2O NH3·H2O
NH3+HCl===NH4Cl
有白烟产生
4NH3+5O2 4NO+6H2O
催化剂
1.某化学兴趣小组利用下列图示装置探究氨的性质。
课堂练习
(1)①中湿润的红色石蕊试纸 。
(2)向②中滴入浓盐酸,现象为 ,反应的化学方程式: 。
变蓝
产生白烟
HCl===NH4Cl
NH3+
(3)将灼热的铂丝伸入③中锥形瓶,可观察到铂丝保持红热,有红棕色气体及少量白烟生成。该过程会同时发生多个反应,写出NH3和O2催化氧化的方程式 该反应为_____(填“吸热”或“放热”)反应,锥形瓶中出现的白烟物质为 。
放热
NH4NO3
一、氨(NH3)
2.喷泉是一种常见的自然现象,其产生的原因是存在压强差。
(1)装置图1中的气体a可能为①氯气、②氢气、③氨、④氯化氢、⑤二氧化碳。打开装置中的止水夹,挤压胶头滴管,若液体b为水时,能产生喷泉现象的气体a可能是 (填序号,下同);若液体b为氢氧化钠浓溶液时,能产生喷泉现象的气体a可能是 。
③④
①④
(2)如果只提供如图2的装置(气体为氨,液体为水),请说明引发喷泉的方法?
打开止水夹,用热毛巾捂住圆底烧瓶至有气泡从水中冒出,移去热毛巾
第五章 化工生产中的重要非金属元素
第二节 氮及其化合物
第2课时 氨气 铵盐
弗里茨·哈伯
合成氨是人类科学技术发展史上的一项重大成就,在很大程度上解决了地球上因粮食不足而导致的饥饿问题,是化学和技术对社会发展与进步的巨大贡献。
我们经常在城市的广场上看到美丽的喷泉,那么你知道,在实验室里也可以形成美丽的喷泉吗?这一节课,我们就来学习一种可以形成喷泉的物质---NH3 。
一、氨(NH3)
1.氨分结构
电子式:
结构式:
氨分子的空间结构:
三角锥形
分子式:
NH3
颜色、状态 气味 密度 特性 溶解性
2.物理性质
无色气体
刺激性
比空气小
易液化
一、氨(NH3)
极易溶于水1体积水能
溶解 700 体积的氨气
氨气
氨很容易液化,液化时放热。液氨汽化时要吸收大量的热,使周围温度急剧降低。因此,液氨可用作制冷剂
液氨
现象:
烧杯里的液体由玻璃管进入烧瓶,形成喷泉;烧瓶中的液体呈红色。
在干燥的圆底烧瓶里充满NH3,用带有玻璃
管和胶头滴管(预先吸入水)的橡胶塞塞紧瓶口。
倒置烧瓶,使玻璃管插入盛有水的烧杯中
(预先在水里滴入少量酚酞溶液)。
打开弹簧夹,挤压胶头滴管,使水进入烧瓶。
喷泉实验
【实验5-6】
结论:
氨极易溶于水;水溶液显碱性。
一、氨(NH3)
1.烧瓶内为什么会形成喷泉?
氨气极易溶于水。溶于水时,使烧瓶内压强急剧减小,
烧瓶内外形成较大压强差;大气压将水压入烧瓶。
想一想
还可以怎么引发喷泉实验?
2.若将NH3换为NO2,能否形成喷泉?
若能形成,则实验后液体能否充满烧瓶?
能,但不能充满烧瓶
3NO2+H2O==2HNO3+NO
一、氨(NH3)
喷泉是一种常见的自然现象,其产生的原因是存在压强差。常见能形成喷泉的物质组合
气体 吸收剂 原理
NH3 水 NH3、HCl均属于极易溶于水(常温下,NH3—1:700,HCl—1:500)
HCl CO2 NaOH溶液 三种气体均为酸性气体,均能与强碱溶液反应
SO2 Cl2 一、氨(NH3)
3.实验成败的关键是什么?
a.烧瓶要干燥;b.装置不漏气;c.气体应集满。
4.城市中常见的人造喷泉及火山爆发的原理与上述的原理一样吗?
相似点:都是利用内外压强差
不同点:前者压强小于大气压
后者压强大于大气压
想一想
一、氨(NH3)
(1)溶液变成红色说明了什么?
NH3·H2O NH4+ + OH-
NH3 + H2O NH3 H2O(一水合氨 )
氨水:
氨气溶于水形成的。氨水是混合物
氨溶于水溶液呈弱碱性
氨水的微粒:
NH3、
H2O、
NH3 H2O、
NH3 · H2O === NH3 ↑ + H2O
△
大部分NH3与水结合成 NH3·H2O,NH3·H2O中一小部分电离成NH4+和OH-。
OH- 、NH4+
、H+(极少量)
2.化学性质
一、氨(NH3)
用此来检验氨气的存在。
NH3·H2O是弱碱( ),为弱电解质,可以部分电离。
NH3·H2O能使酚酞溶液变红或者使紫色的石蕊试纸变蓝 。
氨水具有弱碱性,具有碱的通性
氨气溶于水时 (氨气的水溶液叫氨水),大部分的NH3分子与 H2O分子结合成NH3·H2O(一水合氨)。
一、氨(NH3)
思维启迪
名称 液氨 氨水
物质类别 纯净物 氢化物 非电解质 混合物
氨的水溶液
溶质为氨
粒子种类 NH3 NH3·H2O、NH3、H2O、
、OH-、H+
主要性质 不导电 不具有碱性 能导电
具有碱性
存在条件 常温常压下不存在 常温常压下可存在
液氨、氨水的区别
一、氨(NH3)
(2)氨跟酸的反应
——生成铵盐
沾有浓盐酸和浓氨水的玻璃棒靠近会产生大量白烟
NH3+HCl == NH4Cl
思考:浓氨水遇浓硫酸、浓硝酸也都会产生白烟吗?
2NH3 + H2SO4 = (NH4)2SO4
NH3+HNO3 = NH4NO3 (现象:白烟)
与挥发性酸反应才会有白烟
一、氨(NH3)
【应用】
管道工人用浓氨水检验氯气管道是否漏气,如
果管道某处漏气,会产生白烟,原理是什么
(已知2NH3+3Cl2====N2+6HCl)
提示:若氯气管道漏气,发生反应:
2NH3+3Cl2====N2+6HCl、
NH3+HCl====NH4Cl,产生的白烟是固体NH4Cl。
一、氨(NH3)
(3)氨跟氧气反应
催化剂
△
NH3+ O2 ===== NO+ H2O
氨的催化氧化是工业上制硝酸的基础。
— 氨的催化氧化
一、氨(NH3)
4.氨的用途和保存
硝酸
铵盐
纯碱
有机合成工业原料
用稀氨水治疗
蚊虫叮咬
消除
二氧化氮
的污染
吸收硫酸
生产中的
二氧化硫
制冷剂
2NH3+H2O+SO2===(NH4)2SO3
NH3+H2O+SO2===NH4HSO3
一、氨(NH3)
NH3
一、氨(NH3)
4.氨的用途和保存
氨水的保存方法:
氨水对许多金属有腐蚀作用,所以不能用金属容器盛装氨水。通常把氨水盛装在玻璃容器、橡皮袋、陶瓷坛或内涂沥青的铁桶里。
结构
物理性质
化学性质
氨的用途
喷泉实验
还原性
化肥、有机合成、制冷剂等
三角锥形
刺激性气味、极易溶于水、易液化
溶于水得氨水
与H+反应
课堂小结
氨的结构和性质
NH3+H2O NH3·H2O
NH3+HCl===NH4Cl
有白烟产生
4NH3+5O2 4NO+6H2O
催化剂
1.某化学兴趣小组利用下列图示装置探究氨的性质。
课堂练习
(1)①中湿润的红色石蕊试纸 。
(2)向②中滴入浓盐酸,现象为 ,反应的化学方程式: 。
变蓝
产生白烟
HCl===NH4Cl
NH3+
(3)将灼热的铂丝伸入③中锥形瓶,可观察到铂丝保持红热,有红棕色气体及少量白烟生成。该过程会同时发生多个反应,写出NH3和O2催化氧化的方程式 该反应为_____(填“吸热”或“放热”)反应,锥形瓶中出现的白烟物质为 。
放热
NH4NO3
一、氨(NH3)
2.喷泉是一种常见的自然现象,其产生的原因是存在压强差。
(1)装置图1中的气体a可能为①氯气、②氢气、③氨、④氯化氢、⑤二氧化碳。打开装置中的止水夹,挤压胶头滴管,若液体b为水时,能产生喷泉现象的气体a可能是 (填序号,下同);若液体b为氢氧化钠浓溶液时,能产生喷泉现象的气体a可能是 。
③④
①④
(2)如果只提供如图2的装置(气体为氨,液体为水),请说明引发喷泉的方法?
打开止水夹,用热毛巾捂住圆底烧瓶至有气泡从水中冒出,移去热毛巾
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
