2.2.1 化学平衡状态 课件(共19张PPT) 人教版(2019)选择性必修一
文档属性
| 名称 | 2.2.1 化学平衡状态 课件(共19张PPT) 人教版(2019)选择性必修一 |  | |
| 格式 | pptx | ||
| 文件大小 | 1016.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-06 22:52:26 | ||
图片预览



文档简介
(共19张PPT)
第一课时 化学平衡状态
第二节 化学平衡
工业合成氨
可逆反应有限度,即反应不能进行彻底。
氨气在国民经济中占有重要地位,随着人类社会的发展,对氨的需求量日益增长。
2NH3
N2 + 3H2
催化剂
高温、高压
如何提高生产效率呢?只考虑化学反应速率不够,还需考虑如何尽可能多地将原料转化为产品。
学习任务一:可逆反应
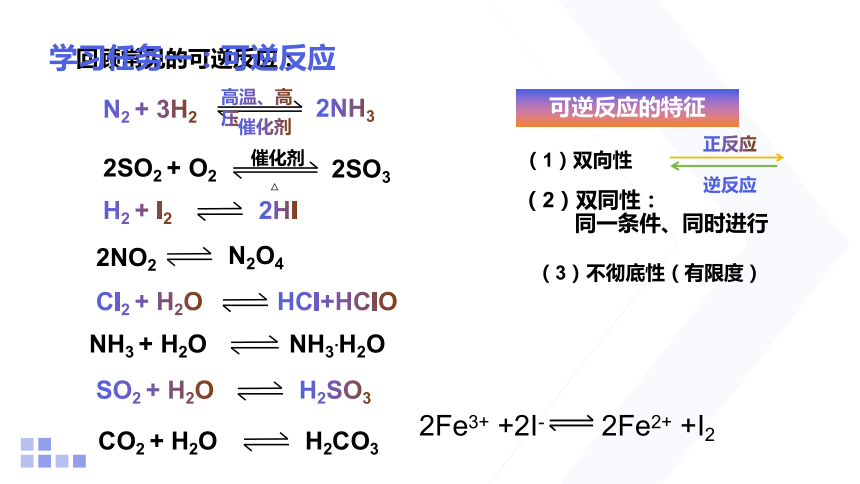
回顾常见的可逆反应:
2SO3
2SO2 + O2
△
催化剂
2NH3
N2 + 3H2
催化剂
高温、高压
2HI
H2 + I2
H2CO3
CO2 + H2O
H2SO3
SO2 + H2O
NH3.H2O
NH3 + H2O
HCl+HClO
Cl2 + H2O
N2O4
2NO2
可逆反应的特征
(2)双同性:
同一条件、同时进行
(3)不彻底性(有限度)
(1)双向性
正反应
逆反应
2Fe3+ +2I- 2Fe2+ +I2
学习任务一:可逆反应
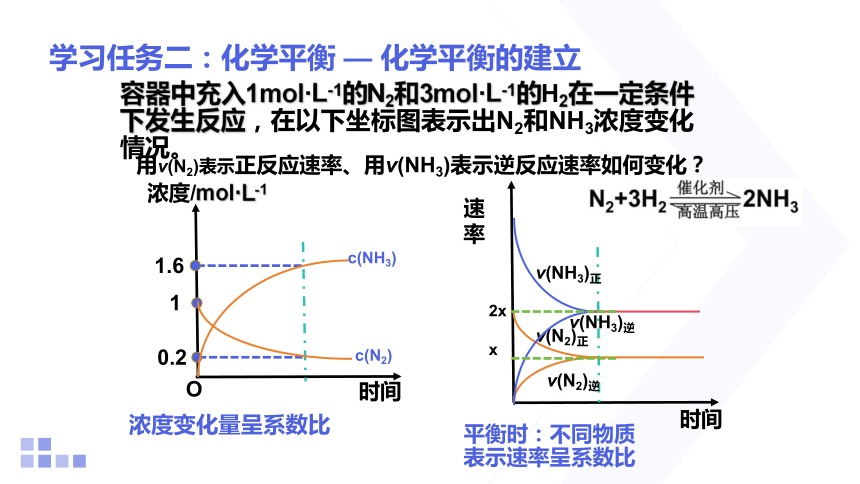
容器中充入1mol·L-1的N2和3mol·L-1的H2在一定条件下发生反应,在以下坐标图表示出N2和NH3浓度变化情况。
时间
O
浓度/mol·L-1
用v(N2)表示正反应速率、用v(NH3)表示逆反应速率如何变化?
时间
速率
1
0.2
1.6
c(N2)
c(NH3)
浓度变化量呈系数比
平衡时:不同物质表示速率呈系数比
v(N2)正
v(NH3)逆
v(N2)逆
v(NH3)正
2x
x
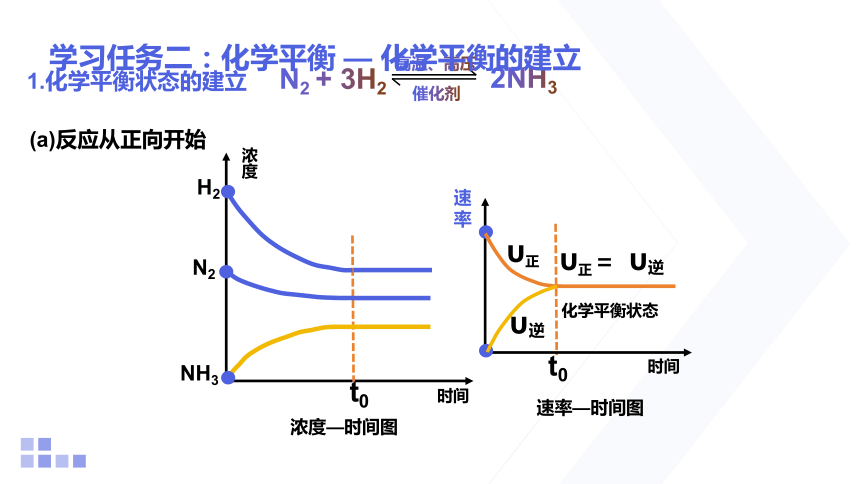
学习任务二:化学平衡 — 化学平衡的建立
浓度
时间
(a)反应从正向开始
2NH3
N2 + 3H2
催化剂
高温、高压
浓度—时间图
1.化学平衡状态的建立
H2
N2
NH3
时间
速率
υ正= υ逆
化学平衡状态
υ正
υ逆
t0
t0
速率—时间图
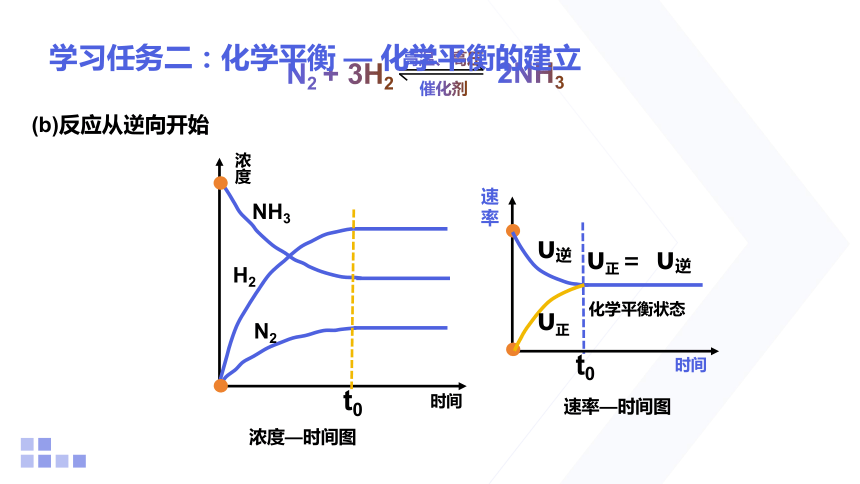
学习任务二:化学平衡 — 化学平衡的建立
浓度
时间
(b)反应从逆向开始
浓度—时间图
t0
H2
N2
NH3
时间
速率
υ正= υ逆
化学平衡状态
υ正
υ逆
t0
速率—时间图
2NH3
N2 + 3H2
催化剂
高温、高压
学习任务二:化学平衡 — 化学平衡的建立
在一定条件下的可逆反应里,当正、逆反应的速率相等时,反应物和生成物的浓度均保持不变,即体系的组成不随时间而改变,这表明该反应中物质的转化达到了“限度”,这时的状态我们称之为化学平衡状态,简称化学平衡。
达到化学平衡时,反应达到该条件下物质转化的最大“限度”,即反应物的转化率最大。
α = ×100%
变化量
起始量
转化率:
2.化学平衡概念:
学习任务二:化学平衡—化学平衡的概念
定
等
动
变
动态平衡
条件改变,原平衡状态被破坏,在新的条件下建立新的平衡
υ(正)= υ(逆)
改变影响化学反应速率的因素,如浓度、压强、温度,就有可能改变化学平衡
研究的对象是可逆反应
逆
υ(正)= υ(逆)≠0
各组分的含量保持一定,各组分的浓度保持一定。
3.化学平衡状态的特征:
学习任务二:化学平衡—化学平衡的特征
若有基元反应 : a A(g) +b B(g) c C(g) +d D(g)
达到化学平衡时, υ正= k正 ×ca(A)×cb(B)
υ逆= k逆 ×cc(C)×cd(D)
因平衡时υ正= υ逆,即k正 ×ca(A)×cb(B) = k逆 ×cc(C)×cd(D)
化学平衡中的速率常数
1.指的是同一物质。若是不同物质,则要化为同一物质进行比较(或者满足速率之比=化学计量数之比);
2.方向一定是一正一逆;
④ N2+ 3H2 2NH3
高温高压
催化剂
如:1.当v(N2)正:v(H2)逆=1:3时或者3v(N2)正=v(H2)逆时,
可作为反应达到平衡状态的判断依据;
2.当消耗1molN2时,同时消耗2molNH3 (或同时生成3molH2)时,
可作为反应达到平衡状态的判断依据;
1.当c(N2):c(H2):c(NH3)=1:3:2时,不作为反应达到平衡状态的判断依据;
!
3. 断裂3molH-H键的同时断裂6molN-H键,可作为反应达到平衡状态的判断依据;
2.当v(N2):v(H2):v(NH3)=1:3:2时,不作为反应达到平衡状态的判断依据;
v(正) =v(逆)>0
温度、气体密度、压强、气体平均摩尔质量
变→不变,套公式
温度:
对于任何一个可逆反应,若正反应为放热(吸热)反应,则逆
反应一定为吸热(放热)反应。在绝热条件下(没有特殊说明一般为恒温,即体系能自由热交换),当反应未达到平衡时,v(正)不等于v(逆),则放热不等于吸热,总体表现为向外界放出或
吸收热量,环境温度会发生变化。
容器体积一定时,有色气体(如:I2 、Br2、 NO2)的 颜色不再变化;
1.气体密度ρ气体=
V(总)
m(总)
2.气体平均分子质量M气体=
n(总)
m(总)
-
2.气体压强P气体:考虑气体物质的量
PV=nRT(R为常数)
各物质的浓度保持不变
类型一:无固体参加
当密度不变时,不能说明反应
达到平衡状态
当密度不变时,不能说明反应
达到平衡状态
PV=nRT
1.气体密度ρ气体=
V(总)
m(总)
A(g)+B(g) 2C(g)
思路:m(总)不变,考虑V
①恒温恒容:
②恒温恒压:
则V不变,ρ气体一直不变
反应前后气体系数一样,则n气体不变,V不变,ρ气体一直不变
类型二:有固体参加
当密度不变时,都可以说明反应达到平衡状态
1.气体密度ρ气体=
V(总)
m(总)
A(s)+3B(g) 2C(g)+D(g)
根据质量守恒,若未达到平衡时,气体m(总)变
①恒温恒容:
②恒温恒压:
则V不变,ρ气体变
反应前后气体系数一样,则n气体不变,V不变,ρ气体变
当压强不变时,都不能说明反应达到平衡状态
类型一:反应前后气体化学计量数之和不变
PV=nRT
A(g)+B(g) 2C(g)
①恒温恒容:
②恒温恒压:
反应前后气体系数一样,n气体不变,则P不变
P一直不变
2.压强
当压强不变时,能说明反应达到平衡状态
类型一:反应前后气体化学计量数之和改变
PV=nRT
2A(g)+B(g) 2C(g)
①恒温恒容:
②恒温恒压:
反应前后气体系数不一样,则n气体变,则P变
P一直不变
当压强不变时,不能说明反应达到平衡状态
2.压强
类型一:有固体参加
气体m(总)发生发生改变,n(总)不变,气体平均分子质量(平均摩尔质量)变
3.气体平均分子质量M气体=
n(总)
m(总)
-
A(s)+2B(g) 2C(g)
当气体平均摩尔质量不变时,可以说明反应
达到平衡状态
气体m(总)不变,n(总)不变,气体平均分子质量(平均摩尔质量)不变
3.气体平均分子质量M气体=
n(总)
m(总)
-
A(g)+B(g) 2C(g)
类型二:无固体参加,反应前后气体化学计量数之和不变
当气体平均摩尔质量不变时,不能说明反应
达到平衡状态
气体m(总)不变,n(总)变,气体平均分子质量(平均摩尔质量)变
3.气体平均分子质量M气体=
n(总)
m(总)
-
2A(g)+B(g) 2C(g)
类型三:无固体参加,反应前后气体化学计量数之和改变
当气体平均摩尔质量不变时,可以说明反应达到平衡状态
【小结】一看条件(恒温恒压、恒温恒容、绝热等);二看反应特点(状态、反应前后气体系数);
三想公式(变量)
练7:向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g) SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如右所示。由图可得出的正确结论是
A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.反应物的总能量低于生成物的总能量
D.△t1=△t2时,SO2的转化率:a~b段小于b~c段
D
图像分析:
(1)横坐标和纵坐标的含义
(2)曲线的斜率或者趋势
(3)曲线上的特殊点,如起点、终点、交点和拐点等
(4)根据需要运用辅助线,如等温线、等压线等
面
线
点
第一课时 化学平衡状态
第二节 化学平衡
工业合成氨
可逆反应有限度,即反应不能进行彻底。
氨气在国民经济中占有重要地位,随着人类社会的发展,对氨的需求量日益增长。
2NH3
N2 + 3H2
催化剂
高温、高压
如何提高生产效率呢?只考虑化学反应速率不够,还需考虑如何尽可能多地将原料转化为产品。
学习任务一:可逆反应
回顾常见的可逆反应:
2SO3
2SO2 + O2
△
催化剂
2NH3
N2 + 3H2
催化剂
高温、高压
2HI
H2 + I2
H2CO3
CO2 + H2O
H2SO3
SO2 + H2O
NH3.H2O
NH3 + H2O
HCl+HClO
Cl2 + H2O
N2O4
2NO2
可逆反应的特征
(2)双同性:
同一条件、同时进行
(3)不彻底性(有限度)
(1)双向性
正反应
逆反应
2Fe3+ +2I- 2Fe2+ +I2
学习任务一:可逆反应
容器中充入1mol·L-1的N2和3mol·L-1的H2在一定条件下发生反应,在以下坐标图表示出N2和NH3浓度变化情况。
时间
O
浓度/mol·L-1
用v(N2)表示正反应速率、用v(NH3)表示逆反应速率如何变化?
时间
速率
1
0.2
1.6
c(N2)
c(NH3)
浓度变化量呈系数比
平衡时:不同物质表示速率呈系数比
v(N2)正
v(NH3)逆
v(N2)逆
v(NH3)正
2x
x
学习任务二:化学平衡 — 化学平衡的建立
浓度
时间
(a)反应从正向开始
2NH3
N2 + 3H2
催化剂
高温、高压
浓度—时间图
1.化学平衡状态的建立
H2
N2
NH3
时间
速率
υ正= υ逆
化学平衡状态
υ正
υ逆
t0
t0
速率—时间图
学习任务二:化学平衡 — 化学平衡的建立
浓度
时间
(b)反应从逆向开始
浓度—时间图
t0
H2
N2
NH3
时间
速率
υ正= υ逆
化学平衡状态
υ正
υ逆
t0
速率—时间图
2NH3
N2 + 3H2
催化剂
高温、高压
学习任务二:化学平衡 — 化学平衡的建立
在一定条件下的可逆反应里,当正、逆反应的速率相等时,反应物和生成物的浓度均保持不变,即体系的组成不随时间而改变,这表明该反应中物质的转化达到了“限度”,这时的状态我们称之为化学平衡状态,简称化学平衡。
达到化学平衡时,反应达到该条件下物质转化的最大“限度”,即反应物的转化率最大。
α = ×100%
变化量
起始量
转化率:
2.化学平衡概念:
学习任务二:化学平衡—化学平衡的概念
定
等
动
变
动态平衡
条件改变,原平衡状态被破坏,在新的条件下建立新的平衡
υ(正)= υ(逆)
改变影响化学反应速率的因素,如浓度、压强、温度,就有可能改变化学平衡
研究的对象是可逆反应
逆
υ(正)= υ(逆)≠0
各组分的含量保持一定,各组分的浓度保持一定。
3.化学平衡状态的特征:
学习任务二:化学平衡—化学平衡的特征
若有基元反应 : a A(g) +b B(g) c C(g) +d D(g)
达到化学平衡时, υ正= k正 ×ca(A)×cb(B)
υ逆= k逆 ×cc(C)×cd(D)
因平衡时υ正= υ逆,即k正 ×ca(A)×cb(B) = k逆 ×cc(C)×cd(D)
化学平衡中的速率常数
1.指的是同一物质。若是不同物质,则要化为同一物质进行比较(或者满足速率之比=化学计量数之比);
2.方向一定是一正一逆;
④ N2+ 3H2 2NH3
高温高压
催化剂
如:1.当v(N2)正:v(H2)逆=1:3时或者3v(N2)正=v(H2)逆时,
可作为反应达到平衡状态的判断依据;
2.当消耗1molN2时,同时消耗2molNH3 (或同时生成3molH2)时,
可作为反应达到平衡状态的判断依据;
1.当c(N2):c(H2):c(NH3)=1:3:2时,不作为反应达到平衡状态的判断依据;
!
3. 断裂3molH-H键的同时断裂6molN-H键,可作为反应达到平衡状态的判断依据;
2.当v(N2):v(H2):v(NH3)=1:3:2时,不作为反应达到平衡状态的判断依据;
v(正) =v(逆)>0
温度、气体密度、压强、气体平均摩尔质量
变→不变,套公式
温度:
对于任何一个可逆反应,若正反应为放热(吸热)反应,则逆
反应一定为吸热(放热)反应。在绝热条件下(没有特殊说明一般为恒温,即体系能自由热交换),当反应未达到平衡时,v(正)不等于v(逆),则放热不等于吸热,总体表现为向外界放出或
吸收热量,环境温度会发生变化。
容器体积一定时,有色气体(如:I2 、Br2、 NO2)的 颜色不再变化;
1.气体密度ρ气体=
V(总)
m(总)
2.气体平均分子质量M气体=
n(总)
m(总)
-
2.气体压强P气体:考虑气体物质的量
PV=nRT(R为常数)
各物质的浓度保持不变
类型一:无固体参加
当密度不变时,不能说明反应
达到平衡状态
当密度不变时,不能说明反应
达到平衡状态
PV=nRT
1.气体密度ρ气体=
V(总)
m(总)
A(g)+B(g) 2C(g)
思路:m(总)不变,考虑V
①恒温恒容:
②恒温恒压:
则V不变,ρ气体一直不变
反应前后气体系数一样,则n气体不变,V不变,ρ气体一直不变
类型二:有固体参加
当密度不变时,都可以说明反应达到平衡状态
1.气体密度ρ气体=
V(总)
m(总)
A(s)+3B(g) 2C(g)+D(g)
根据质量守恒,若未达到平衡时,气体m(总)变
①恒温恒容:
②恒温恒压:
则V不变,ρ气体变
反应前后气体系数一样,则n气体不变,V不变,ρ气体变
当压强不变时,都不能说明反应达到平衡状态
类型一:反应前后气体化学计量数之和不变
PV=nRT
A(g)+B(g) 2C(g)
①恒温恒容:
②恒温恒压:
反应前后气体系数一样,n气体不变,则P不变
P一直不变
2.压强
当压强不变时,能说明反应达到平衡状态
类型一:反应前后气体化学计量数之和改变
PV=nRT
2A(g)+B(g) 2C(g)
①恒温恒容:
②恒温恒压:
反应前后气体系数不一样,则n气体变,则P变
P一直不变
当压强不变时,不能说明反应达到平衡状态
2.压强
类型一:有固体参加
气体m(总)发生发生改变,n(总)不变,气体平均分子质量(平均摩尔质量)变
3.气体平均分子质量M气体=
n(总)
m(总)
-
A(s)+2B(g) 2C(g)
当气体平均摩尔质量不变时,可以说明反应
达到平衡状态
气体m(总)不变,n(总)不变,气体平均分子质量(平均摩尔质量)不变
3.气体平均分子质量M气体=
n(总)
m(总)
-
A(g)+B(g) 2C(g)
类型二:无固体参加,反应前后气体化学计量数之和不变
当气体平均摩尔质量不变时,不能说明反应
达到平衡状态
气体m(总)不变,n(总)变,气体平均分子质量(平均摩尔质量)变
3.气体平均分子质量M气体=
n(总)
m(总)
-
2A(g)+B(g) 2C(g)
类型三:无固体参加,反应前后气体化学计量数之和改变
当气体平均摩尔质量不变时,可以说明反应达到平衡状态
【小结】一看条件(恒温恒压、恒温恒容、绝热等);二看反应特点(状态、反应前后气体系数);
三想公式(变量)
练7:向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g) SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如右所示。由图可得出的正确结论是
A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.反应物的总能量低于生成物的总能量
D.△t1=△t2时,SO2的转化率:a~b段小于b~c段
D
图像分析:
(1)横坐标和纵坐标的含义
(2)曲线的斜率或者趋势
(3)曲线上的特殊点,如起点、终点、交点和拐点等
(4)根据需要运用辅助线,如等温线、等压线等
面
线
点
