广西省南宁市第三中学2024-2025学年高三下学期6月收网考试化学试卷(含答案)
文档属性
| 名称 | 广西省南宁市第三中学2024-2025学年高三下学期6月收网考试化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 5.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-07 14:22:43 | ||
图片预览




文档简介
广西南宁三中2024-2025学年高三下学期6月收网题化学试题
一、单选题
1.化学与人类的生产、生活密切相关。下列说法错误的是
A.“福建舰”海水浸泡区的铝基可保障船体不易腐蚀,利用了牺牲阳极保护法
B.作为纳米荧光材料的碳量子点属于胶体
C.建筑材料沙子的主要成分二氧化硅属于酸性氧化物
D.“神舟十九号”宇航员安装防护罩使用的高强度碳纤维操纵杆属于新型无机非金属材料
2.高活性人工固氮产物的合成原理为。下列有关化学用语表述错误的是
A.LiH的电子式为
B.石墨中碳原子的杂化轨道示意图为
C.的VSEPR模型为
D.基态氮原子电子排布图为
3.用下列实验装置进行相关实验,能达到实验目的的是
A.配制0.1mol/LNaOH溶液 B.分离淀粉胶体和食盐水
C.蒸干Fe2(SO4)3溶液得无水Fe2(SO4)3晶体 D.干燥CO2
A.A B.B C.C D.D
4.苯巴比妥是一种安眠药,其结构如图所示。下列关于苯巴比妥的叙述中错误的是
A.能发生加成、氧化、取代反应
B.分子中所有碳原子不可以共平面
C.1mol分子最多与4molNaOH发生反应
D.与足量H2加成后含2个手性碳原子
5.下列对事实的解释或说明正确的是
事实 解释或说明
A 熔点:SiO2>SiCl4 键能:Si-O键>Si-Cl键
B 用杯酚分离C60和C70 杯酚与C60通过配位键形成超分子
C 缺角的氯化钠晶体在饱和NaCl溶液中慢慢变为完美的立方体 晶体具有各向异性
D 单质硫()难溶于水,易溶于 是极性分子,和是非极性分子
A.A B.B C.C D.D
6.下列离子方程式正确的是
A.用漂粉精消毒游泳池:
B.向溶液中滴入过量溴水:
C.用氨水在空气中吸收SO2制备硫酸铵:
D.溶液与溶液反应生成黑色沉淀:
7.我国科学家发现了一种锂载体物质(),可显著提高锂离子电池的性能。已知短周期元素X、Y、Z、W的原子序数依次增大,X、Y、Z同周期,与同主族,的核外电子占5个原子轨道且有2个未成对电子。的核电荷数等于的最外层电子数。下列叙述正确的是
A.电负性:YB.与的分子空间构型相同
C.、Z的简单氢化物混合时,分子间形成的氢键有4种
D.X、W的最高价氧化物对应水化物均为强酸
8.下列实验过程可以达到实验目的的是
选项 实验过程 实验目的
A 向10mL0.1mol/LNaOH溶液中滴入5滴同浓度MgCl2溶液后再滴入5滴同浓度FeCl3溶液,先出现白色沉淀,后出现红褐色沉淀 验证
B 将少量Zn片放入FeCl3溶液中 证明Zn的金属性比Fe强
C 向某钾盐中滴加浓盐酸,将产生的气体通入品红溶液中,品红溶液褪色 验证某钾盐为K2SO3
D 用pH计测量相同条件下同浓度NaClO、CH3COONa溶液的 比较HClO、CH3COOH酸性强弱
A.A B.B C.C D.D
9.磷化氢是一种在空气中能自燃的剧毒气体,可通过以下流程制取:
设NA为阿伏加德罗常数的值,下列说法正确的是
A.溶液中含有的数目为NA
B.含有的孤电子对数为0.1NA
C.白磷中所含键的数目为2NA
D.常温下,1molH3PO2发生分解反应转移的电子数为4NA
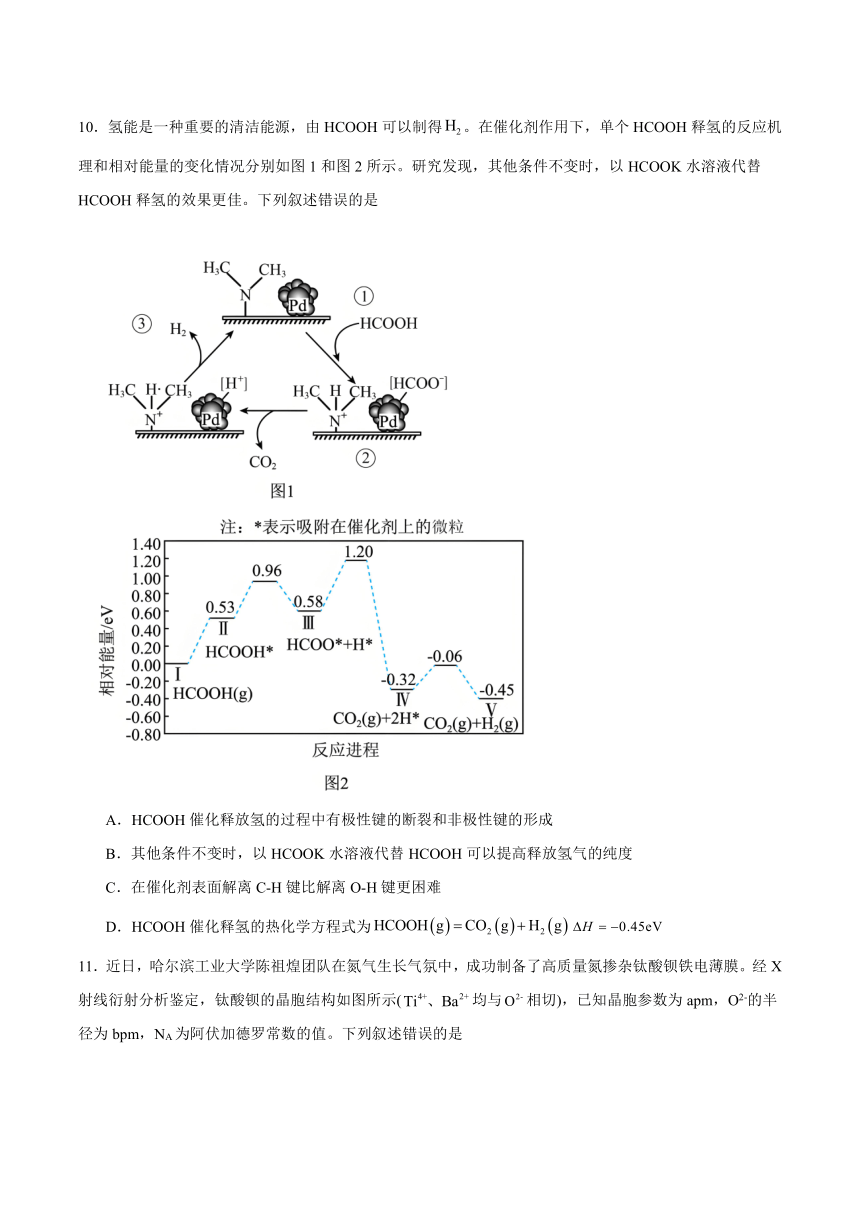
10.氢能是一种重要的清洁能源,由HCOOH可以制得。在催化剂作用下,单个HCOOH释氢的反应机理和相对能量的变化情况分别如图1和图2所示。研究发现,其他条件不变时,以HCOOK水溶液代替HCOOH释氢的效果更佳。下列叙述错误的是
A.HCOOH催化释放氢的过程中有极性键的断裂和非极性键的形成
B.其他条件不变时,以HCOOK水溶液代替HCOOH可以提高释放氢气的纯度
C.在催化剂表面解离C-H键比解离O-H键更困难
D.HCOOH催化释氢的热化学方程式为
11.近日,哈尔滨工业大学陈祖煌团队在氮气生长气氛中,成功制备了高质量氮掺杂钛酸钡铁电薄膜。经X射线衍射分析鉴定,钛酸钡的晶胞结构如图所示(均与相切),已知晶胞参数为apm,O2-的半径为bpm,NA为阿伏加德罗常数的值。下列叙述错误的是
A.钛酸钡的化学式为
B.r(Ba2+)=pm
C.题中涉及的元素属于周期表s区和d区
D.钛酸钡晶体密度
12.大连化物所邓德会团队实现了基于均多相融合的热—电耦合催化室温空气直接转化制HNO3反应的新过程。电解装置如图所示,已知石墨电极a上有气泡冒出,电解液为Li2SO4/H2SO4溶液(pH=3),下列说法正确的是
A.电解时,电流由电极a经导线流入电极b
B.电解时,阳极附近溶液的pH将升高
C.电解时,阴极上O2发生反应的离子方程式为O2+2e-+2H+=H2O2
D.电解时,当电极a上产生22.4LO2(标准状况)时,阴极区将产生0.8molHNO3
13.中国从人工合成淀粉被国际学术界认为是影响世界的重大颠覆性技术,合成步骤由60多步缩减到11步,突破了自然界淀粉合成的复杂调控障碍。其中加氢的主要反应如下。
反应ⅰ:
反应ⅱ:
向密闭容器中通入的混合气体,在不同压强(、)、不同温度下,平衡体系中的转化率、和CO的选择性随温度的变化如图所示。
下列说法错误的是
A.压强:
B.曲线①、⑤分别表示平衡体系中的选择性和的转化率
C.235℃时,m点体系中
D.随着温度升高,与的平衡转化率之比先减小后增大
14.已知常温下水溶液中的分布分数[如表示的分布分数]随变化曲线如图1;溶液中和关系如图2。用溶液滴定溶液,下列说法错误的是
A.曲线a表示
B.酸性:
C.滴定过程中溶液会有沉淀,
D.滴定过程中始终存在:
二、解答题
15.光学性能优异的量子点是一类尺寸在1nm~10nm的半导体纳米晶体,当紫外光作用在量子点上时会发出荧光,量子点的尺寸不同,荧光颜色对应不同。CdTe(碲化镉)其制备的原理和步骤如下:
制备原理:;。
已知:
①RSH代指巯基乙酸,结构简式为;
②Te与S同族,在空气中以+4价稳定存在。
步骤I:按照如下图所示搭建反应装置。
步骤Ⅱ:向C中加入250mL蒸馏水和0.23g的CdCl2·2.5H2O,搅拌溶解,通入氮气,再加入8滴RSH,用2mol·L-1的NaOH溶液调节pH为8~9,继续通入氮气。
步骤Ⅲ:用滴管将NaHTe溶液快速一次性加入到C中。开始加热,反应一段时间,可得到由RSH修饰的CdTe量子点产物。
回答下列问题:
(1)仪器A的名称为 。元素Te与S同族,则Te的价电子排布式为 。
(2)用NaOH溶液调节pH的目的是 。
(3)NaHTe溶液是利用NaBH4与Te在水中反应得到,其余产物是H2和Na2B4O7,则反应的化学方程式为 ;步骤Ⅱ中N2的作用为 。
(4)RSH修饰的CdTe量子点产物是 原子与Cd2+之间以配位键结合而成。
(5)步骤Ⅲ中,可用紫外光照射以监测反应进程,当观察到 (填现象)时,说明CdTe量子点生长基本停止,制备完成。
(6)Te粉中Te质量分数的测定,步骤如下:
①取5.0gTe粉,加入某酸使其转化为亚碲酸,将其配制成100mL溶液,取20.00mL溶液于锥形瓶中。
②往锥形瓶中加入酸性溶液,充分反应使亚碲酸转化为碲。
③往锥形瓶中加入指示剂,用硫酸亚铁铵标准溶液滴定剩余的酸性溶液,进行三次平行实验,平均消耗12.00mL硫酸亚铁铵标准溶液。
试计算Te粉中Te的质量分数为 。(列出计算式即可)
16.广西是我国重要的稀土资源基地,稀土(RE)包括镧(La)、铈(Ce)等元素,从离子型稀土矿(含Fe、Al等元素)中提取稀土元素并获得高附加值产品的一种工艺流程如图所示。
已知:该工艺下,除铈(Ce)外,稀土离子保持+3价不变;草酸可与多种过渡金属离子形成可溶性配位化合物;金属离子形成氢氧化物沉淀的相关pH见下表。
开始沉淀时的pH 1.5 4.3 5.6
沉淀完全时的pH 3.2 5.5 /
回答下列问题:
(1)“预中和”工序中,适宜的pH范围是 。
(2)利用离子交换法浸出稀土的过程如图所示。已知离子半径越小、电荷数越大,离子交换能力越强。下列离子对交换能力最强的是___________。
A. B. C. D.
(3)“草酸化”过程中,测得稀土(RE)的沉淀率随的变化情况如图所示。当草酸用量过多时,稀土(RE)的沉淀率下降的原因是 。
(4)“沉淀”工序产物为 [填“”或“”],理由是 。{,}。(当反应的时可认为反应完全)
(5)含氟稀土抛光粉的主要成分为,“焙烧”时发生反应的化学方程式为 。
(6)氧化铈()常用作玻璃工业添加剂,在其立方晶胞中掺杂,占据原来的位置,可以得到更稳定的结构,这种稳定的结构使得氧化铈具有许多独特的性质和应用,晶胞中与最近的核间距为apm。(已知:)
①若掺杂Y2O3后得到n(CeO2):n(Y2O3)=0.6:0.2的晶体,则此晶体中的空缺率为 。
②晶体的密度为 (列出表达式)。
17.1,3-丁二烯是石油化工的重要原料,采用CO2氧化1-丁烯脱氢生产1,3-丁二烯既可以实现1-丁烯高值转化,又可以实现的资源化利用。发生的反应如下:
反应I: ΔH1=akJ·mol-1
同时还发生以下副反应:
反应Ⅱ: ΔH2=bkJ·mol-1
反应Ⅲ: ΔH3=+46kJ·mol-1
已知:b>46
回答下列问题:
(1)a= kJ·mol-1(用含b的式子表示),反应I在 (填“高温”或“低温”)下能自发进行。
(2)反应I的平衡常数为K1,反应Ⅱ的平衡常数为K2,反应Ⅲ的平衡常数为K3。图1为lgK1、lgK2、lgK3与温度的关系曲线,图2为体积分数与温度的关系曲线。
①x= 。
②图2中,温度低于时,随温度升高增大的原因为 。
(3)600℃时,恒定总压0.10MPa,以起始物质的量均为1mol的1-丁烯、CO2投料,达平衡时,测得1-丁烯和CO2的转化率分别为80%、10%。则600℃时,反应Ⅱ的平衡常数Kp= (列出计算式)。
(4)电化学催化还原乙炔法条件温和,安全性高。在室温下,某团队以溶液为电解液,电催化还原乙炔制备1,3-丁二烯。写出生成1,3-丁二烯的电极反应式 。
(5)1,3-丁二烯与HBr发生加成反应分两步:第一步H+进攻1,3-丁二烯生成碳正离子();第二步Br-进攻碳正离子完成1,2-加成或1,4-加成。反应进程中的能量变化如图所示。
由阿伦尼乌斯公式推知,同一反应在不同温度(T)下,反应速率常数(k)与活化能(Ea)的关系如下:(其中R为常数)。其他条件不变的情况下,升高温度,更有利提高 (填“1,2-加成”或“1,4-加成”)的反应速率。
18.化合物G是一种化疗药物的活性成分,一种合成路线如图所示(部分条件和溶剂已省略):
回答下列问题:
(1)用于制备ClCH2COCl的原料ClCH2COOH的化学名称为 。
(2)D到E的反应类型是 ,F中含氧官能团的名称除了醚键外还有 。
(3)A到B的反应中,羧基对位的酚羟基优先反应的可能原因是 。
(4)E生成F的反应中,有副产物N生成,N为F的同分异构体且具有与F相同的环状结构。写出生成N的化学方程 。
(5)符合下列条件的B的含苯环同分异构体共有 种。
①遇Fe3+发生显色反应;②分子结构中含;③核磁共振氢谱显示有4组峰
(6)氨基具有较强的还原性。参照上述合成路线,以和甲醇为原料,一种合成的路线如下:
①写出M的结构简式:M 。
②步骤Ⅰ与步骤Ⅱ顺序 (填“能”或“不能”)可以互换,原因是 。
参考答案
1.B
2.C
3.C
4.D
5.D
6.C
7.C
8.D
9.B
10.D
11.C
12.C
13.D
14.D
15.(1) 球形冷凝管 5s25p4
(2)使正向进行,增大浓度
(3) 4NaBH4+2Te+7H2O=2NaHTe+Na2B4O7+14H2↑ 排尽装置内空气,防止NaHTe被氧化
(4)硫(或S)
(5)荧光颜色不再变化
(6)
16.(1)3.2≤pH<4.3
(2)C
(3)草酸与RE3+离子形成可溶性配位化合物
(4) 计算的平衡常数K=>105,该反应正向可以完全转化
(5)
(6) 10%
17.(1) b+46 高温
(2) 0 反应Ⅱ正向进行的程度大于反应Ⅲ
(3)
(4)
(5)1,4-加成
18.(1)氯乙酸或2-氯乙酸
(2) 还原反应 酯基、酰胺基
(3)羧基邻位的羟基与羧基形成分子内氢键,因此对位的羟基优先反应
(4)
(5)8
(6) 不能 氨基具有较强还原性,若先还原步骤Ⅱ,在步骤Ⅰ的浓硫酸、加热条件下氨基可能会发生副反应,不利于最后一步形成酰胺基
一、单选题
1.化学与人类的生产、生活密切相关。下列说法错误的是
A.“福建舰”海水浸泡区的铝基可保障船体不易腐蚀,利用了牺牲阳极保护法
B.作为纳米荧光材料的碳量子点属于胶体
C.建筑材料沙子的主要成分二氧化硅属于酸性氧化物
D.“神舟十九号”宇航员安装防护罩使用的高强度碳纤维操纵杆属于新型无机非金属材料
2.高活性人工固氮产物的合成原理为。下列有关化学用语表述错误的是
A.LiH的电子式为
B.石墨中碳原子的杂化轨道示意图为
C.的VSEPR模型为
D.基态氮原子电子排布图为
3.用下列实验装置进行相关实验,能达到实验目的的是
A.配制0.1mol/LNaOH溶液 B.分离淀粉胶体和食盐水
C.蒸干Fe2(SO4)3溶液得无水Fe2(SO4)3晶体 D.干燥CO2
A.A B.B C.C D.D
4.苯巴比妥是一种安眠药,其结构如图所示。下列关于苯巴比妥的叙述中错误的是
A.能发生加成、氧化、取代反应
B.分子中所有碳原子不可以共平面
C.1mol分子最多与4molNaOH发生反应
D.与足量H2加成后含2个手性碳原子
5.下列对事实的解释或说明正确的是
事实 解释或说明
A 熔点:SiO2>SiCl4 键能:Si-O键>Si-Cl键
B 用杯酚分离C60和C70 杯酚与C60通过配位键形成超分子
C 缺角的氯化钠晶体在饱和NaCl溶液中慢慢变为完美的立方体 晶体具有各向异性
D 单质硫()难溶于水,易溶于 是极性分子,和是非极性分子
A.A B.B C.C D.D
6.下列离子方程式正确的是
A.用漂粉精消毒游泳池:
B.向溶液中滴入过量溴水:
C.用氨水在空气中吸收SO2制备硫酸铵:
D.溶液与溶液反应生成黑色沉淀:
7.我国科学家发现了一种锂载体物质(),可显著提高锂离子电池的性能。已知短周期元素X、Y、Z、W的原子序数依次增大,X、Y、Z同周期,与同主族,的核外电子占5个原子轨道且有2个未成对电子。的核电荷数等于的最外层电子数。下列叙述正确的是
A.电负性:Y
C.、Z的简单氢化物混合时,分子间形成的氢键有4种
D.X、W的最高价氧化物对应水化物均为强酸
8.下列实验过程可以达到实验目的的是
选项 实验过程 实验目的
A 向10mL0.1mol/LNaOH溶液中滴入5滴同浓度MgCl2溶液后再滴入5滴同浓度FeCl3溶液,先出现白色沉淀,后出现红褐色沉淀 验证
B 将少量Zn片放入FeCl3溶液中 证明Zn的金属性比Fe强
C 向某钾盐中滴加浓盐酸,将产生的气体通入品红溶液中,品红溶液褪色 验证某钾盐为K2SO3
D 用pH计测量相同条件下同浓度NaClO、CH3COONa溶液的 比较HClO、CH3COOH酸性强弱
A.A B.B C.C D.D
9.磷化氢是一种在空气中能自燃的剧毒气体,可通过以下流程制取:
设NA为阿伏加德罗常数的值,下列说法正确的是
A.溶液中含有的数目为NA
B.含有的孤电子对数为0.1NA
C.白磷中所含键的数目为2NA
D.常温下,1molH3PO2发生分解反应转移的电子数为4NA
10.氢能是一种重要的清洁能源,由HCOOH可以制得。在催化剂作用下,单个HCOOH释氢的反应机理和相对能量的变化情况分别如图1和图2所示。研究发现,其他条件不变时,以HCOOK水溶液代替HCOOH释氢的效果更佳。下列叙述错误的是
A.HCOOH催化释放氢的过程中有极性键的断裂和非极性键的形成
B.其他条件不变时,以HCOOK水溶液代替HCOOH可以提高释放氢气的纯度
C.在催化剂表面解离C-H键比解离O-H键更困难
D.HCOOH催化释氢的热化学方程式为
11.近日,哈尔滨工业大学陈祖煌团队在氮气生长气氛中,成功制备了高质量氮掺杂钛酸钡铁电薄膜。经X射线衍射分析鉴定,钛酸钡的晶胞结构如图所示(均与相切),已知晶胞参数为apm,O2-的半径为bpm,NA为阿伏加德罗常数的值。下列叙述错误的是
A.钛酸钡的化学式为
B.r(Ba2+)=pm
C.题中涉及的元素属于周期表s区和d区
D.钛酸钡晶体密度
12.大连化物所邓德会团队实现了基于均多相融合的热—电耦合催化室温空气直接转化制HNO3反应的新过程。电解装置如图所示,已知石墨电极a上有气泡冒出,电解液为Li2SO4/H2SO4溶液(pH=3),下列说法正确的是
A.电解时,电流由电极a经导线流入电极b
B.电解时,阳极附近溶液的pH将升高
C.电解时,阴极上O2发生反应的离子方程式为O2+2e-+2H+=H2O2
D.电解时,当电极a上产生22.4LO2(标准状况)时,阴极区将产生0.8molHNO3
13.中国从人工合成淀粉被国际学术界认为是影响世界的重大颠覆性技术,合成步骤由60多步缩减到11步,突破了自然界淀粉合成的复杂调控障碍。其中加氢的主要反应如下。
反应ⅰ:
反应ⅱ:
向密闭容器中通入的混合气体,在不同压强(、)、不同温度下,平衡体系中的转化率、和CO的选择性随温度的变化如图所示。
下列说法错误的是
A.压强:
B.曲线①、⑤分别表示平衡体系中的选择性和的转化率
C.235℃时,m点体系中
D.随着温度升高,与的平衡转化率之比先减小后增大
14.已知常温下水溶液中的分布分数[如表示的分布分数]随变化曲线如图1;溶液中和关系如图2。用溶液滴定溶液,下列说法错误的是
A.曲线a表示
B.酸性:
C.滴定过程中溶液会有沉淀,
D.滴定过程中始终存在:
二、解答题
15.光学性能优异的量子点是一类尺寸在1nm~10nm的半导体纳米晶体,当紫外光作用在量子点上时会发出荧光,量子点的尺寸不同,荧光颜色对应不同。CdTe(碲化镉)其制备的原理和步骤如下:
制备原理:;。
已知:
①RSH代指巯基乙酸,结构简式为;
②Te与S同族,在空气中以+4价稳定存在。
步骤I:按照如下图所示搭建反应装置。
步骤Ⅱ:向C中加入250mL蒸馏水和0.23g的CdCl2·2.5H2O,搅拌溶解,通入氮气,再加入8滴RSH,用2mol·L-1的NaOH溶液调节pH为8~9,继续通入氮气。
步骤Ⅲ:用滴管将NaHTe溶液快速一次性加入到C中。开始加热,反应一段时间,可得到由RSH修饰的CdTe量子点产物。
回答下列问题:
(1)仪器A的名称为 。元素Te与S同族,则Te的价电子排布式为 。
(2)用NaOH溶液调节pH的目的是 。
(3)NaHTe溶液是利用NaBH4与Te在水中反应得到,其余产物是H2和Na2B4O7,则反应的化学方程式为 ;步骤Ⅱ中N2的作用为 。
(4)RSH修饰的CdTe量子点产物是 原子与Cd2+之间以配位键结合而成。
(5)步骤Ⅲ中,可用紫外光照射以监测反应进程,当观察到 (填现象)时,说明CdTe量子点生长基本停止,制备完成。
(6)Te粉中Te质量分数的测定,步骤如下:
①取5.0gTe粉,加入某酸使其转化为亚碲酸,将其配制成100mL溶液,取20.00mL溶液于锥形瓶中。
②往锥形瓶中加入酸性溶液,充分反应使亚碲酸转化为碲。
③往锥形瓶中加入指示剂,用硫酸亚铁铵标准溶液滴定剩余的酸性溶液,进行三次平行实验,平均消耗12.00mL硫酸亚铁铵标准溶液。
试计算Te粉中Te的质量分数为 。(列出计算式即可)
16.广西是我国重要的稀土资源基地,稀土(RE)包括镧(La)、铈(Ce)等元素,从离子型稀土矿(含Fe、Al等元素)中提取稀土元素并获得高附加值产品的一种工艺流程如图所示。
已知:该工艺下,除铈(Ce)外,稀土离子保持+3价不变;草酸可与多种过渡金属离子形成可溶性配位化合物;金属离子形成氢氧化物沉淀的相关pH见下表。
开始沉淀时的pH 1.5 4.3 5.6
沉淀完全时的pH 3.2 5.5 /
回答下列问题:
(1)“预中和”工序中,适宜的pH范围是 。
(2)利用离子交换法浸出稀土的过程如图所示。已知离子半径越小、电荷数越大,离子交换能力越强。下列离子对交换能力最强的是___________。
A. B. C. D.
(3)“草酸化”过程中,测得稀土(RE)的沉淀率随的变化情况如图所示。当草酸用量过多时,稀土(RE)的沉淀率下降的原因是 。
(4)“沉淀”工序产物为 [填“”或“”],理由是 。{,}。(当反应的时可认为反应完全)
(5)含氟稀土抛光粉的主要成分为,“焙烧”时发生反应的化学方程式为 。
(6)氧化铈()常用作玻璃工业添加剂,在其立方晶胞中掺杂,占据原来的位置,可以得到更稳定的结构,这种稳定的结构使得氧化铈具有许多独特的性质和应用,晶胞中与最近的核间距为apm。(已知:)
①若掺杂Y2O3后得到n(CeO2):n(Y2O3)=0.6:0.2的晶体,则此晶体中的空缺率为 。
②晶体的密度为 (列出表达式)。
17.1,3-丁二烯是石油化工的重要原料,采用CO2氧化1-丁烯脱氢生产1,3-丁二烯既可以实现1-丁烯高值转化,又可以实现的资源化利用。发生的反应如下:
反应I: ΔH1=akJ·mol-1
同时还发生以下副反应:
反应Ⅱ: ΔH2=bkJ·mol-1
反应Ⅲ: ΔH3=+46kJ·mol-1
已知:b>46
回答下列问题:
(1)a= kJ·mol-1(用含b的式子表示),反应I在 (填“高温”或“低温”)下能自发进行。
(2)反应I的平衡常数为K1,反应Ⅱ的平衡常数为K2,反应Ⅲ的平衡常数为K3。图1为lgK1、lgK2、lgK3与温度的关系曲线,图2为体积分数与温度的关系曲线。
①x= 。
②图2中,温度低于时,随温度升高增大的原因为 。
(3)600℃时,恒定总压0.10MPa,以起始物质的量均为1mol的1-丁烯、CO2投料,达平衡时,测得1-丁烯和CO2的转化率分别为80%、10%。则600℃时,反应Ⅱ的平衡常数Kp= (列出计算式)。
(4)电化学催化还原乙炔法条件温和,安全性高。在室温下,某团队以溶液为电解液,电催化还原乙炔制备1,3-丁二烯。写出生成1,3-丁二烯的电极反应式 。
(5)1,3-丁二烯与HBr发生加成反应分两步:第一步H+进攻1,3-丁二烯生成碳正离子();第二步Br-进攻碳正离子完成1,2-加成或1,4-加成。反应进程中的能量变化如图所示。
由阿伦尼乌斯公式推知,同一反应在不同温度(T)下,反应速率常数(k)与活化能(Ea)的关系如下:(其中R为常数)。其他条件不变的情况下,升高温度,更有利提高 (填“1,2-加成”或“1,4-加成”)的反应速率。
18.化合物G是一种化疗药物的活性成分,一种合成路线如图所示(部分条件和溶剂已省略):
回答下列问题:
(1)用于制备ClCH2COCl的原料ClCH2COOH的化学名称为 。
(2)D到E的反应类型是 ,F中含氧官能团的名称除了醚键外还有 。
(3)A到B的反应中,羧基对位的酚羟基优先反应的可能原因是 。
(4)E生成F的反应中,有副产物N生成,N为F的同分异构体且具有与F相同的环状结构。写出生成N的化学方程 。
(5)符合下列条件的B的含苯环同分异构体共有 种。
①遇Fe3+发生显色反应;②分子结构中含;③核磁共振氢谱显示有4组峰
(6)氨基具有较强的还原性。参照上述合成路线,以和甲醇为原料,一种合成的路线如下:
①写出M的结构简式:M 。
②步骤Ⅰ与步骤Ⅱ顺序 (填“能”或“不能”)可以互换,原因是 。
参考答案
1.B
2.C
3.C
4.D
5.D
6.C
7.C
8.D
9.B
10.D
11.C
12.C
13.D
14.D
15.(1) 球形冷凝管 5s25p4
(2)使正向进行,增大浓度
(3) 4NaBH4+2Te+7H2O=2NaHTe+Na2B4O7+14H2↑ 排尽装置内空气,防止NaHTe被氧化
(4)硫(或S)
(5)荧光颜色不再变化
(6)
16.(1)3.2≤pH<4.3
(2)C
(3)草酸与RE3+离子形成可溶性配位化合物
(4) 计算的平衡常数K=>105,该反应正向可以完全转化
(5)
(6) 10%
17.(1) b+46 高温
(2) 0 反应Ⅱ正向进行的程度大于反应Ⅲ
(3)
(4)
(5)1,4-加成
18.(1)氯乙酸或2-氯乙酸
(2) 还原反应 酯基、酰胺基
(3)羧基邻位的羟基与羧基形成分子内氢键,因此对位的羟基优先反应
(4)
(5)8
(6) 不能 氨基具有较强还原性,若先还原步骤Ⅱ,在步骤Ⅰ的浓硫酸、加热条件下氨基可能会发生副反应,不利于最后一步形成酰胺基
同课章节目录
