999长沙市望城区第二中学2024-2025学年高一下学期7月期末化学试卷 (含答案)
文档属性
| 名称 | 999长沙市望城区第二中学2024-2025学年高一下学期7月期末化学试卷 (含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 190.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-07 16:38:29 | ||
图片预览



文档简介
高一期末化学试卷
一、单选题
1.下列物质中,属于电解质的是
A. B.溶液 C.固体 D.乙醇
2.下列有关说法正确的是
A.Fe2+的电子排布式为[Ar]3d44s2
B.处于同一能级的电子运动状态不相同
C.从空间角度看,2s轨道与2p轨道形状相同
D.基态碳原子的轨道表示式是
3.用NA代表阿伏加德罗常数的值,下列说法正确的是
A.1 mol 锌粒与足量盐酸反应产生22.4 L H2
B.标准状况下,11.2 L 苯所含分子数为0.5NA
C.0.2 mol CH4所含氢原子数为0.8NA
D.常温常压下,56 g N2中所含原子数为2NA
4.将氯气持续通入紫色石蕊试液中,溶液颜色呈如图变化:
关于溶液中导致变色的微粒Ⅰ、Ⅱ、Ⅲ的判断正确的是
A. B.
C. D.
5.归纳和推理是重要的科学思维方法,下列说法合理的是
A.和溶液反应的实质是与反应生成水
B.碱性溶液能使酚酞变红色,所以能使酚酞变红色的溶液一定显碱性
C.碱性氧化物一定是金属氧化物,所以属于碱性氧化物
D.同种元素的原子具有相同的质子数,具有相同质子数的微粒一定属于同种元素
6.下列物质不导电的是
A.Na单质 B.NaCl固体 C.熔融NaCl D.NaCl溶液
7.下列说法正确的是
A.既能和NaOH溶液反应,又能和氢氟酸反应,所以是两性氧化物
B.和NO都不是酸性氧化物
C.是空气中的主要成分之一,雷雨时可直接转化为
D.稀硝酸和锌反应产生的氢气可为工业制氨提供原料
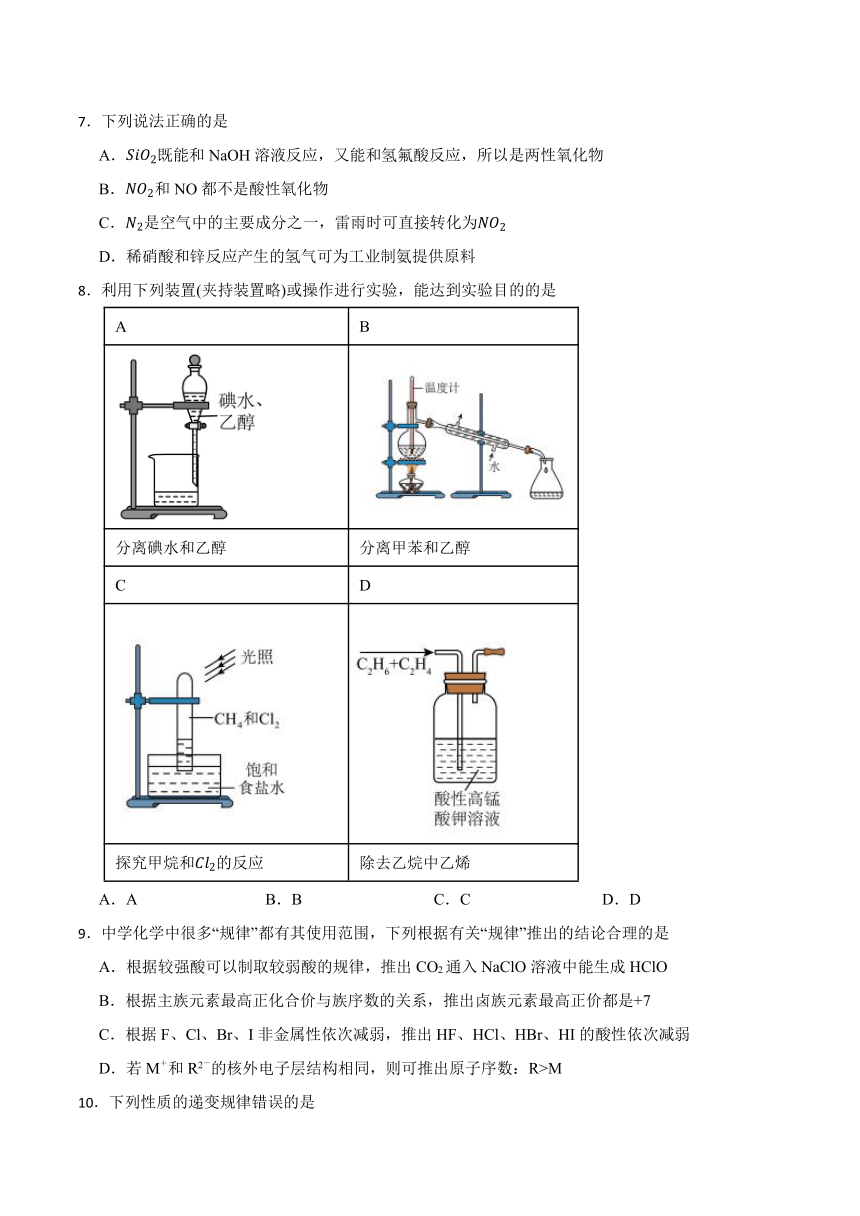
8.利用下列装置(夹持装置略)或操作进行实验,能达到实验目的的是
A B
分离碘水和乙醇 分离甲苯和乙醇
C D
探究甲烷和的反应 除去乙烷中乙烯
A.A B.B C.C D.D
9.中学化学中很多“规律”都有其使用范围,下列根据有关“规律”推出的结论合理的是
A.根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO
B.根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7
C.根据F、Cl、Br、I非金属性依次减弱,推出HF、HCl、HBr、HI的酸性依次减弱
D.若M+和R2-的核外电子层结构相同,则可推出原子序数:R>M
10.下列性质的递变规律错误的是
A.NaOH、KOH、CsOH的碱性依次增强
B.Li、Na、K、Rb的失电子能力逐渐增强
C.、、的半径依次减小
D.、、、的熔、沸点依次升高
11.以甲烷为燃料、含铜氧化物为载体的化学链燃烧过程如图所示,下列说法不正确的是
A.该流程中无需补充CuO
B.空气反应器中的反应为
C.理论上燃料反应器中每产生22.0g,空气反应器中要消耗标况下11.2L
D.该流程比传统燃烧更有利于捕集
12.Na2S2O3是重要的化工原料,用途很广,其还原性较强,在溶液中易被Cl2氧化成SO,常用作脱氯剂,主要用于治疗氰化物中毒.工业上可利用反应Na2CO3+2Na2S+4SO2=3Na2S2O3+CO2制取Na2S2O3,下列说法正确的是
A.每吸收4molSO2,放出22.4LCO2
B.每生成1molNa2S2O3,转移NA个电子
C.氧化产物与还原产物的质量之比为2:1
D.还原性强弱:S2->S2O>Cl-
13.标准状况下,将SO2和Cl2组成的混合气体a L通入200mL 0.1mol·L-1 Fe2(SO4)3溶液中,充分反应后,气体被完全吸收,溶液的棕黄色变浅(溶液体积近似不变)。向反应后的溶液中加入足量的BaCl2溶液,将所得沉淀过滤、洗涤、干燥后称重,其质量为23.3g。则下列分析错误的是(已知:SO2+2Fe3++2H2O=SO+2Fe2++4H+)
A.a L混合气体的物质的量可能为0.08mol
B.混合气体中SO2的体积为0.896L
C.所得沉淀为0.1mol的BaSO4
D.混合气体中Cl2的物质的量可能为0.03mol
14.下列离子方程式中,能正确表达反应变化的是
A.向溶液中滴加溶液,溶液由浅绿色变成黄色:
B.向溶液中滴加稀硫酸,溶液变浑浊:
C.次氯酸钙溶液中通入,有白色沉淀生成:
D.用稀硝酸鉴别铜合金制的假金币:
二、实验探究题
15.某小组同学探究三种价态()疏元素间的相互转化。可以选用的试剂有:①水溶液、②浓硫酸、③稀硫酸、④溶液、⑤溶液、⑥氯水(浅黄绿色)、⑦铜片、⑧稀盐酸、⑨溶液。
实验序号 预期的价态转化 选择的试剂 (填入试剂编号) 实验现象
1 ④⑥
2 i___________ ii___________
3 ①⑤ 出现浑浊
4 ④⑤ 无明显现象
5 iii___________
(1)补全实验表格i ,ii ,iii 。
(2)实验5的化学方程式为 。
(3)为了进一步验证实验1中的转化,甲同学设计实验a:向反应后的溶液中先加过量稀盐酸,再加足量溶液,观察现象。
①实验a的目的是通过检验 ,证明转化得以实现。
②加稀盐酸的作用是 。
乙同学认为还需要补充实验b:取等量的溶液,向其中先加过量稀盐酸,再加足量溶液,观察现象。
③补充实验b的原因是 。
④综合实验a和b,实验1中转化得以实现的证据是 。
(4)丙同学分析实验3和实验4现象不同的原因,在实验4中又添加了一种试剂 (填试剂编号),出现浑浊。发生反应的离子方程式是 。
16.某校化学兴趣小组学习了“氯气的实验室制法”后,利用如图所示实验装置对的制备及性质进行探究。回答下列问题:
(1)仪器的名称为 。
(2)实验室若选用固体和浓盐酸在常温条件下制取干燥的,则选用的发生装置为 (填“A”或“B”);该反应的化学方程式为 。
(3)装置C的主要作用为 ;装置是用于干燥,故装置中的试剂为 (填化学式)。
(4)用装置收集,进气口为 (填“b”或“c”)。
(5)装置F中发生反应的离子方程式为 。
(6)工业上一般将通入石灰乳中制取含氯漂白粉,同学们利用如下图装置进行实验。
已知:①与潮湿的消石灰反应是放热反应;
②温度较高时,与潮湿的反应方程式为。
发现实验所得产率较低,可能的原因是 。
三、综合题
17.完成下列填空:
现有物质:①铜 ②干冰 ③盐酸 ④液态硫酸 ⑤蔗糖 ⑥固体 ⑦红褐色的氢氧化铁胶体。
(1)属于分散系的是 (填序号,下同);能够导电的是 ;写出属于酸式盐的物质溶于水后的电离方程式: 。
(2)⑦区别于溶液和浊液的本质特征为 ,利用 效应可区分胶体和溶液。
(3)氢氧化铁胶体可用于净水的原因是 。
18.如图所示,U型管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混合气体,假定氯气在水中不溶解。将封闭有甲烷和氯气的混合气体的装置放置在有光亮的地方,让混合气体缓慢的反应一段时间。
(1)下列关于甲烷结构的说法中正确的是________。
A.甲烷的分子式是CH4,5个原子共面
B.甲烷分子的空间构型属于正四面体结构
C.甲烷中的任意三个原子都不共面
(2)假设甲烷与氯气反应充分,且只产生一种有机物,请写出化学方程式 。
(3)下列事实能证明甲烷分子是正四面体结构的是 。
a.CH3Cl只代表一种物质b.CH2Cl2只代表一种物质
c.CHCl3只代表一种物质d.CCl4只代表一种物质
(4)烃分子中的碳原子与氢原子结合的方式是 。
a.形成4对共用电子对b.通过1个共价键
c.通过2个共价键d.通过离子键和共价键
(5)若CH4、C2H6、C3H8、C4H10四种烃各为1g,在足量O2中燃烧,消耗O2最多的是 。
答案解析部分
1.【答案】C
2.【答案】B
3.【答案】C
4.【答案】C
5.【答案】B
6.【答案】B
7.【答案】B
8.【答案】C
9.【答案】A
10.【答案】C
11.【答案】C
12.【答案】D
13.【答案】A
14.【答案】B
15.【答案】(1)①⑥;氯水黄绿色褪去;②⑦
(2)
(3);除去未反应的,防止与反应产生白色沉淀干扰实验现象;具有还原性,也可能被空气的中氧化为;实验a中白色沉淀的量比实验b多(或实验a中有白色沉淀而实验b中没有)
(4)③或⑧;
16.【答案】(1)(U形)干燥管
(2)A;
(3)吸收混合气中的;无水(或其他合理答案)
(4)c
(5)
(6)反应放热,部分与潮湿在较高温度下反应生成,故实验所得产率较低
17.【答案】(1)③⑦;①③⑦;
(2)胶体粒子的直径在;丁达尔
(3)氢氧化铁胶体的胶粒具有吸附性,能吸附水中的悬浮颗粒物并沉降
18.【答案】(1)B
(2)CH4+4Cl2→CCl4+4HCl
(3)b
(4)b
(5)CH4
一、单选题
1.下列物质中,属于电解质的是
A. B.溶液 C.固体 D.乙醇
2.下列有关说法正确的是
A.Fe2+的电子排布式为[Ar]3d44s2
B.处于同一能级的电子运动状态不相同
C.从空间角度看,2s轨道与2p轨道形状相同
D.基态碳原子的轨道表示式是
3.用NA代表阿伏加德罗常数的值,下列说法正确的是
A.1 mol 锌粒与足量盐酸反应产生22.4 L H2
B.标准状况下,11.2 L 苯所含分子数为0.5NA
C.0.2 mol CH4所含氢原子数为0.8NA
D.常温常压下,56 g N2中所含原子数为2NA
4.将氯气持续通入紫色石蕊试液中,溶液颜色呈如图变化:
关于溶液中导致变色的微粒Ⅰ、Ⅱ、Ⅲ的判断正确的是
A. B.
C. D.
5.归纳和推理是重要的科学思维方法,下列说法合理的是
A.和溶液反应的实质是与反应生成水
B.碱性溶液能使酚酞变红色,所以能使酚酞变红色的溶液一定显碱性
C.碱性氧化物一定是金属氧化物,所以属于碱性氧化物
D.同种元素的原子具有相同的质子数,具有相同质子数的微粒一定属于同种元素
6.下列物质不导电的是
A.Na单质 B.NaCl固体 C.熔融NaCl D.NaCl溶液
7.下列说法正确的是
A.既能和NaOH溶液反应,又能和氢氟酸反应,所以是两性氧化物
B.和NO都不是酸性氧化物
C.是空气中的主要成分之一,雷雨时可直接转化为
D.稀硝酸和锌反应产生的氢气可为工业制氨提供原料
8.利用下列装置(夹持装置略)或操作进行实验,能达到实验目的的是
A B
分离碘水和乙醇 分离甲苯和乙醇
C D
探究甲烷和的反应 除去乙烷中乙烯
A.A B.B C.C D.D
9.中学化学中很多“规律”都有其使用范围,下列根据有关“规律”推出的结论合理的是
A.根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO
B.根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7
C.根据F、Cl、Br、I非金属性依次减弱,推出HF、HCl、HBr、HI的酸性依次减弱
D.若M+和R2-的核外电子层结构相同,则可推出原子序数:R>M
10.下列性质的递变规律错误的是
A.NaOH、KOH、CsOH的碱性依次增强
B.Li、Na、K、Rb的失电子能力逐渐增强
C.、、的半径依次减小
D.、、、的熔、沸点依次升高
11.以甲烷为燃料、含铜氧化物为载体的化学链燃烧过程如图所示,下列说法不正确的是
A.该流程中无需补充CuO
B.空气反应器中的反应为
C.理论上燃料反应器中每产生22.0g,空气反应器中要消耗标况下11.2L
D.该流程比传统燃烧更有利于捕集
12.Na2S2O3是重要的化工原料,用途很广,其还原性较强,在溶液中易被Cl2氧化成SO,常用作脱氯剂,主要用于治疗氰化物中毒.工业上可利用反应Na2CO3+2Na2S+4SO2=3Na2S2O3+CO2制取Na2S2O3,下列说法正确的是
A.每吸收4molSO2,放出22.4LCO2
B.每生成1molNa2S2O3,转移NA个电子
C.氧化产物与还原产物的质量之比为2:1
D.还原性强弱:S2->S2O>Cl-
13.标准状况下,将SO2和Cl2组成的混合气体a L通入200mL 0.1mol·L-1 Fe2(SO4)3溶液中,充分反应后,气体被完全吸收,溶液的棕黄色变浅(溶液体积近似不变)。向反应后的溶液中加入足量的BaCl2溶液,将所得沉淀过滤、洗涤、干燥后称重,其质量为23.3g。则下列分析错误的是(已知:SO2+2Fe3++2H2O=SO+2Fe2++4H+)
A.a L混合气体的物质的量可能为0.08mol
B.混合气体中SO2的体积为0.896L
C.所得沉淀为0.1mol的BaSO4
D.混合气体中Cl2的物质的量可能为0.03mol
14.下列离子方程式中,能正确表达反应变化的是
A.向溶液中滴加溶液,溶液由浅绿色变成黄色:
B.向溶液中滴加稀硫酸,溶液变浑浊:
C.次氯酸钙溶液中通入,有白色沉淀生成:
D.用稀硝酸鉴别铜合金制的假金币:
二、实验探究题
15.某小组同学探究三种价态()疏元素间的相互转化。可以选用的试剂有:①水溶液、②浓硫酸、③稀硫酸、④溶液、⑤溶液、⑥氯水(浅黄绿色)、⑦铜片、⑧稀盐酸、⑨溶液。
实验序号 预期的价态转化 选择的试剂 (填入试剂编号) 实验现象
1 ④⑥
2 i___________ ii___________
3 ①⑤ 出现浑浊
4 ④⑤ 无明显现象
5 iii___________
(1)补全实验表格i ,ii ,iii 。
(2)实验5的化学方程式为 。
(3)为了进一步验证实验1中的转化,甲同学设计实验a:向反应后的溶液中先加过量稀盐酸,再加足量溶液,观察现象。
①实验a的目的是通过检验 ,证明转化得以实现。
②加稀盐酸的作用是 。
乙同学认为还需要补充实验b:取等量的溶液,向其中先加过量稀盐酸,再加足量溶液,观察现象。
③补充实验b的原因是 。
④综合实验a和b,实验1中转化得以实现的证据是 。
(4)丙同学分析实验3和实验4现象不同的原因,在实验4中又添加了一种试剂 (填试剂编号),出现浑浊。发生反应的离子方程式是 。
16.某校化学兴趣小组学习了“氯气的实验室制法”后,利用如图所示实验装置对的制备及性质进行探究。回答下列问题:
(1)仪器的名称为 。
(2)实验室若选用固体和浓盐酸在常温条件下制取干燥的,则选用的发生装置为 (填“A”或“B”);该反应的化学方程式为 。
(3)装置C的主要作用为 ;装置是用于干燥,故装置中的试剂为 (填化学式)。
(4)用装置收集,进气口为 (填“b”或“c”)。
(5)装置F中发生反应的离子方程式为 。
(6)工业上一般将通入石灰乳中制取含氯漂白粉,同学们利用如下图装置进行实验。
已知:①与潮湿的消石灰反应是放热反应;
②温度较高时,与潮湿的反应方程式为。
发现实验所得产率较低,可能的原因是 。
三、综合题
17.完成下列填空:
现有物质:①铜 ②干冰 ③盐酸 ④液态硫酸 ⑤蔗糖 ⑥固体 ⑦红褐色的氢氧化铁胶体。
(1)属于分散系的是 (填序号,下同);能够导电的是 ;写出属于酸式盐的物质溶于水后的电离方程式: 。
(2)⑦区别于溶液和浊液的本质特征为 ,利用 效应可区分胶体和溶液。
(3)氢氧化铁胶体可用于净水的原因是 。
18.如图所示,U型管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混合气体,假定氯气在水中不溶解。将封闭有甲烷和氯气的混合气体的装置放置在有光亮的地方,让混合气体缓慢的反应一段时间。
(1)下列关于甲烷结构的说法中正确的是________。
A.甲烷的分子式是CH4,5个原子共面
B.甲烷分子的空间构型属于正四面体结构
C.甲烷中的任意三个原子都不共面
(2)假设甲烷与氯气反应充分,且只产生一种有机物,请写出化学方程式 。
(3)下列事实能证明甲烷分子是正四面体结构的是 。
a.CH3Cl只代表一种物质b.CH2Cl2只代表一种物质
c.CHCl3只代表一种物质d.CCl4只代表一种物质
(4)烃分子中的碳原子与氢原子结合的方式是 。
a.形成4对共用电子对b.通过1个共价键
c.通过2个共价键d.通过离子键和共价键
(5)若CH4、C2H6、C3H8、C4H10四种烃各为1g,在足量O2中燃烧,消耗O2最多的是 。
答案解析部分
1.【答案】C
2.【答案】B
3.【答案】C
4.【答案】C
5.【答案】B
6.【答案】B
7.【答案】B
8.【答案】C
9.【答案】A
10.【答案】C
11.【答案】C
12.【答案】D
13.【答案】A
14.【答案】B
15.【答案】(1)①⑥;氯水黄绿色褪去;②⑦
(2)
(3);除去未反应的,防止与反应产生白色沉淀干扰实验现象;具有还原性,也可能被空气的中氧化为;实验a中白色沉淀的量比实验b多(或实验a中有白色沉淀而实验b中没有)
(4)③或⑧;
16.【答案】(1)(U形)干燥管
(2)A;
(3)吸收混合气中的;无水(或其他合理答案)
(4)c
(5)
(6)反应放热,部分与潮湿在较高温度下反应生成,故实验所得产率较低
17.【答案】(1)③⑦;①③⑦;
(2)胶体粒子的直径在;丁达尔
(3)氢氧化铁胶体的胶粒具有吸附性,能吸附水中的悬浮颗粒物并沉降
18.【答案】(1)B
(2)CH4+4Cl2→CCl4+4HCl
(3)b
(4)b
(5)CH4
同课章节目录
