江苏省盐城市东台市2024-2025学年高一下学期期中学业水平考试化学试卷 (图片版,无答案)
文档属性
| 名称 | 江苏省盐城市东台市2024-2025学年高一下学期期中学业水平考试化学试卷 (图片版,无答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-07 16:50:13 | ||
图片预览

文档简介
2024—2025学年度第二学期期中学业水平考试高一化学
注意事项:
1.本试卷考试时间为75分钟,试卷满分100分,考试形式闭卷。
2.本试卷中所有试题必须作答在答题卡上规定的位置,否则不给分。
3.答题前,务必将自己的学校、班级、姓名、准考证号用0.5毫米黑色墨水签字笔填写在答题卡上。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 S-32 Fe-56
一、单项选择题:共14题,每小题3分,共39分。每小题只有一个选项最符合题意。
1.传统的“五金”指中国古代冶炼和应用较早的五种金属。下列不属于传统五金的是( )
A.铝 B.铁 C.锡 D.铜
2.可用于制备少量氨气。下列说法正确的是( )
A.钠离子的结构示意图: B.水分子的球棍模型:
C.中子数为18的Cl原子: D.的电子式:
3.四羟基合铝酸钠与过量反应可制得。下列说法正确的是( )
A.半径: B.沸点:
C.热稳定性: D.碱性:
4.下列物质的性质与用途不具有对应关系的是( )
A.具有强氧化性,可用于杀菌消毒
B.性质较稳定,可用作焊接金属时的保护气
C.熔点高,可用做耐高温材料
D.溶液呈酸性,可用于蚀刻电路板上的铜
阅读下列资料,完成5-7题:
元素周期表中ⅤA族元素及其化合物作用广泛。液氨常用作制冷剂。能与多种物质发生反应,能与结合生成,加热条件下,能将CuO还原成Cu。可用于制取肼()和尿素[]等,工业上常用浓氨水检验输送氯气的管道是否泄漏,泄漏处有白烟生成。工业合成氢的化学反应为。肼()的燃烧热为624kJ/mol,是常用的火箭燃料;铅锑合金一般用作铅蓄电池的负极材料。
5.氮及其化合物的转化具有重要应用,下列说法正确的是( )
A.栽种豆科植物作“绿肥”属于人工固氮
B.液氨用作制冷剂是由于氨气分子与水分子之间存在分子间氢键
C.尿素[]属于含氮量较高的固态氮肥
D.1mol氮气与3mol氢气混合后充分反应放出热量92.4kJ
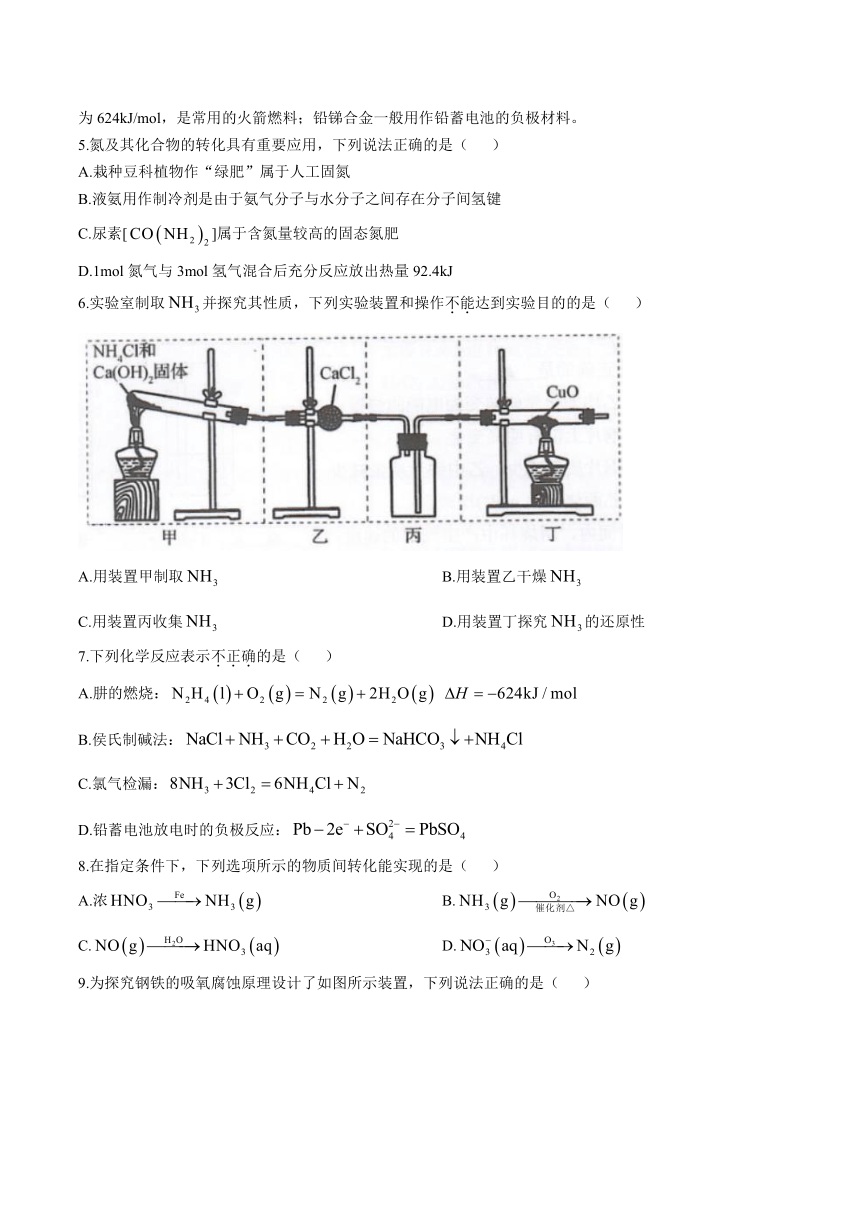
6.实验室制取并探究其性质,下列实验装置和操作不能达到实验目的的是( )
A.用装置甲制取 B.用装置乙干燥
C.用装置丙收集 D.用装置丁探究的还原性
7.下列化学反应表示不正确的是( )
A.肼的燃烧:
B.侯氏制碱法:
C.氯气检漏:
D.铅蓄电池放电时的负极反应:
8.在指定条件下,下列选项所示的物质间转化能实现的是( )
A.浓 B.
C. D.
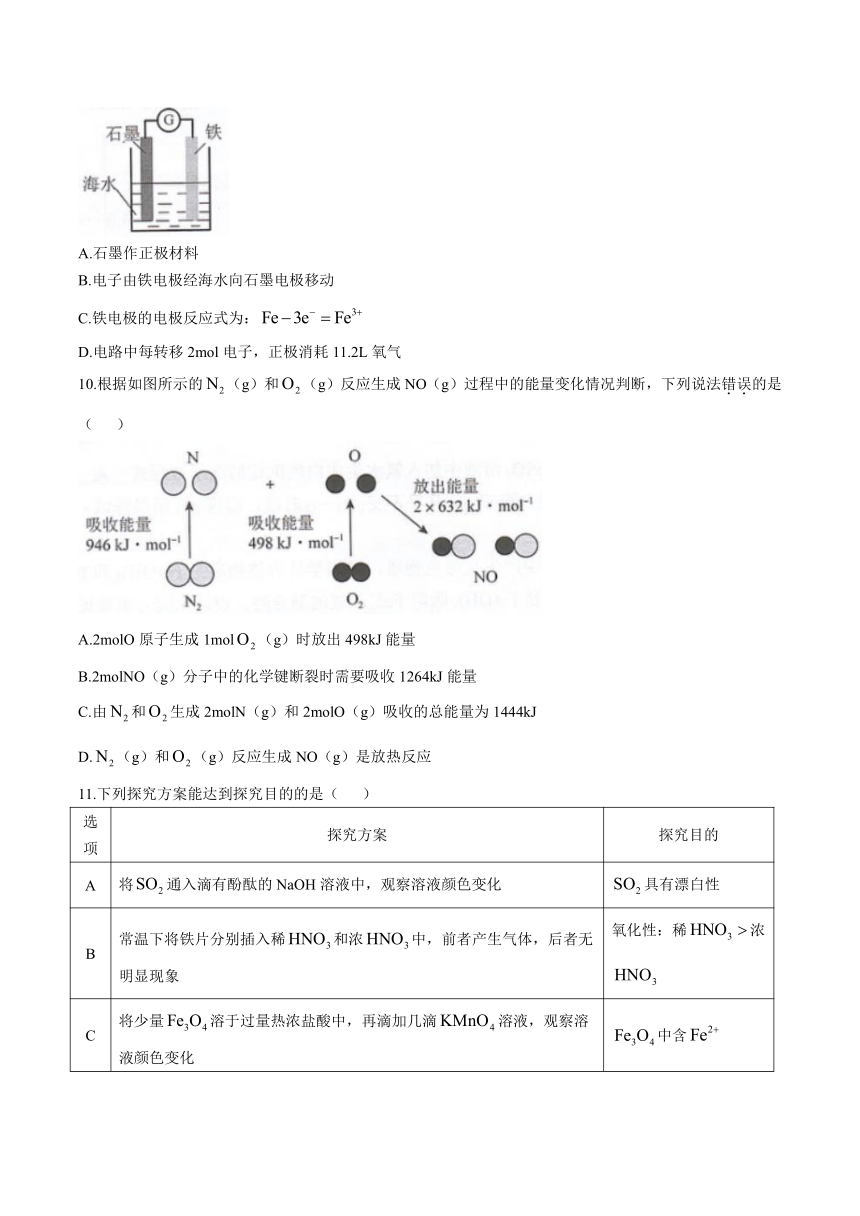
9.为探究钢铁的吸氧腐蚀原理设计了如图所示装置,下列说法正确的是( )
A.石墨作正极材料
B.电子由铁电极经海水向石墨电极移动
C.铁电极的电极反应式为:
D.电路中每转移2mol电子,正极消耗11.2L氧气
10.根据如图所示的(g)和(g)反应生成NO(g)过程中的能量变化情况判断,下列说法错误的是( )
A.2molO原子生成1mol(g)时放出498kJ能量
B.2molNO(g)分子中的化学键断裂时需要吸收1264kJ能量
C.由和生成2molN(g)和2molO(g)吸收的总能量为1444kJ
D.(g)和(g)反应生成NO(g)是放热反应
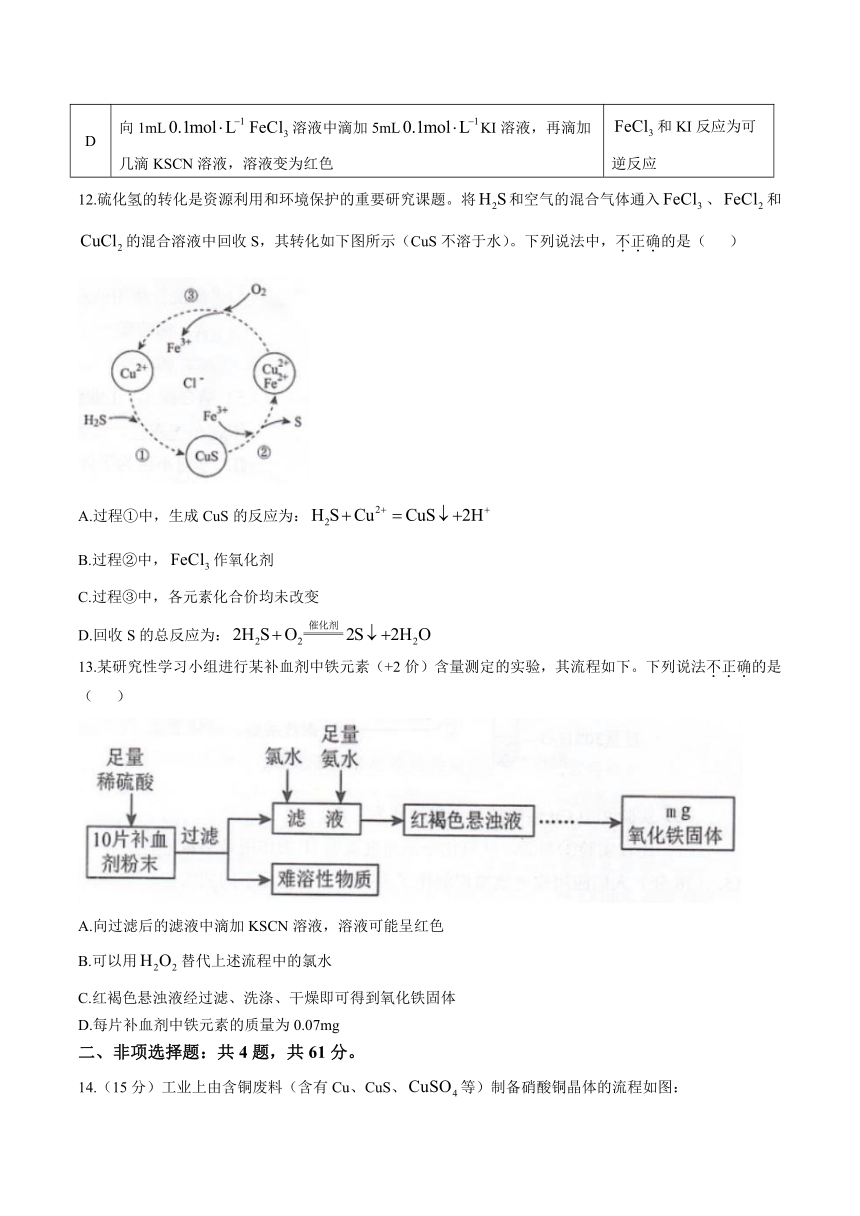
11.下列探究方案能达到探究目的的是( )
选项 探究方案 探究目的
A 将通入滴有酚酞的NaOH溶液中,观察溶液颜色变化 具有漂白性
B 常温下将铁片分别插入稀和浓中,前者产生气体,后者无明显现象 氧化性:稀浓
C 将少量溶于过量热浓盐酸中,再滴加几滴溶液,观察溶液颜色变化 中含
D 向1mL溶液中滴加5mLKI溶液,再滴加几滴KSCN溶液,溶液变为红色 和KI反应为可逆反应
12.硫化氢的转化是资源利用和环境保护的重要研究课题。将和空气的混合气体通入、和的混合溶液中回收S,其转化如下图所示(CuS不溶于水)。下列说法中,不正确的是( )
A.过程①中,生成CuS的反应为:
B.过程②中,作氧化剂
C.过程③中,各元素化合价均未改变
D.回收S的总反应为:
13.某研究性学习小组进行某补血剂中铁元素(+2价)含量测定的实验,其流程如下。下列说法不正确的是( )
A.向过滤后的滤液中滴加KSCN溶液,溶液可能呈红色
B.可以用替代上述流程中的氯水
C.红褐色悬浊液经过滤、洗涤、干燥即可得到氧化铁固体
D.每片补血剂中铁元素的质量为0.07mg
二、非项选择题:共4题,共61分。
14.(15分)工业上由含铜废料(含有Cu、CuS、等)制备硝酸铜晶体的流程如图:
已知:上述流程的“反应”步骤中始终未产生氮氧化合物。
Ⅰ.分析工业流程图,回答下列问题。
(1)写出CuS“焙烧”的化学反应方程式_________________。
(2)“酸化”过程中为加快反应速率,可采用的措施有__________________。(写出一条即可)
(3)“过滤”所得滤液中溶质的主要成分为______________。
(4)“淘洗”所用的溶液A应选用_________(填序号)。
A.稀硫酸 B.浓硫酸 C.稀硝酸 D.浓硝酸
126.4
(5)结合下图,工业流程中反应后“一系列操作”是指蒸发浓缩、_________、过滤、洗涤、干燥等。
Ⅱ.学习小组为了弄清楚上述流程的“反应”过程中,不产生(氮氧化合物)的原因,进行了如下探究性实验。铜与过量反应的探究如下:
(6)实验②中Cu溶解的离子方程式为___________________。
(7)比较实验①和②,从氧化还原角度说明的作用是___________________。
15.(16分)人们应用原电池原理制作了多种电池以满足不同的需要。在现代生活、生产和科学技术发展中,电池发挥着越来越重要的作用。请根据题中信息,回答下列问题:
(1)直接提供电能的一般是放热反应,下列能设计成原电池的是________。(填字母,下同)
A.与反应 B.氢氧化钠与稀盐酸反应
C.灼热的炭与反应 D.与燃烧反应
(2)将纯铁片和纯铜片按图甲、乙方式插入100ml相同浓度的稀硫酸中一段时间,回答下列问题:
①下列说法正确的是_________。
A.甲、乙均为化学能转变为电能的装置
B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中铁片质量减少
D.甲、乙两烧杯中c()均减小
②在相同时间内,两烧杯中产生气泡的速度:甲_______乙。(填“>”“<”或“=”)
③请写出甲、乙中构成原电池的正极电极反应式________________。电池工作一段时间后,甲中溶液质量增重27g时,电极上转移电子数目为________mol。
④若将甲中的稀硫酸换为浓硝酸,则电池总反应的离子方程式为_________________。
(3)图丙为甲烷氧气燃料电池的构造示意图,电解质溶液的溶质是KOH。通甲烷一极的电极反应方程式为__________________。
16.(14分)铁黄(FeOOH)是一种重要的化工产品。
(1)制备铁黄:向一定浓度溶液中加入氨水,产生白色沉淀,并很快变成灰绿色。当滴加氨水至pH为6.0时,停止滴加氨水,开始通氧气,生成铁黄。通入氧气过程中,记录溶液pH变化如图1所示。已知:25℃时,完全沉淀(离子浓度)的pH=8.5。
①请写出溶液中加入氨水生成白色沉淀的离子方程式_______________。
②0~t1时段,溶液pH几乎不变;t1~t2时段,溶液pH明显降低。请结合化学用语解释原因____________。
③实验过程中产生灰绿色物质,甲同学认为该物质是和的混合物,乙同学认为是吸附形成的混合物。设计实验方案验证哪一位同学的观点正确__________________。
(2)在催化剂α-FeOOH的表面上,分解产生·OH。·OH较和更易与烟气中的NO发生反应生成。当一定浓度溶液与烟气以一定的流速经过装有催化剂α-FeOOH的反应管,NO的脱除效率与温度的关系如图2所示。仅用相同浓度相同流速的溶液通过反应管(无催化剂)进行实验测得:随着温度升高,热分解速率加快,升温至80℃以上,大量汽化。
①80~120℃时,随着温度升高NO的脱除效率显著提高的原因是_____________________。
②温度高于180℃,NO的脱除效率降低的原因是_________________________________。
17.(16分)大气中和氮氧化物()气体含量的升高会对环境产生一定的影响。
Ⅰ.下表列出了2种燃煤烟气脱硫方法的原理。
方法Ⅰ 用氨水将转化为,再氧化为
方法Ⅱ 用溶液吸收
(1)用方法Ⅰ脱硫时,一定能提高去除率的措施有_________。
A.增大氨水浓度 B.升高反应温度
C.加快燃煤烟气的流速 D.通过多孔球泡向溶液中通
(2)对方法Ⅱ吸收后的溶液加热可使吸收液再生,其反应的化学方程式_________________。
Ⅱ.通常用以下几种方法对氮氧化物()进行脱除。
(3)利用石灰乳和硝酸工业的尾气反应,既能消除氮氧化物,又能获得应用广泛的,其部分工艺流程如图:
用石灰乳吸收,可将氮氧化物()转化为,若吸收过程中物质的量满足,该过程的化学方程式为________________。
(4)用NaClO溶液吸收和氮氧化物()。某课外小组同学设计了如右图的喷淋吸收塔装置,将NaClO溶液喷淋进吸收塔,其目的是__________________,该装置脱除NO的离子方程式为__________。
(5)催化还原氮氧化物()技术是目前广泛应用的烟气氮氧化物脱除技术。
①一种新型的固氮原理如右图所示,该过程中属于氧化还原反应的是_______(填反应编号)。
②在催化剂的作用下,向280~420℃的烟气中喷入氨可使工厂废气中的氮氧化物转化为无污染的物质,消除的化学反应方程式为____________________。
注意事项:
1.本试卷考试时间为75分钟,试卷满分100分,考试形式闭卷。
2.本试卷中所有试题必须作答在答题卡上规定的位置,否则不给分。
3.答题前,务必将自己的学校、班级、姓名、准考证号用0.5毫米黑色墨水签字笔填写在答题卡上。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 S-32 Fe-56
一、单项选择题:共14题,每小题3分,共39分。每小题只有一个选项最符合题意。
1.传统的“五金”指中国古代冶炼和应用较早的五种金属。下列不属于传统五金的是( )
A.铝 B.铁 C.锡 D.铜
2.可用于制备少量氨气。下列说法正确的是( )
A.钠离子的结构示意图: B.水分子的球棍模型:
C.中子数为18的Cl原子: D.的电子式:
3.四羟基合铝酸钠与过量反应可制得。下列说法正确的是( )
A.半径: B.沸点:
C.热稳定性: D.碱性:
4.下列物质的性质与用途不具有对应关系的是( )
A.具有强氧化性,可用于杀菌消毒
B.性质较稳定,可用作焊接金属时的保护气
C.熔点高,可用做耐高温材料
D.溶液呈酸性,可用于蚀刻电路板上的铜
阅读下列资料,完成5-7题:
元素周期表中ⅤA族元素及其化合物作用广泛。液氨常用作制冷剂。能与多种物质发生反应,能与结合生成,加热条件下,能将CuO还原成Cu。可用于制取肼()和尿素[]等,工业上常用浓氨水检验输送氯气的管道是否泄漏,泄漏处有白烟生成。工业合成氢的化学反应为。肼()的燃烧热为624kJ/mol,是常用的火箭燃料;铅锑合金一般用作铅蓄电池的负极材料。
5.氮及其化合物的转化具有重要应用,下列说法正确的是( )
A.栽种豆科植物作“绿肥”属于人工固氮
B.液氨用作制冷剂是由于氨气分子与水分子之间存在分子间氢键
C.尿素[]属于含氮量较高的固态氮肥
D.1mol氮气与3mol氢气混合后充分反应放出热量92.4kJ
6.实验室制取并探究其性质,下列实验装置和操作不能达到实验目的的是( )
A.用装置甲制取 B.用装置乙干燥
C.用装置丙收集 D.用装置丁探究的还原性
7.下列化学反应表示不正确的是( )
A.肼的燃烧:
B.侯氏制碱法:
C.氯气检漏:
D.铅蓄电池放电时的负极反应:
8.在指定条件下,下列选项所示的物质间转化能实现的是( )
A.浓 B.
C. D.
9.为探究钢铁的吸氧腐蚀原理设计了如图所示装置,下列说法正确的是( )
A.石墨作正极材料
B.电子由铁电极经海水向石墨电极移动
C.铁电极的电极反应式为:
D.电路中每转移2mol电子,正极消耗11.2L氧气
10.根据如图所示的(g)和(g)反应生成NO(g)过程中的能量变化情况判断,下列说法错误的是( )
A.2molO原子生成1mol(g)时放出498kJ能量
B.2molNO(g)分子中的化学键断裂时需要吸收1264kJ能量
C.由和生成2molN(g)和2molO(g)吸收的总能量为1444kJ
D.(g)和(g)反应生成NO(g)是放热反应
11.下列探究方案能达到探究目的的是( )
选项 探究方案 探究目的
A 将通入滴有酚酞的NaOH溶液中,观察溶液颜色变化 具有漂白性
B 常温下将铁片分别插入稀和浓中,前者产生气体,后者无明显现象 氧化性:稀浓
C 将少量溶于过量热浓盐酸中,再滴加几滴溶液,观察溶液颜色变化 中含
D 向1mL溶液中滴加5mLKI溶液,再滴加几滴KSCN溶液,溶液变为红色 和KI反应为可逆反应
12.硫化氢的转化是资源利用和环境保护的重要研究课题。将和空气的混合气体通入、和的混合溶液中回收S,其转化如下图所示(CuS不溶于水)。下列说法中,不正确的是( )
A.过程①中,生成CuS的反应为:
B.过程②中,作氧化剂
C.过程③中,各元素化合价均未改变
D.回收S的总反应为:
13.某研究性学习小组进行某补血剂中铁元素(+2价)含量测定的实验,其流程如下。下列说法不正确的是( )
A.向过滤后的滤液中滴加KSCN溶液,溶液可能呈红色
B.可以用替代上述流程中的氯水
C.红褐色悬浊液经过滤、洗涤、干燥即可得到氧化铁固体
D.每片补血剂中铁元素的质量为0.07mg
二、非项选择题:共4题,共61分。
14.(15分)工业上由含铜废料(含有Cu、CuS、等)制备硝酸铜晶体的流程如图:
已知:上述流程的“反应”步骤中始终未产生氮氧化合物。
Ⅰ.分析工业流程图,回答下列问题。
(1)写出CuS“焙烧”的化学反应方程式_________________。
(2)“酸化”过程中为加快反应速率,可采用的措施有__________________。(写出一条即可)
(3)“过滤”所得滤液中溶质的主要成分为______________。
(4)“淘洗”所用的溶液A应选用_________(填序号)。
A.稀硫酸 B.浓硫酸 C.稀硝酸 D.浓硝酸
126.4
(5)结合下图,工业流程中反应后“一系列操作”是指蒸发浓缩、_________、过滤、洗涤、干燥等。
Ⅱ.学习小组为了弄清楚上述流程的“反应”过程中,不产生(氮氧化合物)的原因,进行了如下探究性实验。铜与过量反应的探究如下:
(6)实验②中Cu溶解的离子方程式为___________________。
(7)比较实验①和②,从氧化还原角度说明的作用是___________________。
15.(16分)人们应用原电池原理制作了多种电池以满足不同的需要。在现代生活、生产和科学技术发展中,电池发挥着越来越重要的作用。请根据题中信息,回答下列问题:
(1)直接提供电能的一般是放热反应,下列能设计成原电池的是________。(填字母,下同)
A.与反应 B.氢氧化钠与稀盐酸反应
C.灼热的炭与反应 D.与燃烧反应
(2)将纯铁片和纯铜片按图甲、乙方式插入100ml相同浓度的稀硫酸中一段时间,回答下列问题:
①下列说法正确的是_________。
A.甲、乙均为化学能转变为电能的装置
B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中铁片质量减少
D.甲、乙两烧杯中c()均减小
②在相同时间内,两烧杯中产生气泡的速度:甲_______乙。(填“>”“<”或“=”)
③请写出甲、乙中构成原电池的正极电极反应式________________。电池工作一段时间后,甲中溶液质量增重27g时,电极上转移电子数目为________mol。
④若将甲中的稀硫酸换为浓硝酸,则电池总反应的离子方程式为_________________。
(3)图丙为甲烷氧气燃料电池的构造示意图,电解质溶液的溶质是KOH。通甲烷一极的电极反应方程式为__________________。
16.(14分)铁黄(FeOOH)是一种重要的化工产品。
(1)制备铁黄:向一定浓度溶液中加入氨水,产生白色沉淀,并很快变成灰绿色。当滴加氨水至pH为6.0时,停止滴加氨水,开始通氧气,生成铁黄。通入氧气过程中,记录溶液pH变化如图1所示。已知:25℃时,完全沉淀(离子浓度)的pH=8.5。
①请写出溶液中加入氨水生成白色沉淀的离子方程式_______________。
②0~t1时段,溶液pH几乎不变;t1~t2时段,溶液pH明显降低。请结合化学用语解释原因____________。
③实验过程中产生灰绿色物质,甲同学认为该物质是和的混合物,乙同学认为是吸附形成的混合物。设计实验方案验证哪一位同学的观点正确__________________。
(2)在催化剂α-FeOOH的表面上,分解产生·OH。·OH较和更易与烟气中的NO发生反应生成。当一定浓度溶液与烟气以一定的流速经过装有催化剂α-FeOOH的反应管,NO的脱除效率与温度的关系如图2所示。仅用相同浓度相同流速的溶液通过反应管(无催化剂)进行实验测得:随着温度升高,热分解速率加快,升温至80℃以上,大量汽化。
①80~120℃时,随着温度升高NO的脱除效率显著提高的原因是_____________________。
②温度高于180℃,NO的脱除效率降低的原因是_________________________________。
17.(16分)大气中和氮氧化物()气体含量的升高会对环境产生一定的影响。
Ⅰ.下表列出了2种燃煤烟气脱硫方法的原理。
方法Ⅰ 用氨水将转化为,再氧化为
方法Ⅱ 用溶液吸收
(1)用方法Ⅰ脱硫时,一定能提高去除率的措施有_________。
A.增大氨水浓度 B.升高反应温度
C.加快燃煤烟气的流速 D.通过多孔球泡向溶液中通
(2)对方法Ⅱ吸收后的溶液加热可使吸收液再生,其反应的化学方程式_________________。
Ⅱ.通常用以下几种方法对氮氧化物()进行脱除。
(3)利用石灰乳和硝酸工业的尾气反应,既能消除氮氧化物,又能获得应用广泛的,其部分工艺流程如图:
用石灰乳吸收,可将氮氧化物()转化为,若吸收过程中物质的量满足,该过程的化学方程式为________________。
(4)用NaClO溶液吸收和氮氧化物()。某课外小组同学设计了如右图的喷淋吸收塔装置,将NaClO溶液喷淋进吸收塔,其目的是__________________,该装置脱除NO的离子方程式为__________。
(5)催化还原氮氧化物()技术是目前广泛应用的烟气氮氧化物脱除技术。
①一种新型的固氮原理如右图所示,该过程中属于氧化还原反应的是_______(填反应编号)。
②在催化剂的作用下,向280~420℃的烟气中喷入氨可使工厂废气中的氮氧化物转化为无污染的物质,消除的化学反应方程式为____________________。
同课章节目录
