四川省成都市第七中学2024-2025学年度下期高一期末测试化学试卷(含答案)
文档属性
| 名称 | 四川省成都市第七中学2024-2025学年度下期高一期末测试化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 983.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-07 16:17:18 | ||
图片预览

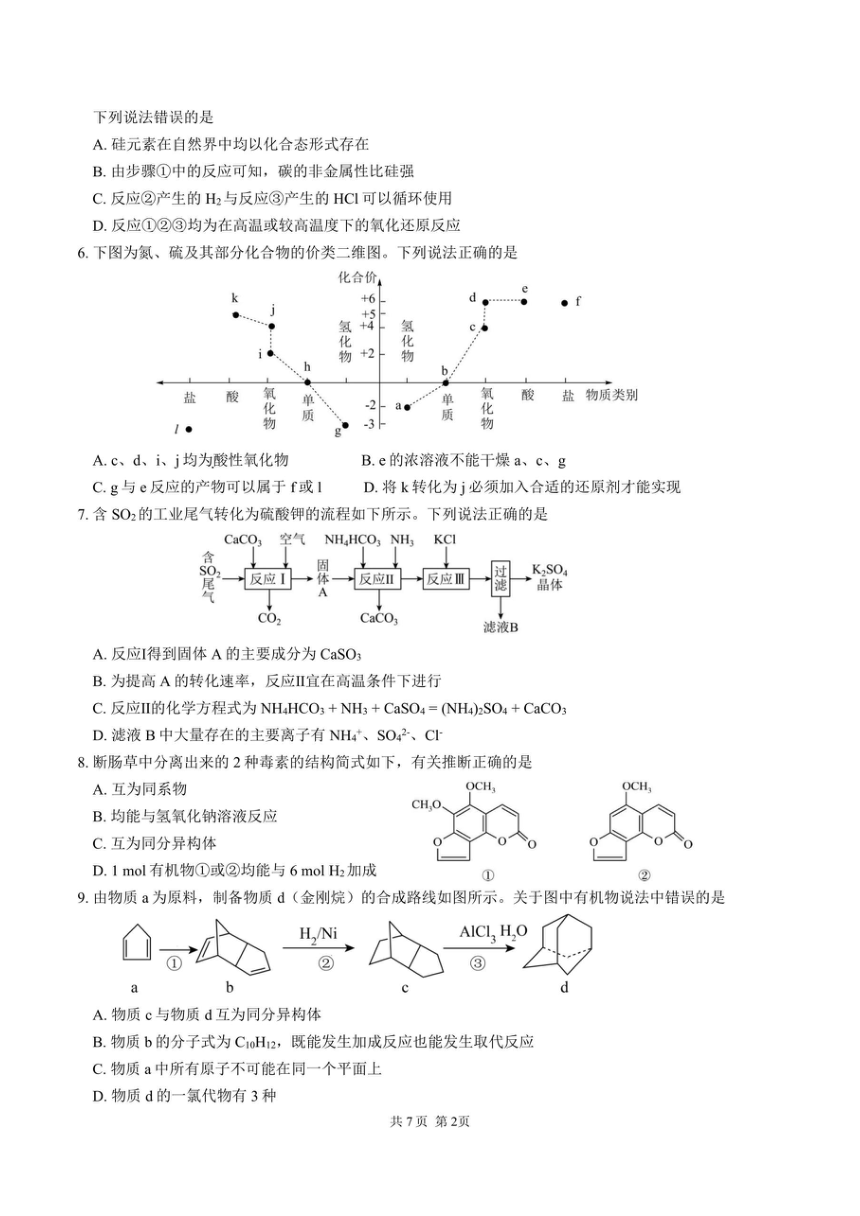
文档简介
2024~2025 学年度下期高 2027届期末考试
化学试卷
(考试时间:75 分钟;满分:100 分)可能用到的相对原子质量:H-1 C-12 N-14 O-16 P-31 S-32 Br-80
第Ⅰ卷 选择题(共 45 分)
一、选择题(本题共 15 个小题,每小题 3 分,共 45 分,每小题只有一个选项符合题意)
化学与生产、生活、科技密切相关。下列说法错误的是
镀锌的铁表面有划损时,铁仍然可受到保护 B. 蔗糖、淀粉、纤维素水解的最终产物都是葡萄糖
C. 非处方药的包装上印有“OTC”标识 D. 在食盐中加入的碘酸钾属于营养强化剂
家务劳动中蕴含着丰富的化学知识。下列相关解释错误的是
用过氧碳酸钠漂白衣物:Na2CO4 具有较强氧化性
酿米酒需晾凉米饭后加酒曲:乙醇受热易挥发
用柠檬酸去除少量水垢(主要成分是碳酸钙):柠檬酸酸性强于碳酸
用碱液清洗厨房油污:油脂可碱性水解
化石燃料的综合利用有利于环境保护,提高经济效益,如图是石油分馏塔的示意图。下列有关叙述正确的是
石油的分馏、煤的干馏都是物理变化
煤中含苯、甲苯、二甲苯
对重油加工处理可以获得沥青、润滑油等产品
a、b、c 三种馏分中 a 的沸点最高
结合已知条件分析,下列热化学方程式正确的是
选项 已知条件 热化学方程式
A 常温常压下,H2 的燃烧热数值为 a kJ/mol H2 (g) + 1/2O2(g) = H2O(g) - a kJ/mol
B 常温常压下,1 mol SO2 与足量 O2 充分反应后放出热量 49.15 kJ 2SO2(g) + O2(g) 2SO3(g) -98.3 kJ/mol
C 一定条件下,在水溶液中 1 mol Cl-、1 mol ClO-、1 mol ClO -的 3 相对能量(kJ)分别为 0,60,63 3ClO-(aq)=ClO-(aq)+2Cl-(aq) ΔH=+117 kJ/mol 3
D 常温常压下,31g 白磷比 31 g 红磷能量多 b kJ P4 (白磷,s) = 4P(红磷,s) - 4b kJ/mol
由 SiO2 制备高纯度硅的工业流程如图所示:
分子式为 C11H14O 的苯的一元取代物,能发生银镜反应的同分异构体(不考虑立体异构)有
A. 4 种 B. 8 种 C. 12 种 D. 16 种
实验室分离苯甲酸乙酯、苯甲酸和环己烷混合液的过程如下:
已知:苯甲酸乙酯的沸点为 212.6℃,“乙醚-环己烷-水共沸物”的沸点为 62.1℃。下列说法错误的是
操作 a 用到的玻璃仪器有分液漏斗和烧杯
乙醚萃取液应和有机相 1 合并后再进行操作 b
操作 b 为蒸馏
由该流程可知在水中溶解度:S(苯甲酸钠)某课外兴趣小组利用硫代硫酸钠与稀硫酸反应探究影响化学反应速率的因素,设计了如下表所示系列实验。下列说法错误的是
设计该实验的基本方法为变量控制法
该实验的化学方程式为 Na2S2O3 + H2SO4 = Na2SO4+S↓+SO2↑+H2O
若用实验 1 和 3 探究稀硫酸浓度对该反应速率的影响,则 V3=10.0,V4=6.0
可用热的 NaOH 浓溶液或 CS2 洗掉反应后仪器中的黄色固体,且原理相同
我国最近在太阳能光电催化~化学耦合分解硫化氢研究中获得新进展,相关装置如图所示。下列说法正确的是
该工艺中能量转化为:光能→电能→化学能
该装置工作时,H+由 b 极区流向 a 极区
a 极上发生的电极反应为 Fe3+ + e- = Fe2+
a 极区需不断补充含 Fe3+和 Fe2+的溶液
反应 X = 2Z 经历两步:①X→Y;②Y→2Z。反应体系中 X、Y、Z 的浓度 c 随时间 t 的变化曲线如图所示。下列说法错误的是
a 为 c(Y)随 t 的变化曲线
t1 时,c(X)=c(Y)=c(Z)
t2 时,Y 的消耗速率小于生成速率
t3 后,c(Z)=2[c0 - c(Y)]
室温下,某溶液初始时仅溶有 M 和 N 且浓度相等,同时发生以下两个反应:①M + N = X + Y;
②M + N = X + Z。化学反应速率不仅可用单位时间内物质的浓度变化表示,还可以用速率方程表示,如反应①的速率可表示为 v1 = k1c2(M),反应②的速率可表示为 v2 = k2c2(M),(k1、k2 为速率常数,c(M)表示某时刻 M 的物质的量浓度)。反应体系中组分 M、Z 的浓度随时间变化情况如图,下列说法错误的是
0~30 min 时间段内,Y 的平均反应速率为
6.67×10-3 mol L-1 min-1
反应开始后,体系中 Y 和 Z 的浓度之比保持不变
如果反应能进行到底,反应结束时 62.5%的 M 转化为 Z
反应①的反应速率小于反应②的速率
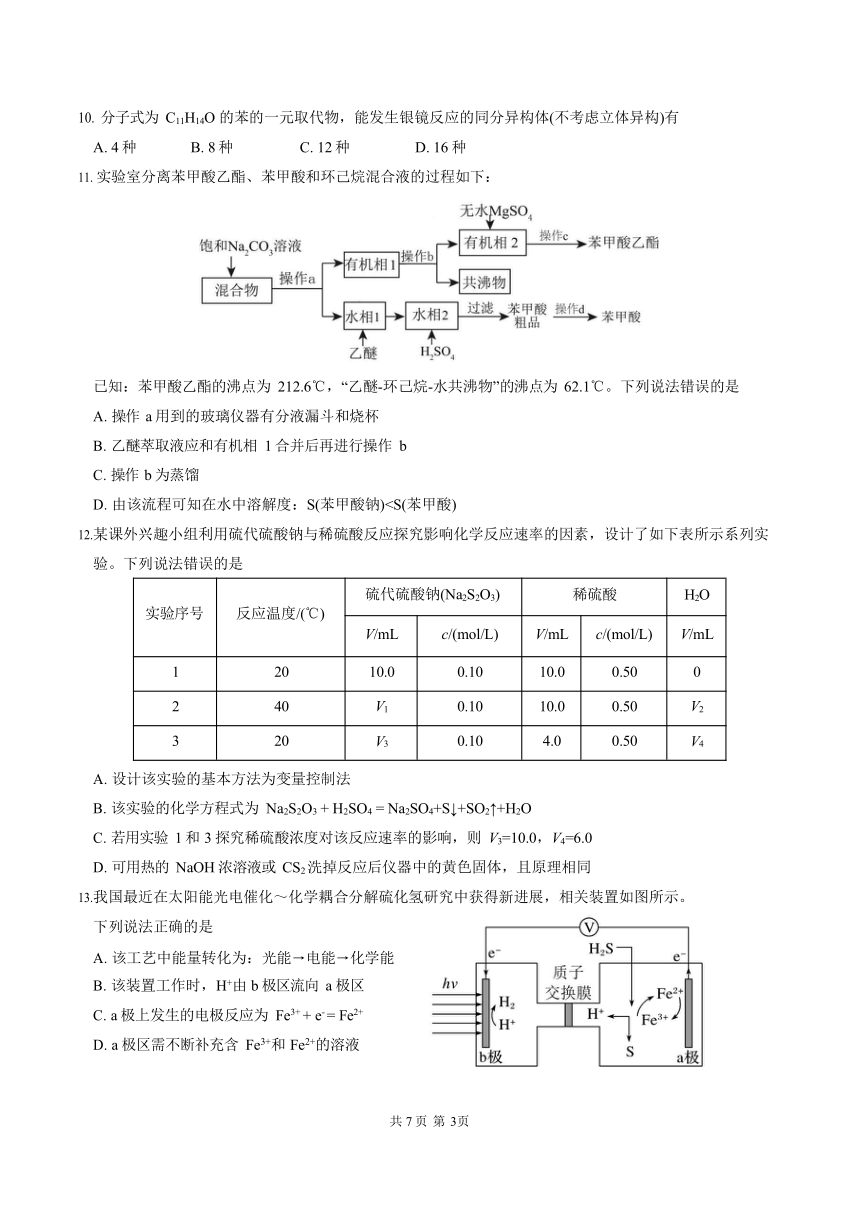
第Ⅱ卷 非选择题(共 55 分)
二、填空题(本题共 4 道题,共 55 分)
16.(14 分)
过二硫酸铵[(NH4)2S2O8]是一种白色晶体,其水溶液受热易分解,微溶于乙醇,常用作半导体材料表面的处理剂,某实验小组用 30%双氧水、浓硫酸和氨气加热至 80~90℃制备过二硫酸铵,实验装置如图(控温和夹持仪器已略去)。回答下列问题:
过二硫酸铵中的硫元素为+6 价,因含有-1 价 O 而具有强氧化性,则 1 mol 过二硫酸铵中含有 “—O—O—”结构为 mol。
为使装置 A 中分液漏斗内的浓硫酸顺利滴下,可将分液漏斗上部的玻璃塞打开或 。
B 框中为制备氨气的装置,其氨气从 c 口导出,下列装置不能填入其中的是 (填序号)。仪器的连接顺序为c (用小.写.字.母.和.箭.头.连接)。
反应过程中若W 仪器内反应温度过高,会导致结果有 。
装置 W 制备过二硫酸铵的化学方程式为 。充分反应后,将W 中混合液经一系列操作得到晶体,然后用无水乙醇洗涤。选择用无水乙醇洗涤的目的是 。
取 4.00 g 过二硫酸铵样品溶于水,配成 250 mL 溶液,量取 25.00 mL 所配溶液于锥形瓶中,加入过量的 KI 溶液,生成的 I2 恰好与 12.50 mL 0.20 mol L-1 的 Na2S2O3 溶液完全反应,样品中过二硫酸铵的质量分数为 %。(提示:I2+2S2O 2- =2I—+ S4O 2-)
17.(13 分)
自然资源(金属矿物、海水资源等)的开发利用,是化学服务社会的重要努力方向。
海水的淡化:
请列举海水淡化的方法:蒸馏法、离子交换法、 (填 1 种方法)。离子交换法净化水的过程如图所示,下列说法正确
的是 (填序号)。
经过阳离子交换树脂后,水中阳离子总数减少
通过阴离子交换树脂后,水中只有 SO42-被除去
通过净化处理后的水,导电性增强
阴离子交换树脂填充段存在反应:H++OH— =H2O
从海水中提取溴的过程:
上述步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将其转化成化合态的溴,目的是 。
Br2 与 Na2CO3 溶液反应的离子方程式为 ,用硫酸酸化时,发生归中反应中氧化产物与还原产物的物质的量之比为 。
某同学测得苦卤中溴的含量是 0.8 g·L-1,已知步骤Ⅰ和Ⅱ中溴共损失了 25%,步骤Ⅲ溴又共损失了 10%,若处理 20 m3 这样的苦卤,可得到液溴 mol。
以萤石(CaF2)和纯碱等为原料制备冰晶石(Na3[AlF6])的流程:
化合物 A 可作为建筑材料, A 是 ,写出由气体 B 制备冰晶石的化学方程式 。
18.(14 分)
在化学反应的研究和实际应用中,人们除了选择合适的化学反应以实现所期待的物质转化和能量转化,如化学能可转化为热能、电能等,同时还要关注化学反应进行的快慢和程度,以提高生产效率。
烟气脱硝可以用 H2 催化还原法。发生反应:2NO(g)+2H2(g)
N2(g)+2H2O(g),反应过程中的能量变化如图所示,部分化学键的键能如表所示:
则破坏 1 molNO 分子中化学键需要吸收 kJ 的能量。
一定条件下,在 5 L 密闭容器内,反应 2NO2(g) N2O4 (g),NO2 的物质的量随时间变化如表:
时间/s 0 1 2 3 4 5
n NO2 /mol 0.040 0.020 0.010 0.005 0.005 0.005
①用 N2O4 表示 0~2 s 内该反应的平均速率为 mol·L-1·s-1;平衡时 N2O4 的体积分数为 %(保留到整数)。
②为了加快反应速率,可采取的措施有 。
a. 升高温度 b. 恒温恒容时充入 He(g) c. 恒温恒压充入 He(g) d. 恒温恒容充入 NO2
将一定量纯净的氨基甲酸铵置于恒容密闭真空容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:H2NCOONH4(s) 2NH3(g)+CO2(g),不.能.判断该反应已经达到化学平衡状态的是 。
a. v NH3 2v CO2 b. 密闭容器中总压强不变
c. 密闭容器中混合气体的密度不变 d. 密闭容器中混合气体的平均相对分子质量不变
已知:2N2O=2N2+O2,不同温度(T)下,N2O 分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度 N2O 消耗一半时所需的相
应时间),则 T1 T2(填“>”、“=”或“<”)。当温度为 T1、起始压强为 p0 ,反应至 t1 min 时,此时体系压强 p= kPa(用 p0 表示)。
氨气-空气碱性燃料电池放电时的总反应为4NH3 3O2 2N2 6H2O ,负极的电极反应式
为 。
19.(14 分)
有机物 J 是一种提高血液中白细胞含量的缓释药的成分,一种合成路线如图所示。
已知:①CH3CH=CH2CH3CH2CH2Cl;②CH3CH2Cl CH3CH2OH。回答下列问题:
A 的化学名称为 ,C 的结构简式为 ,D→E 的反应类型为 。
检验 E 的官能团的一种试剂是 (填名称),F 中官能团的名称是醛基和 ,
H→I 的另一种产物的分子式为 。
D 的最简单的同系物 L 可以由乙烯合成,其合成路线为:CH2=CH2 K L,写出 CH2=CH2→K 的化学方程式 。
写出反应 I→J 的化学方程式 。
I 的同分异构体有多种,写出满足下列条件的同分异构体的结构简式 (写两种即可)。
①与 I 具有相同的官能团;②苯环上有两个取代基;③分子中有 4 种不同化学环境的氢
化学试卷
(考试时间:75 分钟;满分:100 分)可能用到的相对原子质量:H-1 C-12 N-14 O-16 P-31 S-32 Br-80
第Ⅰ卷 选择题(共 45 分)
一、选择题(本题共 15 个小题,每小题 3 分,共 45 分,每小题只有一个选项符合题意)
化学与生产、生活、科技密切相关。下列说法错误的是
镀锌的铁表面有划损时,铁仍然可受到保护 B. 蔗糖、淀粉、纤维素水解的最终产物都是葡萄糖
C. 非处方药的包装上印有“OTC”标识 D. 在食盐中加入的碘酸钾属于营养强化剂
家务劳动中蕴含着丰富的化学知识。下列相关解释错误的是
用过氧碳酸钠漂白衣物:Na2CO4 具有较强氧化性
酿米酒需晾凉米饭后加酒曲:乙醇受热易挥发
用柠檬酸去除少量水垢(主要成分是碳酸钙):柠檬酸酸性强于碳酸
用碱液清洗厨房油污:油脂可碱性水解
化石燃料的综合利用有利于环境保护,提高经济效益,如图是石油分馏塔的示意图。下列有关叙述正确的是
石油的分馏、煤的干馏都是物理变化
煤中含苯、甲苯、二甲苯
对重油加工处理可以获得沥青、润滑油等产品
a、b、c 三种馏分中 a 的沸点最高
结合已知条件分析,下列热化学方程式正确的是
选项 已知条件 热化学方程式
A 常温常压下,H2 的燃烧热数值为 a kJ/mol H2 (g) + 1/2O2(g) = H2O(g) - a kJ/mol
B 常温常压下,1 mol SO2 与足量 O2 充分反应后放出热量 49.15 kJ 2SO2(g) + O2(g) 2SO3(g) -98.3 kJ/mol
C 一定条件下,在水溶液中 1 mol Cl-、1 mol ClO-、1 mol ClO -的 3 相对能量(kJ)分别为 0,60,63 3ClO-(aq)=ClO-(aq)+2Cl-(aq) ΔH=+117 kJ/mol 3
D 常温常压下,31g 白磷比 31 g 红磷能量多 b kJ P4 (白磷,s) = 4P(红磷,s) - 4b kJ/mol
由 SiO2 制备高纯度硅的工业流程如图所示:
分子式为 C11H14O 的苯的一元取代物,能发生银镜反应的同分异构体(不考虑立体异构)有
A. 4 种 B. 8 种 C. 12 种 D. 16 种
实验室分离苯甲酸乙酯、苯甲酸和环己烷混合液的过程如下:
已知:苯甲酸乙酯的沸点为 212.6℃,“乙醚-环己烷-水共沸物”的沸点为 62.1℃。下列说法错误的是
操作 a 用到的玻璃仪器有分液漏斗和烧杯
乙醚萃取液应和有机相 1 合并后再进行操作 b
操作 b 为蒸馏
由该流程可知在水中溶解度:S(苯甲酸钠)
设计该实验的基本方法为变量控制法
该实验的化学方程式为 Na2S2O3 + H2SO4 = Na2SO4+S↓+SO2↑+H2O
若用实验 1 和 3 探究稀硫酸浓度对该反应速率的影响,则 V3=10.0,V4=6.0
可用热的 NaOH 浓溶液或 CS2 洗掉反应后仪器中的黄色固体,且原理相同
我国最近在太阳能光电催化~化学耦合分解硫化氢研究中获得新进展,相关装置如图所示。下列说法正确的是
该工艺中能量转化为:光能→电能→化学能
该装置工作时,H+由 b 极区流向 a 极区
a 极上发生的电极反应为 Fe3+ + e- = Fe2+
a 极区需不断补充含 Fe3+和 Fe2+的溶液
反应 X = 2Z 经历两步:①X→Y;②Y→2Z。反应体系中 X、Y、Z 的浓度 c 随时间 t 的变化曲线如图所示。下列说法错误的是
a 为 c(Y)随 t 的变化曲线
t1 时,c(X)=c(Y)=c(Z)
t2 时,Y 的消耗速率小于生成速率
t3 后,c(Z)=2[c0 - c(Y)]
室温下,某溶液初始时仅溶有 M 和 N 且浓度相等,同时发生以下两个反应:①M + N = X + Y;
②M + N = X + Z。化学反应速率不仅可用单位时间内物质的浓度变化表示,还可以用速率方程表示,如反应①的速率可表示为 v1 = k1c2(M),反应②的速率可表示为 v2 = k2c2(M),(k1、k2 为速率常数,c(M)表示某时刻 M 的物质的量浓度)。反应体系中组分 M、Z 的浓度随时间变化情况如图,下列说法错误的是
0~30 min 时间段内,Y 的平均反应速率为
6.67×10-3 mol L-1 min-1
反应开始后,体系中 Y 和 Z 的浓度之比保持不变
如果反应能进行到底,反应结束时 62.5%的 M 转化为 Z
反应①的反应速率小于反应②的速率
第Ⅱ卷 非选择题(共 55 分)
二、填空题(本题共 4 道题,共 55 分)
16.(14 分)
过二硫酸铵[(NH4)2S2O8]是一种白色晶体,其水溶液受热易分解,微溶于乙醇,常用作半导体材料表面的处理剂,某实验小组用 30%双氧水、浓硫酸和氨气加热至 80~90℃制备过二硫酸铵,实验装置如图(控温和夹持仪器已略去)。回答下列问题:
过二硫酸铵中的硫元素为+6 价,因含有-1 价 O 而具有强氧化性,则 1 mol 过二硫酸铵中含有 “—O—O—”结构为 mol。
为使装置 A 中分液漏斗内的浓硫酸顺利滴下,可将分液漏斗上部的玻璃塞打开或 。
B 框中为制备氨气的装置,其氨气从 c 口导出,下列装置不能填入其中的是 (填序号)。仪器的连接顺序为c (用小.写.字.母.和.箭.头.连接)。
反应过程中若W 仪器内反应温度过高,会导致结果有 。
装置 W 制备过二硫酸铵的化学方程式为 。充分反应后,将W 中混合液经一系列操作得到晶体,然后用无水乙醇洗涤。选择用无水乙醇洗涤的目的是 。
取 4.00 g 过二硫酸铵样品溶于水,配成 250 mL 溶液,量取 25.00 mL 所配溶液于锥形瓶中,加入过量的 KI 溶液,生成的 I2 恰好与 12.50 mL 0.20 mol L-1 的 Na2S2O3 溶液完全反应,样品中过二硫酸铵的质量分数为 %。(提示:I2+2S2O 2- =2I—+ S4O 2-)
17.(13 分)
自然资源(金属矿物、海水资源等)的开发利用,是化学服务社会的重要努力方向。
海水的淡化:
请列举海水淡化的方法:蒸馏法、离子交换法、 (填 1 种方法)。离子交换法净化水的过程如图所示,下列说法正确
的是 (填序号)。
经过阳离子交换树脂后,水中阳离子总数减少
通过阴离子交换树脂后,水中只有 SO42-被除去
通过净化处理后的水,导电性增强
阴离子交换树脂填充段存在反应:H++OH— =H2O
从海水中提取溴的过程:
上述步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将其转化成化合态的溴,目的是 。
Br2 与 Na2CO3 溶液反应的离子方程式为 ,用硫酸酸化时,发生归中反应中氧化产物与还原产物的物质的量之比为 。
某同学测得苦卤中溴的含量是 0.8 g·L-1,已知步骤Ⅰ和Ⅱ中溴共损失了 25%,步骤Ⅲ溴又共损失了 10%,若处理 20 m3 这样的苦卤,可得到液溴 mol。
以萤石(CaF2)和纯碱等为原料制备冰晶石(Na3[AlF6])的流程:
化合物 A 可作为建筑材料, A 是 ,写出由气体 B 制备冰晶石的化学方程式 。
18.(14 分)
在化学反应的研究和实际应用中,人们除了选择合适的化学反应以实现所期待的物质转化和能量转化,如化学能可转化为热能、电能等,同时还要关注化学反应进行的快慢和程度,以提高生产效率。
烟气脱硝可以用 H2 催化还原法。发生反应:2NO(g)+2H2(g)
N2(g)+2H2O(g),反应过程中的能量变化如图所示,部分化学键的键能如表所示:
则破坏 1 molNO 分子中化学键需要吸收 kJ 的能量。
一定条件下,在 5 L 密闭容器内,反应 2NO2(g) N2O4 (g),NO2 的物质的量随时间变化如表:
时间/s 0 1 2 3 4 5
n NO2 /mol 0.040 0.020 0.010 0.005 0.005 0.005
①用 N2O4 表示 0~2 s 内该反应的平均速率为 mol·L-1·s-1;平衡时 N2O4 的体积分数为 %(保留到整数)。
②为了加快反应速率,可采取的措施有 。
a. 升高温度 b. 恒温恒容时充入 He(g) c. 恒温恒压充入 He(g) d. 恒温恒容充入 NO2
将一定量纯净的氨基甲酸铵置于恒容密闭真空容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:H2NCOONH4(s) 2NH3(g)+CO2(g),不.能.判断该反应已经达到化学平衡状态的是 。
a. v NH3 2v CO2 b. 密闭容器中总压强不变
c. 密闭容器中混合气体的密度不变 d. 密闭容器中混合气体的平均相对分子质量不变
已知:2N2O=2N2+O2,不同温度(T)下,N2O 分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度 N2O 消耗一半时所需的相
应时间),则 T1 T2(填“>”、“=”或“<”)。当温度为 T1、起始压强为 p0 ,反应至 t1 min 时,此时体系压强 p= kPa(用 p0 表示)。
氨气-空气碱性燃料电池放电时的总反应为4NH3 3O2 2N2 6H2O ,负极的电极反应式
为 。
19.(14 分)
有机物 J 是一种提高血液中白细胞含量的缓释药的成分,一种合成路线如图所示。
已知:①CH3CH=CH2CH3CH2CH2Cl;②CH3CH2Cl CH3CH2OH。回答下列问题:
A 的化学名称为 ,C 的结构简式为 ,D→E 的反应类型为 。
检验 E 的官能团的一种试剂是 (填名称),F 中官能团的名称是醛基和 ,
H→I 的另一种产物的分子式为 。
D 的最简单的同系物 L 可以由乙烯合成,其合成路线为:CH2=CH2 K L,写出 CH2=CH2→K 的化学方程式 。
写出反应 I→J 的化学方程式 。
I 的同分异构体有多种,写出满足下列条件的同分异构体的结构简式 (写两种即可)。
①与 I 具有相同的官能团;②苯环上有两个取代基;③分子中有 4 种不同化学环境的氢
同课章节目录
