母题必读 命题区间九电化学基础--《高考快车道》2026版高考化学母题必读及衍生卷
文档属性
| 名称 | 母题必读 命题区间九电化学基础--《高考快车道》2026版高考化学母题必读及衍生卷 |

|
|
| 格式 | DOCX | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-10-20 00:00:00 | ||
图片预览



文档简介
电化学基础
命题角度 3年考题分布 考情预测
新型化学电源 2024·甘肃卷T7;2024·新课标卷T6;2024·全国甲卷T6;2023·辽宁卷T11;2023·全国乙卷T12; 2023·山东卷T11;2022·广东卷T16 电化学是高考必考点,预测在2025高考中,以陌生新型二次电池以及含有离子交换膜的电解池为背景的命题将成为热点题型,因为二次电池不仅实现电极材料循环使用,符合“低耗高效”的时代需求,而且命题角度丰富,便于同时考查原电池和电解池的工作原理;含有离子交换膜的电解池设问空间大,便于考查考生的探究能力。
电解原理在工农业生产中的应用 2024·山东卷T13;2024·湖北卷T14;2024·广东卷T16;2023·湖北卷T10;2023·辽宁卷T7;2023·北京卷T5;2022·广东卷T10;2022·浙江6月卷T21;2022·北京卷T4;2022·湖北卷T14
金属的腐蚀与防护 2024·广东卷T5;2024·湖北卷T2;2022·广东卷T11
新型化学电源
高考真题 构建解题模型
(2024·新课标卷T6)一种可植入体内的微型电池工作原理如图所示,通过CuO催化消耗血糖发电,从而控制血糖浓度。当传感器检测到血糖浓度高于标准,电池启动。血糖浓度下降至标准,电池停止工作(血糖浓度以葡萄糖浓度计)。 电池工作时,下列叙述错误的是( ) A.电池总反应为2C6H12O6+O2===2C6H12O7 B.b电极上CuO通过Cu(Ⅱ)和Cu(Ⅰ)相互转变起催化作用 C.消耗18 mg葡萄糖,理论上a电极有0.4 mmol电子流入 D.两电极间血液中的Na+在电场驱动下的迁移方向为b→a 由题中信息可知,b电极为负极,发生反应Cu2O-2e-+2OH-===2CuO+H2O,然后再发生C6H12O6+2CuO===C6H12O7+Cu2O;a电极为正极,发生反应O2+4e-+2H2O===4OH-,在这个过程中发生的总反应为2C6H12O6+O2===2C6H12O7。 由题图知, O2在a电极上得电子生成OH-,a电极为电池正极,Cu2O在b电极上失电子转化成CuO,b电极为电池负极,在负极区,葡萄糖被CuO氧化为葡萄糖酸,CuO被还原为Cu2O,则电池总反应为葡萄糖被O2氧化为葡萄糖酸,A正确;Cu2O在b电极上失电子转化成CuO,CuO氧化葡萄糖时被还原生成Cu2O,它们的相互转变起催化作用,B正确;根据反应2C6H12O6+O2===2C6H12O7可知,1 mol C6H12O6参加反应时转移2 mol电子,18 mg C6H12O6的物质的量为0.1 mmol,则消耗18 mg葡萄糖时,理论上a电极有0.2 mmol电子流入,C错误;原电池中阳离子从负极移向正极,故两极间血液中的Na+迁移方向为b→a,D正确。 C
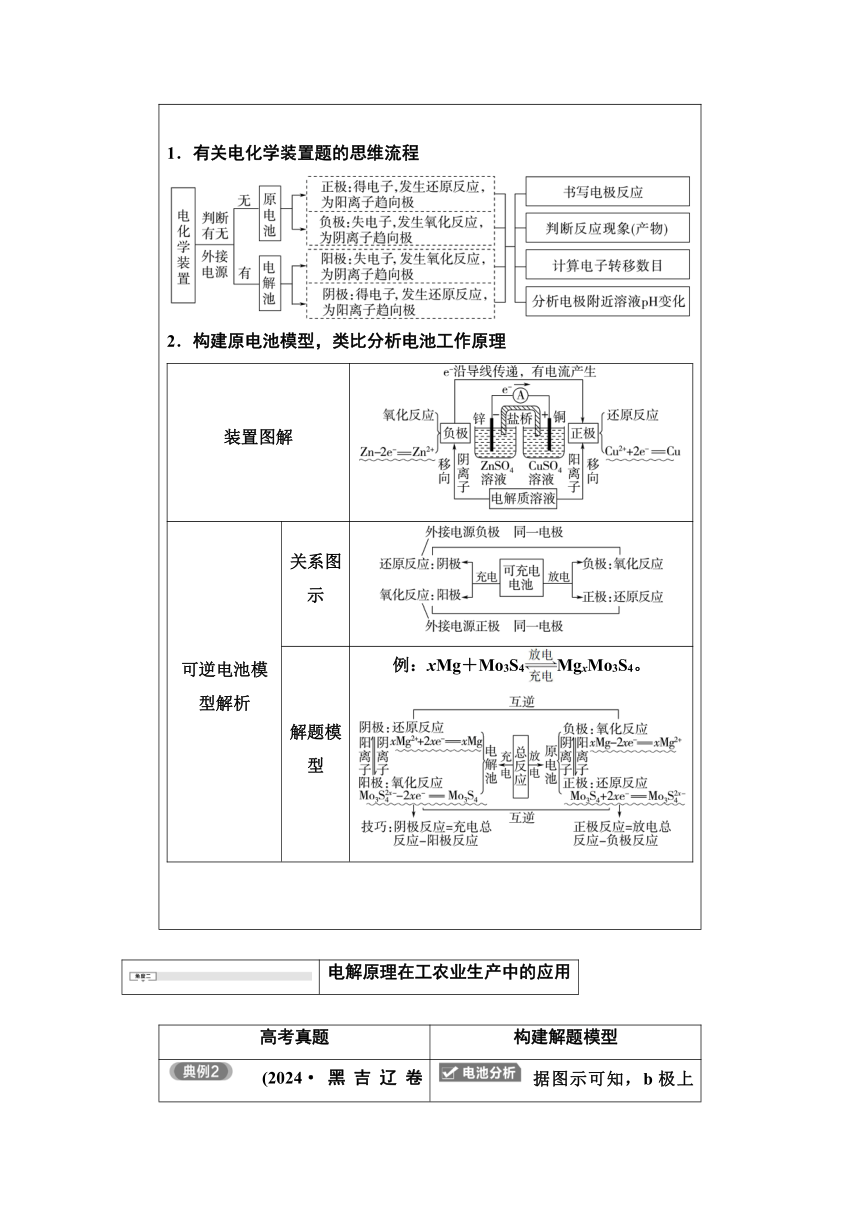
1.有关电化学装置题的思维流程 2.构建原电池模型,类比分析电池工作原理 装置图解可逆电池模型解析关系图示解题模型例:xMg+Mo3S4MgxMo3S4。
电解原理在工农业生产中的应用
高考真题 构建解题模型
(2024·黑吉辽卷T12)“绿色零碳”氢能前景广阔。为解决传统电解水制“绿氢”阳极电势高、反应速率缓慢的问题,科技工作者设计耦合HCHO高效制H2的方法,装置如图所示。部分反应机理为:+H2。下列说法错误的是( ) A.相同电量下H2理论产量是传统电解水的1.5倍 B.阴极反应:2H2O+2e-===2OH-+H2↑ C.电解时OH-通过阴离子交换膜向b极方向移动 D.阳极反应:2HCHO-2e-+4OH-===2HCOO-+2H2O+H2↑ 据图示可知,b极上HCHO转化为HCOO-,发生氧化反应,则b极为阳极,a极为阴极,HCHO为阳极反应物,由反应机理 +H2可知:反应后生成的转化为HCOOH。由元素守恒和电荷守恒可知,在生成HCOOH的同时还生成了H-,生成的HCOOH再与氢氧化钾发生酸碱中和反应:HCOOH+OH-===HCOO-+H2O,而生成的H-在阳极失电子发生氧化反应生成氢气,即2H--2e-===H2↑,阴极上水得电子生成氢气:2H2O+2e-===H2↑+2OH-。 A.由上述分析可知,阳极反应:①HCHO+OH--e-===HCOOH+H2↑,②HCOOH+OH-===HCOO-+H2O,阴极反应:2H2O+2e-===H2↑+2OH-,即转移2 mol电子时,阴、阳两极各生成1 mol H2,共2 mol H2,而传统电解水:2H2O2H2↑+O2↑,转移2 mol电子,只有阴极生成1 mol H2,所以相同电量下H2理论产量是传统电解水的2倍,故A错误;B.阴极上水得电子生成氢气,阴极反应式为2H2O+2e-===H2↑+2OH-,故B正确;C.由电极反应式可知,电解过程中阴极生成OH-,负电荷增多,阳极负电荷减少,要使电解质溶液呈电中性,OH-通过阴离子交换膜向阳极移动,即向b极方向移动,故C正确;D.由上述分析可知,阳极反应涉及:①HCHO+ OH-—e-===HCOOH+HCOOH+===HCOO-+H2O,由(①+②)×2得阳极反应为2HCHO-2e-+4OH-===2HCOO-+2H2O+H2↑,故D正确;答案选A。 A
1.电解池原理及应用 (1)图解电解池工作原理(阳极为惰性电极) (2)正确判断电极产物 ①阳极产物的判断首先看电极,若是活性电极作阳极,则电极材料失电子,电极溶解(注意:铁作阳极溶解生成Fe2+,而不是Fe3+);若是惰性电极,则需看溶液中阴离子的失电子能力,阴离子放电顺序为S2->I->Br->Cl->OH-(水)。 ②阴极产物的判断直接根据阳离子的放电顺序进行判断: Ag+>Hg2+>Fe3+>Cu2+>H+>Pb2+>Fe2+>Zn2+。 2.构建电解池模型类比分析多室电解 电解池模型惰性电极电解CuCl2溶液多室电解池三室电渗析法处理Na2SO4废水
金属的腐蚀与防护
高考真题 构建解题模型
(2024·广东卷T5)我国自主设计建造的浮式生产储卸油装置“海葵一号”将在珠江口盆地海域使用,其钢铁外壳镶嵌了锌块,以利用电化学原理延缓外壳的腐蚀。下列有关说法正确的是( ) A.钢铁外壳为负极 B.镶嵌的锌块可永久使用 C.该法为外加电流法 D.锌发生反应:Zn-2e-===Zn2+ “钢铁外壳镶嵌了锌块”构成原电池,属于牺牲阳极法。 钢铁外壳镶嵌了锌块,由于金属活动性:Zn>Fe,则锌块为负极,钢铁外壳为正极,形成原电池,Zn失去电子,发生氧化反应:Zn-2e-===Zn2+,从而保护钢铁,延缓其腐蚀。A.由于金属活动性:Zn>Fe,则钢铁外壳为正极,锌块为负极,故A错误;B.Zn失去电子,发生氧化反应:Zn-2e-===Zn2+,镶嵌的锌块会被逐渐消耗,需根据腐蚀情况进行维护和更换,不能永久使用,故B错误;C.由分析可知,该方法为牺牲阳极的阴极保护法,故C错误;D.Zn作负极,发生失电子的氧化反应:Zn-2e-===Zn2+,故D正确。 D
金属腐蚀与防护的方法
(1)金属腐蚀快慢的判断方法
(2)金属电化学保护的两种方法
命题角度 3年考题分布 考情预测
新型化学电源 2024·甘肃卷T7;2024·新课标卷T6;2024·全国甲卷T6;2023·辽宁卷T11;2023·全国乙卷T12; 2023·山东卷T11;2022·广东卷T16 电化学是高考必考点,预测在2025高考中,以陌生新型二次电池以及含有离子交换膜的电解池为背景的命题将成为热点题型,因为二次电池不仅实现电极材料循环使用,符合“低耗高效”的时代需求,而且命题角度丰富,便于同时考查原电池和电解池的工作原理;含有离子交换膜的电解池设问空间大,便于考查考生的探究能力。
电解原理在工农业生产中的应用 2024·山东卷T13;2024·湖北卷T14;2024·广东卷T16;2023·湖北卷T10;2023·辽宁卷T7;2023·北京卷T5;2022·广东卷T10;2022·浙江6月卷T21;2022·北京卷T4;2022·湖北卷T14
金属的腐蚀与防护 2024·广东卷T5;2024·湖北卷T2;2022·广东卷T11
新型化学电源
高考真题 构建解题模型
(2024·新课标卷T6)一种可植入体内的微型电池工作原理如图所示,通过CuO催化消耗血糖发电,从而控制血糖浓度。当传感器检测到血糖浓度高于标准,电池启动。血糖浓度下降至标准,电池停止工作(血糖浓度以葡萄糖浓度计)。 电池工作时,下列叙述错误的是( ) A.电池总反应为2C6H12O6+O2===2C6H12O7 B.b电极上CuO通过Cu(Ⅱ)和Cu(Ⅰ)相互转变起催化作用 C.消耗18 mg葡萄糖,理论上a电极有0.4 mmol电子流入 D.两电极间血液中的Na+在电场驱动下的迁移方向为b→a 由题中信息可知,b电极为负极,发生反应Cu2O-2e-+2OH-===2CuO+H2O,然后再发生C6H12O6+2CuO===C6H12O7+Cu2O;a电极为正极,发生反应O2+4e-+2H2O===4OH-,在这个过程中发生的总反应为2C6H12O6+O2===2C6H12O7。 由题图知, O2在a电极上得电子生成OH-,a电极为电池正极,Cu2O在b电极上失电子转化成CuO,b电极为电池负极,在负极区,葡萄糖被CuO氧化为葡萄糖酸,CuO被还原为Cu2O,则电池总反应为葡萄糖被O2氧化为葡萄糖酸,A正确;Cu2O在b电极上失电子转化成CuO,CuO氧化葡萄糖时被还原生成Cu2O,它们的相互转变起催化作用,B正确;根据反应2C6H12O6+O2===2C6H12O7可知,1 mol C6H12O6参加反应时转移2 mol电子,18 mg C6H12O6的物质的量为0.1 mmol,则消耗18 mg葡萄糖时,理论上a电极有0.2 mmol电子流入,C错误;原电池中阳离子从负极移向正极,故两极间血液中的Na+迁移方向为b→a,D正确。 C
1.有关电化学装置题的思维流程 2.构建原电池模型,类比分析电池工作原理 装置图解可逆电池模型解析关系图示解题模型例:xMg+Mo3S4MgxMo3S4。
电解原理在工农业生产中的应用
高考真题 构建解题模型
(2024·黑吉辽卷T12)“绿色零碳”氢能前景广阔。为解决传统电解水制“绿氢”阳极电势高、反应速率缓慢的问题,科技工作者设计耦合HCHO高效制H2的方法,装置如图所示。部分反应机理为:+H2。下列说法错误的是( ) A.相同电量下H2理论产量是传统电解水的1.5倍 B.阴极反应:2H2O+2e-===2OH-+H2↑ C.电解时OH-通过阴离子交换膜向b极方向移动 D.阳极反应:2HCHO-2e-+4OH-===2HCOO-+2H2O+H2↑ 据图示可知,b极上HCHO转化为HCOO-,发生氧化反应,则b极为阳极,a极为阴极,HCHO为阳极反应物,由反应机理 +H2可知:反应后生成的转化为HCOOH。由元素守恒和电荷守恒可知,在生成HCOOH的同时还生成了H-,生成的HCOOH再与氢氧化钾发生酸碱中和反应:HCOOH+OH-===HCOO-+H2O,而生成的H-在阳极失电子发生氧化反应生成氢气,即2H--2e-===H2↑,阴极上水得电子生成氢气:2H2O+2e-===H2↑+2OH-。 A.由上述分析可知,阳极反应:①HCHO+OH--e-===HCOOH+H2↑,②HCOOH+OH-===HCOO-+H2O,阴极反应:2H2O+2e-===H2↑+2OH-,即转移2 mol电子时,阴、阳两极各生成1 mol H2,共2 mol H2,而传统电解水:2H2O2H2↑+O2↑,转移2 mol电子,只有阴极生成1 mol H2,所以相同电量下H2理论产量是传统电解水的2倍,故A错误;B.阴极上水得电子生成氢气,阴极反应式为2H2O+2e-===H2↑+2OH-,故B正确;C.由电极反应式可知,电解过程中阴极生成OH-,负电荷增多,阳极负电荷减少,要使电解质溶液呈电中性,OH-通过阴离子交换膜向阳极移动,即向b极方向移动,故C正确;D.由上述分析可知,阳极反应涉及:①HCHO+ OH-—e-===HCOOH+HCOOH+===HCOO-+H2O,由(①+②)×2得阳极反应为2HCHO-2e-+4OH-===2HCOO-+2H2O+H2↑,故D正确;答案选A。 A
1.电解池原理及应用 (1)图解电解池工作原理(阳极为惰性电极) (2)正确判断电极产物 ①阳极产物的判断首先看电极,若是活性电极作阳极,则电极材料失电子,电极溶解(注意:铁作阳极溶解生成Fe2+,而不是Fe3+);若是惰性电极,则需看溶液中阴离子的失电子能力,阴离子放电顺序为S2->I->Br->Cl->OH-(水)。 ②阴极产物的判断直接根据阳离子的放电顺序进行判断: Ag+>Hg2+>Fe3+>Cu2+>H+>Pb2+>Fe2+>Zn2+。 2.构建电解池模型类比分析多室电解 电解池模型惰性电极电解CuCl2溶液多室电解池三室电渗析法处理Na2SO4废水
金属的腐蚀与防护
高考真题 构建解题模型
(2024·广东卷T5)我国自主设计建造的浮式生产储卸油装置“海葵一号”将在珠江口盆地海域使用,其钢铁外壳镶嵌了锌块,以利用电化学原理延缓外壳的腐蚀。下列有关说法正确的是( ) A.钢铁外壳为负极 B.镶嵌的锌块可永久使用 C.该法为外加电流法 D.锌发生反应:Zn-2e-===Zn2+ “钢铁外壳镶嵌了锌块”构成原电池,属于牺牲阳极法。 钢铁外壳镶嵌了锌块,由于金属活动性:Zn>Fe,则锌块为负极,钢铁外壳为正极,形成原电池,Zn失去电子,发生氧化反应:Zn-2e-===Zn2+,从而保护钢铁,延缓其腐蚀。A.由于金属活动性:Zn>Fe,则钢铁外壳为正极,锌块为负极,故A错误;B.Zn失去电子,发生氧化反应:Zn-2e-===Zn2+,镶嵌的锌块会被逐渐消耗,需根据腐蚀情况进行维护和更换,不能永久使用,故B错误;C.由分析可知,该方法为牺牲阳极的阴极保护法,故C错误;D.Zn作负极,发生失电子的氧化反应:Zn-2e-===Zn2+,故D正确。 D
金属腐蚀与防护的方法
(1)金属腐蚀快慢的判断方法
(2)金属电化学保护的两种方法
同课章节目录
