第二章 海水中的重要元素——钠和氯实验整合练 钠、氯及其化合物的实验探究-《精讲精练》26版高中同步新教材化学人教A版(2019)必修第一册
文档属性
| 名称 | 第二章 海水中的重要元素——钠和氯实验整合练 钠、氯及其化合物的实验探究-《精讲精练》26版高中同步新教材化学人教A版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 332.4KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-09 11:00:49 | ||
图片预览




文档简介
实验整合练 钠、氯及其化合物的实验探究
实验1 钠及其化合物的实验探究
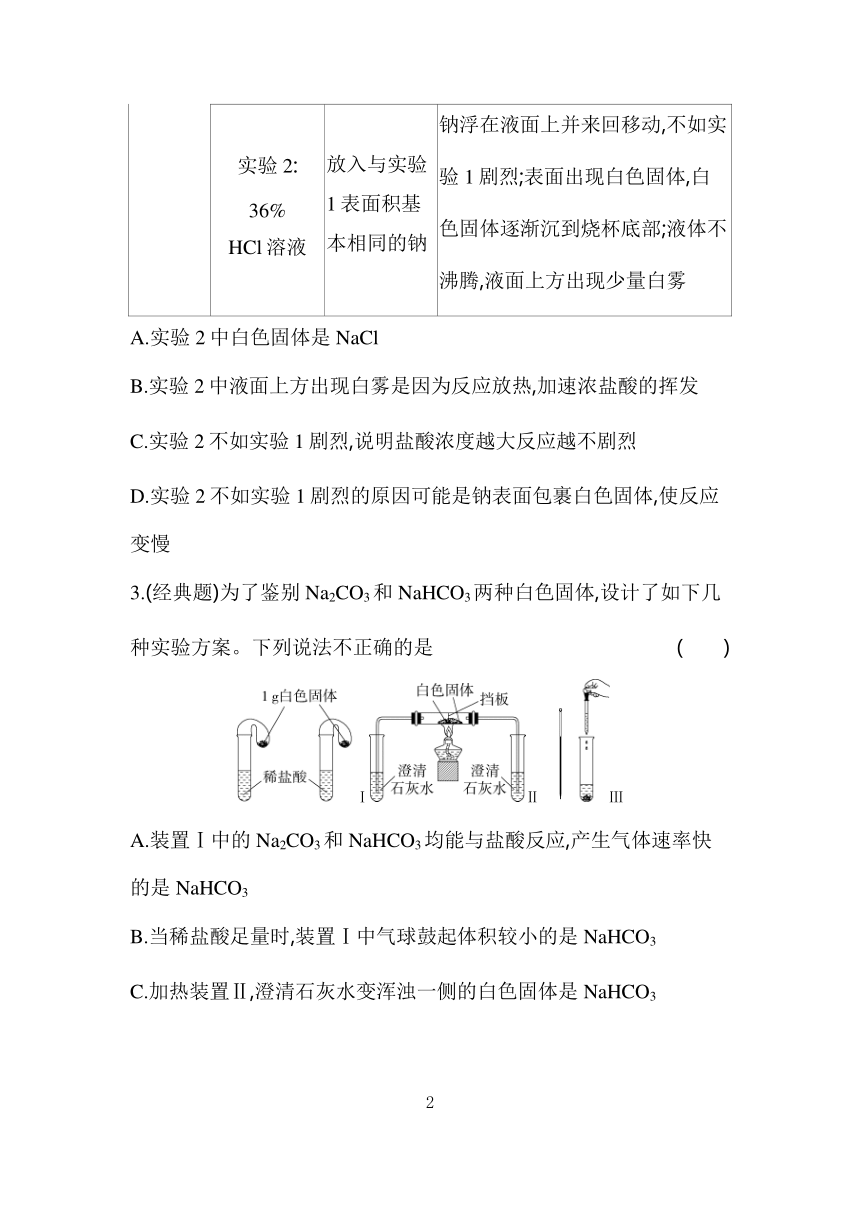
1.NaH是有机合成中用途很广泛的物质。已知:NaH遇水蒸气剧烈反应。某小组设计如图实验装置制备NaH,下列说法错误的是 ( )
安全漏斗的作用是“液封”
B.装置A中的试剂是稀硫酸和粗锌
C.装置B中的试剂是浓硫酸
D.实验开始后先点燃C处酒精灯,再启动A中反应
2.某小组同学探究金属Na与不同浓度的盐酸反应,进行下列实验。下列说法不正确的是 ( )
实验装置 实验试剂 实验操作 实验现象
实验1: 0.36% HCl溶液 放入一小块金属钠 钠浮在液面上并来回移动,与水的反应剧烈程度相当
实验2: 36% HCl溶液 放入与实验1表面积基本相同的钠 钠浮在液面上并来回移动,不如实验1剧烈;表面出现白色固体,白色固体逐渐沉到烧杯底部;液体不沸腾,液面上方出现少量白雾
A.实验2中白色固体是NaCl
B.实验2中液面上方出现白雾是因为反应放热,加速浓盐酸的挥发
C.实验2不如实验1剧烈,说明盐酸浓度越大反应越不剧烈
D.实验2不如实验1剧烈的原因可能是钠表面包裹白色固体,使反应变慢
3.(经典题)为了鉴别Na2CO3和NaHCO3两种白色固体,设计了如下几种实验方案。下列说法不正确的是 ( )
ⅠⅡ Ⅲ
A.装置Ⅰ中的Na2CO3和NaHCO3均能与盐酸反应,产生气体速率快的是NaHCO3
B.当稀盐酸足量时,装置Ⅰ中气球鼓起体积较小的是NaHCO3
C.加热装置Ⅱ,澄清石灰水变浑浊一侧的白色固体是NaHCO3
D.使用装置Ⅲ,在相同条件下分别配制Na2CO3和NaHCO3溶液并立刻测量溶液温度,也能鉴别这两种白色固体
4.化学物质丰富多彩,化学反应千变万化,而常见物质之间的反应往往“隐藏着某些反应机理”。学校化学兴趣小组对过氧化钠参与的某些反应进行了初步探究。该小组设计如图实验装置,验证“二氧化碳与水接触时才能和过氧化钠反应”。
步骤1:打开活塞K2,关闭K1,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
步骤2:打开活塞K1,关闭K2,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
请回答下列问题:
(1)装置①中反应的化学方程式是 。
(2)装置②中盛放的试剂是 ,该试剂的作用是 ;③中的试剂是 。
(3)本实验预期现象是 。
(4)有同学提出质疑,认为上述实验即使观察到木条复燃,也不能证明有水存在时,是过氧化钠与二氧化碳发生了化学反应,其理由是 。
(5)本小组还进一步探究了Na2O2与H2O的反应,实验如下:
下列有关说法不正确的是 (填字母)。
A.实验ⅰ中发生反应的化学方程式为2Na2O2+2H2O 4NaOH+O2↑
B.实验ⅲ中MnO2是H2O2分解反应的催化剂
C.本实验可以说明Na2O2与H2O反应过程中有H2O2生成
D.本实验可以说明使酚酞试液褪色的是O2
实验2 氯及其化合物的实验探究
5.84消毒液的主要成分是NaCl和NaClO。已知:酸性条件下,84消毒液中的NaCl和NaClO会反应生成氯气。实验小组同学围绕“84消毒液能否与医用酒精发生反应”这一问题进行了如下实验。
① 分别取40 mL 84消毒液和医用酒精混合均匀,并测量溶液温度变化 溶液温度由20 ℃升高至23 ℃,并产生大量气泡,略有刺激性气味,溶液颜色无明显变化
② 分别取40 mL医用酒精和蒸馏水混合均匀,水浴至23 ℃ 溶液中无明显现象
③ 分别取40 mL 84消毒液和蒸馏水混合均匀,水浴至23 ℃ 溶液中无明显现象,略有刺激性气味
④ 分别取40 mL 84消毒液、40 mL医用酒精和少量白醋,混合均匀 产生大量气泡,有强烈刺激性气味,溶液逐渐变为淡黄色
下列推理不合理的是 ( )
A.由①②可知,①中产生的大量气泡与酒精挥发无关
B.由①③可知,①中刺激性气味的产生可能与酒精无关
C.由①②③可推断,84消毒液与医用酒精混合后,溶液中发生了化学反应
D.由①④可推断,酸性条件有利于84消毒液与医用酒精发生反应
6.利用NaClO氧化尿素[CO(NH2)2]制备N2H4·H2O(水合肼)的实验流程如图所示:
已知:①Cl2与烧碱溶液的反应是放热反应;②N2H4·H2O有强还原性,能与NaClO剧烈反应生成N2。
下列说法不正确的是 ( )
A.步骤Ⅰ中为避免温度过高,可采用冰水浴
B.步骤Ⅰ制备NaClO溶液时,测得产物中NaClO与NaClO3的物质的量之比为5∶1,则参与反应的氧化剂与还原剂的物质的量之比为5∶3
C.步骤Ⅱ中可将尿素水溶液逐滴滴入NaClO碱性溶液中
D.生成水合肼反应的离子方程式为ClO-+CO(NH2)2+2OH- Cl-+N2H4·H2O+C
7.(经典题)化学是一门以实验为基础的学科,物质的检验鉴别、生产制备都可通过合适的实验方案实现。
(1)纯净干燥的氯气与熔融金属锡反应可制备SnCl4,实验装置如图所示。
已知:ⅰ.金属锡熔点为231 ℃,化学活泼性与铁相似;
ⅱ.SnCl4的沸点为114 ℃,且易与水反应。
回答下列问题:
①装置Ⅰ中反应的离子方程式为 ,装置Ⅳ中发生反应的化学方程式为 。
②装置Ⅱ中的试剂是 ;装置Ⅴ的作用是 。
③装置Ⅵ最好选用下列装置中的 (填标号)。
A B
C
④为了顺利完成实验,点燃酒精灯的正确操作是 (填字母)。
A.先点燃Ⅰ处酒精灯,后点燃Ⅳ处酒精灯
B.先点燃Ⅳ处酒精灯,后点燃Ⅰ处酒精灯
C.同时点燃Ⅰ、Ⅳ两处酒精灯
(2)某同学探究不同条件下Cl2与正二价锰化合物的反应,实验装置如图所示:
查阅资料显示:
a.Mn2+在一定条件下能被Cl2或ClO-氧化成MnO2(棕黑色)、Mn(绿色)、Mn(紫色)。
b.浓碱条件下,Mn。
c.Cl2的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。
序 号 物质X C中实验现象
通入Cl2前 通入Cl2后
Ⅰ 水 得到无色溶液 产生棕黑色沉淀,且放置后不发生变化
Ⅱ 5% NaOH 溶液 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀
Ⅲ 40% NaOH 溶液 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀
①通入Cl2前,Ⅱ、Ⅲ中白色沉淀Mn(OH)2变为棕黑色沉淀MnO2。
②对比实验Ⅰ、Ⅱ通入Cl2后的实验现象,对于Mn2+还原性与溶液酸碱性的认识是 。
③据资料b,Ⅲ中应得到绿色溶液,而实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将Mn。
ⅰ.用化学方程式表示可能导致溶液碱性减弱的原因: 。
ⅱ.取Ⅲ中放置后的1 mL悬浊液,加入4 mL 40% NaOH溶液,观察到溶液紫色迅速变为绿色,且有无色无味气体产生,该气体的化学式为 ;同时还可观察到溶液的绿色缓慢加深,即可证明Ⅲ的悬浊液中氧化剂过量。
答案与分层梯度式解析
1.D 2.C 3.B 5.D 6.C
1.D 装置分析:
加入液体后,部分液体存于安全漏斗上部弯管中起液封作用,避免氢气从漏斗中逸出,A正确;装置A中稀硫酸与粗锌反应生成氢气,用于后续与Na的反应,B正确;B是干燥氢气的装置,装置B中试剂为浓硫酸,C正确;先启动A中反应,利用生成的氢气将装置中的空气排出,防止钠与氧气反应,然后点燃C处酒精灯(易错点),D错误。
2.C 钠和HCl反应生成氯化钠和氢气,氯化钠在浓度较大的盐酸中溶解度降低,所以实验2中钠表面出现NaCl白色固体,A正确;钠和盐酸反应放热,实验2中液面上方出现白雾是因为反应放热,加速浓盐酸的挥发,B正确;实验2不如实验1剧烈的原因是钠表面包裹白色固体,使钠与盐酸接触面积减小,反应变慢,C不正确,D正确。
3.B Na2CO3和NaHCO3均能与盐酸反应生成CO2,盛放NaHCO3的气球鼓起更快,说明NaHCO3与盐酸反应速率更快,A正确;盐酸足量、固体质量相等时,n(Na2CO3)知识拓展 鉴别Na2CO3和NaHCO3的其他方法
①测定相同物质的量浓度溶液的pH,pH较大的是Na2CO3溶液;
②相同物质的量浓度的两溶液中分别逐滴加入稀盐酸,立即产生气体的是NaHCO3溶液。
4.答案 (1)CaCO3+2HCl CaCl2+CO2↑+H2O
(2)饱和NaHCO3溶液 吸收挥发出来的HCl
浓硫酸
(3)步骤1带火星木条不复燃,步骤2带火星木条复燃
(4)气体中有水,水也可与Na2O2反应产生O2,使木条复燃
(5)D
解析 结合实验目的,可对实验装置进行如下梳理:
(1)装置①中碳酸钙和盐酸反应的化学方程式为CaCO3+2HCl CaCl2+H2O+CO2↑。(2)生成的CO2中含挥发出来的HCl杂质,装置②中可用饱和NaHCO3溶液除去HCl。装置③中试剂为浓硫酸,则步骤1、2分别验证干燥和未干燥的CO2能否与Na2O2反应。(3)根据实验目的和实验装置,实验预期现象是步骤1带火星木条不复燃,步骤2带火星木条复燃。(4)气体中有水,水也可与Na2O2反应产生O2,使木条复燃,故题述实验即使观察到木条复燃,也不能证明有水存在时,是Na2O2与CO2发生化学反应。(5)实验ⅰ中Na2O2与水反应的化学方程式为2Na2O2+2H2O 4NaOH+O2↑,A正确;实验ⅲ中加入MnO2后迅速产生大量气泡,即有O2生成,MnO2是H2O2分解反应的催化剂,B正确;实验ⅲ加入MnO2后迅速产生大量O2,可说明Na2O2与H2O的反应过程中有H2O2生成,C正确;对比实验ⅱ和ⅳ可知使酚酞试液褪色的可能是H2O2,D错误。
5.D ①中84消毒液与医用酒精混合,溶液温度升高,产生大量气泡,而②中医用酒精和蒸馏水混合均匀,水浴至相同温度,却无明显现象,说明①中产生的气体不是乙醇蒸气,证明①中产生的大量气泡与酒精挥发无关,故A合理。①中84消毒液和医用酒精混合均匀,溶液温度升高,并产生大量气泡,略有刺激性气味,溶液颜色无明显变化;③中84消毒液和蒸馏水混合均匀并水浴至相同温度,也略有刺激性气味产生,说明①中刺激性气味的产生可能与酒精无关,故B合理。医用酒精和蒸馏水混合,水浴至23 ℃,溶液无明显现象;84消毒液和蒸馏水混合,水浴至23 ℃,溶液中无明显现象,略有刺激性气味;84消毒液和医用酒精混合,溶液温度升高至23 ℃,并产生大量气泡,略有刺激性气味,溶液颜色无明显变化,说明84消毒液与医用酒精混合后,溶液中发生了化学反应,产生了新的物质,故C合理。在酸性条件下,84消毒液中的NaCl、NaClO会反应产生Cl2,不能说明酸性条件有利于84消毒液与医用酒精发生反应,故D不合理。
6.C Cl2与烧碱溶液的反应是放热反应,为避免步骤Ⅰ中反应温度过高,可减缓Cl2的通入速率、采用冰水浴冷却等,A正确;根据步骤Ⅰ产物中n(NaClO)∶n(NaClO3)=5∶1,结合得失电子守恒可写出该反应的离子方程式为8Cl2+16OH- 5ClO-+Cl+10Cl-+8H2O,其中氧化剂与还原剂的物质的量之比为5∶3,B正确;N2H4·H2O有强还原性,将尿素水溶液逐滴滴入NaClO溶液中,会使过量的NaClO溶液氧化水合肼,故应将NaClO溶液逐滴加入到定量尿素溶液中制备水合肼,滴加顺序不能颠倒,且滴加速度不能过快,C错误;生成水合肼的离子方程式为ClO-+CO(NH2)2+2OH- Cl-+N2H4·H2O+C,D正确。
7.答案 (1)①MnO2+4H++2Cl- Mn2++Cl2↑+2H2O Sn+2Cl2 SnCl4 ②饱和食盐水 冷却和收集SnCl4 ③C ④A
(2)②Mn2+的还原性随溶液碱性的增强而增强
③ⅰ.Cl2+2NaOH NaCl+NaClO+H2O ⅱ.O2
解析 (1)①装置Ⅰ中MnO2和浓盐酸制备Cl2的离子方程式为MnO2+4H++2Cl- Mn2++Cl2↑+2H2O;装置Ⅳ中干燥的Cl2与熔融金属锡反应可制备SnCl4,化学方程式为Sn+2Cl2 SnCl4。②根据题图装置及题意可知Ⅱ、Ⅲ分别用于除杂和干燥Cl2,即Ⅱ、Ⅲ中试剂分别为饱和食盐水和浓硫酸。SnCl4的沸点为114 ℃,装置Ⅴ的作用是冷却和收集SnCl4。③因为SnCl4易与水反应,装置Ⅵ的作用是吸收未反应的Cl2,同时防止空气中的水蒸气进入装置Ⅴ,故最好连接一个装有碱石灰的U形管,可选C。④因为加热时锡会和空气中的O2反应,反应开始先用Cl2排出装置中的空气,故应先点燃Ⅰ处酒精灯,后点燃Ⅳ处酒精灯,A正确。(2)②对比实验Ⅰ、Ⅱ通入Cl2后的实验现象,可发现Mn2+的还原性随溶液碱性的增强而增强。③ⅰ.Cl2与NaOH反应产生NaCl、NaClO、H2O,使溶液碱性减弱,反应的化学方程式为Cl2+2NaOH NaCl+NaClO+H2O。ⅱ.取Ⅲ中放置后的1 mL悬浊液,加入4 mL 40% NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色是由于在浓碱条件下,Mn,根据得失电子守恒、电荷守恒及原子守恒,可知OH-被氧化为O2。
15
实验1 钠及其化合物的实验探究
1.NaH是有机合成中用途很广泛的物质。已知:NaH遇水蒸气剧烈反应。某小组设计如图实验装置制备NaH,下列说法错误的是 ( )
安全漏斗的作用是“液封”
B.装置A中的试剂是稀硫酸和粗锌
C.装置B中的试剂是浓硫酸
D.实验开始后先点燃C处酒精灯,再启动A中反应
2.某小组同学探究金属Na与不同浓度的盐酸反应,进行下列实验。下列说法不正确的是 ( )
实验装置 实验试剂 实验操作 实验现象
实验1: 0.36% HCl溶液 放入一小块金属钠 钠浮在液面上并来回移动,与水的反应剧烈程度相当
实验2: 36% HCl溶液 放入与实验1表面积基本相同的钠 钠浮在液面上并来回移动,不如实验1剧烈;表面出现白色固体,白色固体逐渐沉到烧杯底部;液体不沸腾,液面上方出现少量白雾
A.实验2中白色固体是NaCl
B.实验2中液面上方出现白雾是因为反应放热,加速浓盐酸的挥发
C.实验2不如实验1剧烈,说明盐酸浓度越大反应越不剧烈
D.实验2不如实验1剧烈的原因可能是钠表面包裹白色固体,使反应变慢
3.(经典题)为了鉴别Na2CO3和NaHCO3两种白色固体,设计了如下几种实验方案。下列说法不正确的是 ( )
ⅠⅡ Ⅲ
A.装置Ⅰ中的Na2CO3和NaHCO3均能与盐酸反应,产生气体速率快的是NaHCO3
B.当稀盐酸足量时,装置Ⅰ中气球鼓起体积较小的是NaHCO3
C.加热装置Ⅱ,澄清石灰水变浑浊一侧的白色固体是NaHCO3
D.使用装置Ⅲ,在相同条件下分别配制Na2CO3和NaHCO3溶液并立刻测量溶液温度,也能鉴别这两种白色固体
4.化学物质丰富多彩,化学反应千变万化,而常见物质之间的反应往往“隐藏着某些反应机理”。学校化学兴趣小组对过氧化钠参与的某些反应进行了初步探究。该小组设计如图实验装置,验证“二氧化碳与水接触时才能和过氧化钠反应”。
步骤1:打开活塞K2,关闭K1,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
步骤2:打开活塞K1,关闭K2,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
请回答下列问题:
(1)装置①中反应的化学方程式是 。
(2)装置②中盛放的试剂是 ,该试剂的作用是 ;③中的试剂是 。
(3)本实验预期现象是 。
(4)有同学提出质疑,认为上述实验即使观察到木条复燃,也不能证明有水存在时,是过氧化钠与二氧化碳发生了化学反应,其理由是 。
(5)本小组还进一步探究了Na2O2与H2O的反应,实验如下:
下列有关说法不正确的是 (填字母)。
A.实验ⅰ中发生反应的化学方程式为2Na2O2+2H2O 4NaOH+O2↑
B.实验ⅲ中MnO2是H2O2分解反应的催化剂
C.本实验可以说明Na2O2与H2O反应过程中有H2O2生成
D.本实验可以说明使酚酞试液褪色的是O2
实验2 氯及其化合物的实验探究
5.84消毒液的主要成分是NaCl和NaClO。已知:酸性条件下,84消毒液中的NaCl和NaClO会反应生成氯气。实验小组同学围绕“84消毒液能否与医用酒精发生反应”这一问题进行了如下实验。
① 分别取40 mL 84消毒液和医用酒精混合均匀,并测量溶液温度变化 溶液温度由20 ℃升高至23 ℃,并产生大量气泡,略有刺激性气味,溶液颜色无明显变化
② 分别取40 mL医用酒精和蒸馏水混合均匀,水浴至23 ℃ 溶液中无明显现象
③ 分别取40 mL 84消毒液和蒸馏水混合均匀,水浴至23 ℃ 溶液中无明显现象,略有刺激性气味
④ 分别取40 mL 84消毒液、40 mL医用酒精和少量白醋,混合均匀 产生大量气泡,有强烈刺激性气味,溶液逐渐变为淡黄色
下列推理不合理的是 ( )
A.由①②可知,①中产生的大量气泡与酒精挥发无关
B.由①③可知,①中刺激性气味的产生可能与酒精无关
C.由①②③可推断,84消毒液与医用酒精混合后,溶液中发生了化学反应
D.由①④可推断,酸性条件有利于84消毒液与医用酒精发生反应
6.利用NaClO氧化尿素[CO(NH2)2]制备N2H4·H2O(水合肼)的实验流程如图所示:
已知:①Cl2与烧碱溶液的反应是放热反应;②N2H4·H2O有强还原性,能与NaClO剧烈反应生成N2。
下列说法不正确的是 ( )
A.步骤Ⅰ中为避免温度过高,可采用冰水浴
B.步骤Ⅰ制备NaClO溶液时,测得产物中NaClO与NaClO3的物质的量之比为5∶1,则参与反应的氧化剂与还原剂的物质的量之比为5∶3
C.步骤Ⅱ中可将尿素水溶液逐滴滴入NaClO碱性溶液中
D.生成水合肼反应的离子方程式为ClO-+CO(NH2)2+2OH- Cl-+N2H4·H2O+C
7.(经典题)化学是一门以实验为基础的学科,物质的检验鉴别、生产制备都可通过合适的实验方案实现。
(1)纯净干燥的氯气与熔融金属锡反应可制备SnCl4,实验装置如图所示。
已知:ⅰ.金属锡熔点为231 ℃,化学活泼性与铁相似;
ⅱ.SnCl4的沸点为114 ℃,且易与水反应。
回答下列问题:
①装置Ⅰ中反应的离子方程式为 ,装置Ⅳ中发生反应的化学方程式为 。
②装置Ⅱ中的试剂是 ;装置Ⅴ的作用是 。
③装置Ⅵ最好选用下列装置中的 (填标号)。
A B
C
④为了顺利完成实验,点燃酒精灯的正确操作是 (填字母)。
A.先点燃Ⅰ处酒精灯,后点燃Ⅳ处酒精灯
B.先点燃Ⅳ处酒精灯,后点燃Ⅰ处酒精灯
C.同时点燃Ⅰ、Ⅳ两处酒精灯
(2)某同学探究不同条件下Cl2与正二价锰化合物的反应,实验装置如图所示:
查阅资料显示:
a.Mn2+在一定条件下能被Cl2或ClO-氧化成MnO2(棕黑色)、Mn(绿色)、Mn(紫色)。
b.浓碱条件下,Mn。
c.Cl2的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。
序 号 物质X C中实验现象
通入Cl2前 通入Cl2后
Ⅰ 水 得到无色溶液 产生棕黑色沉淀,且放置后不发生变化
Ⅱ 5% NaOH 溶液 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀
Ⅲ 40% NaOH 溶液 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀
①通入Cl2前,Ⅱ、Ⅲ中白色沉淀Mn(OH)2变为棕黑色沉淀MnO2。
②对比实验Ⅰ、Ⅱ通入Cl2后的实验现象,对于Mn2+还原性与溶液酸碱性的认识是 。
③据资料b,Ⅲ中应得到绿色溶液,而实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将Mn。
ⅰ.用化学方程式表示可能导致溶液碱性减弱的原因: 。
ⅱ.取Ⅲ中放置后的1 mL悬浊液,加入4 mL 40% NaOH溶液,观察到溶液紫色迅速变为绿色,且有无色无味气体产生,该气体的化学式为 ;同时还可观察到溶液的绿色缓慢加深,即可证明Ⅲ的悬浊液中氧化剂过量。
答案与分层梯度式解析
1.D 2.C 3.B 5.D 6.C
1.D 装置分析:
加入液体后,部分液体存于安全漏斗上部弯管中起液封作用,避免氢气从漏斗中逸出,A正确;装置A中稀硫酸与粗锌反应生成氢气,用于后续与Na的反应,B正确;B是干燥氢气的装置,装置B中试剂为浓硫酸,C正确;先启动A中反应,利用生成的氢气将装置中的空气排出,防止钠与氧气反应,然后点燃C处酒精灯(易错点),D错误。
2.C 钠和HCl反应生成氯化钠和氢气,氯化钠在浓度较大的盐酸中溶解度降低,所以实验2中钠表面出现NaCl白色固体,A正确;钠和盐酸反应放热,实验2中液面上方出现白雾是因为反应放热,加速浓盐酸的挥发,B正确;实验2不如实验1剧烈的原因是钠表面包裹白色固体,使钠与盐酸接触面积减小,反应变慢,C不正确,D正确。
3.B Na2CO3和NaHCO3均能与盐酸反应生成CO2,盛放NaHCO3的气球鼓起更快,说明NaHCO3与盐酸反应速率更快,A正确;盐酸足量、固体质量相等时,n(Na2CO3)
①测定相同物质的量浓度溶液的pH,pH较大的是Na2CO3溶液;
②相同物质的量浓度的两溶液中分别逐滴加入稀盐酸,立即产生气体的是NaHCO3溶液。
4.答案 (1)CaCO3+2HCl CaCl2+CO2↑+H2O
(2)饱和NaHCO3溶液 吸收挥发出来的HCl
浓硫酸
(3)步骤1带火星木条不复燃,步骤2带火星木条复燃
(4)气体中有水,水也可与Na2O2反应产生O2,使木条复燃
(5)D
解析 结合实验目的,可对实验装置进行如下梳理:
(1)装置①中碳酸钙和盐酸反应的化学方程式为CaCO3+2HCl CaCl2+H2O+CO2↑。(2)生成的CO2中含挥发出来的HCl杂质,装置②中可用饱和NaHCO3溶液除去HCl。装置③中试剂为浓硫酸,则步骤1、2分别验证干燥和未干燥的CO2能否与Na2O2反应。(3)根据实验目的和实验装置,实验预期现象是步骤1带火星木条不复燃,步骤2带火星木条复燃。(4)气体中有水,水也可与Na2O2反应产生O2,使木条复燃,故题述实验即使观察到木条复燃,也不能证明有水存在时,是Na2O2与CO2发生化学反应。(5)实验ⅰ中Na2O2与水反应的化学方程式为2Na2O2+2H2O 4NaOH+O2↑,A正确;实验ⅲ中加入MnO2后迅速产生大量气泡,即有O2生成,MnO2是H2O2分解反应的催化剂,B正确;实验ⅲ加入MnO2后迅速产生大量O2,可说明Na2O2与H2O的反应过程中有H2O2生成,C正确;对比实验ⅱ和ⅳ可知使酚酞试液褪色的可能是H2O2,D错误。
5.D ①中84消毒液与医用酒精混合,溶液温度升高,产生大量气泡,而②中医用酒精和蒸馏水混合均匀,水浴至相同温度,却无明显现象,说明①中产生的气体不是乙醇蒸气,证明①中产生的大量气泡与酒精挥发无关,故A合理。①中84消毒液和医用酒精混合均匀,溶液温度升高,并产生大量气泡,略有刺激性气味,溶液颜色无明显变化;③中84消毒液和蒸馏水混合均匀并水浴至相同温度,也略有刺激性气味产生,说明①中刺激性气味的产生可能与酒精无关,故B合理。医用酒精和蒸馏水混合,水浴至23 ℃,溶液无明显现象;84消毒液和蒸馏水混合,水浴至23 ℃,溶液中无明显现象,略有刺激性气味;84消毒液和医用酒精混合,溶液温度升高至23 ℃,并产生大量气泡,略有刺激性气味,溶液颜色无明显变化,说明84消毒液与医用酒精混合后,溶液中发生了化学反应,产生了新的物质,故C合理。在酸性条件下,84消毒液中的NaCl、NaClO会反应产生Cl2,不能说明酸性条件有利于84消毒液与医用酒精发生反应,故D不合理。
6.C Cl2与烧碱溶液的反应是放热反应,为避免步骤Ⅰ中反应温度过高,可减缓Cl2的通入速率、采用冰水浴冷却等,A正确;根据步骤Ⅰ产物中n(NaClO)∶n(NaClO3)=5∶1,结合得失电子守恒可写出该反应的离子方程式为8Cl2+16OH- 5ClO-+Cl+10Cl-+8H2O,其中氧化剂与还原剂的物质的量之比为5∶3,B正确;N2H4·H2O有强还原性,将尿素水溶液逐滴滴入NaClO溶液中,会使过量的NaClO溶液氧化水合肼,故应将NaClO溶液逐滴加入到定量尿素溶液中制备水合肼,滴加顺序不能颠倒,且滴加速度不能过快,C错误;生成水合肼的离子方程式为ClO-+CO(NH2)2+2OH- Cl-+N2H4·H2O+C,D正确。
7.答案 (1)①MnO2+4H++2Cl- Mn2++Cl2↑+2H2O Sn+2Cl2 SnCl4 ②饱和食盐水 冷却和收集SnCl4 ③C ④A
(2)②Mn2+的还原性随溶液碱性的增强而增强
③ⅰ.Cl2+2NaOH NaCl+NaClO+H2O ⅱ.O2
解析 (1)①装置Ⅰ中MnO2和浓盐酸制备Cl2的离子方程式为MnO2+4H++2Cl- Mn2++Cl2↑+2H2O;装置Ⅳ中干燥的Cl2与熔融金属锡反应可制备SnCl4,化学方程式为Sn+2Cl2 SnCl4。②根据题图装置及题意可知Ⅱ、Ⅲ分别用于除杂和干燥Cl2,即Ⅱ、Ⅲ中试剂分别为饱和食盐水和浓硫酸。SnCl4的沸点为114 ℃,装置Ⅴ的作用是冷却和收集SnCl4。③因为SnCl4易与水反应,装置Ⅵ的作用是吸收未反应的Cl2,同时防止空气中的水蒸气进入装置Ⅴ,故最好连接一个装有碱石灰的U形管,可选C。④因为加热时锡会和空气中的O2反应,反应开始先用Cl2排出装置中的空气,故应先点燃Ⅰ处酒精灯,后点燃Ⅳ处酒精灯,A正确。(2)②对比实验Ⅰ、Ⅱ通入Cl2后的实验现象,可发现Mn2+的还原性随溶液碱性的增强而增强。③ⅰ.Cl2与NaOH反应产生NaCl、NaClO、H2O,使溶液碱性减弱,反应的化学方程式为Cl2+2NaOH NaCl+NaClO+H2O。ⅱ.取Ⅲ中放置后的1 mL悬浊液,加入4 mL 40% NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色是由于在浓碱条件下,Mn,根据得失电子守恒、电荷守恒及原子守恒,可知OH-被氧化为O2。
15
