第四章 物质结构 元素周期律题型整合练 结合元素周期表、元素周期律的推断及实验探究-《精讲精练》26版高中同步新教材化学人教A版(2019)必修第一册
文档属性
| 名称 | 第四章 物质结构 元素周期律题型整合练 结合元素周期表、元素周期律的推断及实验探究-《精讲精练》26版高中同步新教材化学人教A版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 85.5KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-09 11:00:49 | ||
图片预览




文档简介
题型整合练 结合元素周期表、元素周期律的推断及实验探究
题型1 元素周期表中的“位、构、性”关系
1.短周期主族元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的3倍。下列说法不正确的是 ( )
A.原子半径:Z>W>X>Y
B.简单氢化物的稳定性:X>Y>W>Z
C.最高价氧化物对应水化物的酸性:X>W>Z
D.非金属性:Z2.短周期主族元素X、Y、Z、W的原子序数依次增大。X的气态氢化物能使湿润的红色石蕊试纸变蓝,Z是地壳中含量第二的元素,最外层电子数Y+Z=10,Y和W在元素周期表中相邻。下列说法正确的是 ( )
A.ZY2易溶于水
B.简单离子半径:XC.最高价氧化物对应的水化物的酸性:XD.Y2和Y3互称为同素异形体
3.(经典题)几种短周期元素的原子半径及主要化合价如表,下列说法正确的是 ( )
元素代号 X Y Z N M R Q
原子半径/nm 0.037 0.186 0.143 0.082 0.099 0.075 0.074
最高正价 +1 +1 +3 +3 +7 +5
最低负价 -1 -1 -3 -2
A.离子半径:Y>Z>M
B.简单氢化物稳定性:R>Q
C.Y和Q形成的两种化合物中,阴、阳离子个数比不同
D.Y、Z、M三种元素的最高价氧化物对应的水化物两两之间能反应
4.如图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图。下列说法正确的是( )
A.X与W形成的化合物中只有离子键
B.元素的非金属性:X>R>W
C.简单离子的半径:W>R>X
D.单质Y与水反应生成一种酸和一种单质
5.某学者绘制了一种八角星元素周期表,每个八角星代表一个周期(第一周期除外),每个“·”代表一种元素,“”相连代表同族元素。X、Y、Z、R、M为原子半径依次减小的五种短周期主族元素,Y的最外层电子数比最内层电子数多一个,且Y为第三周期元素,下列说法正确的是 ( )
A.原子序数:X>Y>Z
B.Z与M形成的化合物,各原子均满足8电子稳定结构
C.在同一周期中,X最高价氧化物对应的水化物碱性最强
D.X、R形成的两种常见化合物中均只含有离子键
6.已知A、B、C、D为原子序数依次增大的短周期主族元素,E为地壳中含量最高的过渡元素,A与D同主族,只有B、C位于同周期,且C与D的原子序数之和为20;甲、乙分别为元素E、A的单质,丙、丁为A、E分别与B形成的化合物,它们转化关系如图所示(反应条件略)。下列说法不正确的是( )
A.由A、B组成的一种化合物具有强氧化性
B.C的单质能与丙反应置换出B的单质
C.B和D所形成的化合物中阴、阳离子数之比为1∶2
D.丁是一种红棕色固体粉末,俗称铁红
题型2 验证同周期、同主族元素性质的递变规律
7.某同学为了验证元素周期律相关的结论,自己设计了一套实验方案,并记录了有关实验现象。
实验方案 实验现象
①将氯气通入Na2S溶液中 有淡黄色固体(S)生成
②将一小块金属镁,用砂纸磨去表面的氧化膜后,放入试管中,加入2 mL水,观察现象,记录为现象Ⅰ,过一会儿,加热试管至液体沸腾,观察现象,记录为现象Ⅱ 现象Ⅰ:无明显变化 现象Ⅱ:金属镁逐渐溶解,有气体生成
③将溴水滴入NaI溶液中,充分反应后加入淀粉溶液 溶液变蓝
④将一小块金属钠放入冷水中 钠浮在水面上,熔成小球,四处游动,逐渐消失
回答下列问题:
(1)实验①相关反应的离子方程式为 。由实验①可知,Cl、S的非金属性由强到弱的顺序为 。由实验③可知,Br、I的非金属性由强到弱的顺序为 。
(2)由实验②和实验④知,碱性:NaOH (填“>”或“<”)Mg(OH)2。
(3)实验结论:同主族元素自上而下,元素的非金属性逐渐 (填“增强”或“减弱”,下同);同周期主族元素从左到右,原子序数逐渐增大,金属性逐渐 ,非金属性逐渐 。
(4)H2SiO3、H3PO4、H2SO4、HClO4的酸性由强到弱的顺序为 。
(5)常见氢化物NH3、H2O、HF、H2S中稳定性最强的是 。
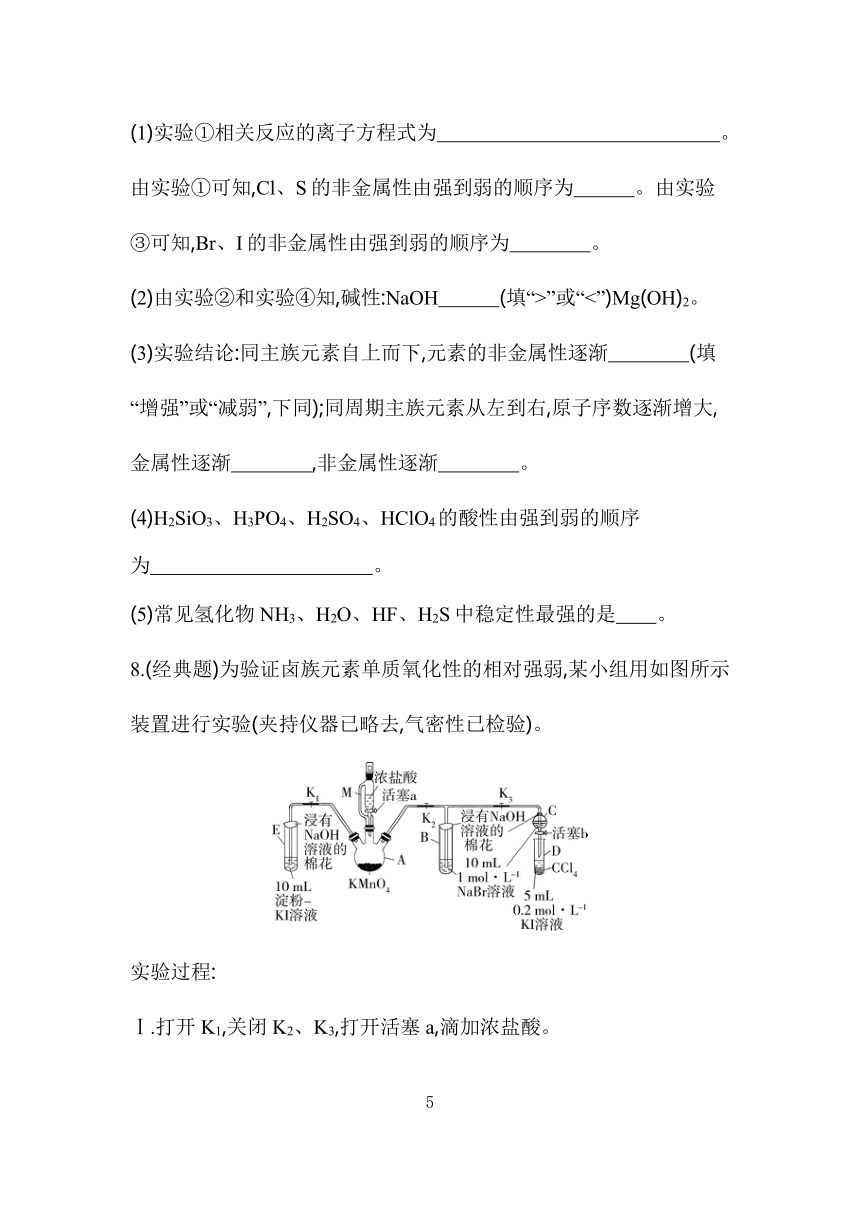
8.(经典题)为验证卤族元素单质氧化性的相对强弱,某小组用如图所示装置进行实验(夹持仪器已略去,气密性已检验)。
实验过程:
Ⅰ.打开K1,关闭K2、K3,打开活塞a,滴加浓盐酸。
Ⅱ.关闭K1,打开K2、K3,当B和C中的溶液都变为黄色时,关闭K3。
Ⅲ.B中继续通气体,当B中溶液由黄色变为红棕色时,关闭活塞a。
Ⅳ.……
回答下列问题:
(1)M的作用: 。
(2)能说明氯气的氧化性强于碘的实验现象是 。
(3)用离子方程式解释过程Ⅱ中溶液变为黄色的原因: 。
(4)过程Ⅳ的目的是验证溴的氧化性强于碘,简述其操作过程: 。
(5)过程Ⅲ的实验目的是 。
(6)请用原子结构的知识解释氯、溴、碘单质的氧化性逐渐减弱的原因: 。
答案与分层梯度式解析
1.B 2.D 3.D 4.D 5.C 6.D
1.B 根据元素在周期表中的位置可知W为第三周期元素,设W的最外层电子数为x,依据题意有2+8+x=3x,解得x=5,即W为P元素;则X、Y、Z分别为N、O、Si元素。同周期主族元素,从左到右,原子半径逐渐减小,同主族元素,由上到下,原子半径逐渐增大,则原子半径:Z>W>X>Y,A正确;根据非金属性:Y>X>W>Z,可知简单氢化物的稳定性:Y>X>W>Z,B错误、D正确;由非金属性可确定最高价氧化物对应水化物酸性:X>W>Z,C正确。
2.D 根据X气态氢化物的性质可知X为N元素;Z是地壳中含量第二的元素,Z为Si元素;由最外层电子数Y+Z=10可知,Y最外层电子数为6,Y原子序数小于Z,则Y为O元素;由Y和W在周期表中相邻可知,W为S元素。ZY2为SiO2,SiO2不溶于水,A错误;N3-、O2-和S2-半径由小到大的顺序为O2-Si,则最高价氧化物对应水化物的酸性X>Z,C错误;O2和O3均为氧元素形成的单质,互称为同素异形体,D正确。
3.D 所给元素均为短周期元素,由题表可知,Q最低负价为-2价,没有最高正价,则Q为O;M的最高正价为+7价,最低负价为-1价,则M为Cl;R有+5、-3价,处于ⅤA族,原子半径小于Cl,与O的原子半径相近,则R为N;Z、N的最高正价为+3价,没有负化合价,处于ⅢA族,且原子半径Z>N,则Z为Al、N为B;X、Y的最高正价均为+1价,处于ⅠA族,而X有-1价,则X为H,结合Y的原子半径知Y为Na。一般,核外电子层数越多,离子半径越大,电子层结构相同的离子,核电荷数越大离子半径越小,则离子半径:Cl->Na+>Al3+,A错误;非金属性:O>N,非金属性越强,简单氢化物的稳定性越强,则稳定性:H2O>NH3,B错误;Y是Na,Q是O,两种元素形成的常见化合物有Na2O、Na2O2,Na2O、Na2O2中阳离子与阴离子的个数比均是2∶1,C错误;Y是Na,Z是Al,M是Cl,三种元素的最高价氧化物对应的水化物化学式分别是NaOH、Al(OH)3、HClO4,Al(OH)3是两性氢氧化物,HClO4是强酸,NaOH是强碱,三种物质两两之间能发生反应,D正确。
4.D 由题图可推出,X为O,Y为F,W为Cl,R为S,Z为Na。Cl和O形成的氯的氧化物中只含有共价键,A错误;非金属性:O>Cl>S,B错误;简单离子的半径:S2->Cl->O2-,C错误;F2氧化性很强,能和H2O反应生成HF和O2,D正确。
5.C 根据Y的最外层电子数比最内层电子数多一个,且Y为第三周期元素可知,Y为Al;M位于第一周期,M为H;根据八角星的结构,可知X为Na,Z为Cl,R为O。原子序数:Z(Cl)>Y(Al)>X(Na),A错误;Cl与H形成的化合物为HCl,其中H原子没有达到8电子稳定结构,B错误;Na为第三周期元素,在第三周期中,Na的最高价氧化物对应的水化物碱性最强,C正确;Na2O2中含非极性共价键,D错误。
6.D 已知A、B、C、D为原子序数依次增大的短周期主族元素,A与D同主族,只有B、C位于同周期,可知A、B、C、D分属三个不同的短周期,则A为H,D为Na,由C与D的原子序数之和为20,可知C为F;E为地壳中含量最高的过渡元素,则E为Fe;甲、乙分别为元素E、A的单质,丙、丁为A、E分别与B形成的化合物,结合图示转化关系,Fe与丙反应生成丁和H2,可推知丙为H2O,丁为Fe3O4,则B为O。H、O两元素组成的H2O2有强氧化性,A正确;F2与水反应生成HF和O2,B正确;O和Na组成的Na2O、Na2O2中阴、阳离子数之比均为1∶2,C正确;丁为Fe3O4,是黑色固体,D错误。
7.答案 (1)S2-+Cl2 2Cl-+S↓ Cl>S Br>I (2)> (3)减弱 减弱 增强 (4)HClO4>H2SO4>H3PO4>H2SiO3 (5)HF
解析 (1)将Cl2通入Na2S溶液中,Cl2将S2-氧化为S单质,其离子方程式为S2-+Cl2 2Cl-+S↓,由此可判断氧化性Cl2>S,则元素的非金属性Cl>S。实验③将溴水滴入NaI溶液中,充分反应后加入淀粉溶液,溶液变蓝,说明溴将I-氧化成I2,故非金属性Br>I。(2)实验②现象表明Mg与冷水不反应,与热水反应,实验④Na与冷水剧烈反应,可判断金属性MgMg(OH)2。(3)结合题中实验分析可知,同主族元素自上而下,元素的非金属性逐渐减弱;同周期主族元素随原子序数逐渐增大,金属性逐渐减弱,非金属性逐渐增强。(4)根据非金属性SiH2SO4>H3PO4>H2SiO3。(5)由非金属性F>O>N>S可知,简单气态氢化物中HF的稳定性最强。
8.答案 (1)平衡气压,有利于浓盐酸顺利滴下
(2)淀粉-KI溶液变成蓝色
(3)Cl2+2Br- Br2+2Cl-
(4)打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D振荡、静置
(5)确认C中黄色溶液中无Cl2,排除Cl2对Br2置换I2实验的干扰
(6)同主族元素从上到下,电子层数逐渐增多,原子半径逐渐增大,得电子能力逐渐减弱
解析 实验过程Ⅰ,打开K1,关闭K2、K3,打开活塞a,滴加浓盐酸,在A中浓盐酸与KMnO4反应生成Cl2,Cl2进入E中与KI反应,验证Cl2的氧化性强于I2;实验过程Ⅱ,关闭K1,打开K2、K3,氯气进入B和C中,与NaBr反应,当B和C中的溶液都变为黄色时,证明B、C中的NaBr溶液中均有少量氯气进入,关闭K3;实验过程Ⅲ,继续向B中通入Cl2,当B中溶液由黄色变为红棕色时,关闭活塞a,停止产生氯气;实验过程Ⅳ,打开活塞b,使C中反应生成的溴进入D中,验证Br2的氧化性强于I2。
(1)M的作用是平衡气压,使浓盐酸能顺利滴下。
(2)E中产生I2就说明Cl2的氧化性比I2强,当E中溶液变蓝时,即说明有碘单质生成,故淀粉-KI溶液变成蓝色,能说明氯气的氧化性强于碘。
(3)在实验过程Ⅱ中,B、C中溶液均变为黄色,说明通入Cl2后,有Br2生成,反应的离子方程式为Cl2+2Br- Br2+2Cl-。
(4)要验证Br2的氧化性强于I2,需要将Br2滴入KI溶液中,C中黄色溶液中存在Br2,而且通入Cl2很少,已被完全反应,没有Cl2的干扰,所以操作为打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D振荡、静置。
(5)继续向B中通氯气,B中溶液颜色变成红棕色,与C中黄色溶液做对比,可证明C中黄色溶液中无Cl2,故过程Ⅲ的实验目的是确认C中黄色溶液中无Cl2,排除Cl2对Br2置换I2实验的干扰。
(6)同主族元素从上到下,电子层数逐渐增多,原子半径逐渐增大,得电子能力逐渐减弱,单质的氧化性逐渐减弱。
6
题型1 元素周期表中的“位、构、性”关系
1.短周期主族元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的3倍。下列说法不正确的是 ( )
A.原子半径:Z>W>X>Y
B.简单氢化物的稳定性:X>Y>W>Z
C.最高价氧化物对应水化物的酸性:X>W>Z
D.非金属性:Z
A.ZY2易溶于水
B.简单离子半径:X
3.(经典题)几种短周期元素的原子半径及主要化合价如表,下列说法正确的是 ( )
元素代号 X Y Z N M R Q
原子半径/nm 0.037 0.186 0.143 0.082 0.099 0.075 0.074
最高正价 +1 +1 +3 +3 +7 +5
最低负价 -1 -1 -3 -2
A.离子半径:Y>Z>M
B.简单氢化物稳定性:R>Q
C.Y和Q形成的两种化合物中,阴、阳离子个数比不同
D.Y、Z、M三种元素的最高价氧化物对应的水化物两两之间能反应
4.如图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图。下列说法正确的是( )
A.X与W形成的化合物中只有离子键
B.元素的非金属性:X>R>W
C.简单离子的半径:W>R>X
D.单质Y与水反应生成一种酸和一种单质
5.某学者绘制了一种八角星元素周期表,每个八角星代表一个周期(第一周期除外),每个“·”代表一种元素,“”相连代表同族元素。X、Y、Z、R、M为原子半径依次减小的五种短周期主族元素,Y的最外层电子数比最内层电子数多一个,且Y为第三周期元素,下列说法正确的是 ( )
A.原子序数:X>Y>Z
B.Z与M形成的化合物,各原子均满足8电子稳定结构
C.在同一周期中,X最高价氧化物对应的水化物碱性最强
D.X、R形成的两种常见化合物中均只含有离子键
6.已知A、B、C、D为原子序数依次增大的短周期主族元素,E为地壳中含量最高的过渡元素,A与D同主族,只有B、C位于同周期,且C与D的原子序数之和为20;甲、乙分别为元素E、A的单质,丙、丁为A、E分别与B形成的化合物,它们转化关系如图所示(反应条件略)。下列说法不正确的是( )
A.由A、B组成的一种化合物具有强氧化性
B.C的单质能与丙反应置换出B的单质
C.B和D所形成的化合物中阴、阳离子数之比为1∶2
D.丁是一种红棕色固体粉末,俗称铁红
题型2 验证同周期、同主族元素性质的递变规律
7.某同学为了验证元素周期律相关的结论,自己设计了一套实验方案,并记录了有关实验现象。
实验方案 实验现象
①将氯气通入Na2S溶液中 有淡黄色固体(S)生成
②将一小块金属镁,用砂纸磨去表面的氧化膜后,放入试管中,加入2 mL水,观察现象,记录为现象Ⅰ,过一会儿,加热试管至液体沸腾,观察现象,记录为现象Ⅱ 现象Ⅰ:无明显变化 现象Ⅱ:金属镁逐渐溶解,有气体生成
③将溴水滴入NaI溶液中,充分反应后加入淀粉溶液 溶液变蓝
④将一小块金属钠放入冷水中 钠浮在水面上,熔成小球,四处游动,逐渐消失
回答下列问题:
(1)实验①相关反应的离子方程式为 。由实验①可知,Cl、S的非金属性由强到弱的顺序为 。由实验③可知,Br、I的非金属性由强到弱的顺序为 。
(2)由实验②和实验④知,碱性:NaOH (填“>”或“<”)Mg(OH)2。
(3)实验结论:同主族元素自上而下,元素的非金属性逐渐 (填“增强”或“减弱”,下同);同周期主族元素从左到右,原子序数逐渐增大,金属性逐渐 ,非金属性逐渐 。
(4)H2SiO3、H3PO4、H2SO4、HClO4的酸性由强到弱的顺序为 。
(5)常见氢化物NH3、H2O、HF、H2S中稳定性最强的是 。
8.(经典题)为验证卤族元素单质氧化性的相对强弱,某小组用如图所示装置进行实验(夹持仪器已略去,气密性已检验)。
实验过程:
Ⅰ.打开K1,关闭K2、K3,打开活塞a,滴加浓盐酸。
Ⅱ.关闭K1,打开K2、K3,当B和C中的溶液都变为黄色时,关闭K3。
Ⅲ.B中继续通气体,当B中溶液由黄色变为红棕色时,关闭活塞a。
Ⅳ.……
回答下列问题:
(1)M的作用: 。
(2)能说明氯气的氧化性强于碘的实验现象是 。
(3)用离子方程式解释过程Ⅱ中溶液变为黄色的原因: 。
(4)过程Ⅳ的目的是验证溴的氧化性强于碘,简述其操作过程: 。
(5)过程Ⅲ的实验目的是 。
(6)请用原子结构的知识解释氯、溴、碘单质的氧化性逐渐减弱的原因: 。
答案与分层梯度式解析
1.B 2.D 3.D 4.D 5.C 6.D
1.B 根据元素在周期表中的位置可知W为第三周期元素,设W的最外层电子数为x,依据题意有2+8+x=3x,解得x=5,即W为P元素;则X、Y、Z分别为N、O、Si元素。同周期主族元素,从左到右,原子半径逐渐减小,同主族元素,由上到下,原子半径逐渐增大,则原子半径:Z>W>X>Y,A正确;根据非金属性:Y>X>W>Z,可知简单氢化物的稳定性:Y>X>W>Z,B错误、D正确;由非金属性可确定最高价氧化物对应水化物酸性:X>W>Z,C正确。
2.D 根据X气态氢化物的性质可知X为N元素;Z是地壳中含量第二的元素,Z为Si元素;由最外层电子数Y+Z=10可知,Y最外层电子数为6,Y原子序数小于Z,则Y为O元素;由Y和W在周期表中相邻可知,W为S元素。ZY2为SiO2,SiO2不溶于水,A错误;N3-、O2-和S2-半径由小到大的顺序为O2-
3.D 所给元素均为短周期元素,由题表可知,Q最低负价为-2价,没有最高正价,则Q为O;M的最高正价为+7价,最低负价为-1价,则M为Cl;R有+5、-3价,处于ⅤA族,原子半径小于Cl,与O的原子半径相近,则R为N;Z、N的最高正价为+3价,没有负化合价,处于ⅢA族,且原子半径Z>N,则Z为Al、N为B;X、Y的最高正价均为+1价,处于ⅠA族,而X有-1价,则X为H,结合Y的原子半径知Y为Na。一般,核外电子层数越多,离子半径越大,电子层结构相同的离子,核电荷数越大离子半径越小,则离子半径:Cl->Na+>Al3+,A错误;非金属性:O>N,非金属性越强,简单氢化物的稳定性越强,则稳定性:H2O>NH3,B错误;Y是Na,Q是O,两种元素形成的常见化合物有Na2O、Na2O2,Na2O、Na2O2中阳离子与阴离子的个数比均是2∶1,C错误;Y是Na,Z是Al,M是Cl,三种元素的最高价氧化物对应的水化物化学式分别是NaOH、Al(OH)3、HClO4,Al(OH)3是两性氢氧化物,HClO4是强酸,NaOH是强碱,三种物质两两之间能发生反应,D正确。
4.D 由题图可推出,X为O,Y为F,W为Cl,R为S,Z为Na。Cl和O形成的氯的氧化物中只含有共价键,A错误;非金属性:O>Cl>S,B错误;简单离子的半径:S2->Cl->O2-,C错误;F2氧化性很强,能和H2O反应生成HF和O2,D正确。
5.C 根据Y的最外层电子数比最内层电子数多一个,且Y为第三周期元素可知,Y为Al;M位于第一周期,M为H;根据八角星的结构,可知X为Na,Z为Cl,R为O。原子序数:Z(Cl)>Y(Al)>X(Na),A错误;Cl与H形成的化合物为HCl,其中H原子没有达到8电子稳定结构,B错误;Na为第三周期元素,在第三周期中,Na的最高价氧化物对应的水化物碱性最强,C正确;Na2O2中含非极性共价键,D错误。
6.D 已知A、B、C、D为原子序数依次增大的短周期主族元素,A与D同主族,只有B、C位于同周期,可知A、B、C、D分属三个不同的短周期,则A为H,D为Na,由C与D的原子序数之和为20,可知C为F;E为地壳中含量最高的过渡元素,则E为Fe;甲、乙分别为元素E、A的单质,丙、丁为A、E分别与B形成的化合物,结合图示转化关系,Fe与丙反应生成丁和H2,可推知丙为H2O,丁为Fe3O4,则B为O。H、O两元素组成的H2O2有强氧化性,A正确;F2与水反应生成HF和O2,B正确;O和Na组成的Na2O、Na2O2中阴、阳离子数之比均为1∶2,C正确;丁为Fe3O4,是黑色固体,D错误。
7.答案 (1)S2-+Cl2 2Cl-+S↓ Cl>S Br>I (2)> (3)减弱 减弱 增强 (4)HClO4>H2SO4>H3PO4>H2SiO3 (5)HF
解析 (1)将Cl2通入Na2S溶液中,Cl2将S2-氧化为S单质,其离子方程式为S2-+Cl2 2Cl-+S↓,由此可判断氧化性Cl2>S,则元素的非金属性Cl>S。实验③将溴水滴入NaI溶液中,充分反应后加入淀粉溶液,溶液变蓝,说明溴将I-氧化成I2,故非金属性Br>I。(2)实验②现象表明Mg与冷水不反应,与热水反应,实验④Na与冷水剧烈反应,可判断金属性Mg
8.答案 (1)平衡气压,有利于浓盐酸顺利滴下
(2)淀粉-KI溶液变成蓝色
(3)Cl2+2Br- Br2+2Cl-
(4)打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D振荡、静置
(5)确认C中黄色溶液中无Cl2,排除Cl2对Br2置换I2实验的干扰
(6)同主族元素从上到下,电子层数逐渐增多,原子半径逐渐增大,得电子能力逐渐减弱
解析 实验过程Ⅰ,打开K1,关闭K2、K3,打开活塞a,滴加浓盐酸,在A中浓盐酸与KMnO4反应生成Cl2,Cl2进入E中与KI反应,验证Cl2的氧化性强于I2;实验过程Ⅱ,关闭K1,打开K2、K3,氯气进入B和C中,与NaBr反应,当B和C中的溶液都变为黄色时,证明B、C中的NaBr溶液中均有少量氯气进入,关闭K3;实验过程Ⅲ,继续向B中通入Cl2,当B中溶液由黄色变为红棕色时,关闭活塞a,停止产生氯气;实验过程Ⅳ,打开活塞b,使C中反应生成的溴进入D中,验证Br2的氧化性强于I2。
(1)M的作用是平衡气压,使浓盐酸能顺利滴下。
(2)E中产生I2就说明Cl2的氧化性比I2强,当E中溶液变蓝时,即说明有碘单质生成,故淀粉-KI溶液变成蓝色,能说明氯气的氧化性强于碘。
(3)在实验过程Ⅱ中,B、C中溶液均变为黄色,说明通入Cl2后,有Br2生成,反应的离子方程式为Cl2+2Br- Br2+2Cl-。
(4)要验证Br2的氧化性强于I2,需要将Br2滴入KI溶液中,C中黄色溶液中存在Br2,而且通入Cl2很少,已被完全反应,没有Cl2的干扰,所以操作为打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D振荡、静置。
(5)继续向B中通氯气,B中溶液颜色变成红棕色,与C中黄色溶液做对比,可证明C中黄色溶液中无Cl2,故过程Ⅲ的实验目的是确认C中黄色溶液中无Cl2,排除Cl2对Br2置换I2实验的干扰。
(6)同主族元素从上到下,电子层数逐渐增多,原子半径逐渐增大,得电子能力逐渐减弱,单质的氧化性逐渐减弱。
6
