利用化学方程式的简单计算
图片预览











文档简介
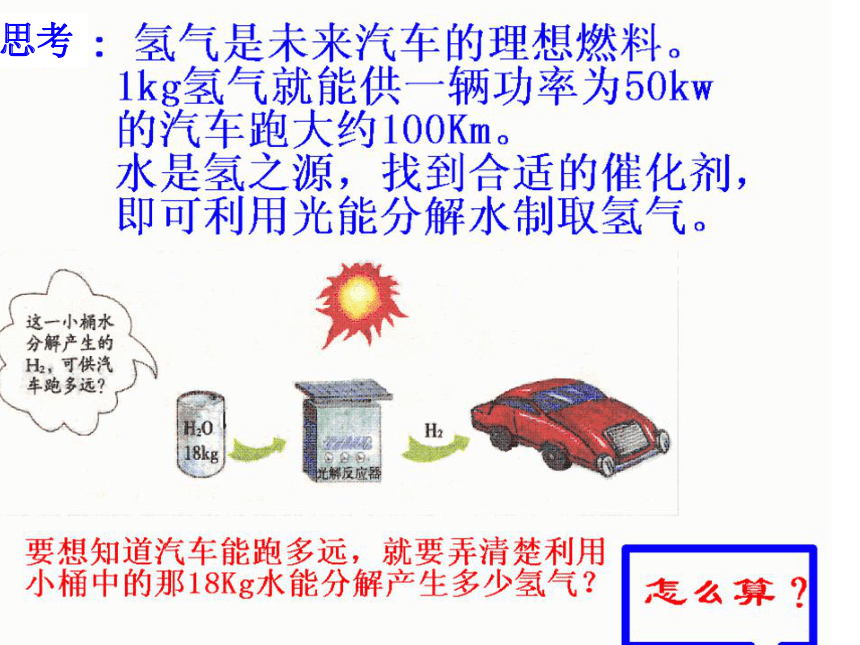
课件37张PPT。请你思考=一种思路:可根据化学式的计算求解理由:水中的氢元素全部转化为氢气解:18kg水中氢元素的质量==2kg×18kg产生氢气的质量为2kg。若某种元素没有全部转化到某种物质(生成物)中去,求该物质的质量该怎么办?如用6g KMnO4制O2,可得到多少克O2?可见根据化学式计算有它的局限性思路二:利用化学方程式来计算第五章 化学方程式课题三 利用化学方程式的简单计算复习提问
以镁在空气中燃烧为例说明化学方程式的涵义之一。镁在空气中燃烧反应中反应物与生成物之间的质量比 2×24 :16×2 : (24+16)×2 48 : 32 : 80若: 48克 :( )克 : ( ) 克若:( )克 :( )克 : 4 0 克说明:在化学反应中,反应物与生成物之间的质量比是成正比例关系。因此,利用正比例关系根据化学方程式和已知的一种反应物(或生成物)的质量,可求生成物(或反应物)的质量。[例题]:3克镁在氧气中充分燃烧,可以生成多少克氧化镁?解:设可生成氧化镁的质量为X(1)设未知数 ….... …….….设2 Mg + O 2 ====== 2 Mg O点燃48 80
3克 X (2)写出化学方程式…...…..写48
------ = ------803克X(4) 写比例式,求解.….……..比X = ------------ 80×3克48= 5 克答:3克镁在氧气中充分燃烧可生成氧化镁 5 克。 ….. …... …………………………….解 (5) 简明地写出答案…..…...答 (3)列出相关数据 …...…..列根据化学方程式计算的注意事项:
(1). 根据物质的组成及化学方程式求各化学式的相对分子质量(或相对原子质量)与化学式前边计量数的乘积,计算时必须准确无误。
(2). 解题格式的书写要规范化。
(3). 注意单位的书写要求。------- = ---------练习一:15.5克红磷在氧气中充分燃烧,可 生成五氧化二磷多少克?(找出下列所解答案中的错误)解:设可生成X克五氧化二磷
点燃
P + O 2 ====== P 2 O 5
31 142
15.5 X 31 15.5142 XX = --------------142×15.531= 71答:可生成五氧化二磷71克.××××③相对分子(或原子)
质量之和计算错误⑤计算结果错误且无单位×④未注明单位,
未带单位计算②未配平×①设未知数不正确Y = ---------------
24524596×12.25克96245X12.25克△MnO2练习二:(1) .加热分解12.25克氯酸钾,可得到多少
克的氧气?同时生成氯化钾多少克?
(2) .制取4.8克氧气,需要氯酸钾多少克?(1) [解]:设可得到氧气的质量为X。2KClO3======2KCl+3O2↑2459612.25克X-------=-------X =--------------= 4.8 克答:解5.8克氯酸钾可得到氧气 2.3克.149245 12.25克------- = ----------149 Y149×12.25克可生成氯化钾7.45克.生成氯化钾的质量为YY= 7.45克MnO2(2) 解:设:需要氯酸钾的质量为X。2KClO3======2KCl+3O224596△↑4.8克X245X4.8克96=--------------X = --------------4.8克×24596= 12.25克答:需要氯酸钾12.25克.V氢气=m氢气练习三.实验室用13g锌粒与足量的稀硫酸反应制取氢气。
(已知:Zn+H2SO4===ZnSO4+H2↑)
计算:(1)生成氢气的质量为多少克?
(2)这些氢气在标准状况下的体积是多少升?
(标准状况下,氢气密度为0.0899g/L)解:Zn+H2SO4===ZnSO4+H2↑设生成氢气的质量为X65213gXX =0.4g=≈4.4L答:生成氢气的质量为0.4克,这些氢气在标准状况下的体积是4.4L。 练习四、实验室用5g锌粒与5ml稀硫酸反应,反应完毕后剩余锌粒3.7g ,问可生成氢气多少克?解:设生成氢气的质量为XZn + H2SO4 === ZnSO4 + H2↑6525g-3.7gXX =0.04g答:生成氢气的质量为0.04克1、把23克乙醇(俗称酒精)在空气中充分燃烧后,只生成27克水和44克二氧化碳,由此推断乙醇由几种元素组成?练习思路:乙醇中肯定有什么元素?为什么有?乙醇中的C元素、H元素的质量是多少?怎么求?C:=44克×12克=H:27克×=27克×=3克因为乙醇23克>12克+3克,所以乙醇中还有氧元素氧元素质量为:23克 -(12克+3克)=8克44克×2、把4.5克含杂质(杂质不与盐酸反应)的锌粒和足量的稀盐酸反应,待反应停止后,烧杯中物质的质量减少了0.1g。求:
(Zn+2HCl===ZnCl2 + H2↑)
①参加反应的锌的质量。
②这种锌粒中含锌的质量分数。解:设参加反应的Zn的质量为X根据题意:反应生成氢气的质量为0.1gZn+2HCl===ZnCl2 + H2↑6520.1gXX= 3.25g∴该锌粒中Zn%=×100%= 72%答:参加反应的锌的质量为3.25g。这种锌粒中锌的质量分数为72%3、 将含3克氯酸钾和1克二氧化锰的混合物加热片刻,冷却,称得残余固体的质量为3.04克,根据质量守恒定律可知,生成氧气的质量为多少克?固体残余物中含有什么物质?质量各为多少?思路:反应中固体物质质量减轻了,原来3克+1克=4克,加热片刻后剩余固体3.04克,固体质量为什么会减轻?减轻了多少?此减轻的是什么物质的质量?解:根据题意,加热片刻生成氧气4克-3.04克=0.96克0.96克24596149设参加反应的KClO3的质量为X,反应生成KCl的质量为YXYX=2.45克Y=1.49克∴反应后固体残余物中
剩余KClO3
3克-2.45克=0.55克
生成KCl 1.49克
有MnO2 1克答:1.根据化学方程式计算的一般方法是:
掌握根据化学方程式计算各反应物和生成物之间的质量比是这类计算的关键。因此必须注意以下几点:
(1)认真审题,分析题目涉及到什么反应,已知物是什么,待求物是什么。
(2)正确书写出反应的化学方程式(这是正确解题的前提),因此在计算之前必须检查化学方程式是否正确(重点查:①各物质的化学式是否正确;②化学方程式是否符合质量守恒定律即是否配平。)。
(3)正确计算出反应中已知物质和待求物质的质量比。
(这是正确解题的关键)
(4)进行准确、熟练的数学运算(这是解题正确的保证)。
(5)要有完整的解题步骤和规范的书写格式。
(这是解题规范的必需)课堂小结: (3) 写出有关物质的相对分子质量
(不忘乘以前面的化学计量数)
已知量和未知量
列比例式 列
比2、根据化学方程式进行计算的步骤(1)设未知数 ……………....…………设 (2)写出化学方程式 …...…… 写(4) 求解 …...….…..………………… 解(5) 简明地写出答案 ….………… 答3.根据化学方程式计算的注意事项:
(1)所有代入化学方程计算的量必须是纯净物的质量,如果是不纯物,则需要转换。
纯物质的质量=不纯物质质量×纯度=不纯物质质量×(1-杂质的质量分数)
(2)气体、液体的体积,要换算成气体、液体的质量。
?? 气体质量(g)=气体体积(L)×密度(g/L)
?? 液体质量(g)=液体体积(mL)×密度(g/mL)
(3)若题目中只给出一种物质的质量,则另一种物质的用量往往用“足量”、“适量”、“过量”或“完全反应”、“恰好完全反应”等来描述。如果同时知道两种反应物的质量,需要考虑过量问题。
(4)注意已知质量的单位;设未知数的时候要设×××的质量为X,而不能设××× X克;整个化学计算过程要带单位,最后求出的X的值后写上单位。(无说明则保留到小数点后一位)例:6克镁粉与8克氧气充分反应后能生成氧化镁多少克? 6克8克∵48 × 8克 32×6克>∴反应后氧气有剩余XX=10克解:设反应后生成氧化镁的质量为X∴答:6克镁粉与8克氧气充分反应能生成氧化镁10克。解题指导例:某纯净物X在空气中完全燃烧,反应的化学方程式为:
X + 3O2 = 2CO2 + 2H2O,试推断X的化学式 。思路:X + 3O2 = 2CO2 + 2H2O反应后C:
H:
O:2个4个6个反应前O:6个X中:C:
H:2个4个注意:X前的计量数若2X + 3O2 = 2CO2 + 4H2O,试推断X的化学式 。
C2H4若2X + 3O2 = 2CO2 + 4H2O,试推断X的化学式 。2X + 3O2 = 2CO2 + 4H2O
反应后C:
H:
O:2个8个8个反应前O: 6个2X中:C:
H:O:2个8个2个∴X的化学式为CH4O(或CH3OH)1.相等质量的下列物质,在氧气中完全燃烧,消耗氧气最多的是?????????????? (? ? )
A.氢气?????????? B.红磷?????????????? C.硫????????? D.铁
2.相等质量的铁和锌分别与足量的稀盐酸反应,已知反应的化学方程式为:Fe+2HCl=FeCl2+H2↑, Zn+2HCl=ZnCl2+H2↑。则生成氢气的质量是???????????? (? ? )
A.相等????????? B.铁大于锌?????????C.铁小于锌???????D.无法比较练习思路:写出反应方程式,作适当的变形,使氧气化学式前的计量数相等(都为1),然后观察比较,一般不必算出最后结果。AFe+2HCl = FeCl2+H2↑ Zn+2HCl = ZnCl2+H2↑mmxy思路:B3.加热15.8g高锰酸钾,当产生1.6g氧气时,固体剩余物的成分 是??????????? (? )
A.K2MnO4和MnO2??????? B.KMnO4、K2MnO4和MnO2
C.KMnO4和MnO2???????? D.KMnO4和K2MnO4
思路:根据氧气的质量来求生成这么多氧气需要分解多少克高锰酸钾。要注意到15.8克高锰酸钾有可能没有全部分解。所以15.8克这个数据在此不能直接用于计算。解:设生成1.6克氧气需要分解高锰酸钾的质量为xx = 15.8克∴ 答案为AA4.下列关于氢气在氧气中燃烧的叙述中正确的是?????(?? )
? A.16g 氢气和2g 氧气反应能生成18g 水??
B.9g 氢气和9g 氧气反应能生成18g 水
C.1g 氢气和8g 氧气反应能生成9g 水????
D.8g 氢气和1g 氧气反应能生成9g 水
C5、在2X + Y2 === 2Z的反应中,X的相对原子质量为24,Y2的相对分子质量为32,Z的相对分子质量是 ( ) A.64 B.56 C.40 D.32?反应前后有三种物质,已知其中二种物质的质量(或相对质量),求第三种物质的质量(或相对质量)。用质量守恒定律解题解:设Z的相对分子质量为X2×24 + 32 = 2×XX = 40C2×X356、某反应A+2B===C+D,若有30gA和15gB恰好完全反应生成10gC,那么要得到7gD,参加反应A的质量应为????? (?? )
A.20g??? ? B.15g????? C.12g?????? D.6g7克?根据质量守恒定律D7、有X、Y两种元素,12gX2与XY3反应生成24gC,若反应的化学方程式为X2 + XY3 === 3C,则X、Y两元素的相对原子质量之比为 ( )A. 1︰1 B.1︰2 C.3︰1 D.3︰48、将含有15克A,10克B,9克C的粉末状混合物充分加热,发生化学反应,A剩余3克,B增加到25克,C已消耗完,还有气体D放出,反应过程中物质质量变化的比A︰B︰C︰D的值为 ( )9、有A、B、C三种物质各15克,在一定条件下充分反应只生成30克D。若增加10克C,A与C恰好完全反应。则参加反应的A与B得质量比为 ( )A. 3 :2 B.2 :3 C.5 :22 D.5 :3A. 5︰4︰3︰2 B. 4︰5︰3︰2
C. 3︰2︰4︰5 D. 2︰3︰5︰4123(a+b)7、有X、Y两种元素,12gX2与XY3反应生成24gC,若反应的化学方程式为X2 + XY3 === 3C,则X、Y两元素的相对原子质量之比为 ( )X2 + XY3 === 3C12克24克(C的化学式为XY)3︰18、将含有15克A,10克B,9克C的粉末状混合物充分加热,发生化学反应,A剩余3克,B增加到25克,C已消耗完,还有气体D放出,反应过程中物质质量变化的比A︰B︰C︰D的值为( )A从15克到3克,A是?B从10克增加到25克,B是?A减少了多少?B增加了多少?C从9克减少到0克,C是?C减少了多少?D是反应物还是生物?D最后质量有多少?6克根据质量守恒定律A︰B︰C︰D = 12︰15︰9︰6 = 4︰5︰3︰250克9、有A、B、C三种物质各15克,在一定条件下充分反应只生成30克D。若增加10克C,A与C恰好完全反应。则参加反应的A与B得质量比为 ( )25克15克30克15克若不增加10克C, A反应后有剩余,C全部反应掉10克根据质量守恒定律10.下列物质在空气中完全燃烧,生成的CO2和H2O分子的个数比为1:2,则该物质是(? ? )
A.CH4???????? B.C2H2?????? C.CH3OH???? D.C2H5OH
思路:方法①配平化学方程式,观察符合题意的A、C方法②设生成1分子CO2,2分子H2O则:C元素质量为12H元素质量为4该物质中碳、氢元素的质量比为 3︰1= 8.8克×11、一定质量的某含碳化合物在空气中完全燃烧后,生成8.8g二氧化碳和5.4g水,则该化合物可能是???????????? (? ? )
?A.CH4 ??B.C3H6????? C.C2H5OH???? D.CH3OH
CO2中C元素的质量:8.8克×H2O中H元素的质量:5.4克×= 5.4克×=0.6克=2.4克含碳化合物中质量比C︰H = 4︰13︰16︰14︰13︰1思路:C12.H2、O2组成的混合气体20g,经点燃充分反应后生成18g水,则混合气体可能是???????????????????????? (? ? )
?A.2g 氢气和16g 氧气??????????? B.4g 氢气和16g 氧气??
?C.2g 氢气和18g 氧气??????????? D.无法确定思路:18克X假设混合气体中氢气全部参加反应,氢气质量为XX = 2克混合气体中氧气质量为:
20克-2克=18克假设混合气体中氧气全部参加反应,氧气质量为YY18克Y= 16克混合气体中氢气质量为:
20克-16克=4克B、C13.在一密闭容器里有甲、乙、丙、丁四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下:
已知甲的相对分子质量为n,丁的相对分子质量为2n,则该反应的化学方程式中甲与丁的系数比为???????? (?? )
??? A.1∶2??????? B.2∶1??????? C.1∶3???????? D.1∶1反应前质量
(克)反应后质量
(克)物质甲乙丙丁410125未测21109思路:根据质量的变化判断出反应物、生成物;思路:根据质量的变化判断出反应物、生成物;乙:从10克到21克,增加11克丙:从1克到10克,增加9克丁:从25克到9克,减少16克乙生成物丙生成物丁反应物甲:是反应物还是生成物?11+9>16克∴甲是反应物
甲反应掉4克xA + yD ==== mB + nCx×ny×2n4克16克化学反应计算中的几种方法1、利用化学式进行计算2、利用化学方程式计算3、利用质量守恒定律计算物质中的某元素完全转化
到另一种物质中已知任何一种物质的质量,
可求其他物质的质量所有反应物和生成物中只
有一种未知
以镁在空气中燃烧为例说明化学方程式的涵义之一。镁在空气中燃烧反应中反应物与生成物之间的质量比 2×24 :16×2 : (24+16)×2 48 : 32 : 80若: 48克 :( )克 : ( ) 克若:( )克 :( )克 : 4 0 克说明:在化学反应中,反应物与生成物之间的质量比是成正比例关系。因此,利用正比例关系根据化学方程式和已知的一种反应物(或生成物)的质量,可求生成物(或反应物)的质量。[例题]:3克镁在氧气中充分燃烧,可以生成多少克氧化镁?解:设可生成氧化镁的质量为X(1)设未知数 ….... …….….设2 Mg + O 2 ====== 2 Mg O点燃48 80
3克 X (2)写出化学方程式…...…..写48
------ = ------803克X(4) 写比例式,求解.….……..比X = ------------ 80×3克48= 5 克答:3克镁在氧气中充分燃烧可生成氧化镁 5 克。 ….. …... …………………………….解 (5) 简明地写出答案…..…...答 (3)列出相关数据 …...…..列根据化学方程式计算的注意事项:
(1). 根据物质的组成及化学方程式求各化学式的相对分子质量(或相对原子质量)与化学式前边计量数的乘积,计算时必须准确无误。
(2). 解题格式的书写要规范化。
(3). 注意单位的书写要求。------- = ---------练习一:15.5克红磷在氧气中充分燃烧,可 生成五氧化二磷多少克?(找出下列所解答案中的错误)解:设可生成X克五氧化二磷
点燃
P + O 2 ====== P 2 O 5
31 142
15.5 X 31 15.5142 XX = --------------142×15.531= 71答:可生成五氧化二磷71克.××××③相对分子(或原子)
质量之和计算错误⑤计算结果错误且无单位×④未注明单位,
未带单位计算②未配平×①设未知数不正确Y = ---------------
24524596×12.25克96245X12.25克△MnO2练习二:(1) .加热分解12.25克氯酸钾,可得到多少
克的氧气?同时生成氯化钾多少克?
(2) .制取4.8克氧气,需要氯酸钾多少克?(1) [解]:设可得到氧气的质量为X。2KClO3======2KCl+3O2↑2459612.25克X-------=-------X =--------------= 4.8 克答:解5.8克氯酸钾可得到氧气 2.3克.149245 12.25克------- = ----------149 Y149×12.25克可生成氯化钾7.45克.生成氯化钾的质量为YY= 7.45克MnO2(2) 解:设:需要氯酸钾的质量为X。2KClO3======2KCl+3O224596△↑4.8克X245X4.8克96=--------------X = --------------4.8克×24596= 12.25克答:需要氯酸钾12.25克.V氢气=m氢气练习三.实验室用13g锌粒与足量的稀硫酸反应制取氢气。
(已知:Zn+H2SO4===ZnSO4+H2↑)
计算:(1)生成氢气的质量为多少克?
(2)这些氢气在标准状况下的体积是多少升?
(标准状况下,氢气密度为0.0899g/L)解:Zn+H2SO4===ZnSO4+H2↑设生成氢气的质量为X65213gXX =0.4g=≈4.4L答:生成氢气的质量为0.4克,这些氢气在标准状况下的体积是4.4L。 练习四、实验室用5g锌粒与5ml稀硫酸反应,反应完毕后剩余锌粒3.7g ,问可生成氢气多少克?解:设生成氢气的质量为XZn + H2SO4 === ZnSO4 + H2↑6525g-3.7gXX =0.04g答:生成氢气的质量为0.04克1、把23克乙醇(俗称酒精)在空气中充分燃烧后,只生成27克水和44克二氧化碳,由此推断乙醇由几种元素组成?练习思路:乙醇中肯定有什么元素?为什么有?乙醇中的C元素、H元素的质量是多少?怎么求?C:=44克×12克=H:27克×=27克×=3克因为乙醇23克>12克+3克,所以乙醇中还有氧元素氧元素质量为:23克 -(12克+3克)=8克44克×2、把4.5克含杂质(杂质不与盐酸反应)的锌粒和足量的稀盐酸反应,待反应停止后,烧杯中物质的质量减少了0.1g。求:
(Zn+2HCl===ZnCl2 + H2↑)
①参加反应的锌的质量。
②这种锌粒中含锌的质量分数。解:设参加反应的Zn的质量为X根据题意:反应生成氢气的质量为0.1gZn+2HCl===ZnCl2 + H2↑6520.1gXX= 3.25g∴该锌粒中Zn%=×100%= 72%答:参加反应的锌的质量为3.25g。这种锌粒中锌的质量分数为72%3、 将含3克氯酸钾和1克二氧化锰的混合物加热片刻,冷却,称得残余固体的质量为3.04克,根据质量守恒定律可知,生成氧气的质量为多少克?固体残余物中含有什么物质?质量各为多少?思路:反应中固体物质质量减轻了,原来3克+1克=4克,加热片刻后剩余固体3.04克,固体质量为什么会减轻?减轻了多少?此减轻的是什么物质的质量?解:根据题意,加热片刻生成氧气4克-3.04克=0.96克0.96克24596149设参加反应的KClO3的质量为X,反应生成KCl的质量为YXYX=2.45克Y=1.49克∴反应后固体残余物中
剩余KClO3
3克-2.45克=0.55克
生成KCl 1.49克
有MnO2 1克答:1.根据化学方程式计算的一般方法是:
掌握根据化学方程式计算各反应物和生成物之间的质量比是这类计算的关键。因此必须注意以下几点:
(1)认真审题,分析题目涉及到什么反应,已知物是什么,待求物是什么。
(2)正确书写出反应的化学方程式(这是正确解题的前提),因此在计算之前必须检查化学方程式是否正确(重点查:①各物质的化学式是否正确;②化学方程式是否符合质量守恒定律即是否配平。)。
(3)正确计算出反应中已知物质和待求物质的质量比。
(这是正确解题的关键)
(4)进行准确、熟练的数学运算(这是解题正确的保证)。
(5)要有完整的解题步骤和规范的书写格式。
(这是解题规范的必需)课堂小结: (3) 写出有关物质的相对分子质量
(不忘乘以前面的化学计量数)
已知量和未知量
列比例式 列
比2、根据化学方程式进行计算的步骤(1)设未知数 ……………....…………设 (2)写出化学方程式 …...…… 写(4) 求解 …...….…..………………… 解(5) 简明地写出答案 ….………… 答3.根据化学方程式计算的注意事项:
(1)所有代入化学方程计算的量必须是纯净物的质量,如果是不纯物,则需要转换。
纯物质的质量=不纯物质质量×纯度=不纯物质质量×(1-杂质的质量分数)
(2)气体、液体的体积,要换算成气体、液体的质量。
?? 气体质量(g)=气体体积(L)×密度(g/L)
?? 液体质量(g)=液体体积(mL)×密度(g/mL)
(3)若题目中只给出一种物质的质量,则另一种物质的用量往往用“足量”、“适量”、“过量”或“完全反应”、“恰好完全反应”等来描述。如果同时知道两种反应物的质量,需要考虑过量问题。
(4)注意已知质量的单位;设未知数的时候要设×××的质量为X,而不能设××× X克;整个化学计算过程要带单位,最后求出的X的值后写上单位。(无说明则保留到小数点后一位)例:6克镁粉与8克氧气充分反应后能生成氧化镁多少克? 6克8克∵48 × 8克 32×6克>∴反应后氧气有剩余XX=10克解:设反应后生成氧化镁的质量为X∴答:6克镁粉与8克氧气充分反应能生成氧化镁10克。解题指导例:某纯净物X在空气中完全燃烧,反应的化学方程式为:
X + 3O2 = 2CO2 + 2H2O,试推断X的化学式 。思路:X + 3O2 = 2CO2 + 2H2O反应后C:
H:
O:2个4个6个反应前O:6个X中:C:
H:2个4个注意:X前的计量数若2X + 3O2 = 2CO2 + 4H2O,试推断X的化学式 。
C2H4若2X + 3O2 = 2CO2 + 4H2O,试推断X的化学式 。2X + 3O2 = 2CO2 + 4H2O
反应后C:
H:
O:2个8个8个反应前O: 6个2X中:C:
H:O:2个8个2个∴X的化学式为CH4O(或CH3OH)1.相等质量的下列物质,在氧气中完全燃烧,消耗氧气最多的是?????????????? (? ? )
A.氢气?????????? B.红磷?????????????? C.硫????????? D.铁
2.相等质量的铁和锌分别与足量的稀盐酸反应,已知反应的化学方程式为:Fe+2HCl=FeCl2+H2↑, Zn+2HCl=ZnCl2+H2↑。则生成氢气的质量是???????????? (? ? )
A.相等????????? B.铁大于锌?????????C.铁小于锌???????D.无法比较练习思路:写出反应方程式,作适当的变形,使氧气化学式前的计量数相等(都为1),然后观察比较,一般不必算出最后结果。AFe+2HCl = FeCl2+H2↑ Zn+2HCl = ZnCl2+H2↑mmxy思路:B3.加热15.8g高锰酸钾,当产生1.6g氧气时,固体剩余物的成分 是??????????? (? )
A.K2MnO4和MnO2??????? B.KMnO4、K2MnO4和MnO2
C.KMnO4和MnO2???????? D.KMnO4和K2MnO4
思路:根据氧气的质量来求生成这么多氧气需要分解多少克高锰酸钾。要注意到15.8克高锰酸钾有可能没有全部分解。所以15.8克这个数据在此不能直接用于计算。解:设生成1.6克氧气需要分解高锰酸钾的质量为xx = 15.8克∴ 答案为AA4.下列关于氢气在氧气中燃烧的叙述中正确的是?????(?? )
? A.16g 氢气和2g 氧气反应能生成18g 水??
B.9g 氢气和9g 氧气反应能生成18g 水
C.1g 氢气和8g 氧气反应能生成9g 水????
D.8g 氢气和1g 氧气反应能生成9g 水
C5、在2X + Y2 === 2Z的反应中,X的相对原子质量为24,Y2的相对分子质量为32,Z的相对分子质量是 ( ) A.64 B.56 C.40 D.32?反应前后有三种物质,已知其中二种物质的质量(或相对质量),求第三种物质的质量(或相对质量)。用质量守恒定律解题解:设Z的相对分子质量为X2×24 + 32 = 2×XX = 40C2×X356、某反应A+2B===C+D,若有30gA和15gB恰好完全反应生成10gC,那么要得到7gD,参加反应A的质量应为????? (?? )
A.20g??? ? B.15g????? C.12g?????? D.6g7克?根据质量守恒定律D7、有X、Y两种元素,12gX2与XY3反应生成24gC,若反应的化学方程式为X2 + XY3 === 3C,则X、Y两元素的相对原子质量之比为 ( )A. 1︰1 B.1︰2 C.3︰1 D.3︰48、将含有15克A,10克B,9克C的粉末状混合物充分加热,发生化学反应,A剩余3克,B增加到25克,C已消耗完,还有气体D放出,反应过程中物质质量变化的比A︰B︰C︰D的值为 ( )9、有A、B、C三种物质各15克,在一定条件下充分反应只生成30克D。若增加10克C,A与C恰好完全反应。则参加反应的A与B得质量比为 ( )A. 3 :2 B.2 :3 C.5 :22 D.5 :3A. 5︰4︰3︰2 B. 4︰5︰3︰2
C. 3︰2︰4︰5 D. 2︰3︰5︰4123(a+b)7、有X、Y两种元素,12gX2与XY3反应生成24gC,若反应的化学方程式为X2 + XY3 === 3C,则X、Y两元素的相对原子质量之比为 ( )X2 + XY3 === 3C12克24克(C的化学式为XY)3︰18、将含有15克A,10克B,9克C的粉末状混合物充分加热,发生化学反应,A剩余3克,B增加到25克,C已消耗完,还有气体D放出,反应过程中物质质量变化的比A︰B︰C︰D的值为( )A从15克到3克,A是?B从10克增加到25克,B是?A减少了多少?B增加了多少?C从9克减少到0克,C是?C减少了多少?D是反应物还是生物?D最后质量有多少?6克根据质量守恒定律A︰B︰C︰D = 12︰15︰9︰6 = 4︰5︰3︰250克9、有A、B、C三种物质各15克,在一定条件下充分反应只生成30克D。若增加10克C,A与C恰好完全反应。则参加反应的A与B得质量比为 ( )25克15克30克15克若不增加10克C, A反应后有剩余,C全部反应掉10克根据质量守恒定律10.下列物质在空气中完全燃烧,生成的CO2和H2O分子的个数比为1:2,则该物质是(? ? )
A.CH4???????? B.C2H2?????? C.CH3OH???? D.C2H5OH
思路:方法①配平化学方程式,观察符合题意的A、C方法②设生成1分子CO2,2分子H2O则:C元素质量为12H元素质量为4该物质中碳、氢元素的质量比为 3︰1= 8.8克×11、一定质量的某含碳化合物在空气中完全燃烧后,生成8.8g二氧化碳和5.4g水,则该化合物可能是???????????? (? ? )
?A.CH4 ??B.C3H6????? C.C2H5OH???? D.CH3OH
CO2中C元素的质量:8.8克×H2O中H元素的质量:5.4克×= 5.4克×=0.6克=2.4克含碳化合物中质量比C︰H = 4︰13︰16︰14︰13︰1思路:C12.H2、O2组成的混合气体20g,经点燃充分反应后生成18g水,则混合气体可能是???????????????????????? (? ? )
?A.2g 氢气和16g 氧气??????????? B.4g 氢气和16g 氧气??
?C.2g 氢气和18g 氧气??????????? D.无法确定思路:18克X假设混合气体中氢气全部参加反应,氢气质量为XX = 2克混合气体中氧气质量为:
20克-2克=18克假设混合气体中氧气全部参加反应,氧气质量为YY18克Y= 16克混合气体中氢气质量为:
20克-16克=4克B、C13.在一密闭容器里有甲、乙、丙、丁四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下:
已知甲的相对分子质量为n,丁的相对分子质量为2n,则该反应的化学方程式中甲与丁的系数比为???????? (?? )
??? A.1∶2??????? B.2∶1??????? C.1∶3???????? D.1∶1反应前质量
(克)反应后质量
(克)物质甲乙丙丁410125未测21109思路:根据质量的变化判断出反应物、生成物;思路:根据质量的变化判断出反应物、生成物;乙:从10克到21克,增加11克丙:从1克到10克,增加9克丁:从25克到9克,减少16克乙生成物丙生成物丁反应物甲:是反应物还是生成物?11+9>16克∴甲是反应物
甲反应掉4克xA + yD ==== mB + nCx×ny×2n4克16克化学反应计算中的几种方法1、利用化学式进行计算2、利用化学方程式计算3、利用质量守恒定律计算物质中的某元素完全转化
到另一种物质中已知任何一种物质的质量,
可求其他物质的质量所有反应物和生成物中只
有一种未知
