第三节:氧化还原反应(课件)
文档属性
| 名称 | 第三节:氧化还原反应(课件) |  | |
| 格式 | pptx | ||
| 文件大小 | 367.7KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-07-06 15:50:37 | ||
图片预览





文档简介
(共12张PPT)
氧化还原反应
一、氧化还原反应的基本概念
1、氧化反应:失去电子的反应;还原反应:得到电子的反应。
2、被氧化:失去电子的变化过程;被还原:得到电子的变化过程。
3、氧化产物:还原剂在反应中失去电子后被氧化而形成的生成物;还原产物:氧化剂在反应中得到电子后被还原而形成的生成物。
4、还原剂:失去电子的物质;氧化剂:得到电子的物质。
5、还原性:还原剂具有的失去电子的性质;氧化性:氧化剂具有的得到电子的性质。
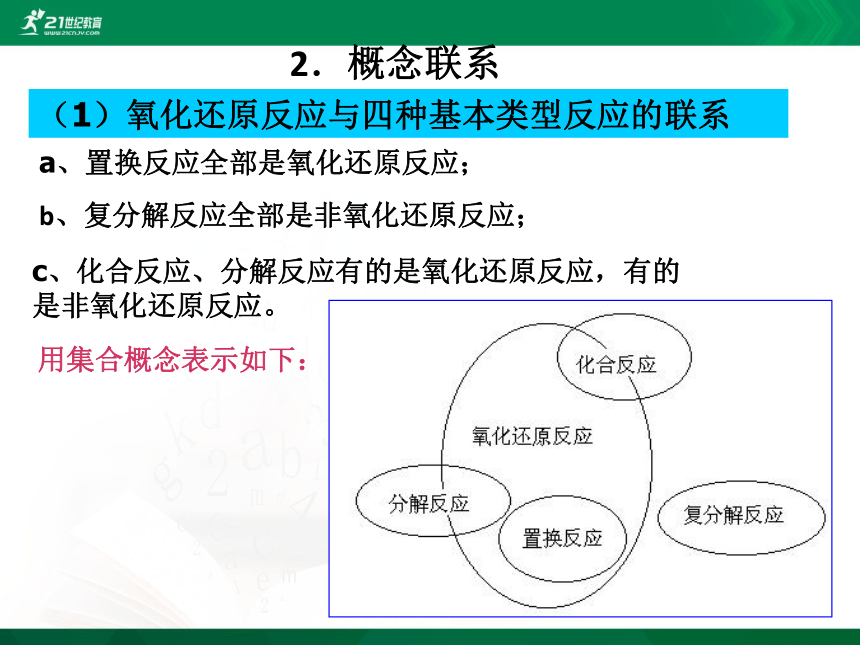
2.概念联系
(1)氧化还原反应与四种基本类型反应的联系
a、置换反应全部是氧化还原反应;
b、复分解反应全部是非氧化还原反应;
c、化合反应、分解反应有的是氧化还原反应,有的是非氧化还原反应。
用集合概念表示如下:
(2)氧化还原反应有关概念之间的相互联系:
还原剂→还原性→氧化反应→失去e-→价升高→被氧化→氧化产物
(弱氧化性)
↑ ↑ ↑ ↑ ↑ ↑ ↑
反应物 性质 反应 本质 特征 过程 生成物
↓ ↓ ↓ ↓ ↓ ↓ ↓
氧化剂→氧化性→还原反应→得到e-→价降低→被还原→还原产物
(弱还原性)
3、氧化还原反应的电予转移的表示方法一双线桥法:
(1)双线桥法
(2)单线桥法
┌───────────┐
│ ↓
│
└───────────┘
↑
得5e-
失e-×5
4.常见氧化剂和还原剂
(1)常见的还原剂
①活泼的金属单质:如Na、Mg、Al、Zn、Fe等。
②某些非金属单质:如H2、C、Si等
③元素处于低化合价时的氧化物:如CO、SO2等
④元素处于低化合价时的酸:如HCl、H2S等
⑤元素处于低化合价时的盐:如Na2SO3 、FeSO4等
(2)常见的氧化剂
①活泼的非金属单质:如Cl2、Br2、O2等
②元素(如Mn、C、N)处于高化合价时的氧化物:如MnO2、CO2、NO2等
③元素(S、N)处于高化合价时的含氧酸:如浓H2SO4、HNO3等
④元素(Mn、Cl、Fe)处于高化合价时的盐:如KMnO4、KClO3、FeCl3等
⑤过氧化物:如Na2O2、H2O2等
5.氧化还原规律
(1)守恒律
氧化还原反应中得失电子守恒,
即:氧化剂得电子总数=还原剂失电子总数
应用:有关氧化还原反应的计算及配平氧化还原反应方程式。
(2)价态律
元素处于最高价态时,只有氧化性,但不一定具有强氧化性;
元素处于最低价态时,只有还原性,但不一定具有强还原性;
元素处于中间价态时,既有氧化性又有还原性,但主要呈现一种性质。
物质含有多种元素,其性质是这些元素性质的综合体现。
应用:判断元素或物质有无氧化性、还原性。
(3)强弱律
氧化剂 + 还原剂 = 还原产物 + 氧化产物
(强氧化性)(强还原性)(弱还原性)(弱氧化性)
┌──────────┐
└───────────┘
得ne-
失ne-
应用:①比较物质间氧化性或还原性的强弱;
②在适宜条件下,用氧化性强的物质制备氧化性弱的物质或用还原性强的物质制备还原性弱的物质。
(4)转化律
①氧化还原反应中,以元素相邻价态间的转化最容易;
②同种元素不同价态之间的氧化还原反应,化合价的变化遵循:
高价+低价 ─────→ 中间价(归中反应)
中间价──────→高价+低价(歧化反应)
③同种元素,相邻价态间不发生氧化还原反应。
应用:分析判断氧化还原反应能否发生。
(5)难易律
①越易失电子的物质,失后就越难得电子,越易得电子的物质,得后就越难失电子。(注意:难失电子的物质不一定易得电子,难得电子的物质也不一定易失电子。如稀有气体既难失电子,又难得电子。)
②一种氧化剂同时和几种还原剂相遇时,还原性最强的优先发生反应;
一种还原剂同时和几种氧化剂相遇时,氧化性最强的优先发生反应。
应用:判断物质的稳定性及反应顺序。
1.有0.3mol硫化亚铜与适量的稀硝酸恰好完全反应生成硝酸铜、硫酸、一氧化氮和水,则末被还原的硝酸为( ) mol,被还原的硝酸为( )mol,消耗的硝酸为( )mol。
A.2.2 B.0.6
C.1.2 D.1.0
解析:0.3×2×2=1.2mol , 0.3×(2 + 8)=3x
x=1.0 mol , 1.2+1.0=2.2mol
选:C、D、A
C
D
A
氧化还原反应
一、氧化还原反应的基本概念
1、氧化反应:失去电子的反应;还原反应:得到电子的反应。
2、被氧化:失去电子的变化过程;被还原:得到电子的变化过程。
3、氧化产物:还原剂在反应中失去电子后被氧化而形成的生成物;还原产物:氧化剂在反应中得到电子后被还原而形成的生成物。
4、还原剂:失去电子的物质;氧化剂:得到电子的物质。
5、还原性:还原剂具有的失去电子的性质;氧化性:氧化剂具有的得到电子的性质。
2.概念联系
(1)氧化还原反应与四种基本类型反应的联系
a、置换反应全部是氧化还原反应;
b、复分解反应全部是非氧化还原反应;
c、化合反应、分解反应有的是氧化还原反应,有的是非氧化还原反应。
用集合概念表示如下:
(2)氧化还原反应有关概念之间的相互联系:
还原剂→还原性→氧化反应→失去e-→价升高→被氧化→氧化产物
(弱氧化性)
↑ ↑ ↑ ↑ ↑ ↑ ↑
反应物 性质 反应 本质 特征 过程 生成物
↓ ↓ ↓ ↓ ↓ ↓ ↓
氧化剂→氧化性→还原反应→得到e-→价降低→被还原→还原产物
(弱还原性)
3、氧化还原反应的电予转移的表示方法一双线桥法:
(1)双线桥法
(2)单线桥法
┌───────────┐
│ ↓
│
└───────────┘
↑
得5e-
失e-×5
4.常见氧化剂和还原剂
(1)常见的还原剂
①活泼的金属单质:如Na、Mg、Al、Zn、Fe等。
②某些非金属单质:如H2、C、Si等
③元素处于低化合价时的氧化物:如CO、SO2等
④元素处于低化合价时的酸:如HCl、H2S等
⑤元素处于低化合价时的盐:如Na2SO3 、FeSO4等
(2)常见的氧化剂
①活泼的非金属单质:如Cl2、Br2、O2等
②元素(如Mn、C、N)处于高化合价时的氧化物:如MnO2、CO2、NO2等
③元素(S、N)处于高化合价时的含氧酸:如浓H2SO4、HNO3等
④元素(Mn、Cl、Fe)处于高化合价时的盐:如KMnO4、KClO3、FeCl3等
⑤过氧化物:如Na2O2、H2O2等
5.氧化还原规律
(1)守恒律
氧化还原反应中得失电子守恒,
即:氧化剂得电子总数=还原剂失电子总数
应用:有关氧化还原反应的计算及配平氧化还原反应方程式。
(2)价态律
元素处于最高价态时,只有氧化性,但不一定具有强氧化性;
元素处于最低价态时,只有还原性,但不一定具有强还原性;
元素处于中间价态时,既有氧化性又有还原性,但主要呈现一种性质。
物质含有多种元素,其性质是这些元素性质的综合体现。
应用:判断元素或物质有无氧化性、还原性。
(3)强弱律
氧化剂 + 还原剂 = 还原产物 + 氧化产物
(强氧化性)(强还原性)(弱还原性)(弱氧化性)
┌──────────┐
└───────────┘
得ne-
失ne-
应用:①比较物质间氧化性或还原性的强弱;
②在适宜条件下,用氧化性强的物质制备氧化性弱的物质或用还原性强的物质制备还原性弱的物质。
(4)转化律
①氧化还原反应中,以元素相邻价态间的转化最容易;
②同种元素不同价态之间的氧化还原反应,化合价的变化遵循:
高价+低价 ─────→ 中间价(归中反应)
中间价──────→高价+低价(歧化反应)
③同种元素,相邻价态间不发生氧化还原反应。
应用:分析判断氧化还原反应能否发生。
(5)难易律
①越易失电子的物质,失后就越难得电子,越易得电子的物质,得后就越难失电子。(注意:难失电子的物质不一定易得电子,难得电子的物质也不一定易失电子。如稀有气体既难失电子,又难得电子。)
②一种氧化剂同时和几种还原剂相遇时,还原性最强的优先发生反应;
一种还原剂同时和几种氧化剂相遇时,氧化性最强的优先发生反应。
应用:判断物质的稳定性及反应顺序。
1.有0.3mol硫化亚铜与适量的稀硝酸恰好完全反应生成硝酸铜、硫酸、一氧化氮和水,则末被还原的硝酸为( ) mol,被还原的硝酸为( )mol,消耗的硝酸为( )mol。
A.2.2 B.0.6
C.1.2 D.1.0
解析:0.3×2×2=1.2mol , 0.3×(2 + 8)=3x
x=1.0 mol , 1.2+1.0=2.2mol
选:C、D、A
C
D
A
