第一节:物质的分类(课件)
文档属性
| 名称 | 第一节:物质的分类(课件) |  | |
| 格式 | pptx | ||
| 文件大小 | 512.1KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-07-06 15:51:50 | ||
图片预览




文档简介
(共21张PPT)
化学物质及其变化
物质的分类
例1、对下列化学反应进行分类:
(1)硫在氧气里燃烧
(2)红磷在氧气里燃烧
(3)铁丝在氧气里燃烧
(4)铝箔在氧气里燃烧
(5)蜡烛在氧气里燃烧
1、交叉分类法
①是不是化合反应
②是不是氧化反应
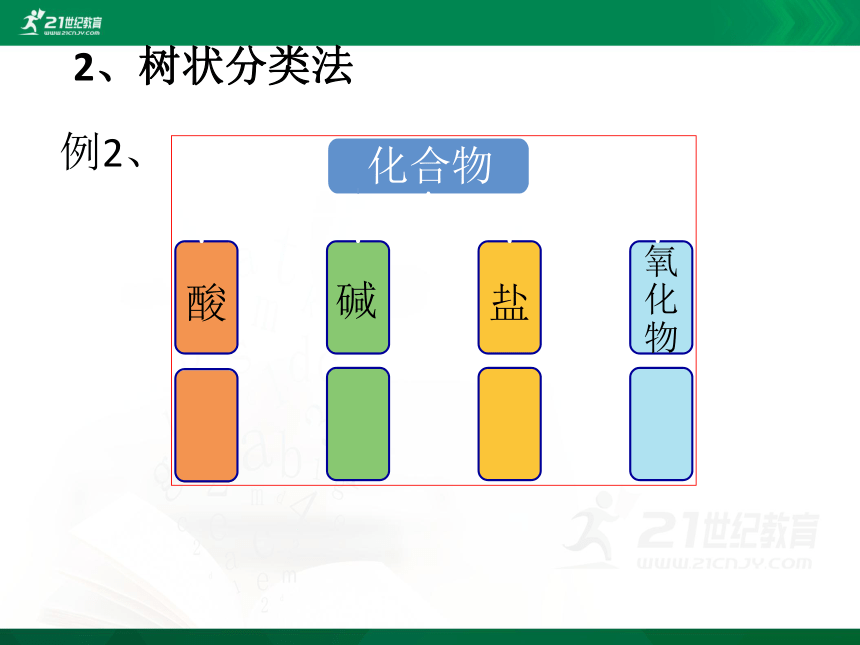
2、树状分类法
例2、
1、定义:一种或一种以上的物质分散到另一种物质中所得到的混合物
分散质:被分散的物质
分散剂:能分散分散质的物质
一、分散系
溶液、悬(乳)浊液、胶体
(其中分散成微粒的物质)
(微粒分散在其中的物质)
分散系
2、分散系的分类
本质依据——分散质微粒直径大小
分散系 溶液 胶体 浊液
分散质微粒直径
<10-9m
(< 1nm)
10-9m-10-7m
(1 ~100 nm)
>10-7m
(>100 nm)
二、胶体
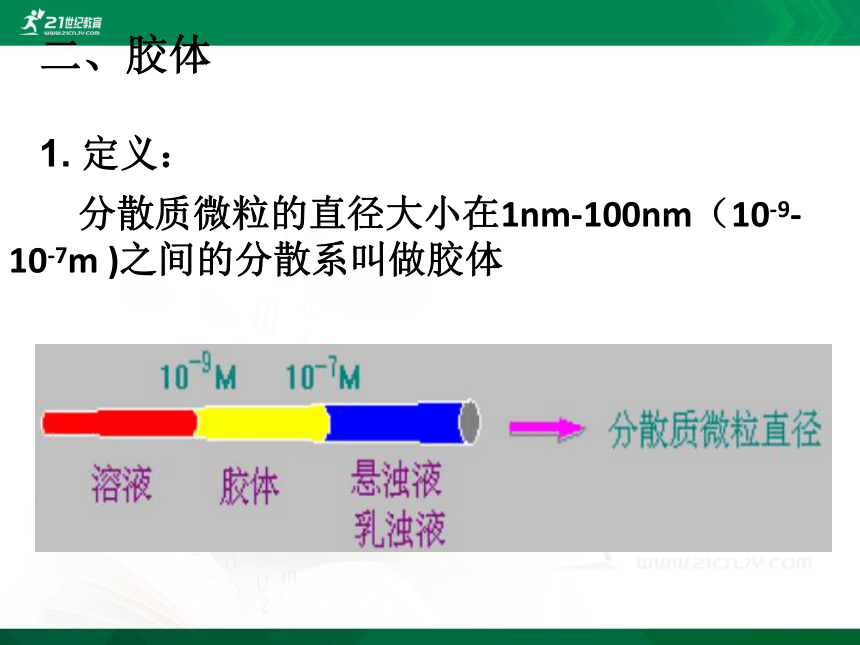
分散质微粒的直径大小在1nm-100nm(10-9-10-7m )之间的分散系叫做胶体
1. 定义:
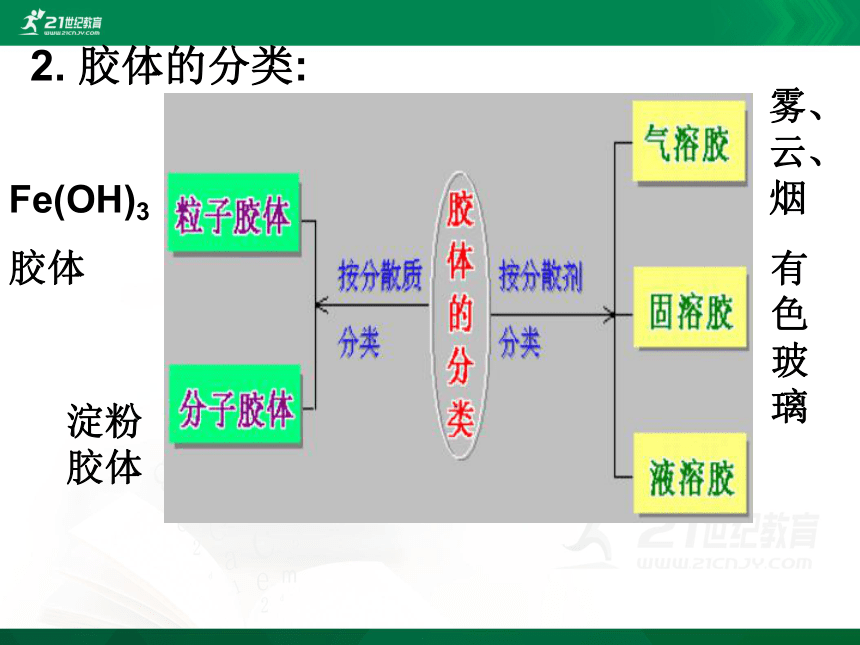
2. 胶体的分类:
Fe(OH)3
胶体
淀粉胶体
雾、云、烟
有色玻璃
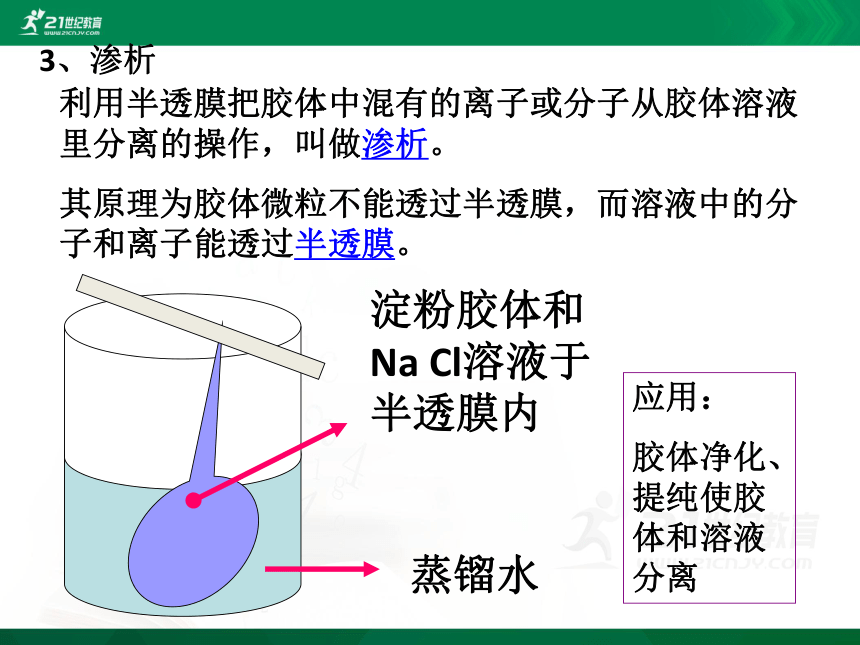
淀粉胶体和 Na Cl溶液于半透膜内
蒸镏水
3、渗析
利用半透膜把胶体中混有的离子或分子从胶体溶液里分离的操作,叫做渗析。
其原理为胶体微粒不能透过半透膜,而溶液中的分子和离子能透过半透膜。
应用:
胶体净化、提纯使胶体和溶液分离
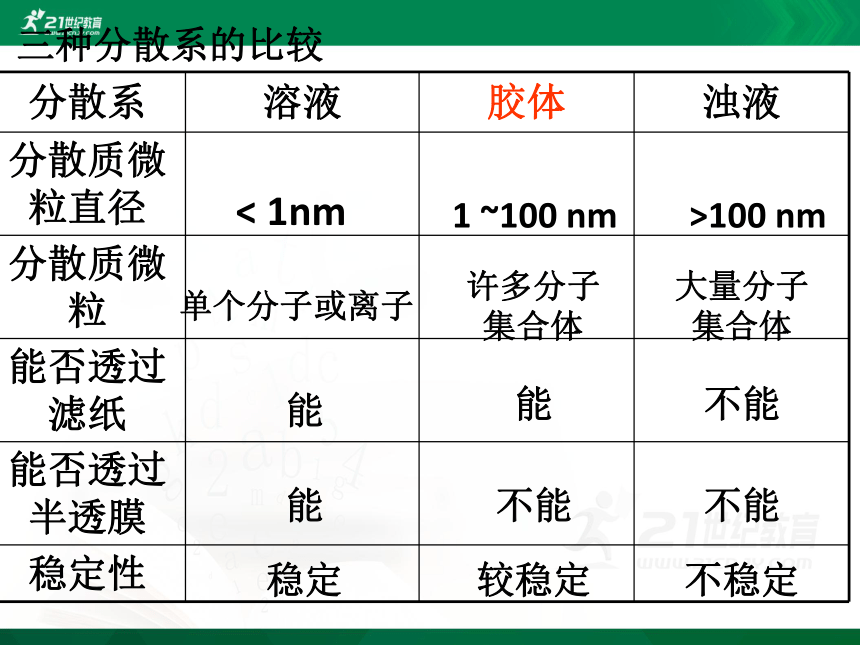
分散系 溶液 胶体 浊液
分散质微粒直径
分散质微粒
能否透过滤纸
能否透过半透膜
稳定性
< 1nm
1 ~100 nm
>100 nm
单个分子或离子
许多分子集合体
大量分子集合体
能
能
不能
能
不能
不能
稳定
较稳定
不稳定
三种分散系的比较
(胶体)
(溶液)
三、胶体的性质
1、丁达尔现象(光学性质)
实验:光束分别通过AgI胶体和CuSO4溶液,观察现象。
现象:一束光通过胶体时,从侧面可观察到胶体里
产生一条光亮的“通路”。
原因:胶粒直径大小与光的波长相近,胶粒对
光有散射作用;而溶液分散质的粒子太
小,不发生散射。
应用:鉴别溶胶和溶液。
练习:不能发生丁达尔现象的分散系是( )
A、碘酒 B、无水酒精
C、蛋白质溶液 D、钴玻璃
A B
普遍存在的现象
2、 布朗运动(动力学性质)
在超显微镜下观察胶体溶液可以看到胶体颗粒不断地作无规则的运动。
原因:溶剂分子不均匀地撞击胶体粒子,使其发生不断改变方向、改变速率的布朗运动。
胶体微粒作布朗运动是胶体稳定的原因之一。
练习:胶体粒子能作布朗运动的原因是 ( )
①水分子对胶体粒子的撞击 ②胶体粒子有
吸附能力 ③胶体粒子带电 ④胶体粒子质
量很小,所受重力小
A、①② B、①③ C、①④ D、②④
c
在外加电场作用下, 胶体粒子在分散剂里向电极 (阴极或阳极) 作定向移动的现象, 叫做电泳
-
阴极
+
阳极
Fe(OH)3胶体向阴极
移动——带正电荷
3、 电泳现象(电学性质)
重要胶粒带电的一般规律:
胶粒带同种电荷,相互间产生排斥作用,不易结合成更大的沉淀微粒,这是胶体具有稳定性的主要因素。
带正电荷胶粒 带负电荷胶粒
金属氢氧化物 金属氧化物 金属硫化物(如Sb2S3)
非金属硫化物(如As2S3)
非金属氧化物(如SiO2泥沙)
硅酸盐(土壤和水泥)
在陶瓷工业上常遇到因陶土里混有Fe2O3而影响产品质量的问题。解决方法之一是把这些陶土和水放在一起搅拌,使粒子大小在1nm~100nm之间,然后插入两根电极,接通直流电源,这时阳极聚积 ,
阴极聚积 ,理由
是 。
例题
带负电荷的胶粒(粒子陶土)
带正电荷的胶粒(Fe2O3)
含有杂质的陶土和水形成了胶体,利用电泳将
陶土和杂质分离除杂
五、胶体的凝聚
要使胶体凝聚成沉淀,就要减少或消除胶体微粒表面吸附的电荷,使之减弱或失去电性排斥力作用,从而使胶粒在运动中碰撞结合成更大的颗粒。
胶体为什么能够稳定存在?
胶粒带电、布朗运动
如何破坏胶体的稳定状态?
使胶体微粒凝聚成更大的颗粒,形成沉淀,从分散剂里析出的过程叫胶体的凝聚。
实例:
1.豆浆里加盐卤(MgCl2·6H2O)或石膏(CaSO4·2H2O) ,使之凝聚成豆腐;
2.水泥里加石膏能调节水泥浆的硬化速率;
3.在江河与海的交汇处形成的沙洲。
(1)加入电解质
(2)加入胶粒带相反电荷的胶体
带不同电荷的胶体微粒相互吸引发生电性中和,从而在胶粒碰撞时发生凝聚,形成沉淀或凝胶。
实验:将Fe(OH)3胶体溶液与硅酸胶体溶液
现象:形成大量的沉淀.
结论:Fe(OH)3胶粒与H2SiO3胶粒带相反电荷.
实例:①用明矾、氯化铁等净水;②不同种类的墨水混合使用时有沉淀产生,使墨水失效。
(3)加热
温度升高,胶粒的吸附能力减弱,减少了胶粒所吸引的阴离子或阳离子数量,胶粒所带的电荷数减少,胶粒间的斥力作用减弱,使得胶粒在碰撞时容易结合成大颗粒,形成沉淀或凝胶。
实例:淀粉溶液加热后凝聚成了浆糊凝胶,蛋清加热后凝聚成了白色胶状物(同时发生变性)。
练习:氯化铁溶液与氢氧化铁胶体具有的共同性
质是 ( )
A、分散质颗粒直径都在1nm~100nm之间
B、能透过半透膜
C、加热蒸干、灼烧后都有氧化铁生成
D、呈红褐色
C
练习:下列事实:①用盐卤点豆腐 ②水泥的硬化 ③用明矾净水 ④河海交汇处可沉积沙洲 ⑤制肥皂时在高级脂肪酸钠、甘油和水形成的混合物中加入食盐,析出肥皂 ⑥钢笔使用两种不同颜色的蓝墨水,易出现堵塞 ⑦血液透析。其中与胶体知识有关的是 ( )
A、①②③④⑤ B、③④⑤⑥⑦
C、①③⑤⑥⑦ D、全部都是
D
化学物质及其变化
物质的分类
例1、对下列化学反应进行分类:
(1)硫在氧气里燃烧
(2)红磷在氧气里燃烧
(3)铁丝在氧气里燃烧
(4)铝箔在氧气里燃烧
(5)蜡烛在氧气里燃烧
1、交叉分类法
①是不是化合反应
②是不是氧化反应
2、树状分类法
例2、
1、定义:一种或一种以上的物质分散到另一种物质中所得到的混合物
分散质:被分散的物质
分散剂:能分散分散质的物质
一、分散系
溶液、悬(乳)浊液、胶体
(其中分散成微粒的物质)
(微粒分散在其中的物质)
分散系
2、分散系的分类
本质依据——分散质微粒直径大小
分散系 溶液 胶体 浊液
分散质微粒直径
<10-9m
(< 1nm)
10-9m-10-7m
(1 ~100 nm)
>10-7m
(>100 nm)
二、胶体
分散质微粒的直径大小在1nm-100nm(10-9-10-7m )之间的分散系叫做胶体
1. 定义:
2. 胶体的分类:
Fe(OH)3
胶体
淀粉胶体
雾、云、烟
有色玻璃
淀粉胶体和 Na Cl溶液于半透膜内
蒸镏水
3、渗析
利用半透膜把胶体中混有的离子或分子从胶体溶液里分离的操作,叫做渗析。
其原理为胶体微粒不能透过半透膜,而溶液中的分子和离子能透过半透膜。
应用:
胶体净化、提纯使胶体和溶液分离
分散系 溶液 胶体 浊液
分散质微粒直径
分散质微粒
能否透过滤纸
能否透过半透膜
稳定性
< 1nm
1 ~100 nm
>100 nm
单个分子或离子
许多分子集合体
大量分子集合体
能
能
不能
能
不能
不能
稳定
较稳定
不稳定
三种分散系的比较
(胶体)
(溶液)
三、胶体的性质
1、丁达尔现象(光学性质)
实验:光束分别通过AgI胶体和CuSO4溶液,观察现象。
现象:一束光通过胶体时,从侧面可观察到胶体里
产生一条光亮的“通路”。
原因:胶粒直径大小与光的波长相近,胶粒对
光有散射作用;而溶液分散质的粒子太
小,不发生散射。
应用:鉴别溶胶和溶液。
练习:不能发生丁达尔现象的分散系是( )
A、碘酒 B、无水酒精
C、蛋白质溶液 D、钴玻璃
A B
普遍存在的现象
2、 布朗运动(动力学性质)
在超显微镜下观察胶体溶液可以看到胶体颗粒不断地作无规则的运动。
原因:溶剂分子不均匀地撞击胶体粒子,使其发生不断改变方向、改变速率的布朗运动。
胶体微粒作布朗运动是胶体稳定的原因之一。
练习:胶体粒子能作布朗运动的原因是 ( )
①水分子对胶体粒子的撞击 ②胶体粒子有
吸附能力 ③胶体粒子带电 ④胶体粒子质
量很小,所受重力小
A、①② B、①③ C、①④ D、②④
c
在外加电场作用下, 胶体粒子在分散剂里向电极 (阴极或阳极) 作定向移动的现象, 叫做电泳
-
阴极
+
阳极
Fe(OH)3胶体向阴极
移动——带正电荷
3、 电泳现象(电学性质)
重要胶粒带电的一般规律:
胶粒带同种电荷,相互间产生排斥作用,不易结合成更大的沉淀微粒,这是胶体具有稳定性的主要因素。
带正电荷胶粒 带负电荷胶粒
金属氢氧化物 金属氧化物 金属硫化物(如Sb2S3)
非金属硫化物(如As2S3)
非金属氧化物(如SiO2泥沙)
硅酸盐(土壤和水泥)
在陶瓷工业上常遇到因陶土里混有Fe2O3而影响产品质量的问题。解决方法之一是把这些陶土和水放在一起搅拌,使粒子大小在1nm~100nm之间,然后插入两根电极,接通直流电源,这时阳极聚积 ,
阴极聚积 ,理由
是 。
例题
带负电荷的胶粒(粒子陶土)
带正电荷的胶粒(Fe2O3)
含有杂质的陶土和水形成了胶体,利用电泳将
陶土和杂质分离除杂
五、胶体的凝聚
要使胶体凝聚成沉淀,就要减少或消除胶体微粒表面吸附的电荷,使之减弱或失去电性排斥力作用,从而使胶粒在运动中碰撞结合成更大的颗粒。
胶体为什么能够稳定存在?
胶粒带电、布朗运动
如何破坏胶体的稳定状态?
使胶体微粒凝聚成更大的颗粒,形成沉淀,从分散剂里析出的过程叫胶体的凝聚。
实例:
1.豆浆里加盐卤(MgCl2·6H2O)或石膏(CaSO4·2H2O) ,使之凝聚成豆腐;
2.水泥里加石膏能调节水泥浆的硬化速率;
3.在江河与海的交汇处形成的沙洲。
(1)加入电解质
(2)加入胶粒带相反电荷的胶体
带不同电荷的胶体微粒相互吸引发生电性中和,从而在胶粒碰撞时发生凝聚,形成沉淀或凝胶。
实验:将Fe(OH)3胶体溶液与硅酸胶体溶液
现象:形成大量的沉淀.
结论:Fe(OH)3胶粒与H2SiO3胶粒带相反电荷.
实例:①用明矾、氯化铁等净水;②不同种类的墨水混合使用时有沉淀产生,使墨水失效。
(3)加热
温度升高,胶粒的吸附能力减弱,减少了胶粒所吸引的阴离子或阳离子数量,胶粒所带的电荷数减少,胶粒间的斥力作用减弱,使得胶粒在碰撞时容易结合成大颗粒,形成沉淀或凝胶。
实例:淀粉溶液加热后凝聚成了浆糊凝胶,蛋清加热后凝聚成了白色胶状物(同时发生变性)。
练习:氯化铁溶液与氢氧化铁胶体具有的共同性
质是 ( )
A、分散质颗粒直径都在1nm~100nm之间
B、能透过半透膜
C、加热蒸干、灼烧后都有氧化铁生成
D、呈红褐色
C
练习:下列事实:①用盐卤点豆腐 ②水泥的硬化 ③用明矾净水 ④河海交汇处可沉积沙洲 ⑤制肥皂时在高级脂肪酸钠、甘油和水形成的混合物中加入食盐,析出肥皂 ⑥钢笔使用两种不同颜色的蓝墨水,易出现堵塞 ⑦血液透析。其中与胶体知识有关的是 ( )
A、①②③④⑤ B、③④⑤⑥⑦
C、①③⑤⑥⑦ D、全部都是
D
