第一节:无机非金属主角—硅(课件)
文档属性
| 名称 | 第一节:无机非金属主角—硅(课件) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-07-06 15:57:02 | ||
图片预览







文档简介
(共22张PPT)
无机非金属主角—硅
硅的氧化物及硅酸盐构成了地壳中大部分的岩石、沙子和土壤、约占地壳总量的90%以上。
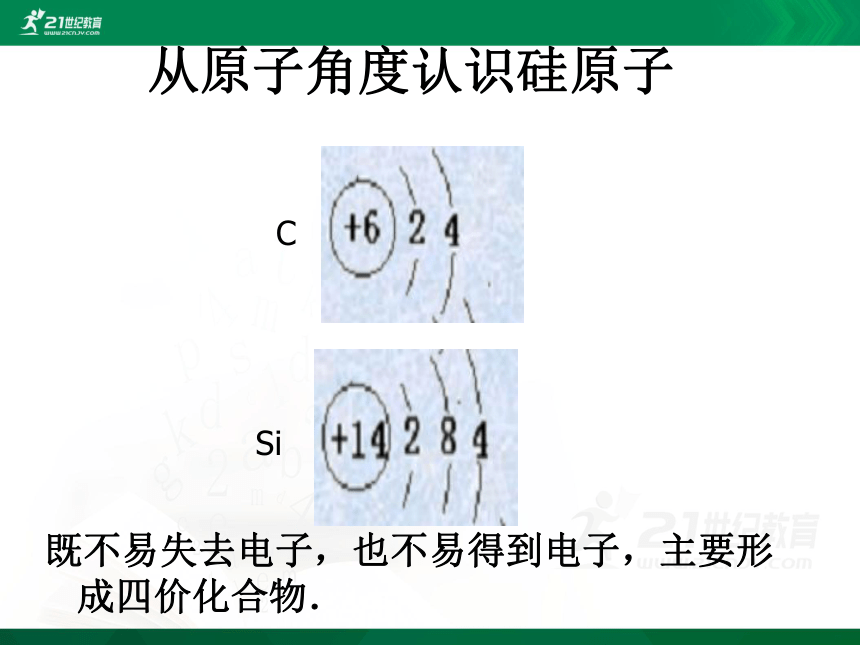
从原子角度认识硅原子
既不易失去电子,也不易得到电子,主要形成四价化合物.
C
Si
思考:
根据阅读想一想碳和硅在自然界中存在形式有所不同的原因是什么?
Si在地壳中含量丰富,仅次于O,约占26.3%
碳和硅都是亲氧元素但是硅的亲氧能力更强
Si无游离态
化合态:硅的氧化物和硅酸盐
水晶
玛瑙
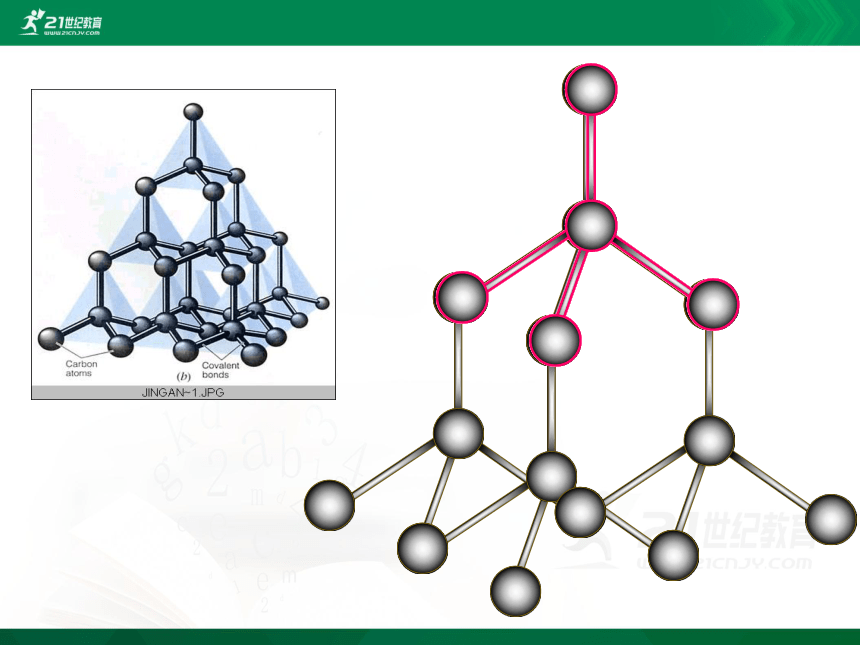
结构:
四面体
每1个Si原子周围结合4个O原子,Si在中心,O在四个顶角.
同时每1个O原子周围结合2个Si原子相结合。
二氧化硅中氧原子与硅原子个数比为2:1,通常用SiO2来表示二氧化硅的组成.
水晶
玛瑙
由图片思考:二氧化硅具有哪些物理性质 化学稳定性如何 你的根据是什么 SiO2的这些性质是由什么决定的?
结构与性质的关系:SiO2的网状结构
物理性质:熔点高,硬度大的固体
不溶于水,纯净的SiO2晶体无色透明
化学性质:稳定(化学性质不活泼)
SiO2的化学性质(不活泼)
1.酸性氧化物
与碱性氧化物反应生成盐
SiO2+ CaO == CaSiO3
与强碱反应生成盐和水
SiO2 + 2NaOH = Na2SiO3 +H2O
硅酸钠
高温
讨论:初中学过的酸性氧化物的通性包括哪些方面?(以CO2为例)
2.特性
与HF的反应
SiO2 + 4HF = SiF4↑+ 2H2O
此反应常用于雕刻玻璃
3.弱氧化性
高温
高温
高温
SiO2+ 2C = Si + 2CO↑
4.与某些盐反应
SiO2 + Na2CO3 = Na2SiO3+CO2↑
SiO2 + CaCO3 = CaSiO3+CO2↑
此两个反应用于工业制玻璃
1.为什么在实验室中盛放NaOH
溶液的试剂瓶用橡皮塞而不用玻璃塞?
答:玻璃中的SiO2 与NaOH 反应生成有粘胶性的硅酸钠
想一想
2.实验室为什么不用玻璃瓶盛装氢氟酸?
答:HF能腐蚀玻璃,因此,盛装氢氟酸不能用玻璃试剂瓶而要用塑料瓶。
3.某同学根据SiO2既可与碱反应,也能与氢氟酸反应,推断SiO2为两性氧化物.是否正确
二氧化碳 二氧化硅
化学式
化学式的意义
通常状况下的状态
硬度
水溶性
熔沸点
二氧化硅和二氧化碳的比较
CO2
SiO2
表示二氧化碳分子及其组成
表示二氧化硅晶体中硅氧原子个数比
气态
固态
很小
很大
可溶于水
不溶于水
很低
很高
二氧化碳 二氧化硅
稳定性
与水 反应
与碱性氧化物反应
与碱 反应
与HF 反应
高温
稳定
很稳定
CO2+H2O=H2CO3
不反应
CO2+CaO = CaCO3
SiO2+CaO = CaSiO3
CO2+2NaOH =
Na2CO3+H2O
SiO2+2NaOH =
Na2SiO3+H2O
不反应
SiO2+4HF =
SiF4↑+2H2O
化学性质
二氧化碳 二氧化硅
弱氧 化性
与碳 酸钠 等反 应
高温
SiO2 + Na2CO3 =
Na2SiO3 + CO2↑
SiO2 + CaCO3 =
CaSiO3 + CO2↑
高温
高温
CO2 + C = 2CO
高温
SiO2 + 2C =
Si + 2CO↑
CO2+H2O+Na2CO3
=2NaHCO3
CO2 +H2O+ CaCO3
= Ca(HCO3)2
现象
结论
反应式
实验:观察现象并填写下表
滴入酚酞溶液显红色,再滴入盐酸红色消失,并有透明胶状物质生成
Na2SiO3溶液呈碱性,与酸反应生成了H2SiO3
Na2SiO3 + 2HCl = H2SiO3↓ + 2NaCl
二.硅酸 (H2SiO3)
制备:
可溶性硅酸盐(如Na2SiO3)与酸反应
硅酸的酸性比盐酸弱,那么硅酸酸性与碳酸相比较如何呢?请你设计一个实验论证你的推断。
实验:将CO2通入Na2SiO3溶液中
现象:透明的硅酸凝胶生成
方程式:
Na2SiO3+H2O+CO2=H2SiO3 + Na2CO3
结论:
硅酸是一种很弱的酸,
酸性比碳酸还弱
不稳定,受热易分解
SiO32- + H2O + CO2= CO32- + H2SiO3↓
Na2SiO3 + H2O + CO2 = Na2CO3 + H2SiO3↓
SiO32- + 2H+ = H2SiO3↓
Na2SiO3 + 2HCl = 2NaCl + H2SiO3↓
H2SiO3 = H2O + SiO2
无机非金属主角—硅
硅的氧化物及硅酸盐构成了地壳中大部分的岩石、沙子和土壤、约占地壳总量的90%以上。
从原子角度认识硅原子
既不易失去电子,也不易得到电子,主要形成四价化合物.
C
Si
思考:
根据阅读想一想碳和硅在自然界中存在形式有所不同的原因是什么?
Si在地壳中含量丰富,仅次于O,约占26.3%
碳和硅都是亲氧元素但是硅的亲氧能力更强
Si无游离态
化合态:硅的氧化物和硅酸盐
水晶
玛瑙
结构:
四面体
每1个Si原子周围结合4个O原子,Si在中心,O在四个顶角.
同时每1个O原子周围结合2个Si原子相结合。
二氧化硅中氧原子与硅原子个数比为2:1,通常用SiO2来表示二氧化硅的组成.
水晶
玛瑙
由图片思考:二氧化硅具有哪些物理性质 化学稳定性如何 你的根据是什么 SiO2的这些性质是由什么决定的?
结构与性质的关系:SiO2的网状结构
物理性质:熔点高,硬度大的固体
不溶于水,纯净的SiO2晶体无色透明
化学性质:稳定(化学性质不活泼)
SiO2的化学性质(不活泼)
1.酸性氧化物
与碱性氧化物反应生成盐
SiO2+ CaO == CaSiO3
与强碱反应生成盐和水
SiO2 + 2NaOH = Na2SiO3 +H2O
硅酸钠
高温
讨论:初中学过的酸性氧化物的通性包括哪些方面?(以CO2为例)
2.特性
与HF的反应
SiO2 + 4HF = SiF4↑+ 2H2O
此反应常用于雕刻玻璃
3.弱氧化性
高温
高温
高温
SiO2+ 2C = Si + 2CO↑
4.与某些盐反应
SiO2 + Na2CO3 = Na2SiO3+CO2↑
SiO2 + CaCO3 = CaSiO3+CO2↑
此两个反应用于工业制玻璃
1.为什么在实验室中盛放NaOH
溶液的试剂瓶用橡皮塞而不用玻璃塞?
答:玻璃中的SiO2 与NaOH 反应生成有粘胶性的硅酸钠
想一想
2.实验室为什么不用玻璃瓶盛装氢氟酸?
答:HF能腐蚀玻璃,因此,盛装氢氟酸不能用玻璃试剂瓶而要用塑料瓶。
3.某同学根据SiO2既可与碱反应,也能与氢氟酸反应,推断SiO2为两性氧化物.是否正确
二氧化碳 二氧化硅
化学式
化学式的意义
通常状况下的状态
硬度
水溶性
熔沸点
二氧化硅和二氧化碳的比较
CO2
SiO2
表示二氧化碳分子及其组成
表示二氧化硅晶体中硅氧原子个数比
气态
固态
很小
很大
可溶于水
不溶于水
很低
很高
二氧化碳 二氧化硅
稳定性
与水 反应
与碱性氧化物反应
与碱 反应
与HF 反应
高温
稳定
很稳定
CO2+H2O=H2CO3
不反应
CO2+CaO = CaCO3
SiO2+CaO = CaSiO3
CO2+2NaOH =
Na2CO3+H2O
SiO2+2NaOH =
Na2SiO3+H2O
不反应
SiO2+4HF =
SiF4↑+2H2O
化学性质
二氧化碳 二氧化硅
弱氧 化性
与碳 酸钠 等反 应
高温
SiO2 + Na2CO3 =
Na2SiO3 + CO2↑
SiO2 + CaCO3 =
CaSiO3 + CO2↑
高温
高温
CO2 + C = 2CO
高温
SiO2 + 2C =
Si + 2CO↑
CO2+H2O+Na2CO3
=2NaHCO3
CO2 +H2O+ CaCO3
= Ca(HCO3)2
现象
结论
反应式
实验:观察现象并填写下表
滴入酚酞溶液显红色,再滴入盐酸红色消失,并有透明胶状物质生成
Na2SiO3溶液呈碱性,与酸反应生成了H2SiO3
Na2SiO3 + 2HCl = H2SiO3↓ + 2NaCl
二.硅酸 (H2SiO3)
制备:
可溶性硅酸盐(如Na2SiO3)与酸反应
硅酸的酸性比盐酸弱,那么硅酸酸性与碳酸相比较如何呢?请你设计一个实验论证你的推断。
实验:将CO2通入Na2SiO3溶液中
现象:透明的硅酸凝胶生成
方程式:
Na2SiO3+H2O+CO2=H2SiO3 + Na2CO3
结论:
硅酸是一种很弱的酸,
酸性比碳酸还弱
不稳定,受热易分解
SiO32- + H2O + CO2= CO32- + H2SiO3↓
Na2SiO3 + H2O + CO2 = Na2CO3 + H2SiO3↓
SiO32- + 2H+ = H2SiO3↓
Na2SiO3 + 2HCl = 2NaCl + H2SiO3↓
H2SiO3 = H2O + SiO2
