第四节:硫酸、硝酸和氨(课件)
文档属性
| 名称 | 第四节:硫酸、硝酸和氨(课件) |  | |
| 格式 | pptx | ||
| 文件大小 | 452.7KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-07-06 16:01:07 | ||
图片预览








文档简介
(共24张PPT)
硫酸、硝酸和氨
现象:
固体由蓝色变为灰白色,溶液仍为无色。
反应:
CuSO4·5H2O + H2SO4(浓)
= CuSO4 + H2SO4·5H2O
结论:
浓硫酸有吸水性
一、浓硫酸的特性 :
在点滴板中放入少量胆矾,再加入少量浓硫酸
1、吸水性
2、脱水性
把少量浓硫酸滴在纸片、火柴梗上
现象:
滴有浓硫酸的滤纸炭化变黑。
解释:
滤纸的主要成份是纤维素,由碳、氢、氧三种元素组成,浓硫酸能把滤纸中的氢、氧元素按水的比例脱去。
结论:
浓硫酸有脱水性
3、强氧化性
在试管中放入一块铜片,加热。用湿润的品红试纸检验放出的气体,把反应后的溶液倒在水中稀释。
现象:
加热能反应,产生的气体能使湿润的品红试纸褪色,溶液稀释后呈蓝色。
反应:
Cu + 2H2SO4(浓)
= CuSO4 + SO2 + 2H2O
结论:
浓硫酸有强氧化性
△
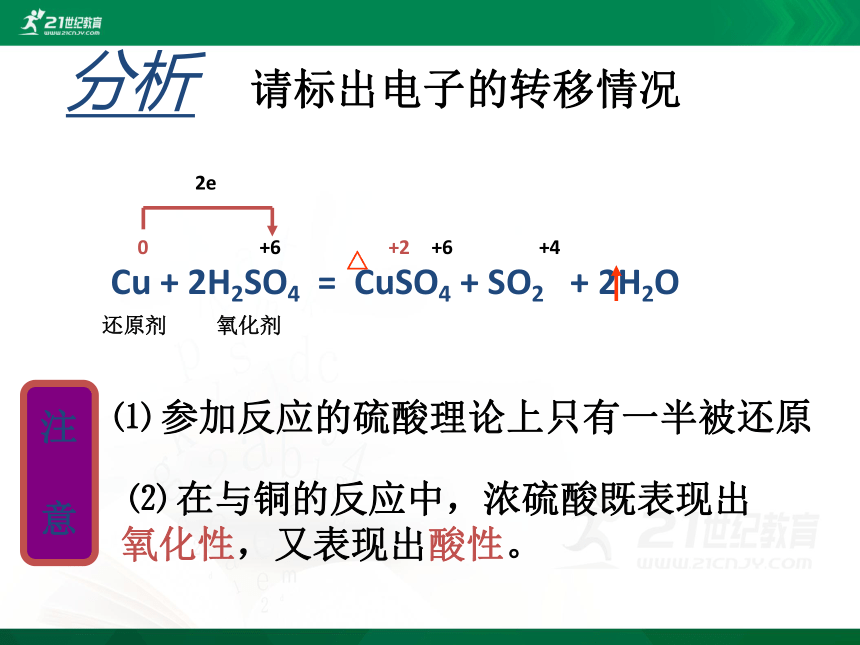
分析
Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O
△
0
+6
+6
+4
+2
还原剂
氧化剂
2e
注
意
⑴ 参加反应的硫酸理论上只有一半被还原
⑵ 在与铜的反应中,浓硫酸既表现出 氧化性,又表现出酸性。
请标出电子的转移情况
现象:
蔗糖变黑,体积膨胀,放出大量热,放出有刺激性气味的气体。
反应:
结论:
体现出浓硫酸的吸水性、脱水性和氧化性
C12H22O11 12C + 11H2O
浓硫酸
2H2SO4 (浓) + C
= CO2 + 2H2O + 2SO2
△
在烧杯中放入少量蔗糖,用少量水调成糊状,注入浓硫酸,用玻棒搅拌。
→
现象:
常温无明显变化,加热后能反应。
解释:
常温下,浓硫酸能使铁、铝等金属表面生成一层致密的氧化物保护膜,阻止内部金属继续跟硫酸起反应。此现象称 “钝化”。
4、钝化
总结
浓硫酸的特性
⑴ 吸水性
⑶ 强氧化性
① 加热时浓硫酸能与大多数金属反应,但不生成氢气。
常温下使铁铝钝化
⑵ 脱水性
Cu + 2H2SO4 (浓) = CuSO4 + SO2 + 2H2O
△
② 与某些非金属反应
C + 2H2SO4 (浓) = CO2 +2 SO2 + 2H2O
△
③ 与硫化氢、碘化氢等还原剂反应
H2S + H2SO4 (浓) = S + SO2 + 2H2O
硫酸用途
制过磷酸钙
电镀前去锈
制硫酸铵
制硫酸盐
制挥发性酸
精炼石油,制炸
药、农药、染料
Ca3(PO4)2 + 2H2SO4 = Ca(H2PO4)2 + 2CaSO4
释疑:稀硫酸的氧化性和浓硫酸的氧化性有何不同?
稀硫酸的氧化性是由电离出的H+引起的,
氢离子只能氧化金属活动顺序表中氢前的金属,
所以稀硫酸具有弱的氧化性。
浓硫酸的氧化性是由硫酸分子中+6价硫元素引起的,它可以氧化金属活动顺序表氢后的金属;
所以浓硫酸具有强的氧化性。
大多数金属(Pt、Au除外)都能被硝酸氧化,不活泼金属与硝酸反应,硝酸被还原为NO2或NO,活泼金属与硝酸反应,硝酸的还原产物很复杂。
二、硝酸的氧化性 (随浓度增大而增强)
性质见下表:
浓硫酸和硝酸的性质对比
浓H2SO4 HNO3
与Cu反应
钝化现象
与C反应
吸水性 脱水性
Cu+2H2SO4( 浓) =
CuSO4+SO2 +2H2O
△
使Fe、 Al 钝化
浓HNO3 使Fe, Al 钝化
Cu+4HNO3(浓) = Cu(NO3)2
+2NO2 +2H2O
3Cu+8HNO3(稀) = 3Cu(NO3)2+2NO +4H2O
2H2SO4(浓)+C =
CO2 +2H2O+2SO2
△
4HNO3(浓)+C = CO2 +4NO2 + 2H2O
△
有吸水性、脱水性
无
三、氨
物理性质 :
容易液化
分子式:
NH3
颜色:
密度:
气味:
水溶性:
无色
比空气小
有刺激性气味
极易溶于水(1:700)
(1) 氨与水的反应
氨的化学性质
NH3+H2O===NH3· H2O===NH4++OH-
氨水不稳定,受热会分解。
NH3· H2O = NH3 + H2O
△
演示实验:氨气溶于水的喷泉实验
实验现象:烧杯里的水由玻璃管进入烧瓶,形成喷泉,烧瓶内溶液呈红色。
结论:氨气易溶于水,生成了碱性物质。
氨水中存在哪些微粒?
想一想:
分子:
离子:
NH3 、H2O 、 NH3 · H2O
NH4+ 、 OH- 、 极少 H+
(2) 氨与酸反应生成铵盐
演示实验:使两根分别蘸有浓氨 水和浓盐酸的玻璃棒接近。
实验现象:两根玻璃棒靠近时产生大量白烟。
实验结论:这种白烟是氨水挥发出的NH3与浓盐酸挥发出的HCl化合生成的NH4Cl晶体。
NH3+HCl = NH4Cl
注意: 氨能与多种酸反应,生成铵盐。但只有与挥发性酸反应才有产生白烟的现象
请写出下列反应的化学方程式, 并推测反应的现象:
NH3+HNO3 = NH4NO3
2NH3+H2SO4 = (NH4)2SO4
3、铵盐的性质
(1)易溶于水,受热易分解
NH4Cl = NH3 + HCl
△
NH4HCO3 = NH3 + H2O + CO2
△
(2) 与碱反应放出氨气
NH4NO3+NaOH = NaNO3+H2O+NH3
△
产生的气体使湿润的红色石蕊试纸变蓝。
4、氨气的实验室制法
反应原理:利用氨盐与碱反应的性质 制取氨气
2NH4Cl+Ca(OH)2 = CaCl2+2NH3 +2H2O
△
收集方法:
向下排气法
验满方法:
将湿润的红色石蕊试纸放在试管口,如果试纸变蓝,说明氨气已集满。
环保措施:
用稀硫酸吸收多余的氨气。
干燥方法:
用碱石灰(NaOH和 CaO)干燥。
氨气的制备
发生装置与收集方法
基本原理
2NH4Cl+Ca(OH)2 = CaCl2+2H2O+2NH3
△
氨与酸的反应生成铵盐
铵盐的性质:
与碱反应放出氨气
都易溶于水
受热易分解
干燥剂的选择
选择酸性干燥剂(如浓硫酸和P2O5)
方法1、用湿润的红色石蕊试纸
方法2、用玻璃棒蘸取浓盐酸
检验
不宜
不宜
应选择碱性干燥剂(如碱石灰)
或中性干燥剂硅胶
,因为CaCl2会吸收NH3
(CaCl2+8NH3=CaCl2。8NH3)
选择无水CaCl2
氨的用途
性质特点
主要用途
易液化
作致冷剂
易溶于水
跟水反应
制氨水
跟酸反应
制氨肥(化肥)
决定
反映
硫酸、硝酸和氨
现象:
固体由蓝色变为灰白色,溶液仍为无色。
反应:
CuSO4·5H2O + H2SO4(浓)
= CuSO4 + H2SO4·5H2O
结论:
浓硫酸有吸水性
一、浓硫酸的特性 :
在点滴板中放入少量胆矾,再加入少量浓硫酸
1、吸水性
2、脱水性
把少量浓硫酸滴在纸片、火柴梗上
现象:
滴有浓硫酸的滤纸炭化变黑。
解释:
滤纸的主要成份是纤维素,由碳、氢、氧三种元素组成,浓硫酸能把滤纸中的氢、氧元素按水的比例脱去。
结论:
浓硫酸有脱水性
3、强氧化性
在试管中放入一块铜片,加热。用湿润的品红试纸检验放出的气体,把反应后的溶液倒在水中稀释。
现象:
加热能反应,产生的气体能使湿润的品红试纸褪色,溶液稀释后呈蓝色。
反应:
Cu + 2H2SO4(浓)
= CuSO4 + SO2 + 2H2O
结论:
浓硫酸有强氧化性
△
分析
Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O
△
0
+6
+6
+4
+2
还原剂
氧化剂
2e
注
意
⑴ 参加反应的硫酸理论上只有一半被还原
⑵ 在与铜的反应中,浓硫酸既表现出 氧化性,又表现出酸性。
请标出电子的转移情况
现象:
蔗糖变黑,体积膨胀,放出大量热,放出有刺激性气味的气体。
反应:
结论:
体现出浓硫酸的吸水性、脱水性和氧化性
C12H22O11 12C + 11H2O
浓硫酸
2H2SO4 (浓) + C
= CO2 + 2H2O + 2SO2
△
在烧杯中放入少量蔗糖,用少量水调成糊状,注入浓硫酸,用玻棒搅拌。
→
现象:
常温无明显变化,加热后能反应。
解释:
常温下,浓硫酸能使铁、铝等金属表面生成一层致密的氧化物保护膜,阻止内部金属继续跟硫酸起反应。此现象称 “钝化”。
4、钝化
总结
浓硫酸的特性
⑴ 吸水性
⑶ 强氧化性
① 加热时浓硫酸能与大多数金属反应,但不生成氢气。
常温下使铁铝钝化
⑵ 脱水性
Cu + 2H2SO4 (浓) = CuSO4 + SO2 + 2H2O
△
② 与某些非金属反应
C + 2H2SO4 (浓) = CO2 +2 SO2 + 2H2O
△
③ 与硫化氢、碘化氢等还原剂反应
H2S + H2SO4 (浓) = S + SO2 + 2H2O
硫酸用途
制过磷酸钙
电镀前去锈
制硫酸铵
制硫酸盐
制挥发性酸
精炼石油,制炸
药、农药、染料
Ca3(PO4)2 + 2H2SO4 = Ca(H2PO4)2 + 2CaSO4
释疑:稀硫酸的氧化性和浓硫酸的氧化性有何不同?
稀硫酸的氧化性是由电离出的H+引起的,
氢离子只能氧化金属活动顺序表中氢前的金属,
所以稀硫酸具有弱的氧化性。
浓硫酸的氧化性是由硫酸分子中+6价硫元素引起的,它可以氧化金属活动顺序表氢后的金属;
所以浓硫酸具有强的氧化性。
大多数金属(Pt、Au除外)都能被硝酸氧化,不活泼金属与硝酸反应,硝酸被还原为NO2或NO,活泼金属与硝酸反应,硝酸的还原产物很复杂。
二、硝酸的氧化性 (随浓度增大而增强)
性质见下表:
浓硫酸和硝酸的性质对比
浓H2SO4 HNO3
与Cu反应
钝化现象
与C反应
吸水性 脱水性
Cu+2H2SO4( 浓) =
CuSO4+SO2 +2H2O
△
使Fe、 Al 钝化
浓HNO3 使Fe, Al 钝化
Cu+4HNO3(浓) = Cu(NO3)2
+2NO2 +2H2O
3Cu+8HNO3(稀) = 3Cu(NO3)2+2NO +4H2O
2H2SO4(浓)+C =
CO2 +2H2O+2SO2
△
4HNO3(浓)+C = CO2 +4NO2 + 2H2O
△
有吸水性、脱水性
无
三、氨
物理性质 :
容易液化
分子式:
NH3
颜色:
密度:
气味:
水溶性:
无色
比空气小
有刺激性气味
极易溶于水(1:700)
(1) 氨与水的反应
氨的化学性质
NH3+H2O===NH3· H2O===NH4++OH-
氨水不稳定,受热会分解。
NH3· H2O = NH3 + H2O
△
演示实验:氨气溶于水的喷泉实验
实验现象:烧杯里的水由玻璃管进入烧瓶,形成喷泉,烧瓶内溶液呈红色。
结论:氨气易溶于水,生成了碱性物质。
氨水中存在哪些微粒?
想一想:
分子:
离子:
NH3 、H2O 、 NH3 · H2O
NH4+ 、 OH- 、 极少 H+
(2) 氨与酸反应生成铵盐
演示实验:使两根分别蘸有浓氨 水和浓盐酸的玻璃棒接近。
实验现象:两根玻璃棒靠近时产生大量白烟。
实验结论:这种白烟是氨水挥发出的NH3与浓盐酸挥发出的HCl化合生成的NH4Cl晶体。
NH3+HCl = NH4Cl
注意: 氨能与多种酸反应,生成铵盐。但只有与挥发性酸反应才有产生白烟的现象
请写出下列反应的化学方程式, 并推测反应的现象:
NH3+HNO3 = NH4NO3
2NH3+H2SO4 = (NH4)2SO4
3、铵盐的性质
(1)易溶于水,受热易分解
NH4Cl = NH3 + HCl
△
NH4HCO3 = NH3 + H2O + CO2
△
(2) 与碱反应放出氨气
NH4NO3+NaOH = NaNO3+H2O+NH3
△
产生的气体使湿润的红色石蕊试纸变蓝。
4、氨气的实验室制法
反应原理:利用氨盐与碱反应的性质 制取氨气
2NH4Cl+Ca(OH)2 = CaCl2+2NH3 +2H2O
△
收集方法:
向下排气法
验满方法:
将湿润的红色石蕊试纸放在试管口,如果试纸变蓝,说明氨气已集满。
环保措施:
用稀硫酸吸收多余的氨气。
干燥方法:
用碱石灰(NaOH和 CaO)干燥。
氨气的制备
发生装置与收集方法
基本原理
2NH4Cl+Ca(OH)2 = CaCl2+2H2O+2NH3
△
氨与酸的反应生成铵盐
铵盐的性质:
与碱反应放出氨气
都易溶于水
受热易分解
干燥剂的选择
选择酸性干燥剂(如浓硫酸和P2O5)
方法1、用湿润的红色石蕊试纸
方法2、用玻璃棒蘸取浓盐酸
检验
不宜
不宜
应选择碱性干燥剂(如碱石灰)
或中性干燥剂硅胶
,因为CaCl2会吸收NH3
(CaCl2+8NH3=CaCl2。8NH3)
选择无水CaCl2
氨的用途
性质特点
主要用途
易液化
作致冷剂
易溶于水
跟水反应
制氨水
跟酸反应
制氨肥(化肥)
决定
反映
