河南省周口市2024-2025学年高二下学期期末考试 化学试卷(含答案)
文档属性
| 名称 | 河南省周口市2024-2025学年高二下学期期末考试 化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 724.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-11 20:37:04 | ||
图片预览


文档简介
河南省周口市 2024-2025 学年高二下学期期末
化学试题
一、单选题
神舟二十号载人飞船瞄准北京时间 4 月 24 日 17 时 17 分发射。航天员陈冬、陈中瑞和王杰执行此次载人飞行任务。关于航天材料,下列叙述错误的是
硬铝密度小、硬度大,属于金属材料 B.棉花、羊毛等天然纤维常用作航天服内层的保暖舒适材料 C.光学石英玻璃材料的主要成分二氧化硅属于共价晶体 D.再生纤维强度高、弹性好,是航天器的常用外壳结构材料
下列化学用语或图示表示正确的是
乙醚的实验式: C2 H6O
苯分子中的大π 键示意图:
用电子式表示 HCl 的形成过程:
铅酸蓄电池充电时的阳极反应式: PbSO 2e 2H O PbO SO2 4H
4 2 2 4
高分子材料在生活中应用十分广泛。下列说法错误的是
聚乳酸 塑料可发生降解
聚乙炔在掺杂状态下具有较高的电导率,其链节为—CH—CH—
高分子材料 的单体具有亲水性
苯酚和 40%甲醛溶液在酸化作用下生成酚醛树脂
设 NA 表示阿伏加德罗常数的值。下列说法正确的是
1L1mol L 1Na S 溶液中阴阳离子总数小于3N
常温下,17gNH3 中含有的价电子总数为10NA
Na2O2 与水反应生成 32g 氧气时,转移的电子数为2NA
2molSO2 和1molO2 在密闭容器中混合后充分反应,生成SO3 的分子数为2NA
下列过程对应的离子方程式书写正确的是 A.向氯化亚铁溶液中滴加氯水: Fe2 Cl Fe3 2Cl
B.铜与浓硝酸反应: Cu 2NO 4H Cu2 2NO 2H O
3 2 2
C.将Cl 通入冷的石灰乳中制漂白粉: Cl 2OH Cl ClO H O
D.向Na Al OH 溶液中加入过量的盐酸: Al OH H Al OH H O
4
4 3 2
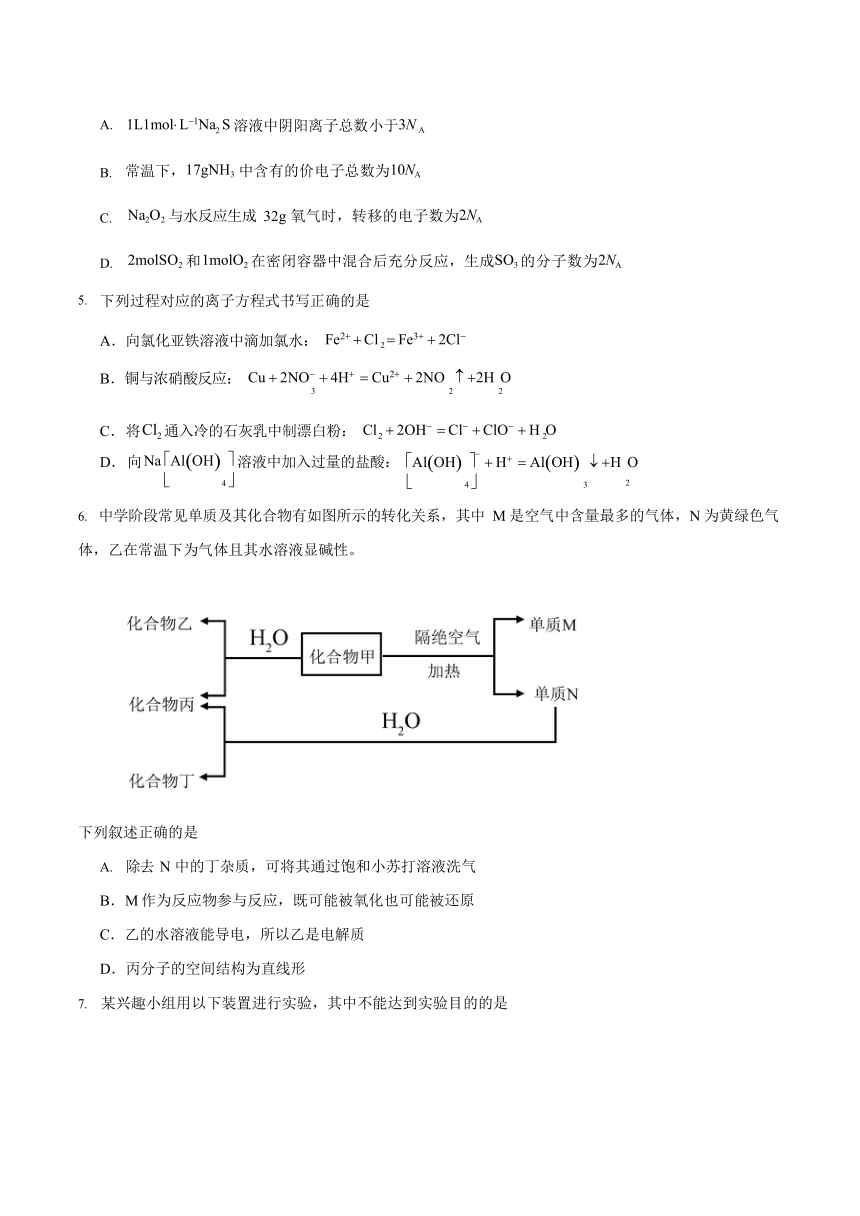
中学阶段常见单质及其化合物有如图所示的转化关系,其中 M 是空气中含量最多的气体,N 为黄绿色气体,乙在常温下为气体且其水溶液显碱性。
下列叙述正确的是
除去 N 中的丁杂质,可将其通过饱和小苏打溶液洗气
B.M 作为反应物参与反应,既可能被氧化也可能被还原 C.乙的水溶液能导电,所以乙是电解质 D.丙分子的空间结构为直线形
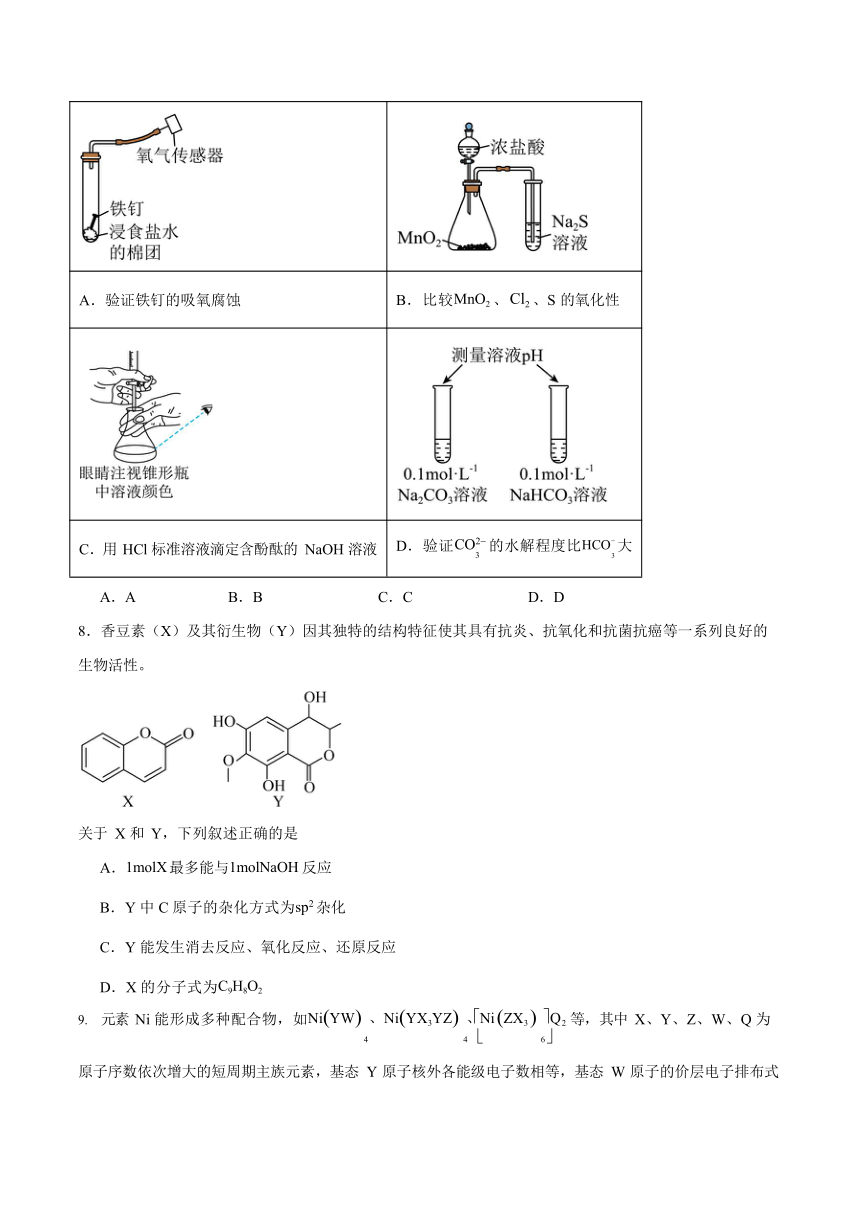
某兴趣小组用以下装置进行实验,其中不能达到实验目的的是
A.验证铁钉的吸氧腐蚀 B.比较MnO2 、Cl2 、S 的氧化性
C.用 HCl 标准溶液滴定含酚酞的 NaOH 溶液 D.验证CO2 的水解程度比HCO 大 3 3
A.A B.B C.C D.D 8.香豆素(X)及其衍生物(Y)因其独特的结构特征使其具有抗炎、抗氧化和抗菌抗癌等一系列良好的生物活性。
关于 X 和 Y,下列叙述正确的是 A.1molX 最多能与1molNaOH 反应
B.Y 中 C 原子的杂化方式为sp2 杂化
C.Y 能发生消去反应、氧化反应、还原反应
D.X 的分子式为C9H8O2
元素 Ni 能形成多种配合物,如Ni YW 、Ni YX3YZ 、 Ni ZX3 Q2 等,其中 X、Y、Z、W、Q 为
4 4 6
原子序数依次增大的短周期主族元素,基态 Y 原子核外各能级电子数相等,基态 W 原子的价层电子排布式
为nsnnp2n ,Q 的最高价氧化物对应水化物是一元酸。下列叙述正确的是
第一电离能: W Z Y
B.Y 的氢化物一定不能被酸性高锰酸钾溶液氧化
C.配体YX3YZ 中σ 键与π 键数目之比为5 : 2
D. Ni ZX3 Q2 中存在的化学键有离子键、配位键、共价键、氢键
6
工业上可通过羰基硫(COS)与水蒸气在一定条件下反应制备H2S ,反应的原理为
COS g H2O g CO2 g H2S g H 0 。一定条件下发生该反应,测得 COS(g)的平衡转化率与
n COS
起始投料比 n H O [ n COS n H2O 为定值]的关系如图所示,图中各点对应的反应温度可能相同,也可
2
能不同。
下列叙述错误的是
对 e 点平衡体系适当降低温度,可使 COS 的平衡转化率增大至 50%
若 a、e 两点对应的反应温度分别为Ta 和Te ,则Ta Te
b、c 两点对应的反应速率vb正、vc逆 ,则vb正>vc逆
图中 a 点条件下反应的平衡常数K 1
6
根据下列实验操作、现象得到的解释或结论正确的是
选项 实验操作 现象 解释或结论
A 向FeCl3 溶液中滴加淀粉碘化钾溶液 溶液变 氧化性: Fe3 I 2
蓝
B 向溶有SO2 的BaCl2 溶液中通入气体 X 出现白色沉淀 X 具有强氧化性
C 向脱脂棉上滴加蒸馏水和浓硫酸,反应后再滴入少量新制氢氧化铜并加热 无砖红色沉淀产生 纤维素水解产物中无醛基
D 向盛有4mL0.1mol L 1CuSO 溶液的试管中滴加1mol L 1 的氨水, 4 得到深蓝色的透明溶液,再向试管中加入 8mL95%乙醇,并用玻璃棒摩擦试管壁 得到深蓝色晶体 玻璃棒摩擦试管壁有利于晶核形成,加速结晶
A.A B.B C.C D.D
用电解法制备 2-氯环己醇的工作原理如图所示:
下列叙述正确的是
A.H+由 N 极移向 M 极
B.N 极电势高于 M 极电势
C.外电路中转移 2 mol 电子,一定生成 1 mol2-氯环己醇 D.从有机基本反应类型看,环己烯与 HClO 的反应类型属于加成反应
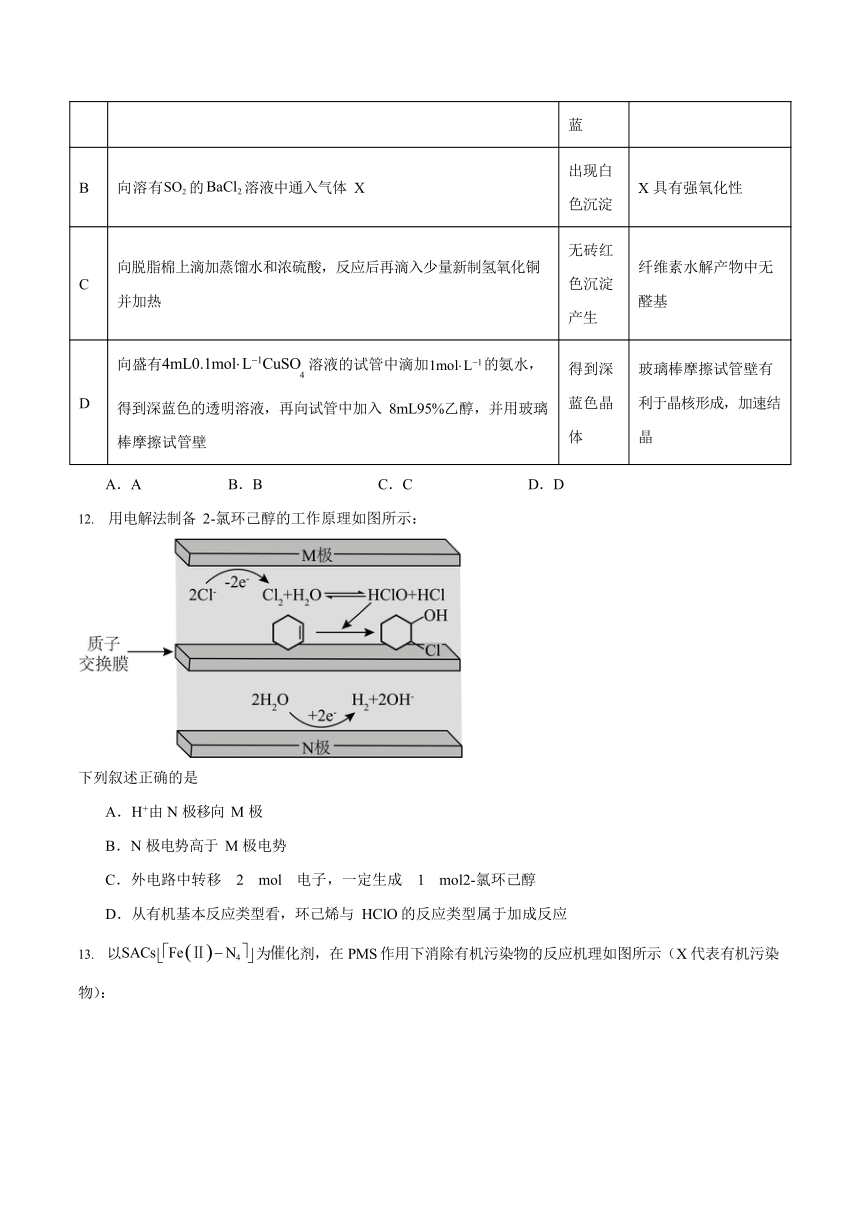
以SACs Fe Ⅱ N4 为化剂,在 PMS 作用下消除有机污染物的反应机理如图所示(X 代表有机污染物):
下列叙述错误的是
A.PMS 具有强氧化性,与其含有—O—O—结构有关
B.SACs 改变了总反应的活化能和焓变
C.在HSO 中,中心硫原子的杂化类型为sp3
D. 为中间产物
已知:常温下,两种可溶性一元有机弱碱 AOH、BOH 的电离常数Kb AOH Kb BOH 。常温下,调节浓度均为0.1mol L 1AOH 、BOH 混合溶液的 pH,溶液中含 A 或 B 物种的分布系数变化关系如图所示[如
n A n AOH n A
下列叙述正确的是
L1 代表δ AOH 随 pH 的变化
Kb AOH 的数量级为10 6 C.当混合溶液显中性时, c BOH c AOH c A c B
D.浓度均为0.1mol L 1 的 ACl、BCl 混合溶液中: 2c H c AOH c BOH 2c OH
二、解答题
乙酸异戊酯俗称香蕉水,主要用于调味、制革、人造丝、胶片和纺织品等加工工业。实验室可通过酯化反应制备,数据如下表:
酯化反应制粗酯:在 25mL 两颈烧瓶中加入 5.4mL 异戊醇和 6.4mL 冰醋酸,摇动下慢慢加入 1.3mL 浓硫酸,混匀后加入几粒沸石,缓慢加入 3mL 环己烷,按图示安装带分水器和冷凝器的反应装置,并在分水器中预先加入水,使液面略低于分水器的支管口,通入冷却水,控制温度为 69~81℃,回流 1h。
粗酯的提纯:反应物冷却至室温,转入分液漏斗,用 15mL 冷水洗涤两颈烧瓶,洗液合并至分液漏斗,摇振后静置,分出水相,有机相用 8mL5%碳酸氢钠溶液洗涤两次,再用水洗后转入锥形瓶,加入 0.8g 无水
MgSO4 ,过滤后将滤液转入蒸馏烧瓶,蒸馏,收集 138~142℃馏分。
回答下列问题:
冷却水应从 a 口通入,原因是 (填一条)。
分水器的基本工作原理:溶剂环己烷和反应中生成的水形成二元共沸物,沸腾时二者共同蒸出,经冷凝后落入分水器中。若实验中未使用分水器,可能导致乙酸异戊酯产率 (填“偏高”“偏低”或“不变”),其
原因是 ;分水器的另一重要用途是观察和控制反应进度,当观察到 现象时,说明酯化反应已基本
完成。
摇振后静置,先分出下层水相,再从 有机相(填“下口放出”或“上口倒出”);用碳酸氢钠溶液洗涤有
机相的目的是 。
实验中加入无水MgSO4 的作用是 。
甲同学设计出如图所示装置进行蒸馏操作,乙同学认为该装置中有 3 处错误需要改正后才能进行实验(加热及夹持装置略)。
观察装置,写出改正方法: 、 、 。
Fe3O4 @ TiO2 是一种高效非贵金属光/热化剂,以FeCl2 为原料制备Fe3O4 @ TiO2 的工艺流程如图所示:
已知:25℃时, K
Fe OH 4.9 10 17 、K
Fe OH 2.8 10 39 、K
Ca OH 5.0 10 6 。回答
sp 2
sp 3
sp 2
下列问题:
实验室在配制FeCl2 溶液时为避免其被氧化,需加入适量 (填物质名称)。
实验室按如图所示装置进行“加压过滤”。
气体 X 可能是 (填“空气”或“氮气”),该步操作采用“加压过滤”而不是“常压过滤”的优点是 。
反应釜 2 中总反应的离子方程式为 。
进入反应釜 1、反应釜 2 中FeCl2 的物质的量理论比值为 。
反应釜 3 中,25℃下Ca2 浓度为1.25mol L 1 时,理论上 pH 应小于 (已知lg2 0.3 )。
将滤液经“一系列”操作可获得副产物CaCl2 水合物,该操作包括 、过滤。
乙烯酮( CH2 C O ,简写为CH2CO)是一种重要的有机中间体,有两种制备途径:
反应ⅰ: CH COCH g CH CO g CH g
H 84kJ mol 1
3 3 2 4
反应ⅱ: CH3COOH g CH2CO g H2O g
1
H 143kJ mol 1
回答下列问题:
已知C C 键的键能为612kJ mol 1 ,则 C—C 键的键能为 kJ mol 1 。
CH3COCH3 (g) H2O(g) CH4 (g) CH3COOH(g)
ΔH3 = kJ mol 1 。
T℃条件下,维持总压 36kPa 不变,向真空密闭容器中加入1molCH3COCH3 g 和2molH2O g ,仅发生反应ⅰ和反应ⅱ,达到平衡状态时,测得平衡体系中有0.8molCH4 g 和0.2molCH3COOH g 。
①反应ⅰ在 (填“高温”或“低温”)条件下能自发进行。
② T℃条件下,维持总压 36kPa 不变时, CH3COOH g CH2CO g H2O g 的平衡常数K p kPa
( Kp 为用分压表示的平衡常数,分压=总压×物质的量分数)。
通过乙酸晶体 X 射线衍射实验可以得出乙酸晶胞的结构如图所示。
①已知NA 为阿伏加德罗常数的值,则乙酸晶体的密度ρ g cm 3 用含 a、b、c、 NA 的代数式表示)。
② CH3COOH、CH2ClCOOH、CHCl2COOH 的酸性由强到弱的顺序为 ,其原因是 。
氯雷他定是第二代抗组胺药,用于皮肤疾病(湿疹、过敏性皮炎等)治疗,部分合成路线如图所示:
已知:—Et 代表 C2H5 、 Me 代表 CH3 。回答下列问题:
A 的化学名称为 。
C 中含氧官能团的名称为 。
指出反应类型:A→B: 、D→E: 。
反应 E→F 有能使品红溶液褪色的气体生成,且该反应要在无水条件下进行,写出该反应的化学方程式: 。
同等条件下, CH3 NH2 与NH3 相比, CH3 NH2 更容易结合H ,原因是 。
F 的同分异构体中,同时满足下列条件的有 种(不考虑立体异构);其中,核磁共振氢谱显示有四组峰且峰面积之比为1:1: 2 : 2 的结构简式为 。
①含有( )碳氮骨架结构(R 为氢原子或其他基团)②含 CH2Cl
B→C 的反应被称为狄克曼缩合反应(分子中的两个酯基被四个或四个以上的碳原子隔开,就发生分子内
的缩合反应,形成五元环或更大环内酯的环化酯缩合反应)。写出 发生狄克曼缩合反
应所得环内酯产物的结构简式: 。
参考答案
1.D
2.D
3.B
4.C
5.B
6.B
7.B
8.C
9.C
10.A
11.D
12.D
13.B
14.C
15.(1)冷却水能充满冷凝管,冷凝效果更好(合理即可)
偏低 分水器能及时分离出反应生成的水,有利于平衡正向移动(合理即可) 分水器中水层液面的高度不再变化(合理即可)
上口倒出 除去醋酸和硫酸
作干燥剂
温度计的水银球应置于支管口处 应选用直形冷凝管 去掉锥形瓶上面的橡胶塞
16.(1)铁粉
氮气 过滤速度快,固液分离彻底(合理即可)
4CaO 6H O 4Fe2 O 4Fe OH 4Ca2
1: 2
11.3
加热浓缩、冷却结晶 17.(1)348
(2) 59
(3) 高温 54
(4)
2.4
abcNA
1023
CHCl2COOH CH2ClCOOH CH3COOH
氯原子是吸电子基,甲基是推电
子基,故二氯乙酸的羧基中的羟基极性最大,最易电离出H ,乙酸的羧基中的羟基极性最小,最难电离出
H
18.(1)丙烯酸乙酯
酮羰基(羰基)、酯基
加成反应 还原反应
甲基属于推电子基团,导致CH3 NH2 分子中氮原子上的电子云密度更大,结合H 时更容易给出孤电子对
(合理即可)
(6) 15
化学试题
一、单选题
神舟二十号载人飞船瞄准北京时间 4 月 24 日 17 时 17 分发射。航天员陈冬、陈中瑞和王杰执行此次载人飞行任务。关于航天材料,下列叙述错误的是
硬铝密度小、硬度大,属于金属材料 B.棉花、羊毛等天然纤维常用作航天服内层的保暖舒适材料 C.光学石英玻璃材料的主要成分二氧化硅属于共价晶体 D.再生纤维强度高、弹性好,是航天器的常用外壳结构材料
下列化学用语或图示表示正确的是
乙醚的实验式: C2 H6O
苯分子中的大π 键示意图:
用电子式表示 HCl 的形成过程:
铅酸蓄电池充电时的阳极反应式: PbSO 2e 2H O PbO SO2 4H
4 2 2 4
高分子材料在生活中应用十分广泛。下列说法错误的是
聚乳酸 塑料可发生降解
聚乙炔在掺杂状态下具有较高的电导率,其链节为—CH—CH—
高分子材料 的单体具有亲水性
苯酚和 40%甲醛溶液在酸化作用下生成酚醛树脂
设 NA 表示阿伏加德罗常数的值。下列说法正确的是
1L1mol L 1Na S 溶液中阴阳离子总数小于3N
常温下,17gNH3 中含有的价电子总数为10NA
Na2O2 与水反应生成 32g 氧气时,转移的电子数为2NA
2molSO2 和1molO2 在密闭容器中混合后充分反应,生成SO3 的分子数为2NA
下列过程对应的离子方程式书写正确的是 A.向氯化亚铁溶液中滴加氯水: Fe2 Cl Fe3 2Cl
B.铜与浓硝酸反应: Cu 2NO 4H Cu2 2NO 2H O
3 2 2
C.将Cl 通入冷的石灰乳中制漂白粉: Cl 2OH Cl ClO H O
D.向Na Al OH 溶液中加入过量的盐酸: Al OH H Al OH H O
4
4 3 2
中学阶段常见单质及其化合物有如图所示的转化关系,其中 M 是空气中含量最多的气体,N 为黄绿色气体,乙在常温下为气体且其水溶液显碱性。
下列叙述正确的是
除去 N 中的丁杂质,可将其通过饱和小苏打溶液洗气
B.M 作为反应物参与反应,既可能被氧化也可能被还原 C.乙的水溶液能导电,所以乙是电解质 D.丙分子的空间结构为直线形
某兴趣小组用以下装置进行实验,其中不能达到实验目的的是
A.验证铁钉的吸氧腐蚀 B.比较MnO2 、Cl2 、S 的氧化性
C.用 HCl 标准溶液滴定含酚酞的 NaOH 溶液 D.验证CO2 的水解程度比HCO 大 3 3
A.A B.B C.C D.D 8.香豆素(X)及其衍生物(Y)因其独特的结构特征使其具有抗炎、抗氧化和抗菌抗癌等一系列良好的生物活性。
关于 X 和 Y,下列叙述正确的是 A.1molX 最多能与1molNaOH 反应
B.Y 中 C 原子的杂化方式为sp2 杂化
C.Y 能发生消去反应、氧化反应、还原反应
D.X 的分子式为C9H8O2
元素 Ni 能形成多种配合物,如Ni YW 、Ni YX3YZ 、 Ni ZX3 Q2 等,其中 X、Y、Z、W、Q 为
4 4 6
原子序数依次增大的短周期主族元素,基态 Y 原子核外各能级电子数相等,基态 W 原子的价层电子排布式
为nsnnp2n ,Q 的最高价氧化物对应水化物是一元酸。下列叙述正确的是
第一电离能: W Z Y
B.Y 的氢化物一定不能被酸性高锰酸钾溶液氧化
C.配体YX3YZ 中σ 键与π 键数目之比为5 : 2
D. Ni ZX3 Q2 中存在的化学键有离子键、配位键、共价键、氢键
6
工业上可通过羰基硫(COS)与水蒸气在一定条件下反应制备H2S ,反应的原理为
COS g H2O g CO2 g H2S g H 0 。一定条件下发生该反应,测得 COS(g)的平衡转化率与
n COS
起始投料比 n H O [ n COS n H2O 为定值]的关系如图所示,图中各点对应的反应温度可能相同,也可
2
能不同。
下列叙述错误的是
对 e 点平衡体系适当降低温度,可使 COS 的平衡转化率增大至 50%
若 a、e 两点对应的反应温度分别为Ta 和Te ,则Ta Te
b、c 两点对应的反应速率vb正、vc逆 ,则vb正>vc逆
图中 a 点条件下反应的平衡常数K 1
6
根据下列实验操作、现象得到的解释或结论正确的是
选项 实验操作 现象 解释或结论
A 向FeCl3 溶液中滴加淀粉碘化钾溶液 溶液变 氧化性: Fe3 I 2
蓝
B 向溶有SO2 的BaCl2 溶液中通入气体 X 出现白色沉淀 X 具有强氧化性
C 向脱脂棉上滴加蒸馏水和浓硫酸,反应后再滴入少量新制氢氧化铜并加热 无砖红色沉淀产生 纤维素水解产物中无醛基
D 向盛有4mL0.1mol L 1CuSO 溶液的试管中滴加1mol L 1 的氨水, 4 得到深蓝色的透明溶液,再向试管中加入 8mL95%乙醇,并用玻璃棒摩擦试管壁 得到深蓝色晶体 玻璃棒摩擦试管壁有利于晶核形成,加速结晶
A.A B.B C.C D.D
用电解法制备 2-氯环己醇的工作原理如图所示:
下列叙述正确的是
A.H+由 N 极移向 M 极
B.N 极电势高于 M 极电势
C.外电路中转移 2 mol 电子,一定生成 1 mol2-氯环己醇 D.从有机基本反应类型看,环己烯与 HClO 的反应类型属于加成反应
以SACs Fe Ⅱ N4 为化剂,在 PMS 作用下消除有机污染物的反应机理如图所示(X 代表有机污染物):
下列叙述错误的是
A.PMS 具有强氧化性,与其含有—O—O—结构有关
B.SACs 改变了总反应的活化能和焓变
C.在HSO 中,中心硫原子的杂化类型为sp3
D. 为中间产物
已知:常温下,两种可溶性一元有机弱碱 AOH、BOH 的电离常数Kb AOH Kb BOH 。常温下,调节浓度均为0.1mol L 1AOH 、BOH 混合溶液的 pH,溶液中含 A 或 B 物种的分布系数变化关系如图所示[如
n A n AOH n A
下列叙述正确的是
L1 代表δ AOH 随 pH 的变化
Kb AOH 的数量级为10 6 C.当混合溶液显中性时, c BOH c AOH c A c B
D.浓度均为0.1mol L 1 的 ACl、BCl 混合溶液中: 2c H c AOH c BOH 2c OH
二、解答题
乙酸异戊酯俗称香蕉水,主要用于调味、制革、人造丝、胶片和纺织品等加工工业。实验室可通过酯化反应制备,数据如下表:
酯化反应制粗酯:在 25mL 两颈烧瓶中加入 5.4mL 异戊醇和 6.4mL 冰醋酸,摇动下慢慢加入 1.3mL 浓硫酸,混匀后加入几粒沸石,缓慢加入 3mL 环己烷,按图示安装带分水器和冷凝器的反应装置,并在分水器中预先加入水,使液面略低于分水器的支管口,通入冷却水,控制温度为 69~81℃,回流 1h。
粗酯的提纯:反应物冷却至室温,转入分液漏斗,用 15mL 冷水洗涤两颈烧瓶,洗液合并至分液漏斗,摇振后静置,分出水相,有机相用 8mL5%碳酸氢钠溶液洗涤两次,再用水洗后转入锥形瓶,加入 0.8g 无水
MgSO4 ,过滤后将滤液转入蒸馏烧瓶,蒸馏,收集 138~142℃馏分。
回答下列问题:
冷却水应从 a 口通入,原因是 (填一条)。
分水器的基本工作原理:溶剂环己烷和反应中生成的水形成二元共沸物,沸腾时二者共同蒸出,经冷凝后落入分水器中。若实验中未使用分水器,可能导致乙酸异戊酯产率 (填“偏高”“偏低”或“不变”),其
原因是 ;分水器的另一重要用途是观察和控制反应进度,当观察到 现象时,说明酯化反应已基本
完成。
摇振后静置,先分出下层水相,再从 有机相(填“下口放出”或“上口倒出”);用碳酸氢钠溶液洗涤有
机相的目的是 。
实验中加入无水MgSO4 的作用是 。
甲同学设计出如图所示装置进行蒸馏操作,乙同学认为该装置中有 3 处错误需要改正后才能进行实验(加热及夹持装置略)。
观察装置,写出改正方法: 、 、 。
Fe3O4 @ TiO2 是一种高效非贵金属光/热化剂,以FeCl2 为原料制备Fe3O4 @ TiO2 的工艺流程如图所示:
已知:25℃时, K
Fe OH 4.9 10 17 、K
Fe OH 2.8 10 39 、K
Ca OH 5.0 10 6 。回答
sp 2
sp 3
sp 2
下列问题:
实验室在配制FeCl2 溶液时为避免其被氧化,需加入适量 (填物质名称)。
实验室按如图所示装置进行“加压过滤”。
气体 X 可能是 (填“空气”或“氮气”),该步操作采用“加压过滤”而不是“常压过滤”的优点是 。
反应釜 2 中总反应的离子方程式为 。
进入反应釜 1、反应釜 2 中FeCl2 的物质的量理论比值为 。
反应釜 3 中,25℃下Ca2 浓度为1.25mol L 1 时,理论上 pH 应小于 (已知lg2 0.3 )。
将滤液经“一系列”操作可获得副产物CaCl2 水合物,该操作包括 、过滤。
乙烯酮( CH2 C O ,简写为CH2CO)是一种重要的有机中间体,有两种制备途径:
反应ⅰ: CH COCH g CH CO g CH g
H 84kJ mol 1
3 3 2 4
反应ⅱ: CH3COOH g CH2CO g H2O g
1
H 143kJ mol 1
回答下列问题:
已知C C 键的键能为612kJ mol 1 ,则 C—C 键的键能为 kJ mol 1 。
CH3COCH3 (g) H2O(g) CH4 (g) CH3COOH(g)
ΔH3 = kJ mol 1 。
T℃条件下,维持总压 36kPa 不变,向真空密闭容器中加入1molCH3COCH3 g 和2molH2O g ,仅发生反应ⅰ和反应ⅱ,达到平衡状态时,测得平衡体系中有0.8molCH4 g 和0.2molCH3COOH g 。
①反应ⅰ在 (填“高温”或“低温”)条件下能自发进行。
② T℃条件下,维持总压 36kPa 不变时, CH3COOH g CH2CO g H2O g 的平衡常数K p kPa
( Kp 为用分压表示的平衡常数,分压=总压×物质的量分数)。
通过乙酸晶体 X 射线衍射实验可以得出乙酸晶胞的结构如图所示。
①已知NA 为阿伏加德罗常数的值,则乙酸晶体的密度ρ g cm 3 用含 a、b、c、 NA 的代数式表示)。
② CH3COOH、CH2ClCOOH、CHCl2COOH 的酸性由强到弱的顺序为 ,其原因是 。
氯雷他定是第二代抗组胺药,用于皮肤疾病(湿疹、过敏性皮炎等)治疗,部分合成路线如图所示:
已知:—Et 代表 C2H5 、 Me 代表 CH3 。回答下列问题:
A 的化学名称为 。
C 中含氧官能团的名称为 。
指出反应类型:A→B: 、D→E: 。
反应 E→F 有能使品红溶液褪色的气体生成,且该反应要在无水条件下进行,写出该反应的化学方程式: 。
同等条件下, CH3 NH2 与NH3 相比, CH3 NH2 更容易结合H ,原因是 。
F 的同分异构体中,同时满足下列条件的有 种(不考虑立体异构);其中,核磁共振氢谱显示有四组峰且峰面积之比为1:1: 2 : 2 的结构简式为 。
①含有( )碳氮骨架结构(R 为氢原子或其他基团)②含 CH2Cl
B→C 的反应被称为狄克曼缩合反应(分子中的两个酯基被四个或四个以上的碳原子隔开,就发生分子内
的缩合反应,形成五元环或更大环内酯的环化酯缩合反应)。写出 发生狄克曼缩合反
应所得环内酯产物的结构简式: 。
参考答案
1.D
2.D
3.B
4.C
5.B
6.B
7.B
8.C
9.C
10.A
11.D
12.D
13.B
14.C
15.(1)冷却水能充满冷凝管,冷凝效果更好(合理即可)
偏低 分水器能及时分离出反应生成的水,有利于平衡正向移动(合理即可) 分水器中水层液面的高度不再变化(合理即可)
上口倒出 除去醋酸和硫酸
作干燥剂
温度计的水银球应置于支管口处 应选用直形冷凝管 去掉锥形瓶上面的橡胶塞
16.(1)铁粉
氮气 过滤速度快,固液分离彻底(合理即可)
4CaO 6H O 4Fe2 O 4Fe OH 4Ca2
1: 2
11.3
加热浓缩、冷却结晶 17.(1)348
(2) 59
(3) 高温 54
(4)
2.4
abcNA
1023
CHCl2COOH CH2ClCOOH CH3COOH
氯原子是吸电子基,甲基是推电
子基,故二氯乙酸的羧基中的羟基极性最大,最易电离出H ,乙酸的羧基中的羟基极性最小,最难电离出
H
18.(1)丙烯酸乙酯
酮羰基(羰基)、酯基
加成反应 还原反应
甲基属于推电子基团,导致CH3 NH2 分子中氮原子上的电子云密度更大,结合H 时更容易给出孤电子对
(合理即可)
(6) 15
同课章节目录
