福建省厦泉五校2024-2025学年高二下学期期末联考化学试卷(含答案)
文档属性
| 名称 | 福建省厦泉五校2024-2025学年高二下学期期末联考化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-11 20:49:06 | ||
图片预览


文档简介
厦泉五校2024-2025学年高二年级第二学期期末联考
化学科试卷
试卷分第I卷(选择题)和第II卷(非选择题)两部分
可能用到的相对原子质量:H 1 C 12 O 16 Au 197 B 11 Na 23 Sm 150 Co 59
第I卷 (选择题,共48分)
一、选择题(本题共12小题,每小题4分,共48分,每小题只有一个选项符合题目要求)
1.我国科研人员在研究嫦娥五号返回器带回的月壤时,发现月壤钛铁矿(FeTiO3)存在亚纳米孔道,吸附并储存了大量来自太阳风的氢原子。加热月壤钛铁矿可生成单质铁和大量水蒸气,水蒸气冷却为液态水储存起来以供使用。下列说法不正确的是( )
A.月壤钛铁矿中存在s区、p区、d区的元素
B.将地球上开采的钛铁矿直接加热也一定生成单质铁和水蒸气
C.月壤钛铁矿加热生成水蒸气的过程中发生了氧化还原反应
D.将获得的水蒸气冷却为液态水的过程会放出热量
2.下列化学用语或图示表达不正确的是( )
A.乙醇的分子模型:
B.BF3的VSEPR模型:
C. 反-2-丁烯的结构简式为
D.基态29Cu原子的价层电子排布式:3d104s1
3.下列宏观现象与微观解释不符的是( )
选项 宏观现象 微观解释
A 四氟乙烯(PTFE)化学稳定性极高,能够抵御强酸、强碱、溶剂以及氧化剂等。 F的电负性较强,C—F的键能较大,断开该共价键需要较多的能量
B 苯不能使溴的CCl4溶液褪色 苯分子中碳原子形成了稳定的大π键
C 天然水晶呈现多面体外形 原子在三维空间里呈周期性有序排列
D 氯化钠晶体熔点高于氯化铝晶体 二者均为离子晶体,离子所带电荷数越少,离子半径越大,离子晶体熔点越低
4.共价键、离子键和分子间作用力是微粒之间的三种作用力。下列晶体含有其中两种作用力的是( )
①Na2O2 ②SiC ③冰 ④金刚石 ⑤NaCl ⑥白磷
A.①②⑤ B.①③⑥
C.②④⑥ D.①②③⑥
5.丁香挥发油中含丁香色原酮(K)、香草酸(M),其结构简式如下:
下列说法正确的是( )
A.K中含手性碳原子
B.M中碳原子的杂化类型只有sp2杂化
C.K、M均能与NaHCO3反应
D.K、M共有四种含氧官能团
6.某化合物的结构如图所示。W、X、Y、Z是原子序数依次增大的短周期元素,其中X、Z位于同一主族。
下列说法错误的是( )
A.该物质中X和Z分别为O和S元素
B.元素电负性:X>Z>Y
C.基态原子未成对电子数:W<X<Y
D. 基态原子的第一电离能:X>Z>Y
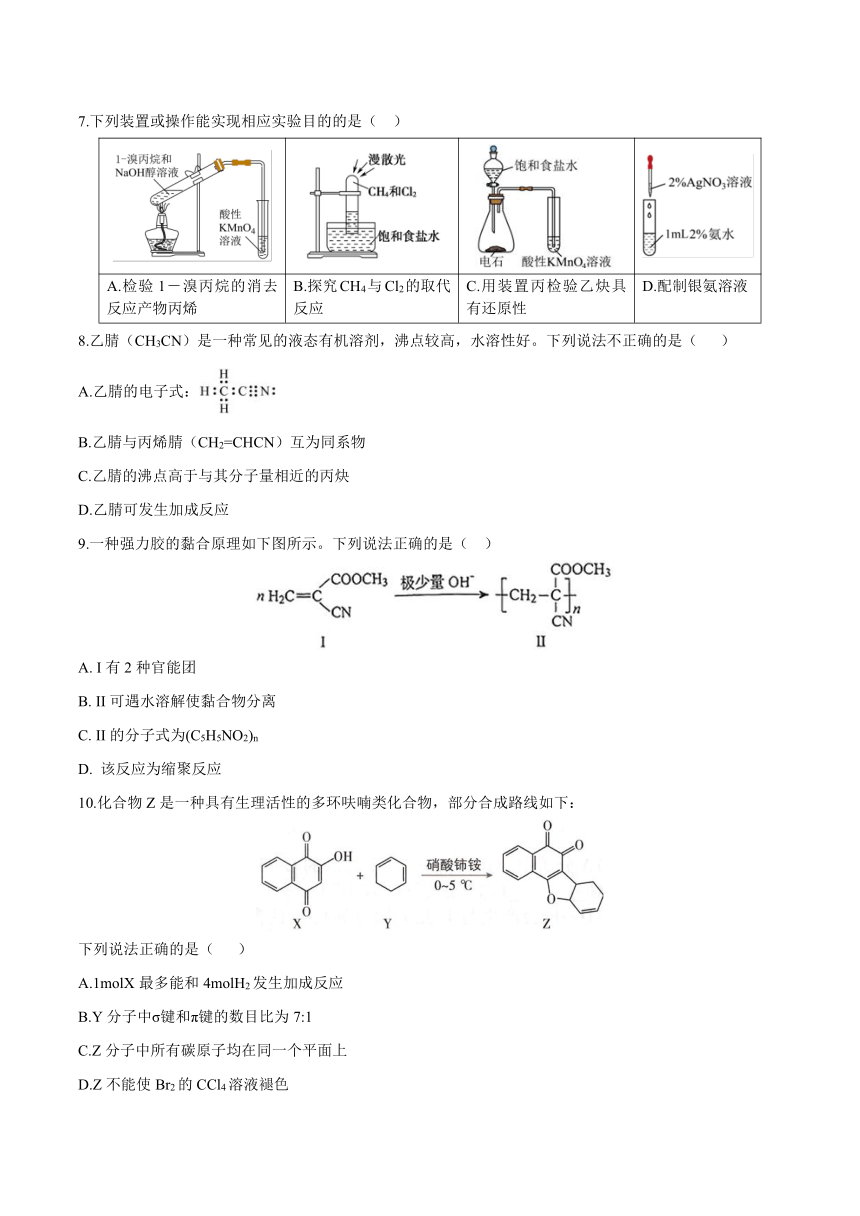
7.下列装置或操作能实现相应实验目的的是( )
A.检验1―溴丙烷的消去反应产物丙烯 B.探究CH4与Cl2的取代反应 C.用装置丙检验乙炔具有还原性 D.配制银氨溶液
8.乙腈(CH3CN)是一种常见的液态有机溶剂,沸点较高,水溶性好。下列说法不正确的是( )
A.乙腈的电子式:
B.乙腈与丙烯腈(CH2=CHCN)互为同系物
C.乙腈的沸点高于与其分子量相近的丙炔
D.乙腈可发生加成反应
9.一种强力胶的黏合原理如下图所示。下列说法正确的是( )
A. I有2种官能团
B. II可遇水溶解使黏合物分离
C. II的分子式为(C5H5NO2)n
D. 该反应为缩聚反应
10.化合物Z是一种具有生理活性的多环呋喃类化合物,部分合成路线如下:
下列说法正确的是( )
A.1molX最多能和4molH2发生加成反应
B.Y分子中σ键和π键的数目比为7:1
C.Z分子中所有碳原子均在同一个平面上
D.Z不能使Br2的CCl4溶液褪色
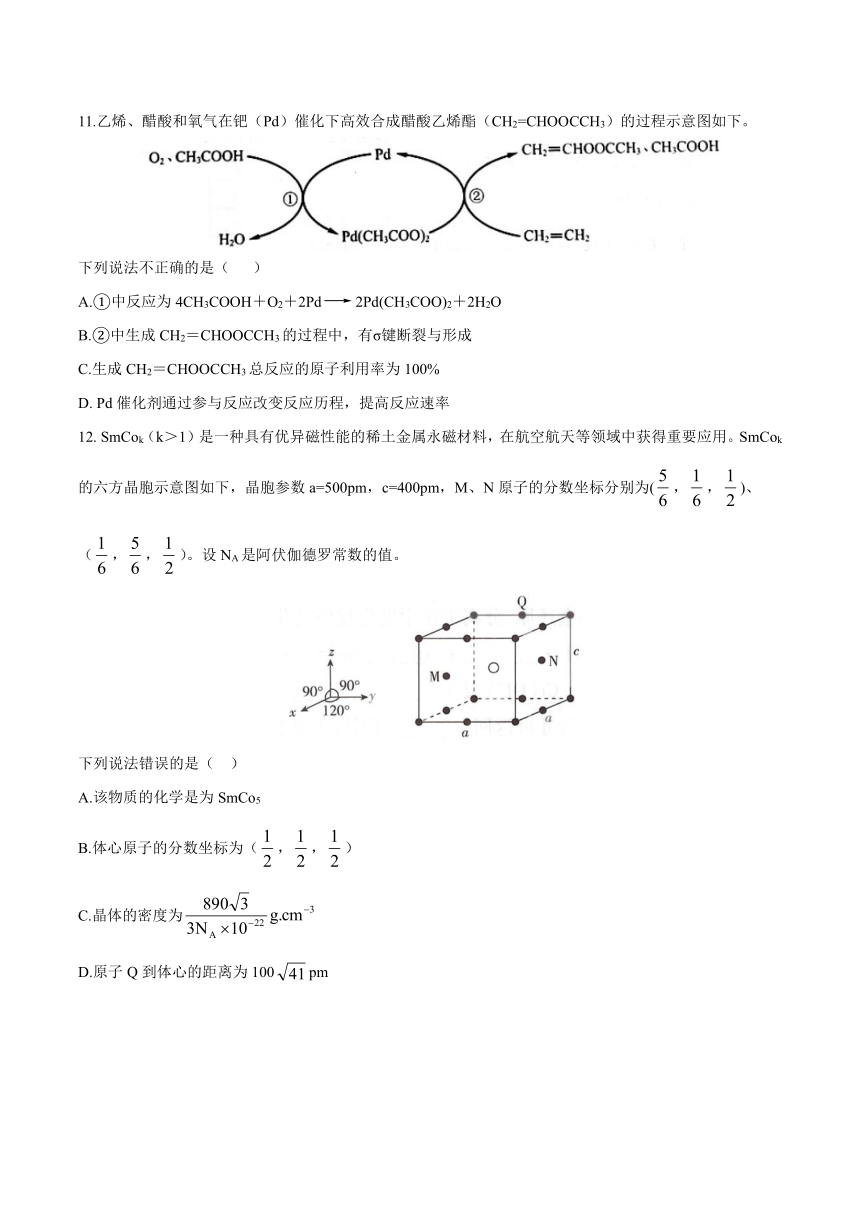
11.乙烯、醋酸和氧气在钯(Pd)催化下高效合成醋酸乙烯酯(CH2=CHOOCCH3)的过程示意图如下。
下列说法不正确的是( )
A.①中反应为4CH3COOH+O2+2Pd2Pd(CH3COO)2+2H2O
B.②中生成CH2=CHOOCCH3的过程中,有σ键断裂与形成
C.生成CH2=CHOOCCH3总反应的原子利用率为100%
D. Pd催化剂通过参与反应改变反应历程,提高反应速率
12. SmCok(k>1)是一种具有优异磁性能的稀土金属永磁材料,在航空航天等领域中获得重要应用。SmCok的六方晶胞示意图如下,晶胞参数a=500pm,c=400pm,M、N原子的分数坐标分别为(,,)、
(,,)。设NA是阿伏伽德罗常数的值。
下列说法错误的是( )
A.该物质的化学是为SmCo5
B.体心原子的分数坐标为(,,)
C.晶体的密度为
D.原子Q到体心的距离为100pm
第II卷 非选择题(4大题,共52分)
13.(18分)镁是一种神奇的金属。
I.通过MgCl2和[Mg(NH3)6]Cl2的相互转化可实现NH3的高效存储和利用。
(1)写出Mg的基态原子轨道表示式:________________。
(2)NH3分子中的H—N—H键角_______ [Mg(NH3)6]2+中的H—N—H键角(填:“>”“<”或“=”),从结构角度解释原因:______________。
(3)[Mg(NH3)6]Cl2的晶胞是立方体结构,边长为a nm,结构示意图如下。
[Mg(NH3)6]Cl2中的配位原子是_______,中心离子的配位数为________,离[Mg(NH3)6]2+最近的Cl—有_____个。
II.格氏试剂是一种用途广泛的有机镁化合物,通常用有机卤化物与金属镁在无水乙醚或四氢呋喃(THF)中反应制得。反应原理如下:
由A()合成I()的流程图:
注:NBS为溴化试剂,在一定条件下能与烯烃作用得到溴代烯烃。
(4)物质A的名称为______;由A 生成B 的反应类型是______。
(5)写出由A制备的化学方程式______。
(6)四氢呋喃是一种优良的溶剂,可由呋喃()加氢得到,则四氢呋喃的结构简式为______。
(7)写出物质C在NaOH的水溶液中加热反应的化学方程式______。
(8)写出符合下列要求的Ⅰ的同分异构体的结构简式______写出一种即可,同一碳上不能连接2个羟基。
芳香族化合物 二元醇 分子中有5种化学环境的H
14.(12分)某工厂采用如下工艺回收废渣(含有ZnS、PbSO4、FeS和CuCl)中的Zn、Pb元素。
已知:①“氧化浸出”时,PbSO4不发生变化,ZnS、CuCl分别转变为[Zn(NH3)4]2+、[Cu(NH3)4]2+
②酒石酸(记作H2A)结构简式为HOOC(CHOH)2COOH。
回答下列问题:
(1)酒石酸分子中含有_____种化学环境不同的氢原子,写出酒石酸与足量金属Na反应的化学方程式______________________________
有机物M是酒石酸的一种同分异构体,且M与酒石酸含有的官能团种类和数目均相同,写成M的结构简式____________________
(2)在元素周期表中,Zn位于第_____周期______族,其原子结构示意图为__________
(3)过二硫酸根(S2O82—)具有强氧化性,其中的S的化合价为_______,“氧化浸出”时,S2O82—转变为
______________(填离子符号)
(4)“除铜”步骤中发生反应的离子方程式为___________________________
15.(14分)硼氢化钠(NaBH4)是一种万能还原剂和潜在储氢剂,实验室用金属钠、H2、硼酸三甲酯[B(OCH3)3,沸点68℃]制备NaBH4的装置如下(夹持和加热装置略去),实验步骤有如下五步:
①降温后,分离得到NaBH4和CH3ONa的固体混合物;
②升温到200℃,关闭K2,打开通入H2,充分反应得到NaH;
③连接装置,检查气密性;
④升温到240℃,关闭K1,打开K2,持续搅拌下通入氩气,再打开K3向三颈烧瓶中滴入硼酸三甲酯
[B(OCH3)3 ]充分反应;
⑤装入试剂,打开K2,向装置中鼓入氩气,然后升温到110℃,并搅拌。
已知:、NaBH4易与水反应,NaBH4在强碱性条件下能稳定存在。
(1)仪器A的名称是 ,B的侧边上小玻璃导管的作用是 。在空气冷凝管b接口上需要连接1个 装置和1个处理装置。
(2)写成NaH的电子式___________,BH4—的空间构型是____________
(3)实验步骤的正确顺序是③ (填序号)。
(4)石蜡油的主要成分是 ,
a.烃 b.烃的衍生物 c.高分子化合物
石蜡油在实验中的作用是______________________________
(5)写出NaH与硼酸三甲酯反应的化学方程式 。
(6)分离后测定NaBH4的纯度:取 w g产品,在强碱性条件下与Au3+反应得到 m g Au,其反应的离子方程式为8Au3++3BH4—+24OH—=8Au+3BO2—+18H2O;产品中NaBH4的纯度为 (写出算式即可)。
16.(8分)化合物G是某药物的关键原料,合成路线如下:
回答下列问题:
(1)化合物A分子内非含氧官能团的名称为________________
(2)化合物A→B的反应类型为___________,C的苯环上的一氯代物有_______种。
(3)能与化合物B和C都发生反应的试剂为_______(填标号)
a. NaHCO3水溶液 b. NaOH水溶液 c. Na2SO4水溶液 d.HCl
(4)C→D的反应方程式为______________。
(5)化合物D与H+间的反应方程式:
用类比法,下列反应中的X化学式为__________
参考答案
1.B 2.C 3.D 4.B 5.D 6.D 7.B 8.B 9.C 10.B 11.C 12.D
13.(共18分)(1)(2分)
(2)<(1分) NH3中的N有孤电子对,对成键电子的排斥力较大,而[Mg(NH3)6]2+中的N的孤电子对与Mg2+形成配位键,对成键电子的排斥力减小。(2分,答出关键大意即给分)
(3)N 6 8 (各1分) (4)环己醇 消去反应(各1分)(少反应二字也给分)
(5)2+O2 2+2H2O(2分) (6)(2分)
(7) +NaOH OH+NaBr (2分)
(8)或(2分)
14.(共12分)(1)3 (1分) HOOC(CHOH)2COOH+4Na→NaOOC(CHONa)2COONa+2H2↑(2分)
(2分) (2) 四或4 IIB (各1分) (3)+6 SO42— (各1分)
(4)Zn+[Cu(NH3)4]2+=Cu+[Zn(NH3)4]2+ (2份)
15.(共14分)(1)三颈烧瓶或三口烧瓶(1分) 平衡压强,使液体顺利滴入(2分) 干燥(1分)
(2) 正四面体形(各1分) (3)⑤②④①(2分) (4)a 溶剂 (各1分)
(5)4NaH+B(OCH3)3NaBH4+3CH3ONa(2分) (6)(2分)
16.(共8分)(1)氨基(1分) (2)取代反应 3 (各1分)
(3)b d(2分)
(4)+ H2O → + CH3COOH(2分) (5)NO+ (1分)
化学科试卷
试卷分第I卷(选择题)和第II卷(非选择题)两部分
可能用到的相对原子质量:H 1 C 12 O 16 Au 197 B 11 Na 23 Sm 150 Co 59
第I卷 (选择题,共48分)
一、选择题(本题共12小题,每小题4分,共48分,每小题只有一个选项符合题目要求)
1.我国科研人员在研究嫦娥五号返回器带回的月壤时,发现月壤钛铁矿(FeTiO3)存在亚纳米孔道,吸附并储存了大量来自太阳风的氢原子。加热月壤钛铁矿可生成单质铁和大量水蒸气,水蒸气冷却为液态水储存起来以供使用。下列说法不正确的是( )
A.月壤钛铁矿中存在s区、p区、d区的元素
B.将地球上开采的钛铁矿直接加热也一定生成单质铁和水蒸气
C.月壤钛铁矿加热生成水蒸气的过程中发生了氧化还原反应
D.将获得的水蒸气冷却为液态水的过程会放出热量
2.下列化学用语或图示表达不正确的是( )
A.乙醇的分子模型:
B.BF3的VSEPR模型:
C. 反-2-丁烯的结构简式为
D.基态29Cu原子的价层电子排布式:3d104s1
3.下列宏观现象与微观解释不符的是( )
选项 宏观现象 微观解释
A 四氟乙烯(PTFE)化学稳定性极高,能够抵御强酸、强碱、溶剂以及氧化剂等。 F的电负性较强,C—F的键能较大,断开该共价键需要较多的能量
B 苯不能使溴的CCl4溶液褪色 苯分子中碳原子形成了稳定的大π键
C 天然水晶呈现多面体外形 原子在三维空间里呈周期性有序排列
D 氯化钠晶体熔点高于氯化铝晶体 二者均为离子晶体,离子所带电荷数越少,离子半径越大,离子晶体熔点越低
4.共价键、离子键和分子间作用力是微粒之间的三种作用力。下列晶体含有其中两种作用力的是( )
①Na2O2 ②SiC ③冰 ④金刚石 ⑤NaCl ⑥白磷
A.①②⑤ B.①③⑥
C.②④⑥ D.①②③⑥
5.丁香挥发油中含丁香色原酮(K)、香草酸(M),其结构简式如下:
下列说法正确的是( )
A.K中含手性碳原子
B.M中碳原子的杂化类型只有sp2杂化
C.K、M均能与NaHCO3反应
D.K、M共有四种含氧官能团
6.某化合物的结构如图所示。W、X、Y、Z是原子序数依次增大的短周期元素,其中X、Z位于同一主族。
下列说法错误的是( )
A.该物质中X和Z分别为O和S元素
B.元素电负性:X>Z>Y
C.基态原子未成对电子数:W<X<Y
D. 基态原子的第一电离能:X>Z>Y
7.下列装置或操作能实现相应实验目的的是( )
A.检验1―溴丙烷的消去反应产物丙烯 B.探究CH4与Cl2的取代反应 C.用装置丙检验乙炔具有还原性 D.配制银氨溶液
8.乙腈(CH3CN)是一种常见的液态有机溶剂,沸点较高,水溶性好。下列说法不正确的是( )
A.乙腈的电子式:
B.乙腈与丙烯腈(CH2=CHCN)互为同系物
C.乙腈的沸点高于与其分子量相近的丙炔
D.乙腈可发生加成反应
9.一种强力胶的黏合原理如下图所示。下列说法正确的是( )
A. I有2种官能团
B. II可遇水溶解使黏合物分离
C. II的分子式为(C5H5NO2)n
D. 该反应为缩聚反应
10.化合物Z是一种具有生理活性的多环呋喃类化合物,部分合成路线如下:
下列说法正确的是( )
A.1molX最多能和4molH2发生加成反应
B.Y分子中σ键和π键的数目比为7:1
C.Z分子中所有碳原子均在同一个平面上
D.Z不能使Br2的CCl4溶液褪色
11.乙烯、醋酸和氧气在钯(Pd)催化下高效合成醋酸乙烯酯(CH2=CHOOCCH3)的过程示意图如下。
下列说法不正确的是( )
A.①中反应为4CH3COOH+O2+2Pd2Pd(CH3COO)2+2H2O
B.②中生成CH2=CHOOCCH3的过程中,有σ键断裂与形成
C.生成CH2=CHOOCCH3总反应的原子利用率为100%
D. Pd催化剂通过参与反应改变反应历程,提高反应速率
12. SmCok(k>1)是一种具有优异磁性能的稀土金属永磁材料,在航空航天等领域中获得重要应用。SmCok的六方晶胞示意图如下,晶胞参数a=500pm,c=400pm,M、N原子的分数坐标分别为(,,)、
(,,)。设NA是阿伏伽德罗常数的值。
下列说法错误的是( )
A.该物质的化学是为SmCo5
B.体心原子的分数坐标为(,,)
C.晶体的密度为
D.原子Q到体心的距离为100pm
第II卷 非选择题(4大题,共52分)
13.(18分)镁是一种神奇的金属。
I.通过MgCl2和[Mg(NH3)6]Cl2的相互转化可实现NH3的高效存储和利用。
(1)写出Mg的基态原子轨道表示式:________________。
(2)NH3分子中的H—N—H键角_______ [Mg(NH3)6]2+中的H—N—H键角(填:“>”“<”或“=”),从结构角度解释原因:______________。
(3)[Mg(NH3)6]Cl2的晶胞是立方体结构,边长为a nm,结构示意图如下。
[Mg(NH3)6]Cl2中的配位原子是_______,中心离子的配位数为________,离[Mg(NH3)6]2+最近的Cl—有_____个。
II.格氏试剂是一种用途广泛的有机镁化合物,通常用有机卤化物与金属镁在无水乙醚或四氢呋喃(THF)中反应制得。反应原理如下:
由A()合成I()的流程图:
注:NBS为溴化试剂,在一定条件下能与烯烃作用得到溴代烯烃。
(4)物质A的名称为______;由A 生成B 的反应类型是______。
(5)写出由A制备的化学方程式______。
(6)四氢呋喃是一种优良的溶剂,可由呋喃()加氢得到,则四氢呋喃的结构简式为______。
(7)写出物质C在NaOH的水溶液中加热反应的化学方程式______。
(8)写出符合下列要求的Ⅰ的同分异构体的结构简式______写出一种即可,同一碳上不能连接2个羟基。
芳香族化合物 二元醇 分子中有5种化学环境的H
14.(12分)某工厂采用如下工艺回收废渣(含有ZnS、PbSO4、FeS和CuCl)中的Zn、Pb元素。
已知:①“氧化浸出”时,PbSO4不发生变化,ZnS、CuCl分别转变为[Zn(NH3)4]2+、[Cu(NH3)4]2+
②酒石酸(记作H2A)结构简式为HOOC(CHOH)2COOH。
回答下列问题:
(1)酒石酸分子中含有_____种化学环境不同的氢原子,写出酒石酸与足量金属Na反应的化学方程式______________________________
有机物M是酒石酸的一种同分异构体,且M与酒石酸含有的官能团种类和数目均相同,写成M的结构简式____________________
(2)在元素周期表中,Zn位于第_____周期______族,其原子结构示意图为__________
(3)过二硫酸根(S2O82—)具有强氧化性,其中的S的化合价为_______,“氧化浸出”时,S2O82—转变为
______________(填离子符号)
(4)“除铜”步骤中发生反应的离子方程式为___________________________
15.(14分)硼氢化钠(NaBH4)是一种万能还原剂和潜在储氢剂,实验室用金属钠、H2、硼酸三甲酯[B(OCH3)3,沸点68℃]制备NaBH4的装置如下(夹持和加热装置略去),实验步骤有如下五步:
①降温后,分离得到NaBH4和CH3ONa的固体混合物;
②升温到200℃,关闭K2,打开通入H2,充分反应得到NaH;
③连接装置,检查气密性;
④升温到240℃,关闭K1,打开K2,持续搅拌下通入氩气,再打开K3向三颈烧瓶中滴入硼酸三甲酯
[B(OCH3)3 ]充分反应;
⑤装入试剂,打开K2,向装置中鼓入氩气,然后升温到110℃,并搅拌。
已知:、NaBH4易与水反应,NaBH4在强碱性条件下能稳定存在。
(1)仪器A的名称是 ,B的侧边上小玻璃导管的作用是 。在空气冷凝管b接口上需要连接1个 装置和1个处理装置。
(2)写成NaH的电子式___________,BH4—的空间构型是____________
(3)实验步骤的正确顺序是③ (填序号)。
(4)石蜡油的主要成分是 ,
a.烃 b.烃的衍生物 c.高分子化合物
石蜡油在实验中的作用是______________________________
(5)写出NaH与硼酸三甲酯反应的化学方程式 。
(6)分离后测定NaBH4的纯度:取 w g产品,在强碱性条件下与Au3+反应得到 m g Au,其反应的离子方程式为8Au3++3BH4—+24OH—=8Au+3BO2—+18H2O;产品中NaBH4的纯度为 (写出算式即可)。
16.(8分)化合物G是某药物的关键原料,合成路线如下:
回答下列问题:
(1)化合物A分子内非含氧官能团的名称为________________
(2)化合物A→B的反应类型为___________,C的苯环上的一氯代物有_______种。
(3)能与化合物B和C都发生反应的试剂为_______(填标号)
a. NaHCO3水溶液 b. NaOH水溶液 c. Na2SO4水溶液 d.HCl
(4)C→D的反应方程式为______________。
(5)化合物D与H+间的反应方程式:
用类比法,下列反应中的X化学式为__________
参考答案
1.B 2.C 3.D 4.B 5.D 6.D 7.B 8.B 9.C 10.B 11.C 12.D
13.(共18分)(1)(2分)
(2)<(1分) NH3中的N有孤电子对,对成键电子的排斥力较大,而[Mg(NH3)6]2+中的N的孤电子对与Mg2+形成配位键,对成键电子的排斥力减小。(2分,答出关键大意即给分)
(3)N 6 8 (各1分) (4)环己醇 消去反应(各1分)(少反应二字也给分)
(5)2+O2 2+2H2O(2分) (6)(2分)
(7) +NaOH OH+NaBr (2分)
(8)或(2分)
14.(共12分)(1)3 (1分) HOOC(CHOH)2COOH+4Na→NaOOC(CHONa)2COONa+2H2↑(2分)
(2分) (2) 四或4 IIB (各1分) (3)+6 SO42— (各1分)
(4)Zn+[Cu(NH3)4]2+=Cu+[Zn(NH3)4]2+ (2份)
15.(共14分)(1)三颈烧瓶或三口烧瓶(1分) 平衡压强,使液体顺利滴入(2分) 干燥(1分)
(2) 正四面体形(各1分) (3)⑤②④①(2分) (4)a 溶剂 (各1分)
(5)4NaH+B(OCH3)3NaBH4+3CH3ONa(2分) (6)(2分)
16.(共8分)(1)氨基(1分) (2)取代反应 3 (各1分)
(3)b d(2分)
(4)+ H2O → + CH3COOH(2分) (5)NO+ (1分)
同课章节目录
