山东省淄博市2024-2025学年高一下学期教学质量检测化学试卷(含答案)
文档属性
| 名称 | 山东省淄博市2024-2025学年高一下学期教学质量检测化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-11 20:53:33 | ||
图片预览



文档简介
山东省淄博市2024-2025学年高一下学期教学质量检测化学试题
一、单选题
1.下列工业生产中不涉及氧化还原反应的是
A.油脂氢化 B.侯氏制碱 C.煤的干馏 D.石油裂解
2.化学品在生产、生活中有重要的应用,下列说法错误的是
A.可用于漂白蚕丝制品 B.苯甲酸钠可用做食品防腐剂
C.硫黄可用于处理洒落的汞 D.高纯硅可用做半导体材料和光导纤维
3.实验室中,下列试剂保存方法正确的是
A.浓硝酸保存在棕色细口试剂瓶中
B.氢氟酸保存在细口玻璃试剂瓶中
C.液溴加水封保存在广口试剂瓶中
D.高锰酸钾与无水乙醇存放在同一药品柜中
4.设为阿伏加德罗常数的值。下列说法正确的是
A.中含有的共价键数目为
B.与足量铁粉反应,转移电子数为
C.和在一定条件下充分反应,转移电子数为
D.标准状况下,与混合气体中含有的原子数目为
5.下列实验或过程涉及反应的离子方程式书写正确的是
A.用治疗胃酸过多:
B.用溶液吸收+
C.用稀硝酸溶解少量铁屑:
D.用和浓盐酸制备
6.下列有关热化学反应的说法正确的是
A.需要加热才能发生的反应一定是吸热反应
B.,金刚石比石墨稳定
C.,则
D.的燃烧热为,则反应的
7.下列实验装置或操作能达到实验目的的是
A.测定中和热 B.检验氨气极易溶于水
C.制备乙酸乙酯 D.验证甲烷的取代反应
A.A B.B C.C D.D
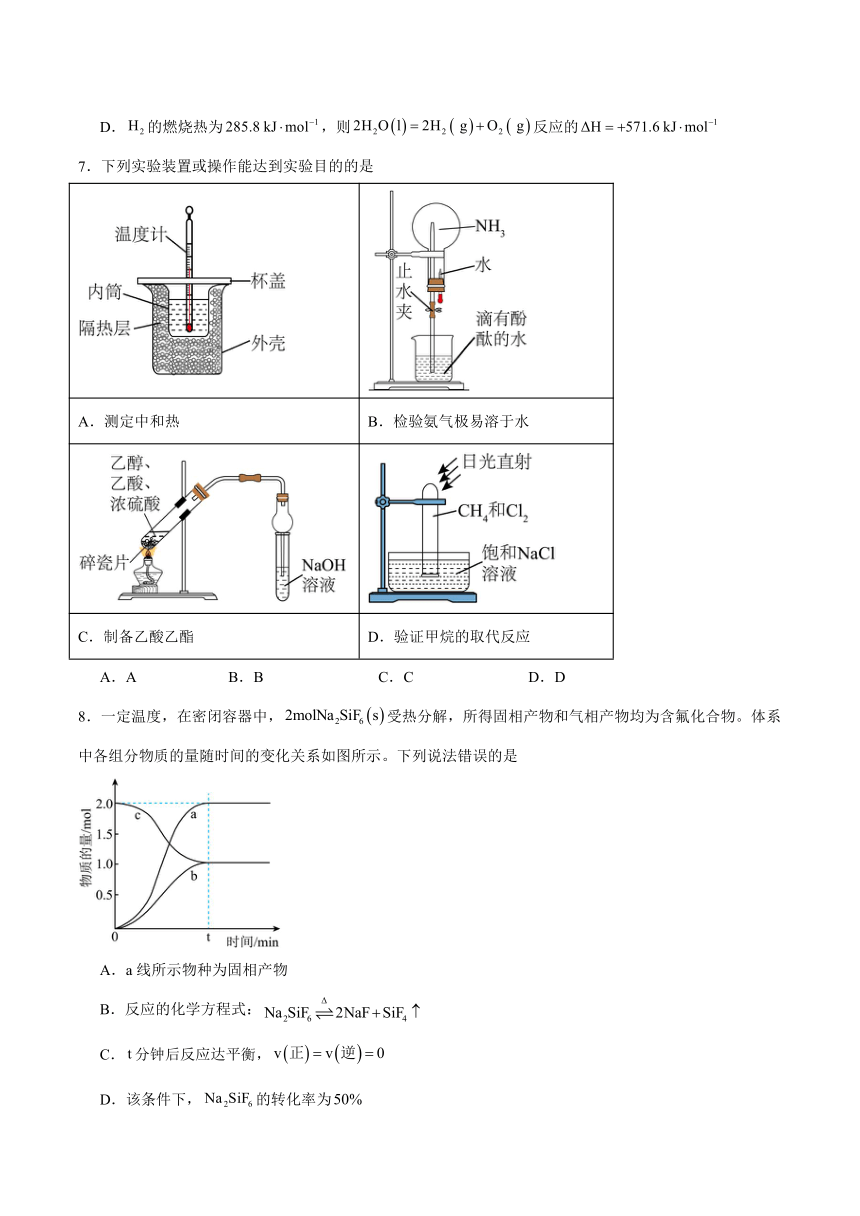
8.一定温度,在密闭容器中,受热分解,所得固相产物和气相产物均为含氟化合物。体系中各组分物质的量随时间的变化关系如图所示。下列说法错误的是
A.a线所示物种为固相产物
B.反应的化学方程式:
C.分钟后反应达平衡,
D.该条件下,的转化率为
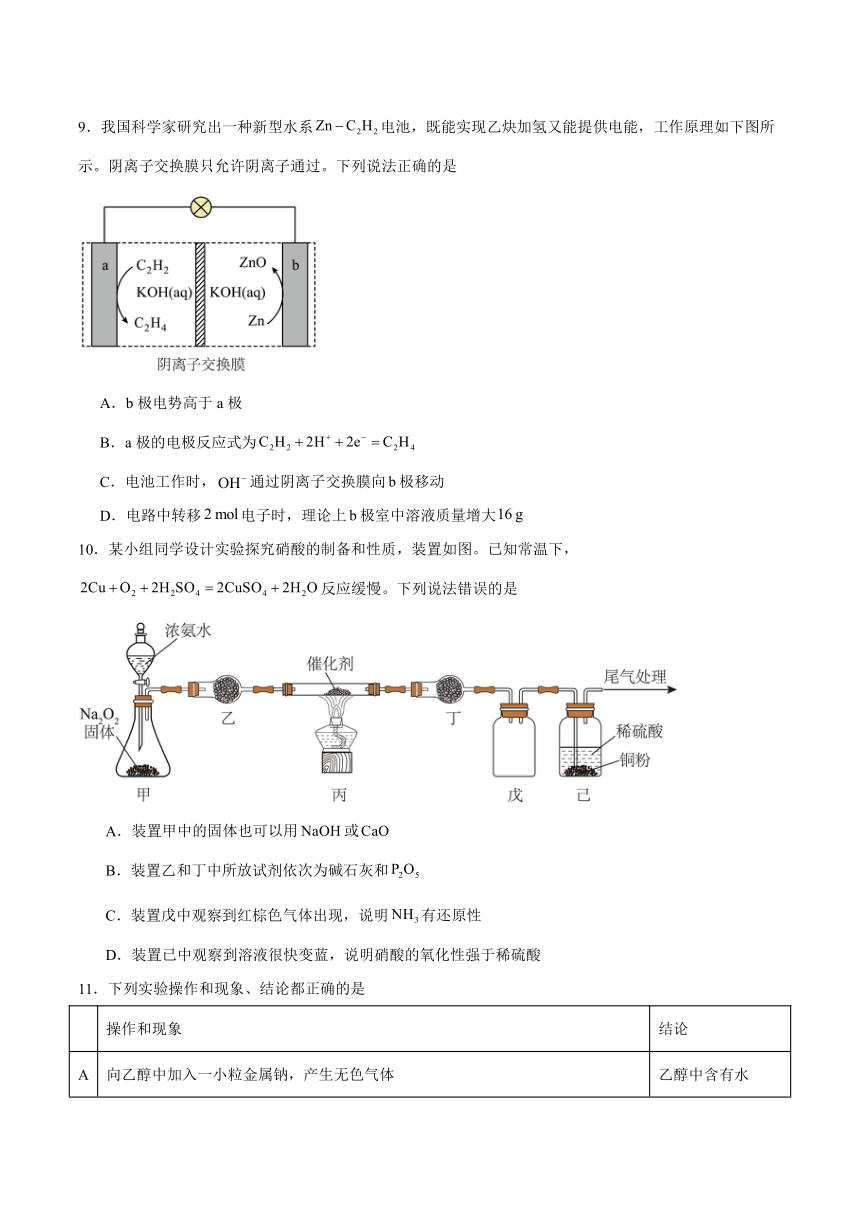
9.我国科学家研究出一种新型水系电池,既能实现乙炔加氢又能提供电能,工作原理如下图所示。阴离子交换膜只允许阴离子通过。下列说法正确的是
A.b极电势高于a极
B.a极的电极反应式为
C.电池工作时,通过阴离子交换膜向极移动
D.电路中转移电子时,理论上极室中溶液质量增大
10.某小组同学设计实验探究硝酸的制备和性质,装置如图。已知常温下,反应缓慢。下列说法错误的是
A.装置甲中的固体也可以用或
B.装置乙和丁中所放试剂依次为碱石灰和
C.装置戊中观察到红棕色气体出现,说明有还原性
D.装置已中观察到溶液很快变蓝,说明硝酸的氧化性强于稀硫酸
11.下列实验操作和现象、结论都正确的是
操作和现象 结论
A 向乙醇中加入一小粒金属钠,产生无色气体 乙醇中含有水
B 向某盐溶液中加入浓NaOH溶液,加热,将湿润的红色石蕊试纸置于试管口,试纸变蓝 溶液中含有
C 向20%蔗糖溶液中加入少量稀,加热;冷却,再加入银氨溶液,水浴加热,未出现银镜 蔗糖未发生水解
D 加热盛有固体的试管,试管底部固体消失,试管口有晶体凝结 固体可以升华
A.A B.B C.C D.D
12.某元素的单质及其化合物的转化关系如图所示,常温常压下均为无色气体,具有漂白性。下列说法正确的是
A.该元素可为或
B.可为
C.试剂甲、乙、丙可为同一种物质
D.与足量反应可直接转化为
13.利用浊度传感器探究溶液与溶液在不同温度和浓度下的反应,实验数据如下。下列说法错误的是
编 号 溶液 溶液 温度/℃
V/mL V/mL V/mL
① 0.1 1.5 0.1 3.5 10 25
② 0.1 3.5 0.1 3.5 25
③ 0.1 3.5 0.1 1.5 10 25
④ 0.1 1.5 0.1 3.5 10 40
溶液的浑浊度随时间的变化
A.反应的离子方程式为
B.反应①②③探究浓度对反应速率的影响,
C.由①④可知其它条件不变时,温度越高,反应速率越大
D.由①③可知与溶液相比,溶液浓度对反应速率的影响更显著
二、多选题
14.化合物之间的转化关系如下,下列说法错误的是
A.反应①的原子利用率为100%
B.化合物M与乙烯互为同系物
C.化合物P、Q可用溴的四氯化碳溶液鉴别
D.化合物能发生加成反应、取代反应、氧化反应
15.从海水苦卤(含等)中提取的流程如下。下列说法错误的是
A.试剂为石灰乳,电解溶液制备
B.吸收塔中剩余的酸可返回吹出塔循环使用
C.吸收塔中发生的主要反应离子方程式为
D.吹出塔和蒸馏塔通入发生的主要反应离子方程式均为
三、解答题
16.“价一类”二维图体现了化学转化之美,元素对应物质的“价一类”二维图如图所示。回答下列问题:
(1)X元素位于元素周期表第 周期 族,a的电子式为 。
(2)c是引发酸雨的主要物质之一,与过量溶液反应的离子方程式为 。
(3)含X物质在一定条件下能够相互转化,如下表所示。
可选用的试剂有:①e的浓溶液;②e的稀溶液;③h溶液;④f溶液;⑤酸性溶液;⑥品红溶液;⑦铜片。
转化目标 (价态变化) 转化前的 含X物质 选择试剂(氧化 剂或还原剂) 转化后的 含X物质
第一组 ④ ⑤
第二组 ⑦
第三组 ③ ②④
第一组的实验现象是 。第二组实验转化前的含物质可选用试剂为 (填标号),反应的化学方程式为 。第三组实验转化后的含X物质为 (填化学式),氧化产物与还原产物物质的量之比为 。
17.工业上以铬铁矿(FeC,含有少量、和等)为原料制备的流程如下。
已知:该工艺条件下,焙烧时转化为与;一次净化后铝元素以存在;+6价在酸性介质中以存在,在碱性介质中以存在。
回答下列问题:
(1)“焙烧”时将铬铁矿粉碎的目的是 。理论上,该过程中氧化剂与还原剂的物质的量之比为 。
(2)“一次净化”后滤渣1的主要成分为 (填化学式)。“二次净化”主要反应的离子方程式为 , 。
(3)“转化I”中主要反应的离子方程式为2, 。“转化”中加入饱和溶液析出晶体,说明该条件下溶解度 (填“”“”或“”)。
(4)工业上常利用溶液测定空气中的含量[+SO2+H+→Cr3+++H2O(未配平)],若空气流量为后恰好消耗的溶液,则空气中的含量为 (用含的代数式表示)。
18.亚硝酰氯(NOCl)是一种红褐色液体或黄色气体,熔点为,沸点为,易遇水反应生成。某同学利用制备并测定其纯度,制备装置如图所示(夹持装置略)。
回答下列问题:
(1)装置A中a的作用是 ,装置B中主要反应的离子方程式为 。
(2)制备NOCl时进行操作:(i)连接装置, ,加入药品;(ii)打开、,关闭,通入干燥纯净的,当装置中三颈烧瓶内 (填写实验现象)时停止通。(iii)关闭,打开和装置活塞,数分钟后关闭 ,打开 ,继续通入干燥纯净的,一段时间后,三颈烧瓶内现象为 ,图示装置存在的一处缺陷是 。
(3)测定NOCl样品的纯度:取中所得产物溶于水(忽略的挥发),配制溶液,量取于锥形瓶内,滴加的溶液恰好完全反应,NOCl样品的纯度为 %(用含a、b的代数式表示)。
19.甲酸(HCOOH)是重要的化工原料。回答下列问题:
I.HCOOH的分解涉及如下反应:
反应i:
反应ii:
(1)上述反应能量变化的关系如图所示,表示反应能量变化的为 (填“”或“”),反应的 。
(2)温度时,向2L恒容密闭容器中通入1molHCOOH(g),发生上述反应。
①时,测得容器中和的浓度分别为和,则此时容器中 ,反应开始到的平均反应速率 mol。
②下列说法中能表明上述反应达到化学平衡状态的是 (填标号)。
A.气体密度不变 B.气体总压强不变
C.的浓度不变 D.和的物质的量之比不变
Ⅱ.甲酸燃料电池装置可额外获得等工业原料
(3)物质为 (填化学式),电池的负极反应式为 ,理论上,消耗标准状况下可获得的质量为 g。
20.淀粉作为原料可合成多种化工产品,流程如下:
已知:
回答下列问题:
(1)B的名称为 ,B→C反应的化学方程式为 。
(2)的结构简式为 ,的反应类型为 。
(3)的化学方程式为 ,反应类型为 。
(4)乳酸中官能团的名称为 ,J的结构简式为 。
(5)等物质的量的乳酸、和分别与足量的金属反应,产生的物质的量之比为 。
题号 1 2 3 4 5 6 7 8 9 10
答案 B D A A B D B C C A
题号 11 12 13 14 15
答案 B C A BD AC
16.(1) 三 ⅥA
(2)
(3) 高锰酸钾溶液褪色 ① S 2:1
17.(1) 增大固体表面极,加快反应速率和焙烧效率
(2)
(3)
(4)
18.(1) 保证反应容器内压强一致,便于分液漏斗的硝酸溶液滴下
(2) 检查装置气密性 充满黄绿色气体 有红褐色液体或黄色气体出现 处理尾气的E装置中的无法吸收和
(3)
19.(1)
(2) 0.06 BC
(3) 20
20.(1) 乙醇
(2) CH2=CH2 加成反应
(3) 酯化反应
(4) 羟基、羧基
(5)2:1:1
一、单选题
1.下列工业生产中不涉及氧化还原反应的是
A.油脂氢化 B.侯氏制碱 C.煤的干馏 D.石油裂解
2.化学品在生产、生活中有重要的应用,下列说法错误的是
A.可用于漂白蚕丝制品 B.苯甲酸钠可用做食品防腐剂
C.硫黄可用于处理洒落的汞 D.高纯硅可用做半导体材料和光导纤维
3.实验室中,下列试剂保存方法正确的是
A.浓硝酸保存在棕色细口试剂瓶中
B.氢氟酸保存在细口玻璃试剂瓶中
C.液溴加水封保存在广口试剂瓶中
D.高锰酸钾与无水乙醇存放在同一药品柜中
4.设为阿伏加德罗常数的值。下列说法正确的是
A.中含有的共价键数目为
B.与足量铁粉反应,转移电子数为
C.和在一定条件下充分反应,转移电子数为
D.标准状况下,与混合气体中含有的原子数目为
5.下列实验或过程涉及反应的离子方程式书写正确的是
A.用治疗胃酸过多:
B.用溶液吸收+
C.用稀硝酸溶解少量铁屑:
D.用和浓盐酸制备
6.下列有关热化学反应的说法正确的是
A.需要加热才能发生的反应一定是吸热反应
B.,金刚石比石墨稳定
C.,则
D.的燃烧热为,则反应的
7.下列实验装置或操作能达到实验目的的是
A.测定中和热 B.检验氨气极易溶于水
C.制备乙酸乙酯 D.验证甲烷的取代反应
A.A B.B C.C D.D
8.一定温度,在密闭容器中,受热分解,所得固相产物和气相产物均为含氟化合物。体系中各组分物质的量随时间的变化关系如图所示。下列说法错误的是
A.a线所示物种为固相产物
B.反应的化学方程式:
C.分钟后反应达平衡,
D.该条件下,的转化率为
9.我国科学家研究出一种新型水系电池,既能实现乙炔加氢又能提供电能,工作原理如下图所示。阴离子交换膜只允许阴离子通过。下列说法正确的是
A.b极电势高于a极
B.a极的电极反应式为
C.电池工作时,通过阴离子交换膜向极移动
D.电路中转移电子时,理论上极室中溶液质量增大
10.某小组同学设计实验探究硝酸的制备和性质,装置如图。已知常温下,反应缓慢。下列说法错误的是
A.装置甲中的固体也可以用或
B.装置乙和丁中所放试剂依次为碱石灰和
C.装置戊中观察到红棕色气体出现,说明有还原性
D.装置已中观察到溶液很快变蓝,说明硝酸的氧化性强于稀硫酸
11.下列实验操作和现象、结论都正确的是
操作和现象 结论
A 向乙醇中加入一小粒金属钠,产生无色气体 乙醇中含有水
B 向某盐溶液中加入浓NaOH溶液,加热,将湿润的红色石蕊试纸置于试管口,试纸变蓝 溶液中含有
C 向20%蔗糖溶液中加入少量稀,加热;冷却,再加入银氨溶液,水浴加热,未出现银镜 蔗糖未发生水解
D 加热盛有固体的试管,试管底部固体消失,试管口有晶体凝结 固体可以升华
A.A B.B C.C D.D
12.某元素的单质及其化合物的转化关系如图所示,常温常压下均为无色气体,具有漂白性。下列说法正确的是
A.该元素可为或
B.可为
C.试剂甲、乙、丙可为同一种物质
D.与足量反应可直接转化为
13.利用浊度传感器探究溶液与溶液在不同温度和浓度下的反应,实验数据如下。下列说法错误的是
编 号 溶液 溶液 温度/℃
V/mL V/mL V/mL
① 0.1 1.5 0.1 3.5 10 25
② 0.1 3.5 0.1 3.5 25
③ 0.1 3.5 0.1 1.5 10 25
④ 0.1 1.5 0.1 3.5 10 40
溶液的浑浊度随时间的变化
A.反应的离子方程式为
B.反应①②③探究浓度对反应速率的影响,
C.由①④可知其它条件不变时,温度越高,反应速率越大
D.由①③可知与溶液相比,溶液浓度对反应速率的影响更显著
二、多选题
14.化合物之间的转化关系如下,下列说法错误的是
A.反应①的原子利用率为100%
B.化合物M与乙烯互为同系物
C.化合物P、Q可用溴的四氯化碳溶液鉴别
D.化合物能发生加成反应、取代反应、氧化反应
15.从海水苦卤(含等)中提取的流程如下。下列说法错误的是
A.试剂为石灰乳,电解溶液制备
B.吸收塔中剩余的酸可返回吹出塔循环使用
C.吸收塔中发生的主要反应离子方程式为
D.吹出塔和蒸馏塔通入发生的主要反应离子方程式均为
三、解答题
16.“价一类”二维图体现了化学转化之美,元素对应物质的“价一类”二维图如图所示。回答下列问题:
(1)X元素位于元素周期表第 周期 族,a的电子式为 。
(2)c是引发酸雨的主要物质之一,与过量溶液反应的离子方程式为 。
(3)含X物质在一定条件下能够相互转化,如下表所示。
可选用的试剂有:①e的浓溶液;②e的稀溶液;③h溶液;④f溶液;⑤酸性溶液;⑥品红溶液;⑦铜片。
转化目标 (价态变化) 转化前的 含X物质 选择试剂(氧化 剂或还原剂) 转化后的 含X物质
第一组 ④ ⑤
第二组 ⑦
第三组 ③ ②④
第一组的实验现象是 。第二组实验转化前的含物质可选用试剂为 (填标号),反应的化学方程式为 。第三组实验转化后的含X物质为 (填化学式),氧化产物与还原产物物质的量之比为 。
17.工业上以铬铁矿(FeC,含有少量、和等)为原料制备的流程如下。
已知:该工艺条件下,焙烧时转化为与;一次净化后铝元素以存在;+6价在酸性介质中以存在,在碱性介质中以存在。
回答下列问题:
(1)“焙烧”时将铬铁矿粉碎的目的是 。理论上,该过程中氧化剂与还原剂的物质的量之比为 。
(2)“一次净化”后滤渣1的主要成分为 (填化学式)。“二次净化”主要反应的离子方程式为 , 。
(3)“转化I”中主要反应的离子方程式为2, 。“转化”中加入饱和溶液析出晶体,说明该条件下溶解度 (填“”“”或“”)。
(4)工业上常利用溶液测定空气中的含量[+SO2+H+→Cr3+++H2O(未配平)],若空气流量为后恰好消耗的溶液,则空气中的含量为 (用含的代数式表示)。
18.亚硝酰氯(NOCl)是一种红褐色液体或黄色气体,熔点为,沸点为,易遇水反应生成。某同学利用制备并测定其纯度,制备装置如图所示(夹持装置略)。
回答下列问题:
(1)装置A中a的作用是 ,装置B中主要反应的离子方程式为 。
(2)制备NOCl时进行操作:(i)连接装置, ,加入药品;(ii)打开、,关闭,通入干燥纯净的,当装置中三颈烧瓶内 (填写实验现象)时停止通。(iii)关闭,打开和装置活塞,数分钟后关闭 ,打开 ,继续通入干燥纯净的,一段时间后,三颈烧瓶内现象为 ,图示装置存在的一处缺陷是 。
(3)测定NOCl样品的纯度:取中所得产物溶于水(忽略的挥发),配制溶液,量取于锥形瓶内,滴加的溶液恰好完全反应,NOCl样品的纯度为 %(用含a、b的代数式表示)。
19.甲酸(HCOOH)是重要的化工原料。回答下列问题:
I.HCOOH的分解涉及如下反应:
反应i:
反应ii:
(1)上述反应能量变化的关系如图所示,表示反应能量变化的为 (填“”或“”),反应的 。
(2)温度时,向2L恒容密闭容器中通入1molHCOOH(g),发生上述反应。
①时,测得容器中和的浓度分别为和,则此时容器中 ,反应开始到的平均反应速率 mol。
②下列说法中能表明上述反应达到化学平衡状态的是 (填标号)。
A.气体密度不变 B.气体总压强不变
C.的浓度不变 D.和的物质的量之比不变
Ⅱ.甲酸燃料电池装置可额外获得等工业原料
(3)物质为 (填化学式),电池的负极反应式为 ,理论上,消耗标准状况下可获得的质量为 g。
20.淀粉作为原料可合成多种化工产品,流程如下:
已知:
回答下列问题:
(1)B的名称为 ,B→C反应的化学方程式为 。
(2)的结构简式为 ,的反应类型为 。
(3)的化学方程式为 ,反应类型为 。
(4)乳酸中官能团的名称为 ,J的结构简式为 。
(5)等物质的量的乳酸、和分别与足量的金属反应,产生的物质的量之比为 。
题号 1 2 3 4 5 6 7 8 9 10
答案 B D A A B D B C C A
题号 11 12 13 14 15
答案 B C A BD AC
16.(1) 三 ⅥA
(2)
(3) 高锰酸钾溶液褪色 ① S 2:1
17.(1) 增大固体表面极,加快反应速率和焙烧效率
(2)
(3)
(4)
18.(1) 保证反应容器内压强一致,便于分液漏斗的硝酸溶液滴下
(2) 检查装置气密性 充满黄绿色气体 有红褐色液体或黄色气体出现 处理尾气的E装置中的无法吸收和
(3)
19.(1)
(2) 0.06 BC
(3) 20
20.(1) 乙醇
(2) CH2=CH2 加成反应
(3) 酯化反应
(4) 羟基、羧基
(5)2:1:1
同课章节目录
