人教版高中化学选择性必修1第二章化学反应速率与化学平衡聚焦突破2反应历程与活化能课件(共20张PPT)
文档属性
| 名称 | 人教版高中化学选择性必修1第二章化学反应速率与化学平衡聚焦突破2反应历程与活化能课件(共20张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 5.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-12 16:27:11 | ||
图片预览






文档简介
(共20张PPT)
聚焦突破2 反应历程与活化能
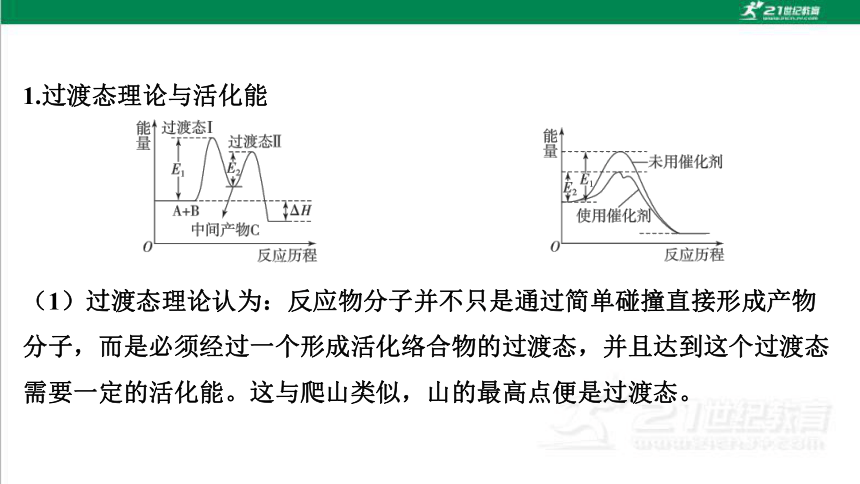
1.过渡态理论与活化能
(1)过渡态理论认为:反应物分子并不只是通过简单碰撞直接形成产物
分子,而是必须经过一个形成活化络合物的过渡态,并且达到这个过渡态
需要一定的活化能。这与爬山类似,山的最高点便是过渡态。
(2)活化能和反应速率的关系:基元反应的活化能越大,反应物到达过
渡态就越不容易,该基元反应的反应速率就越小。
(3)催化剂参与化学反应,生成能量更低的中间产物,降低了达到过渡
态所需要的活化能,使反应易于发生,反应速率增大。
√
A. B. C. D.
√
【突破集训】
√
√
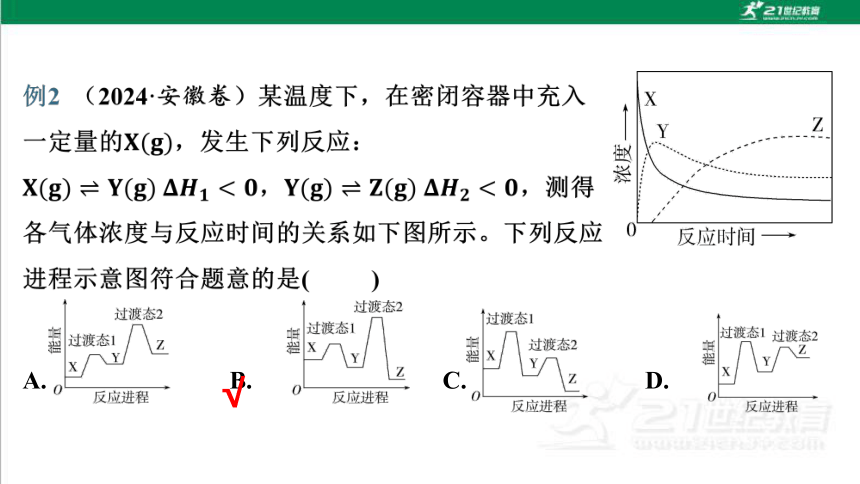
3.(2025·黑龙江哈九中高二检测)研究表明,
甲醇通过催化氧化制取甲醛时,在无催化剂
(图中实线)和加入特定催化剂(图中虚线)
时均会产生甲醛,其反应中物质的相对能量如
下图所示。下列说法错误的是( )
√
√
√
√
2门世2有
3厚
熊
过渡态I
过渡态Ⅱ
E
A+B
AH
中间产物C
反应历程
螚
一未用催化剂
使用催化剂
反应历程
2.解答能垒图像题的注意事项
(1)能垒图中涉及物质的能量往往是指一个分子变化过程的能量变化,
单位一般为eV(电子伏特)。活化能E,一般指每摩尔物质反应的能量变化
单位多为kJ·mol-1。
(2)催化反应历程一般为扩散→吸附→断键→成键→脱附。要关注断
键和成键的部位及元素化合价的变化。
(3)复杂反应的反应速率由基元反应中活化能(能垒)最大的慢反应决定
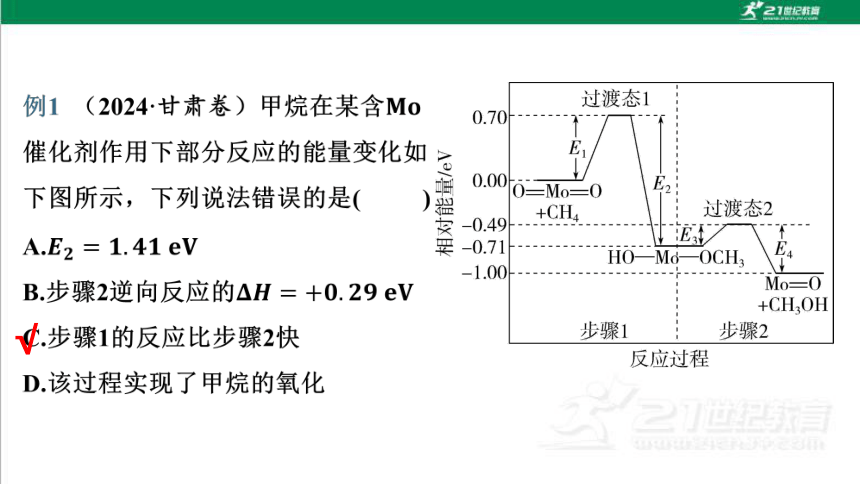
过渡态1
0.70
0.00
0=M0=0
2
过渡态2
HOMo-OCH
E
Mo=O
+CHOH
1
步骤1
-
步骤2
反应过程
A.E2=1.41eV
B.步骤2逆向反应的AH=+0.29eV
C.步骤1的反应比步骤2快
D.该过程实现了甲烷的氧化
解析:由能量变化图可知,E2=0.70eV-(-0.71eV)=1.41eV,A项
正确;步骤2逆向反应的△H=-0.71eV-(-1.00eV)=+0.29eV,B项
正确;步骤1的活化能E1=0.70eV,步骤2的活化能
E3=-0.49eV
(-0.71eV)=0.22eV,步骤1的活化能大于步骠2的活
化能,步骤1的反应比步骤2慢,C项错误;该过程中甲烷转化为甲醇,实
现了甲烷的氧化,D项正确
聚焦突破2 反应历程与活化能
1.过渡态理论与活化能
(1)过渡态理论认为:反应物分子并不只是通过简单碰撞直接形成产物
分子,而是必须经过一个形成活化络合物的过渡态,并且达到这个过渡态
需要一定的活化能。这与爬山类似,山的最高点便是过渡态。
(2)活化能和反应速率的关系:基元反应的活化能越大,反应物到达过
渡态就越不容易,该基元反应的反应速率就越小。
(3)催化剂参与化学反应,生成能量更低的中间产物,降低了达到过渡
态所需要的活化能,使反应易于发生,反应速率增大。
√
A. B. C. D.
√
【突破集训】
√
√
3.(2025·黑龙江哈九中高二检测)研究表明,
甲醇通过催化氧化制取甲醛时,在无催化剂
(图中实线)和加入特定催化剂(图中虚线)
时均会产生甲醛,其反应中物质的相对能量如
下图所示。下列说法错误的是( )
√
√
√
√
2门世2有
3厚
熊
过渡态I
过渡态Ⅱ
E
A+B
AH
中间产物C
反应历程
螚
一未用催化剂
使用催化剂
反应历程
2.解答能垒图像题的注意事项
(1)能垒图中涉及物质的能量往往是指一个分子变化过程的能量变化,
单位一般为eV(电子伏特)。活化能E,一般指每摩尔物质反应的能量变化
单位多为kJ·mol-1。
(2)催化反应历程一般为扩散→吸附→断键→成键→脱附。要关注断
键和成键的部位及元素化合价的变化。
(3)复杂反应的反应速率由基元反应中活化能(能垒)最大的慢反应决定
过渡态1
0.70
0.00
0=M0=0
2
过渡态2
HOMo-OCH
E
Mo=O
+CHOH
1
步骤1
-
步骤2
反应过程
A.E2=1.41eV
B.步骤2逆向反应的AH=+0.29eV
C.步骤1的反应比步骤2快
D.该过程实现了甲烷的氧化
解析:由能量变化图可知,E2=0.70eV-(-0.71eV)=1.41eV,A项
正确;步骤2逆向反应的△H=-0.71eV-(-1.00eV)=+0.29eV,B项
正确;步骤1的活化能E1=0.70eV,步骤2的活化能
E3=-0.49eV
(-0.71eV)=0.22eV,步骤1的活化能大于步骠2的活
化能,步骤1的反应比步骤2慢,C项错误;该过程中甲烷转化为甲醇,实
现了甲烷的氧化,D项正确
