人教版高中化学选择性必修1第二章化学反应速率与化学平衡聚焦突破3速率常数、压强平衡常数及其应用课件(共28张PPT)
文档属性
| 名称 | 人教版高中化学选择性必修1第二章化学反应速率与化学平衡聚焦突破3速率常数、压强平衡常数及其应用课件(共28张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 5.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-12 16:27:49 | ||
图片预览







文档简介
(共28张PPT)
聚焦突破3 速率常数、压强平衡常数
及其应用
一、速率常数与平衡常数
二、压强平衡常数
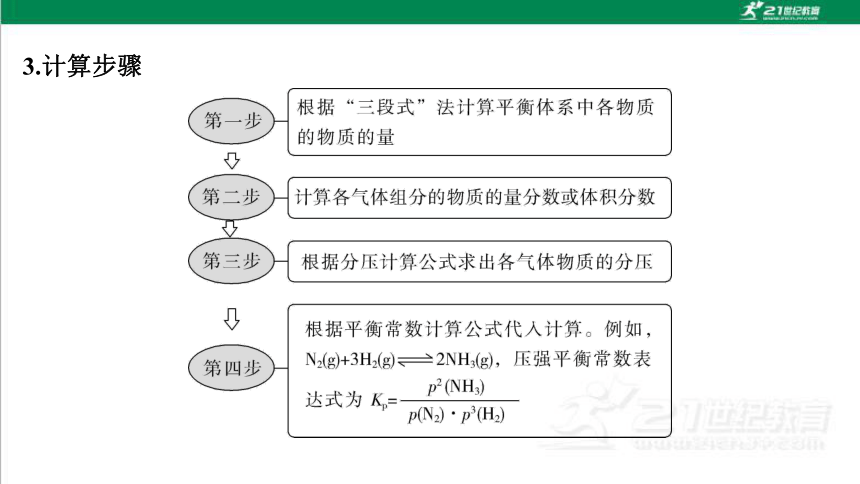
3.计算步骤
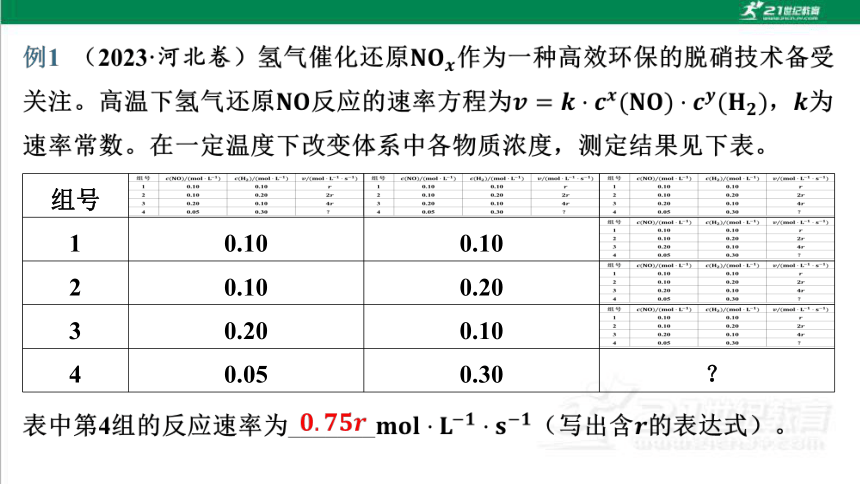
组号
1 0.10 0.10
2 0.10 0.20
3 0.20 0.10
4 0.05 0.30 ?
【突破集训】
序号
① 0.30
② 0.60
③ 0.90
2
0.1 8.0
16.0
0.15 6.75
0.2
0 10 20 30 40
15.00 14.02 13.20 12.50 12.50
0.1
6.(2023·全国乙卷)硫酸亚铁在工农业生产中有许多用途,如可用作农药
防治小麦黑穗病,制造磁性氧化铁、铁催化剂等。回答下列问题:
3.0
2.25
增大
46.26
2门世2有
3厚
1.速率常数(k):在给定温度下,反应物浓度皆为1mol·L1时的反应速率。
1)
在相同浓度的条件下,可用速率常数大小来比较化学反应的反应速率
。
(2)速率常数是温度的函数,在恒温条件下,速率常数不随反应物浓度
的变化而改变。
2.速率方程:反应速率与参加反应的物质的浓度的关系式。例如,反应
H2(g)+2(g)=2HI(g)的速率方程为v=k·c(H2)·c(2)。
[注意]速率方程是实验测定的结果,不能随意根据反应的化学方程式
直接写出。
3.速率常数与平衡常数之间的关系
般情况下,反应mA(g)+nB(g)=pC(g),v正=k正·cm(A)·c(B),
逆=k逆·cP(C),平衡常数K=
k正
1.分压
(1)定义:相同温度下,当某组分气体B单独存在且具有与混合气体总体
积相同的体积时,该气体B所具有的压强,称为气体B的分压。
(2)计算公式:混合气体中某组分的分压=总压×该组分的物质的量分数
即PB=卫总义。
(3)分压定律:混合气体的总压等于相同温度下各组分气体的分压之和
即p总=pA十pB十pC十
2.压强平衡常数
-定温度下,气相反应mA(g)+nB(g)=eC(g)+fD(g)达到平衡时,气
态生成物分压幂之积与气态反应物分压幂之积的比值为一个常数,称为该
反应的压强平衡常数,用符号K表示,K,的表达式为K,=9”C
A)pn(B)
根据“三段式”法计算平衡休系中各物质
第一步
的物质的量
第二步
计算各气体组分的物质的量分数或体积分数
第三步
根据分压计算公式求出各气体物质的分压
根据平衡常数计算公式代入计算。例如,
第四步
N2(g)+3H2(g)≥2NH3(g),压强平衡常数表
p2(NH3)
达式为K=
pN2)·p3(H2)
聚焦突破3 速率常数、压强平衡常数
及其应用
一、速率常数与平衡常数
二、压强平衡常数
3.计算步骤
组号
1 0.10 0.10
2 0.10 0.20
3 0.20 0.10
4 0.05 0.30 ?
【突破集训】
序号
① 0.30
② 0.60
③ 0.90
2
0.1 8.0
16.0
0.15 6.75
0.2
0 10 20 30 40
15.00 14.02 13.20 12.50 12.50
0.1
6.(2023·全国乙卷)硫酸亚铁在工农业生产中有许多用途,如可用作农药
防治小麦黑穗病,制造磁性氧化铁、铁催化剂等。回答下列问题:
3.0
2.25
增大
46.26
2门世2有
3厚
1.速率常数(k):在给定温度下,反应物浓度皆为1mol·L1时的反应速率。
1)
在相同浓度的条件下,可用速率常数大小来比较化学反应的反应速率
。
(2)速率常数是温度的函数,在恒温条件下,速率常数不随反应物浓度
的变化而改变。
2.速率方程:反应速率与参加反应的物质的浓度的关系式。例如,反应
H2(g)+2(g)=2HI(g)的速率方程为v=k·c(H2)·c(2)。
[注意]速率方程是实验测定的结果,不能随意根据反应的化学方程式
直接写出。
3.速率常数与平衡常数之间的关系
般情况下,反应mA(g)+nB(g)=pC(g),v正=k正·cm(A)·c(B),
逆=k逆·cP(C),平衡常数K=
k正
1.分压
(1)定义:相同温度下,当某组分气体B单独存在且具有与混合气体总体
积相同的体积时,该气体B所具有的压强,称为气体B的分压。
(2)计算公式:混合气体中某组分的分压=总压×该组分的物质的量分数
即PB=卫总义。
(3)分压定律:混合气体的总压等于相同温度下各组分气体的分压之和
即p总=pA十pB十pC十
2.压强平衡常数
-定温度下,气相反应mA(g)+nB(g)=eC(g)+fD(g)达到平衡时,气
态生成物分压幂之积与气态反应物分压幂之积的比值为一个常数,称为该
反应的压强平衡常数,用符号K表示,K,的表达式为K,=9”C
A)pn(B)
根据“三段式”法计算平衡休系中各物质
第一步
的物质的量
第二步
计算各气体组分的物质的量分数或体积分数
第三步
根据分压计算公式求出各气体物质的分压
根据平衡常数计算公式代入计算。例如,
第四步
N2(g)+3H2(g)≥2NH3(g),压强平衡常数表
p2(NH3)
达式为K=
pN2)·p3(H2)
