人教版高中化学选择性必修1第三章水溶液中的离子反应与平衡聚焦突破6溶液中微粒浓度的大小比较课件(共25张PPT)
文档属性
| 名称 | 人教版高中化学选择性必修1第三章水溶液中的离子反应与平衡聚焦突破6溶液中微粒浓度的大小比较课件(共25张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 5.9MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-12 16:29:10 | ||
图片预览








文档简介
(共25张PPT)
聚焦突破6 溶液中微粒浓度的大小比较
一、溶液中的电离、水解理论
二、溶液中的守恒规律
例1 常温下,下列有关电解质溶液的叙述正确的是( )
√
下列说法正确的是( )
√
电解质溶液中微粒浓度大小比较的思维方法
【突破集训】
一、单一溶液中微粒浓度的关系
√
√
二、不同溶液中同一微粒浓度的大小比较
3.比较下列几组溶液中指定微粒浓度的大小(填序号)。
三、混合溶液中微粒浓度的关系
√
√
一元弱酸溶液
下列说法错误的是( )
√
2门世2有
3厚
1.电离理论
(1)弱电解质的电离是微弱的,电离产生的微粒都非常少,同时还要考
虑水的电离。
如氨水中,NH3·H2O、NH4、OH的浓度大小关系是
c(NH3 H2O)>C(OH-)>C(NH).
(2)多元弱酸的电离是分步进行的,且第一步电离程度远大于第二步,
以此类推。
如H2S溶液中,H2S、HS、S2-、H+的浓度大小关系是
c(H2S)>c(H+)>c(HS-)>c(S2-).
2水解理论
(1)盐的水解是微弱的,水解生成微粒的浓度一般小于发生水解的离子
的浓度。
如NH4CI溶液中,NH4、CI、NH3·H2O、H+的浓度大小关系为
c(CI)>c(NH4)>c(H+)>c(NH3·H2O)。
(2)多元弱酸阴离子的水解是分步进行的,且第一步水解程度远大于第
二步,以此类推。
如Na2C03溶液中,C0 、HC03、H2CO3的浓度大小关系为
c(C03)>c(HC03)>c(H2CO3)。
1.电荷守恒
电解质溶液中阳离子所带的电荷总数与阴离子所带的电荷总数相等,即电
荷守恒,溶液呈电中性。
如NaHCO3溶液中存在Na+、H+、HCO3、CO 、OH,根据电荷守恒,
可推出各种离子的浓度之间的关系为
c(Na+)+c(H+)=c(HC03)+c(OH-)+2c(CO3).
2.元素守恒
在电解质溶液中,由于某些离子发生水解或电离,离子的存在形式发生了
变化。离子所含的某种元素在变化前后是守恒的
如K2S溶液中,S元素以S2-、HS、H2S三种形式存在,K+的浓度与它们
的浓度之间的关系为c(K+)=2c(S2-)+2c(HS)+2c(H2S)。
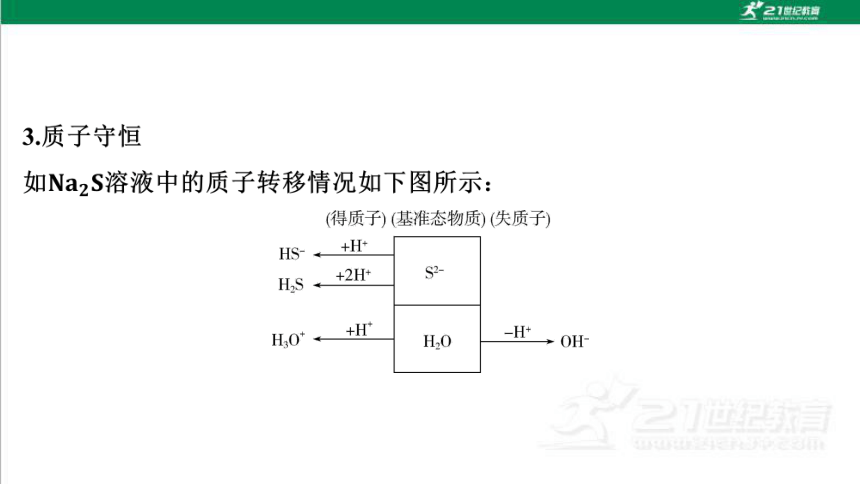
(得质子)(基准态物质)(失质子)
HS-
+H+
+2H+
S2-
HS
H:O
+H'
-H+
H30
OH
聚焦突破6 溶液中微粒浓度的大小比较
一、溶液中的电离、水解理论
二、溶液中的守恒规律
例1 常温下,下列有关电解质溶液的叙述正确的是( )
√
下列说法正确的是( )
√
电解质溶液中微粒浓度大小比较的思维方法
【突破集训】
一、单一溶液中微粒浓度的关系
√
√
二、不同溶液中同一微粒浓度的大小比较
3.比较下列几组溶液中指定微粒浓度的大小(填序号)。
三、混合溶液中微粒浓度的关系
√
√
一元弱酸溶液
下列说法错误的是( )
√
2门世2有
3厚
1.电离理论
(1)弱电解质的电离是微弱的,电离产生的微粒都非常少,同时还要考
虑水的电离。
如氨水中,NH3·H2O、NH4、OH的浓度大小关系是
c(NH3 H2O)>C(OH-)>C(NH).
(2)多元弱酸的电离是分步进行的,且第一步电离程度远大于第二步,
以此类推。
如H2S溶液中,H2S、HS、S2-、H+的浓度大小关系是
c(H2S)>c(H+)>c(HS-)>c(S2-).
2水解理论
(1)盐的水解是微弱的,水解生成微粒的浓度一般小于发生水解的离子
的浓度。
如NH4CI溶液中,NH4、CI、NH3·H2O、H+的浓度大小关系为
c(CI)>c(NH4)>c(H+)>c(NH3·H2O)。
(2)多元弱酸阴离子的水解是分步进行的,且第一步水解程度远大于第
二步,以此类推。
如Na2C03溶液中,C0 、HC03、H2CO3的浓度大小关系为
c(C03)>c(HC03)>c(H2CO3)。
1.电荷守恒
电解质溶液中阳离子所带的电荷总数与阴离子所带的电荷总数相等,即电
荷守恒,溶液呈电中性。
如NaHCO3溶液中存在Na+、H+、HCO3、CO 、OH,根据电荷守恒,
可推出各种离子的浓度之间的关系为
c(Na+)+c(H+)=c(HC03)+c(OH-)+2c(CO3).
2.元素守恒
在电解质溶液中,由于某些离子发生水解或电离,离子的存在形式发生了
变化。离子所含的某种元素在变化前后是守恒的
如K2S溶液中,S元素以S2-、HS、H2S三种形式存在,K+的浓度与它们
的浓度之间的关系为c(K+)=2c(S2-)+2c(HS)+2c(H2S)。
(得质子)(基准态物质)(失质子)
HS-
+H+
+2H+
S2-
HS
H:O
+H'
-H+
H30
OH
