人教版高中化学选择性必修1第三章水溶液中的离子反应与平衡聚焦突破7酸碱中和滴定曲线、分布系数图像分析课件(共31张PPT)
文档属性
| 名称 | 人教版高中化学选择性必修1第三章水溶液中的离子反应与平衡聚焦突破7酸碱中和滴定曲线、分布系数图像分析课件(共31张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 7.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-12 00:00:00 | ||
图片预览



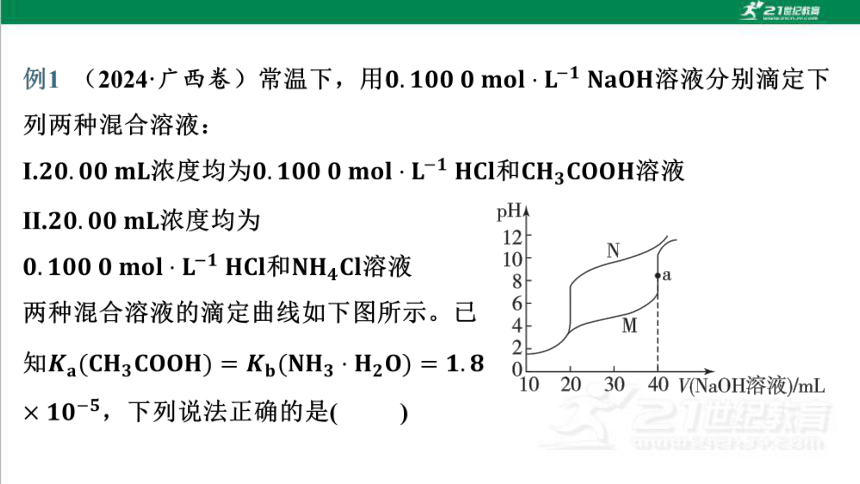




文档简介
(共31张PPT)
聚焦突破7 酸碱中和滴定曲线、分布系数图
像分析
一、酸碱中和滴定曲线分析
关键点 溶液中溶质成分及微粒浓度大小关系
关键点 溶液中溶质成分及微粒浓度大小关系
续表
2.抓好“三步”,做出精准判断
(1)明确横、纵坐标含义:分析滴定曲线时,要分清加入的是酸溶液还
是碱溶液。
(2)抓住关键点:重视起点、交点、最高点和终点。利用起点可判断酸
或碱的强弱,计算电离常数;关注交点,交点处微粒浓度相同,可用此特
殊关系计算电离常数或水解常数。
(3)联系规律:注意运用电离平衡、水解平衡规律及电荷守恒、元素守
恒关系分析判断。
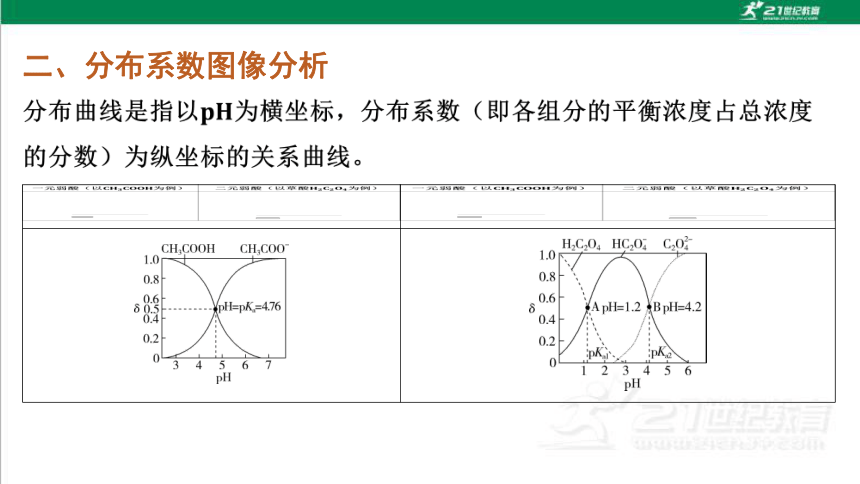
二、分布系数图像分析
_________________________________________ ______________________________________________
续表
√
√
【突破集训】
√
√
√
√
√
√
2门世2有
3厚
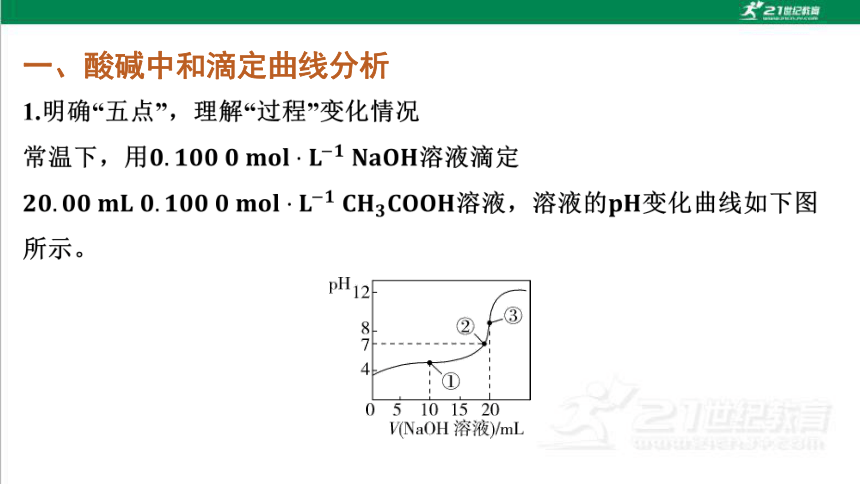
1.明确“五点”,理解“过程”变化情况
常温下,用0.1000mol·L-1Na0H溶液滴定
20.00mL0.1000mol·L-1CH3C00H溶液,溶液的pH变化曲线如下图
所示。
PH12
3
87
2
1
4
I
I
I
0
5
10
15
20
VNaOH溶液)/mL
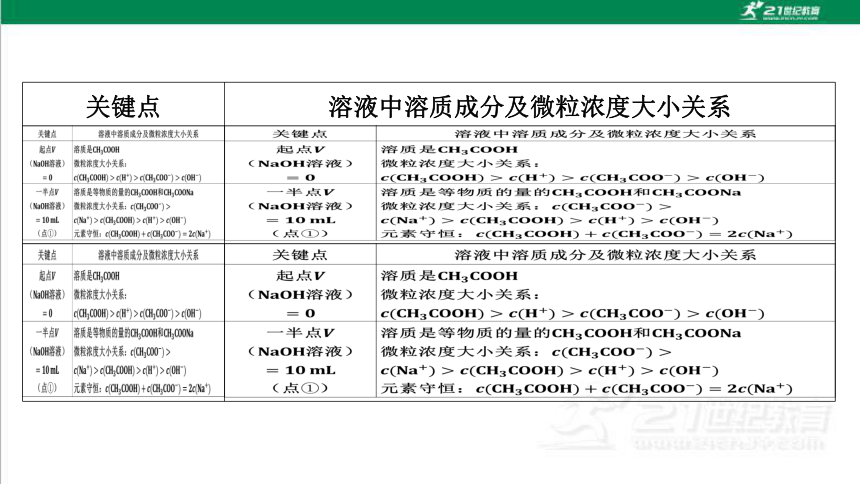
关键点
溶液中溶质成分及微粒浓度大小关系
起点V
溶质是CH3COOH
(NaOH溶液
微粒浓度大小关系:
三
0
C(CH3COOH)>C(H)>C(CH3COO)>C(OH)
一半点V
溶质是等物质的量的CH3COOH和CH3 COONa
(NaOH溶液
)
微粒浓度大小关系:c(CH3CO0)>
=10mL
c(Na+)>c(CH3COOH)c(H+)>c(OH-)
(点①)
元素守恒:c(CH3C0OH)+c(CH3CO0)=2c(Na+)
关键点
溶液中溶质成分及微粒浓度大小关系
溶质是CH3 COONa和少量的CH3COOH
中性点pH=7(点②
微粒浓度大小关系:
c(Na)c(CH3COO-)>c(H+)=c(OH-)
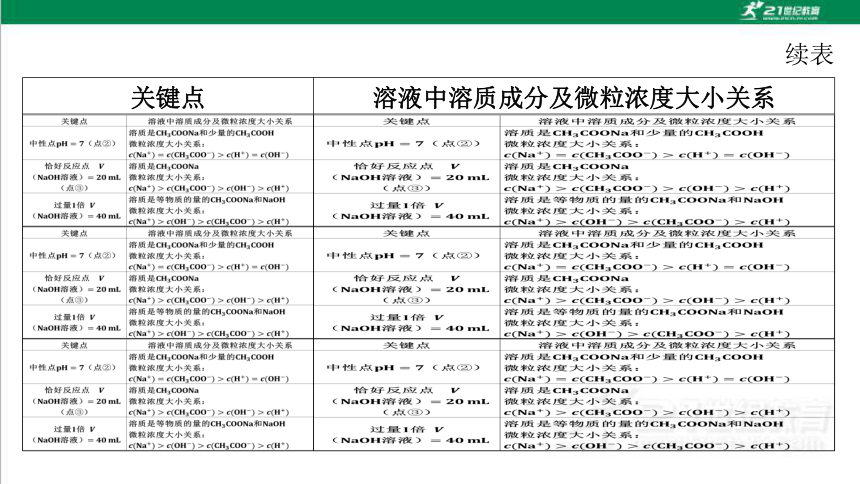
恰好反应点V
溶质是CH3 COONa
(Na0H溶液)=20mL
微粒浓度大小关系:
(点③)
c(Na)>c(CH3COO-)>C(OH)>c(H+)
溶质是等物质的量的CH3 COONa和NaOH
过量1倍
微粒浓度大小关系:
(Na0H溶液)=40mL
c(Na)>c(OH-)>c(CH3COO-)>c(H+)
聚焦突破7 酸碱中和滴定曲线、分布系数图
像分析
一、酸碱中和滴定曲线分析
关键点 溶液中溶质成分及微粒浓度大小关系
关键点 溶液中溶质成分及微粒浓度大小关系
续表
2.抓好“三步”,做出精准判断
(1)明确横、纵坐标含义:分析滴定曲线时,要分清加入的是酸溶液还
是碱溶液。
(2)抓住关键点:重视起点、交点、最高点和终点。利用起点可判断酸
或碱的强弱,计算电离常数;关注交点,交点处微粒浓度相同,可用此特
殊关系计算电离常数或水解常数。
(3)联系规律:注意运用电离平衡、水解平衡规律及电荷守恒、元素守
恒关系分析判断。
二、分布系数图像分析
_________________________________________ ______________________________________________
续表
√
√
【突破集训】
√
√
√
√
√
√
2门世2有
3厚
1.明确“五点”,理解“过程”变化情况
常温下,用0.1000mol·L-1Na0H溶液滴定
20.00mL0.1000mol·L-1CH3C00H溶液,溶液的pH变化曲线如下图
所示。
PH12
3
87
2
1
4
I
I
I
0
5
10
15
20
VNaOH溶液)/mL
关键点
溶液中溶质成分及微粒浓度大小关系
起点V
溶质是CH3COOH
(NaOH溶液
微粒浓度大小关系:
三
0
C(CH3COOH)>C(H)>C(CH3COO)>C(OH)
一半点V
溶质是等物质的量的CH3COOH和CH3 COONa
(NaOH溶液
)
微粒浓度大小关系:c(CH3CO0)>
=10mL
c(Na+)>c(CH3COOH)c(H+)>c(OH-)
(点①)
元素守恒:c(CH3C0OH)+c(CH3CO0)=2c(Na+)
关键点
溶液中溶质成分及微粒浓度大小关系
溶质是CH3 COONa和少量的CH3COOH
中性点pH=7(点②
微粒浓度大小关系:
c(Na)c(CH3COO-)>c(H+)=c(OH-)
恰好反应点V
溶质是CH3 COONa
(Na0H溶液)=20mL
微粒浓度大小关系:
(点③)
c(Na)>c(CH3COO-)>C(OH)>c(H+)
溶质是等物质的量的CH3 COONa和NaOH
过量1倍
微粒浓度大小关系:
(Na0H溶液)=40mL
c(Na)>c(OH-)>c(CH3COO-)>c(H+)
