人教版高中化学选择性必修1第一章化学反应的热效应聚焦突破1反应热的大小比较和再计算课件(共20张PPT)
文档属性
| 名称 | 人教版高中化学选择性必修1第一章化学反应的热效应聚焦突破1反应热的大小比较和再计算课件(共20张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 4.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-12 16:32:44 | ||
图片预览








文档简介
(共20张PPT)
聚焦突破1 反应热的大小比较和再计算
一、“五相关”突破反应热的大小比较
二、“四步骤”突破盖斯定律在反应热计算中的应用
√
【突破集训】
√
√
3.下图为两种制备硫酸的途径(反应条件略),下列说法正确的是( )
√
2门世2有
3厚
1.与“符号”相关
对于放热反应来说,△H=一Qk·mol-1,虽然”仅表示放热的意思,但在
比较△H大小时要将其看成真正意义上的“负号”,即放热越多,△H反而越小。
2.与“化学计量数”相关
例如,H2(g)+02(g)=H20)△H1=-ak·mol1,
2H2(g)+02(g)=2H20(①)
AH2=-bk·mol-1,则aAH2
3.与“物质聚集状态”相关
(1)同一反应,生成物状态不同
A(g)+B(g)=C(g)△H1<0
A(g)+B(g)=C(①)△H2<0
因为C(g)=CI)△H3<0,AH3=△H2-△H1,所以△H2<△H1
4.与“同素异形体”相关
C(石墨,S)+02(g)=C02(g)AH1
C(金刚石,S)+02(g)=C02(g)△H2
因为C(石墨,S)=C(金刚石,S)△H>0,所以△H1>△H2。
5.与“反应进行程度”相关
(1)对于燃烧反应,燃烧越充分放出的热量越多,△H越小。如
2C(s)+02(g)=2C0(g)AH1,2C(s)+202(g)=2C02(g)△H2,
△H1>△H2
(2)对于可逆反应,若正反应为放热(吸热)反应,则反应正向进行的
程度越大,反应放出(吸收)的热量就越多。
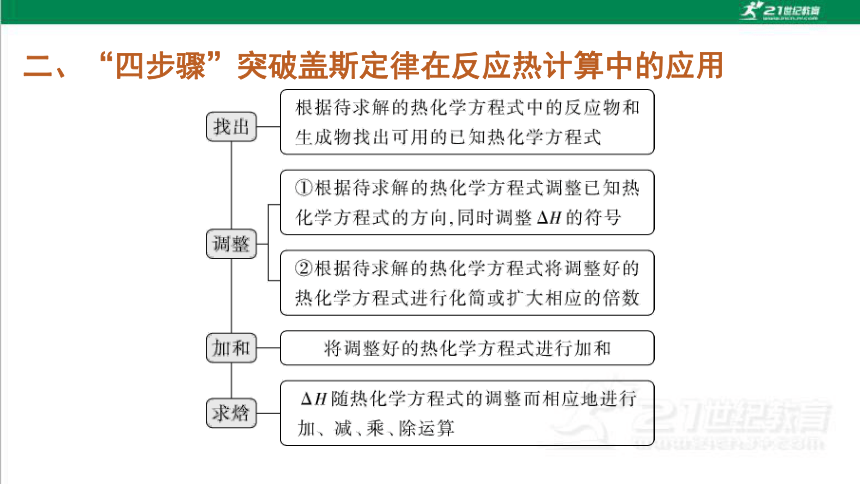
根据待求解的热化学方程式中的反应物和
找出
生成物找出可用的已知热化学方程式
①根据待求解的热化学方程式调整已知热
化学方程式的方向,同时调整△H的符号
调整
②根据待求解的热化学方程式将调整好的
热化学方程式进行化简或扩大相应的倍数
加和
将调整好的热化学方程式进行加和
△H随热化学方程式的调整而相应地进行
水焓
加、减、乘、除运算
例1已知:
①2H2(g)+02(g)=2H20(g)AH1
②3H2(g)+Fe203(s)=2Fe(s)+3H20(g)△H2
2Fe(s)+02(g)=Fe203(s)AH3
④2AI(S)+02(g)=Al203(s)△H4
52Al(s)+Fe203(s)=Al203(s)+2Fe(s)AH5
下列关于上述反应焓变的判断正确的是(
聚焦突破1 反应热的大小比较和再计算
一、“五相关”突破反应热的大小比较
二、“四步骤”突破盖斯定律在反应热计算中的应用
√
【突破集训】
√
√
3.下图为两种制备硫酸的途径(反应条件略),下列说法正确的是( )
√
2门世2有
3厚
1.与“符号”相关
对于放热反应来说,△H=一Qk·mol-1,虽然”仅表示放热的意思,但在
比较△H大小时要将其看成真正意义上的“负号”,即放热越多,△H反而越小。
2.与“化学计量数”相关
例如,H2(g)+02(g)=H20)△H1=-ak·mol1,
2H2(g)+02(g)=2H20(①)
AH2=-bk·mol-1,则a
3.与“物质聚集状态”相关
(1)同一反应,生成物状态不同
A(g)+B(g)=C(g)△H1<0
A(g)+B(g)=C(①)△H2<0
因为C(g)=CI)△H3<0,AH3=△H2-△H1,所以△H2<△H1
4.与“同素异形体”相关
C(石墨,S)+02(g)=C02(g)AH1
C(金刚石,S)+02(g)=C02(g)△H2
因为C(石墨,S)=C(金刚石,S)△H>0,所以△H1>△H2。
5.与“反应进行程度”相关
(1)对于燃烧反应,燃烧越充分放出的热量越多,△H越小。如
2C(s)+02(g)=2C0(g)AH1,2C(s)+202(g)=2C02(g)△H2,
△H1>△H2
(2)对于可逆反应,若正反应为放热(吸热)反应,则反应正向进行的
程度越大,反应放出(吸收)的热量就越多。
根据待求解的热化学方程式中的反应物和
找出
生成物找出可用的已知热化学方程式
①根据待求解的热化学方程式调整已知热
化学方程式的方向,同时调整△H的符号
调整
②根据待求解的热化学方程式将调整好的
热化学方程式进行化简或扩大相应的倍数
加和
将调整好的热化学方程式进行加和
△H随热化学方程式的调整而相应地进行
水焓
加、减、乘、除运算
例1已知:
①2H2(g)+02(g)=2H20(g)AH1
②3H2(g)+Fe203(s)=2Fe(s)+3H20(g)△H2
2Fe(s)+02(g)=Fe203(s)AH3
④2AI(S)+02(g)=Al203(s)△H4
52Al(s)+Fe203(s)=Al203(s)+2Fe(s)AH5
下列关于上述反应焓变的判断正确的是(
