沪科教九年级化学第二章第一节 性质活泼的氧气(共35张PPT)
文档属性
| 名称 | 沪科教九年级化学第二章第一节 性质活泼的氧气(共35张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 4.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-07-07 09:16:26 | ||
图片预览








文档简介
课件35张PPT。第一节 性质活泼的氧气空气中各组分气体的体积分数大约是:空气是由多种气体组成的混合物氮气(N2):78%
氧气(O2):21%
稀有气体:0.94%
二氧化碳(CO2):0.03%
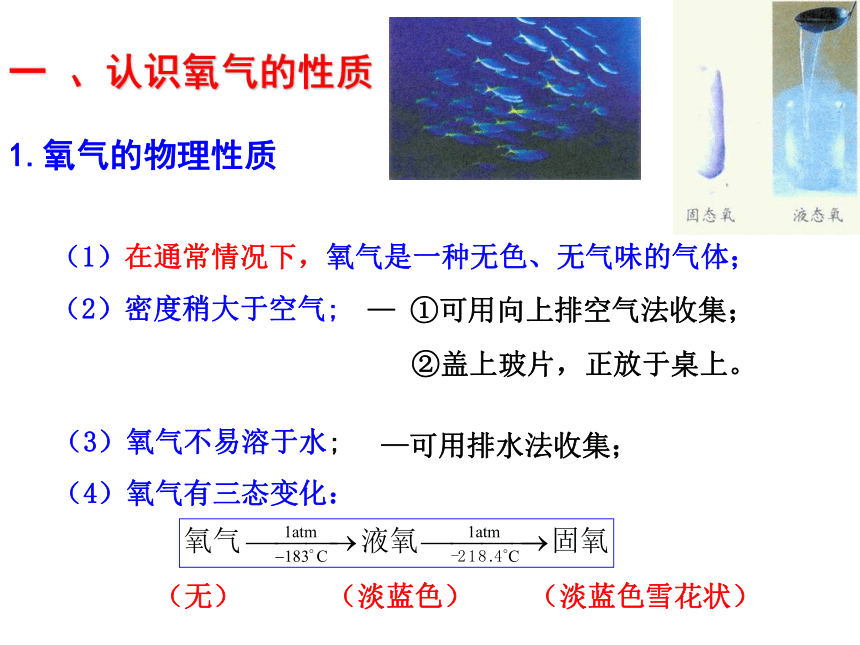
其他气体和杂质:0.03%为什么各种生物在消耗氧气,物质的燃烧也消耗氧气。但空气中的氧气含量却能几乎保持恒定?通常情况下,因自然界中的氧循环,使空气中的氧气的含量几乎保持相对恒定。氧气有哪些重要的性质?举例说明。1.氧气的物理性质 (1)在通常情况下,氧气是一种无色、无气味的气体;
(2)密度稍大于空气;(3)氧气不易溶于水;— ①可用向上排空气法收集;—可用排水法收集; ②盖上玻片,正放于桌上。(4)氧气有三态变化:
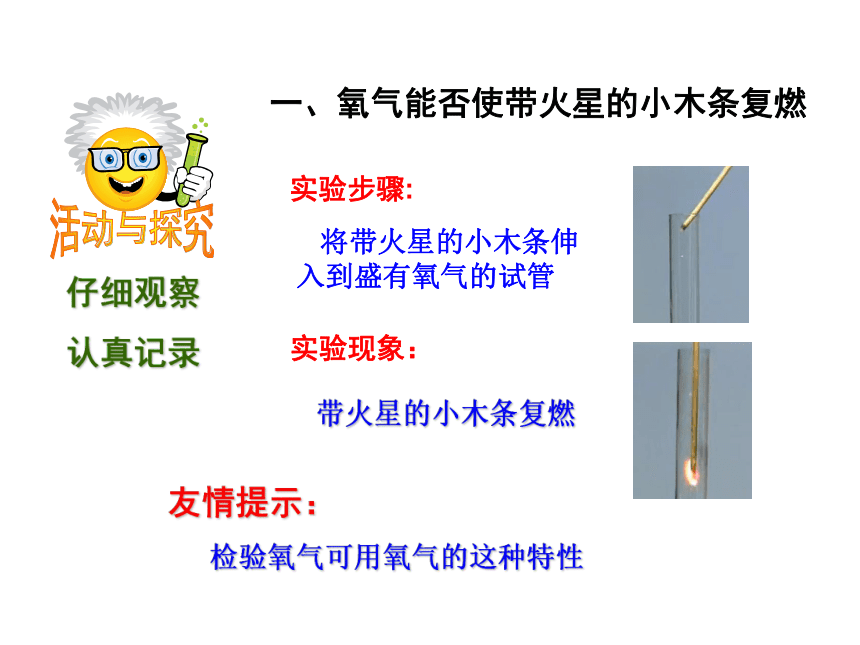
(无) (淡蓝色) (淡蓝色雪花状)一 、认识氧气的性质小知识:标准状况是指:__________________通常状况是指:__________________0℃,1.01×105Pa20℃,1.01×105Pa一 、认识氧气的性质2、化学性质:化学性质比较活泼的气体,在一定条件下,可以和物质发生化学反应,同时放出热量。一、氧气能否使带火星的小木条复燃 将带火星的小木条伸入到盛有氧气的试管实验步骤:实验现象:带火星的小木条复燃友情提示:
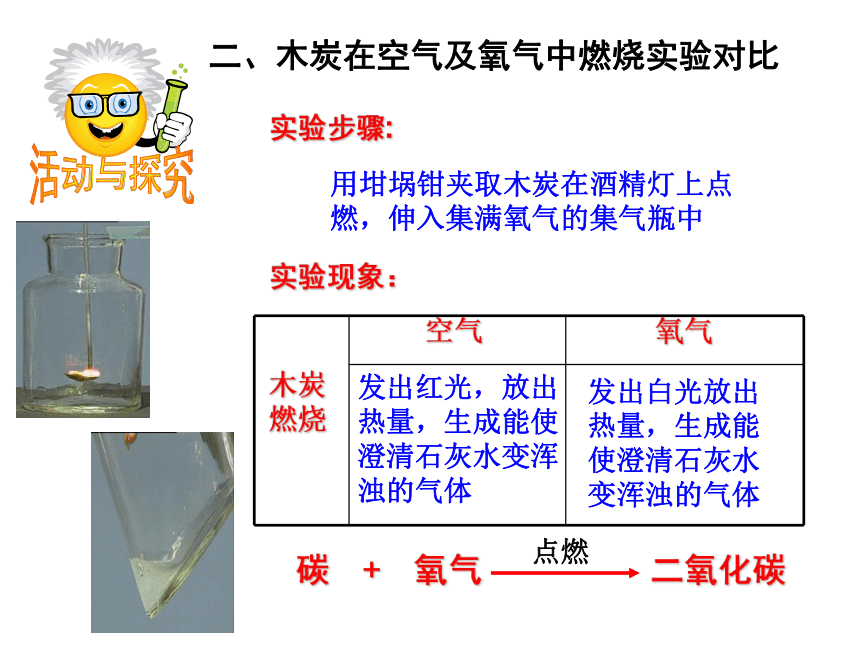
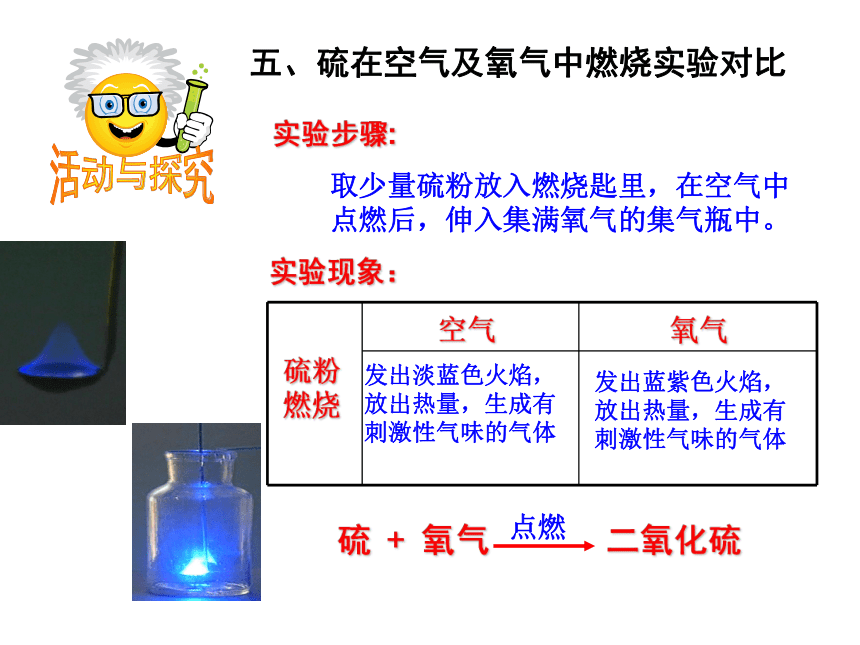
检验氧气可用氧气的这种特性活动与探究二、木炭在空气及氧气中燃烧实验对比实验现象:木炭燃烧空气氧气发出红光,放出热量,生成能使澄清石灰水变浑浊的气体发出白光放出热量,生成能使澄清石灰水变浑浊的气体活动与探究三、蜡烛在空气及氧气中燃烧实验对比实验步骤:将蜡烛固定在燃烧匙内,在空气中点燃后,伸入集满氧气的集气瓶。空气氧气黄白色的火焰,放出热量,瓶壁有水雾出现,生成能使澄清石灰水变浑浊的气体火焰明亮,发出白光,放出热量,瓶壁有水雾出现,生成能使澄清石灰水变浑浊的气体实验现象:蜡烛燃烧活动与探究四、铁丝在氧气中燃烧实验实验步骤:在螺旋状的细铁丝末端系上火柴杆,点燃末端火柴杆,待即将燃尽时,伸入集满氧气的集气瓶中。瓶底铺少量沙子或加少量的水。空气氧气剧烈燃烧,火星四射,放出大量的热,生成黑色固体实验现象:铁丝燃烧活动与探究五、硫在空气及氧气中燃烧实验对比实验步骤:取少量硫粉放入燃烧匙里,在空气中点燃后,伸入集满氧气的集气瓶中。空气氧气发出淡蓝色火焰,放出热量,生成有刺激性气味的气体发出蓝紫色火焰,放出热量,生成有刺激性气味的气体实验现象:硫粉燃烧小结:氧气的化学性质⑶ 可燃物在氧气中燃烧通常比在空气中剧烈;⑷ 某些在空气中不能燃烧的物质,在氧气中却可以燃烧,而且燃烧很剧烈。因为氧气的浓度不同⑵ 有助燃性、无可燃性⑴ 氧气的化学性质比较活泼,能和许多物质发生反应;在反应中,氧气体现出氧化性。腐烂的苹果 氧气化学性质比较活泼。许多物质会被氧气氧化。在某些条件下,反应比较剧烈;而另 一些条件下,只发生缓慢的氧化反应。有机肥的腐熟铁钉锈蚀二 、氧气的用途氧气的用途1、 工业制法原 理:利用液氧液氮沸点的不同来分离液态空气(属物理变化)三 、氧气的制法2、 实验室制法三 、氧气的制法氧气实验室制法氧气实验室制法高锰酸钾制氧气固固加热型固液不加热型双氧水制氧气与高锰酸钾制氧气相比具有的优点是:2、产物无污染3、不需要加热,节约能源1、操作简单思考:高锰酸钾制氧气氧气实验室制法氧气实验室制法一查:检查装置的气密性
二装:将药品装入试管并塞紧胶塞
三定:将试管固定在铁架台上
四点:点燃酒精灯给试管加热
五收:用排水法收集氧气
六离:将导管移离出水面
七熄:熄灭酒精灯高锰酸钾(茶庄定点收利息)高锰酸钾制氧气氧气实验室制法1、检查装置的气密性
2、向锥形瓶装入二氧化锰,塞紧双孔胶塞再通过长颈漏斗倒入双氧水
3、用排水法收集氧气
4、将导管移出水面双氧水氧气实验室制法(1)试管口要放置一团棉花(2)试管口要略向下倾斜防止水倒流后炸裂试管(3)导管只须露出橡皮塞少许; (4)先均匀加热,再将外焰对准药品处加热;(5)收集时,应等气泡连续均匀放出时再收集;(7)用排水法收集完毕后,应把导管先从水中取出再停止加热,防止水倒流使试管骤冷炸裂。(6)铁夹应夹持在试管中上部; 氧气实验室制法用带火星的木条伸入集气瓶中,木条复燃,则收集到的是氧气。验满方法:
若用向上排空气法收集,将带火星的木条靠近瓶口,木条复燃则满了。
用排水法收集时,当水中出现大气泡时,则已满。实验装置组装原则:“先左后右,由下而上”;拆卸与组装相反。催化剂的特点:一变二不变
一 变:改变反应速率
二不变:本身质量和化学性质不变
催化剂的作用:催化作用氧气实验室制法导管水槽水集气瓶3.气体收集方法(1)排水集气法(排水法)(1)排水法一.适用范围不易溶解于水的气体,并且不与水反应二.优点三.缺点收集不如排空气法方便1.易于收集到较纯的气体
2.便于观察气体是否已经收集满导管集气瓶玻片(2)向上排空气法(2)向上排空气法一.适用范围密度比空气大的气体二.优点操作较为方便三.缺点1. 较难判断气体是否已经收集满2. 收集到的气体可能不纯1.工业上制备大量氧气是采用 的方法,其原理是利用液态氮的沸点比液态氧的沸点 的性质。蒸发液态空气时, 首先蒸发出来,剩下的主要是 。此变化属于 。工业上为了便于贮存、运输和使用,常把氧气加压到1.5×107 Pa,并贮存在钢瓶中。分离液态空气低氮气液氧物理变化A__________B_________
C__________D_________
E__________F_________试 管铁架台酒精灯导 管集气瓶水槽2.仪器名称:气体的
发生装置气体的
收集装置3.实验室制取氧气时,装药品的大试管口应 ( )
A.朝下 B.朝上
C.略向下倾斜 D.略向上倾斜C 4.实验室采用排水法收集氧气时,需将导气管伸入盛满水的集气瓶,这个操作应在( )
A.加热固体药品前
B.与加热固体药品同时
C.开始有气泡放出时
D.气泡连续并均匀放出时D5.下列说法中正确的是( )
A.在过氧化氢催化分解的反应中,二氧化锰起催化作用
B.氧气的化学性质很活泼,在常温下能与所有物质发生化学反应
C.工业上分离液态空气制氧气的过程属于化学变化
D.没有二氧化锰作催化剂,过氧化氢溶液就不会产生氧气A 6.如图所示,过氧化氢(H2O2)在催
化剂二氧化锰的作用下,迅速分解
放出大量氧气。下列现象正确的
是 ( )
A.气球胀大,红墨水左移
B.气球缩小,红墨水右移
C.气球胀大,红墨水右移
D.气球缩小,红墨水左移D
氧气(O2):21%
稀有气体:0.94%
二氧化碳(CO2):0.03%
其他气体和杂质:0.03%为什么各种生物在消耗氧气,物质的燃烧也消耗氧气。但空气中的氧气含量却能几乎保持恒定?通常情况下,因自然界中的氧循环,使空气中的氧气的含量几乎保持相对恒定。氧气有哪些重要的性质?举例说明。1.氧气的物理性质 (1)在通常情况下,氧气是一种无色、无气味的气体;
(2)密度稍大于空气;(3)氧气不易溶于水;— ①可用向上排空气法收集;—可用排水法收集; ②盖上玻片,正放于桌上。(4)氧气有三态变化:
(无) (淡蓝色) (淡蓝色雪花状)一 、认识氧气的性质小知识:标准状况是指:__________________通常状况是指:__________________0℃,1.01×105Pa20℃,1.01×105Pa一 、认识氧气的性质2、化学性质:化学性质比较活泼的气体,在一定条件下,可以和物质发生化学反应,同时放出热量。一、氧气能否使带火星的小木条复燃 将带火星的小木条伸入到盛有氧气的试管实验步骤:实验现象:带火星的小木条复燃友情提示:
检验氧气可用氧气的这种特性活动与探究二、木炭在空气及氧气中燃烧实验对比实验现象:木炭燃烧空气氧气发出红光,放出热量,生成能使澄清石灰水变浑浊的气体发出白光放出热量,生成能使澄清石灰水变浑浊的气体活动与探究三、蜡烛在空气及氧气中燃烧实验对比实验步骤:将蜡烛固定在燃烧匙内,在空气中点燃后,伸入集满氧气的集气瓶。空气氧气黄白色的火焰,放出热量,瓶壁有水雾出现,生成能使澄清石灰水变浑浊的气体火焰明亮,发出白光,放出热量,瓶壁有水雾出现,生成能使澄清石灰水变浑浊的气体实验现象:蜡烛燃烧活动与探究四、铁丝在氧气中燃烧实验实验步骤:在螺旋状的细铁丝末端系上火柴杆,点燃末端火柴杆,待即将燃尽时,伸入集满氧气的集气瓶中。瓶底铺少量沙子或加少量的水。空气氧气剧烈燃烧,火星四射,放出大量的热,生成黑色固体实验现象:铁丝燃烧活动与探究五、硫在空气及氧气中燃烧实验对比实验步骤:取少量硫粉放入燃烧匙里,在空气中点燃后,伸入集满氧气的集气瓶中。空气氧气发出淡蓝色火焰,放出热量,生成有刺激性气味的气体发出蓝紫色火焰,放出热量,生成有刺激性气味的气体实验现象:硫粉燃烧小结:氧气的化学性质⑶ 可燃物在氧气中燃烧通常比在空气中剧烈;⑷ 某些在空气中不能燃烧的物质,在氧气中却可以燃烧,而且燃烧很剧烈。因为氧气的浓度不同⑵ 有助燃性、无可燃性⑴ 氧气的化学性质比较活泼,能和许多物质发生反应;在反应中,氧气体现出氧化性。腐烂的苹果 氧气化学性质比较活泼。许多物质会被氧气氧化。在某些条件下,反应比较剧烈;而另 一些条件下,只发生缓慢的氧化反应。有机肥的腐熟铁钉锈蚀二 、氧气的用途氧气的用途1、 工业制法原 理:利用液氧液氮沸点的不同来分离液态空气(属物理变化)三 、氧气的制法2、 实验室制法三 、氧气的制法氧气实验室制法氧气实验室制法高锰酸钾制氧气固固加热型固液不加热型双氧水制氧气与高锰酸钾制氧气相比具有的优点是:2、产物无污染3、不需要加热,节约能源1、操作简单思考:高锰酸钾制氧气氧气实验室制法氧气实验室制法一查:检查装置的气密性
二装:将药品装入试管并塞紧胶塞
三定:将试管固定在铁架台上
四点:点燃酒精灯给试管加热
五收:用排水法收集氧气
六离:将导管移离出水面
七熄:熄灭酒精灯高锰酸钾(茶庄定点收利息)高锰酸钾制氧气氧气实验室制法1、检查装置的气密性
2、向锥形瓶装入二氧化锰,塞紧双孔胶塞再通过长颈漏斗倒入双氧水
3、用排水法收集氧气
4、将导管移出水面双氧水氧气实验室制法(1)试管口要放置一团棉花(2)试管口要略向下倾斜防止水倒流后炸裂试管(3)导管只须露出橡皮塞少许; (4)先均匀加热,再将外焰对准药品处加热;(5)收集时,应等气泡连续均匀放出时再收集;(7)用排水法收集完毕后,应把导管先从水中取出再停止加热,防止水倒流使试管骤冷炸裂。(6)铁夹应夹持在试管中上部; 氧气实验室制法用带火星的木条伸入集气瓶中,木条复燃,则收集到的是氧气。验满方法:
若用向上排空气法收集,将带火星的木条靠近瓶口,木条复燃则满了。
用排水法收集时,当水中出现大气泡时,则已满。实验装置组装原则:“先左后右,由下而上”;拆卸与组装相反。催化剂的特点:一变二不变
一 变:改变反应速率
二不变:本身质量和化学性质不变
催化剂的作用:催化作用氧气实验室制法导管水槽水集气瓶3.气体收集方法(1)排水集气法(排水法)(1)排水法一.适用范围不易溶解于水的气体,并且不与水反应二.优点三.缺点收集不如排空气法方便1.易于收集到较纯的气体
2.便于观察气体是否已经收集满导管集气瓶玻片(2)向上排空气法(2)向上排空气法一.适用范围密度比空气大的气体二.优点操作较为方便三.缺点1. 较难判断气体是否已经收集满2. 收集到的气体可能不纯1.工业上制备大量氧气是采用 的方法,其原理是利用液态氮的沸点比液态氧的沸点 的性质。蒸发液态空气时, 首先蒸发出来,剩下的主要是 。此变化属于 。工业上为了便于贮存、运输和使用,常把氧气加压到1.5×107 Pa,并贮存在钢瓶中。分离液态空气低氮气液氧物理变化A__________B_________
C__________D_________
E__________F_________试 管铁架台酒精灯导 管集气瓶水槽2.仪器名称:气体的
发生装置气体的
收集装置3.实验室制取氧气时,装药品的大试管口应 ( )
A.朝下 B.朝上
C.略向下倾斜 D.略向上倾斜C 4.实验室采用排水法收集氧气时,需将导气管伸入盛满水的集气瓶,这个操作应在( )
A.加热固体药品前
B.与加热固体药品同时
C.开始有气泡放出时
D.气泡连续并均匀放出时D5.下列说法中正确的是( )
A.在过氧化氢催化分解的反应中,二氧化锰起催化作用
B.氧气的化学性质很活泼,在常温下能与所有物质发生化学反应
C.工业上分离液态空气制氧气的过程属于化学变化
D.没有二氧化锰作催化剂,过氧化氢溶液就不会产生氧气A 6.如图所示,过氧化氢(H2O2)在催
化剂二氧化锰的作用下,迅速分解
放出大量氧气。下列现象正确的
是 ( )
A.气球胀大,红墨水左移
B.气球缩小,红墨水右移
C.气球胀大,红墨水右移
D.气球缩小,红墨水左移D
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
