山东省蓬莱市第三中学2015-2016学年高二下期6月月考化学试卷(解析版)
文档属性
| 名称 | 山东省蓬莱市第三中学2015-2016学年高二下期6月月考化学试卷(解析版) |

|
|
| 格式 | zip | ||
| 文件大小 | 227.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-07-07 00:00:00 | ||
图片预览


文档简介
山东省蓬莱市第三中学2015-2016学年高二下期6月月考化学试卷(解析版)
1.已知某元素的最高化合价为+7价,下列说法中正确的是
A.该元素在元素周期表中一定处于ⅦA族
B.该元素可能是氟元素
C.该元素的某种化合物可能具有漂白性
D.该元素的单质没有还原性
【答案】C
【解析】C最高化合价为+7价的也可能是副
( http: / / www.21cnjy.com )族的锰元素(KMnO4),
氟元素是自然界氧化性最强的元素,最高价为0价,除氟元素外的
其他卤族元素兼有氧化性和还原性,以氧化性为主。
2.下列有关能量或反应热的说法正确的是(
)
A、化石燃料和植物燃料燃烧时放出的能量均来源于太阳能
B、牺牲阳极保护法是电能转化为化学能的过程
C、CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)===2CO(g)+O2(g)反应的△H=+2×283.0kJ/mol
D、放热反应一定比吸热反应更容易发生。
【答案】A、C
【解析】A、正确。
B、牺牲阳极保护法是活泼金属失去电子被氧化是过程,属于化学能转变成为电能的过程。
C、燃烧热的定义是1mol物质完全反应释放的能量,所以C正确。
D、错误
3.化合物分子中的所有原子都处于同一平面的是
A.甲苯
B.对二甲苯
C.氯乙烯
D.丙烯
【答案】C
【解析】
试题分析:A、甲苯中含有-CH3,甲基是四面体结构,故甲苯分子中所有原子不可能都处于同一平面,故A错误;
B、对二甲苯()是2个-CH3取代了苯分子中的2个H原子,因烷烃中C、H原子是四面体结构,故-CH3中C原子与3个H原子不可能全部处于同一平面,所以对二甲苯分子中所有原子不可能都处于同一平面,故B错误;C、乙烯是平面结构,氯乙烯分子中有一个氯原子代替了乙烯分子中的氢,位置关系不变,所有原子处于同一平面,故C正确;D、丙烯分子中也含有-CH3,故丙烯分子中所有原子不可能都处于同一平面,故D错误;故选C。
【考点定位】考查常见有机化合物的结构
【名师点晴】本题主要考查有机化合物的结构特
( http: / / www.21cnjy.com )点,做题时注意从甲烷、乙烯、苯和乙炔的结构特点判断有机分子的空间结构,在常见的有机化合物中甲烷是正四面体结构,乙烯和苯是平面型结构,乙炔是直线型结构,其它有机物可在此基础上进行判断,对有机物进行肢解,分部分析,另外要重点掌握碳碳单键可旋转、双键和三键不可旋转。
4.下列关于原子的叙述不正确的是(
)
A.中子数为33
B.电子数为33
C.质量数为60
D.质子数为27
【答案】B
【解析】
试题分析:在表示原子组成时元素符号的左下角
( http: / / www.21cnjy.com )表示质子数,左上角表示质量数。因为质子数和中子数之和是质量数,核外电子数=质子数,则该微粒的中子数是60—27=33,电子数是27,质量数是60,质子数是27,A、中子数是33,A项正确;B、电子数是27,B项错误;C、质量数是60,C项正确;D、质子数是27,D项正确;答案选B。
考点:考查原子结构
5.某溶液中加入铝粉有氢气产生,该溶液中一定可以大量共存的离子组是:
A.Na+、NO3-、Cl-、SO42-
B.Na+、K+、Ba2+、HCO3-
C.Fe3+、H+、SO42-、Cl-
D.Na+、K+、Cl-、SO42-
【答案】D
【解析】加入铝粉产生氢气,该溶液既可能是酸性,又可能为碱性;A、有硝酸根,物氢气产生;B、碳酸氢根不能共存;C、若为碱性,氢离子不能共存。
6.下列实验能够成功的是
A.用重结晶的方法分离苯甲酸和氯化钠的混合物
B.用苯和溴水在Fe催化下可制得溴苯
C.用乙醇、冰醋酸和pH=1的H2SO4溶液混合加热可制备乙酸乙酯
D.将电石与水反应后的气体直接通入到溴水中,可以验证乙炔能使溴水褪色的性质
【答案】A
【解析】
试题分析:A.苯甲酸与氯化
( http: / / www.21cnjy.com )钠的溶解度随温度变化不同,可用重结晶的方法分离,A正确;B.用苯和液溴在Fe催化下可制得溴苯,B错误;C.用乙醇、冰醋酸和浓硫酸混合加热可制备乙酸乙酯,C错误;D.将电石与水反应后的气体乙炔中还含有H2S等杂质,H2S等杂质也能使溴水褪色,则如果直接通入到溴水中,不能验证乙炔能使溴水褪色的性质,D错误,答案选A。
考点:考查有机化学实验方案设计与评价
7.下列各组中的两种物质相互反应时,无论哪种过量,都可用同一个离子方程式表示的是
①碳酸钠溶液与盐酸
②硫化氢气体与氯
( http: / / www.21cnjy.com )化铁溶液
③硫酸铝溶液与氨水
④硝酸银溶液与氨水
⑤碘化亚铁溶液与氯水
⑥碳酸氢钙溶液与澄清石灰水
A.②③⑥
B.①③⑥
C.②④
D.③⑤
【答案】A
【解析】
试题分析:①碳酸钠溶液与盐酸反应如
( http: / / www.21cnjy.com )果盐酸不足,则生成碳酸氢钠和氯化钠,如果盐酸过量则生成氯化钠、H2O和CO2,离子方程式不同;②硫化氢气体与氯化铁溶液反应生成物只能是氯化亚铁、S和氯化氢,离子方程式相同;③硫酸铝溶液与氨水反应生成物只有氢氧化铝和硫酸铵,离子方程式相同;④硝酸银溶液与氨水反应如果氨水过量则生成氢氧化二铵合银,如果硝酸银过量则生成氢氧化银沉淀,离子方程式不同;⑤碘化亚铁溶液与氯水反应如果氯水不足,则只氧化碘离子。氯水过量两种离子均被氧化,离子方程式不同;⑥碳酸氢钙溶液与澄清石灰水生成物是碳酸钙和水,离子方程式相同,答案选A。
考点:考查元素及其化合物转化的判断
8.下列各组离子一定能大量共存的是
(
)
A.加入铝粉有氢气产生的溶液中:Na+、K+、SO42-、Cl-
B.含有大量硝酸根离子的溶液中:H+、Fe2+、SO42-、Cl-
C.C(H+)/c(OH-)=l×10-10的溶液中:.NH4+、K+、Ca2+、Cl-
D.水电离的c(H+)=l×l0-12mol·L-1的溶液中:Na+、K+、HCO3-、Cl-
【答案】A
【解析】略
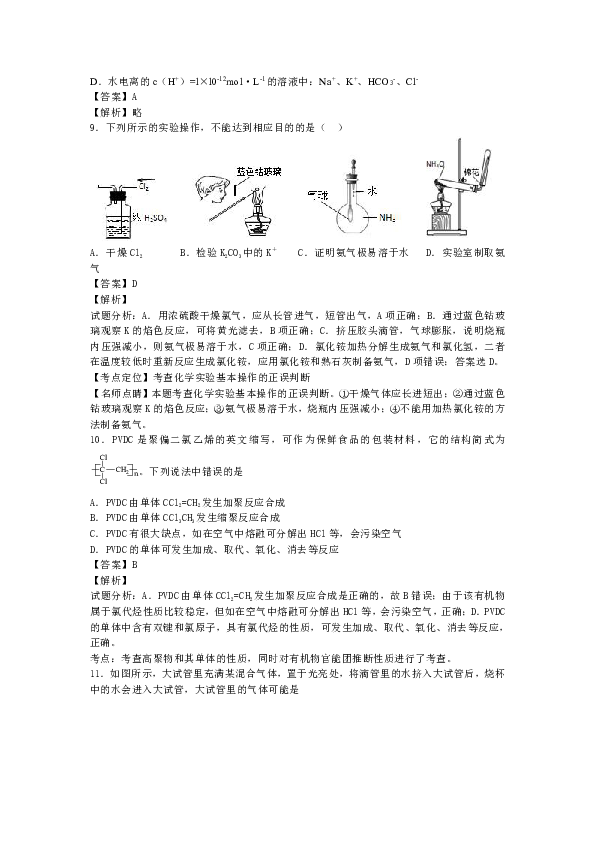
9.下列所示的实验操作,不能达到相应目的的是(
)
( http: / / www.21cnjy.com )
A.干燥Cl2
B.检验K2CO3中的K+
C.证明氨气极易溶于水
D.实验室制取氨气
【答案】D
【解析】
试题分析:A.用浓硫酸干燥氯气,应
( http: / / www.21cnjy.com )从长管进气,短管出气,A项正确;B.通过蓝色钴玻璃观察K的焰色反应,可将黄光滤去,B项正确;C.挤压胶头滴管,气球膨胀,说明烧瓶内压强减小,则氨气极易溶于水,C项正确;D.氯化铵加热分解生成氨气和氯化氢,二者在温度较低时重新反应生成氯化铵,应用氯化铵和熟石灰制备氨气,D项错误;答案选D。
【考点定位】考查化学实验基本操作的正误判断
【名师点睛】本题考查化学实验基本操作的正误判
( http: / / www.21cnjy.com )断。①干燥气体应长进短出;②通过蓝色钴玻璃观察K的焰色反应;③氨气极易溶于水,烧瓶内压强减小;④不能用加热氯化铵的方法制备氨气。
10.PVDC是聚偏二氯乙烯的英文缩写,可作为保鲜食品的包装材料,它的结构简式为。下列说法中错误的是
A.PVDC由单体CCl2=CH2发生加聚反应合成
B.PVDC由单体CCl3CH3发生缩聚反应合成
C.PVDC有很大缺点,如在空气中熔融可分解出HCl等,会污染空气
D.PVDC的单体可发生加成、取代、氧化、消去等反应
【答案】B
【解析】
试题分析:A.PVDC由单
( http: / / www.21cnjy.com )体CCl2=CH2发生加聚反应合成是正确的,故B错误;由于该有机物属于氯代烃性质比较稳定,但如在空气中熔融可分解出HCl等,会污染空气,正确;D.PVDC的单体中含有双键和氯原子,具有氯代烃的性质,可发生加成、取代、氧化、消去等反应,正确。
考点:考查高聚物和其单体的性质,同时对有机物官能团推断性质进行了考查。
11.如图所示,大试管里充满某混合气体,置于光亮处,将滴管里的水挤入大试管后,烧杯中的水会进入大试管,大试管里的气体可能是
( http: / / www.21cnjy.com )
①N2、H2;②CO、O2;
③NO2、O2;④CH4、Cl2
A.①或③
B.②或④
C.①或③或④
D.③或④
【答案】D
【解析】
试题分析:烧杯中的水会进
( http: / / www.21cnjy.com )入大试管,说明大试管中气体体积减少,压强减小造成的;①N2和H2不反应;②CO和O2不反应;③NO2、O2和水能反应,气体体积减小;④CH4和Cl2在光照条件下,发生取代反应,生成液体氯代烃,气体体积减少;满足题意的是③或④,选D。
考点:常见气体的性质。
12.设NA表示阿伏加德罗常数的值。下列叙述正确的是
A.1.7
g
NH3中含有的电子数为NA
B.22.4
L
H2中含有的氢分子数为NA
C.标准状况下,22.4
L水中含有的原子数为3NA
D.1
L
2
mol/L
Na2SO4溶液中含有的钠离子数为2NA
【答案】A
【解析】
试题分析:A、1.7克氨气为0.1摩尔
( http: / / www.21cnjy.com ),含有的电子数为0.1
10=1摩尔,正确,选A;B、没有说明气体是在标准状况下,所以22.4升氢气不能计算物质的量,所以不选B;C、标准状况下,水不是气体,22.4升水为22.4千克,不是1摩尔,所以含有的原子数不是3摩尔,不选C;D、硫酸钠溶液中硫酸钠的物质的量为2摩尔,含有的钠离子为4摩尔,所以不选D。
考点:阿伏伽德罗常数。
13.根据反应式:(1)2Fe3++2
( http: / / www.21cnjy.com )I-=2Fe2++I2,(2)Br2+2Fe2+=2Fe3++2Br-,判断下列离子的还原性由强到弱的顺序是(
)
A.Br-、Fe2+、I-
( http: / / www.21cnjy.com )
B.I-、Fe2+、Br-
C.Br-、I-、Fe2+
D.Fe2+、I-、Br-
【答案】B
【解析】
试题分析:在氧化还原反应中。还原剂的还原
( http: / / www.21cnjy.com )性大于还原产物。所以根据(1)可知还原性:I->Fe2+;根据(2)可知还原性:Fe2+>Br-;所以离子的还原性由强到弱的顺序是I->Fe2+>Br-.故选项是B。
考点:考查微粒的还原性大小的比较的知识。
14.分子式为C6H12的烯烃含有3个甲基的同分异构体有(不考虑立体异构)
A.5种
B.6种
C.7种
D.8种
【答案】A
【解析】
试题分析:分子式为C6H12的烯烃含
( http: / / www.21cnjy.com )有3个甲基的同分异构体有2-甲基-2-戊烯,3-甲基-2-戊烯,4-甲基-2-戊烯,2,3-二甲基-1-丁烯,3,3-二甲基-1-丁烯,共5种。选A。
考点:考查同分异构体数目的判断
15.在2
L的密闭容器中,发生反应3A(g)+B(g)
2C(g),若最初加入的A和B都是4
mol,测得10
s内A的平均速率v(A)=?0.12
则反应进行到10
s时容器中B的物质的量是(
)
A.1.6
mol
B.2.8
mol
C.3.2
mol
D.3.6
mol
【答案】C
【解析】
试题分析:10
s内A的平均速率v(A)=?0.12
则消耗A的物质的量是0.12×10s×2L=2.4mol,所以根据化学方程式可知,此时消耗B的物质的量是2.4mol÷3=0.8mol,则还剩余B是4mol-0.8mol=3.2mol,答案选C。
考点:考查反应速率的有关计算
点评:该题也可以利用反应速率之比是相应的化学计量数之比计算出B的反应速率,然后再带入有关数据计算也可。
16.下表是元素周期表的一部分,表中所列的字母分别代表某一种化学元素。
(1)上述第三周期元素中第一电离能(I
( http: / / www.21cnjy.com )1)最大的是________(用字母表示,下同),c和f的I1大小关系是________大于________。
(2)上述元素中,原子中未成对电子数最多的是________,写出该元素的电子排布式:________________。
(3)根据下表所提供的电离能数据,回答下列问题。
锂
X
Y
I1
519
502
580
I2
7296
4570
1820
I3
11799
6920
2750
I4
9550
11600
①表中X可能为以上13种元素中的________元素。用元素符号表示X和j形成的化合物的化学式____
____。
②Y是周期表中的________族的元素。
【答案】1)m
c
f
(2)i
1s22s22p63s23p3
(3)①a
Na2O、Na2O2(2分,其余每空1分)
②ⅢA
【解析】
试题分析:(1)周期表中所列1
( http: / / www.21cnjy.com )3种元素分别是:Na、H、Mg、Sr、Sc、Al、Ge、C、P、O、Te、Cl、Ar,其中Na、Mg、Al、P、Cl、Ar属于第三周期,原子最稳定的是Ar,故其I1最大,Mg、Al的核外电子排布分别为1s22s22p63s2、1s22s22p63s23p1,Mg中3s2为全满状态,故其I1比Al的I1大。
(2)i元素最外层电子排布为3s23p3,有3个未成对电子,是最多的。
(3)由表中数据可以看出,锂和X的I1
( http: / / www.21cnjy.com )均比I2、I3小很多,说明X与Li同主族,且X的I1比Li的I1更小,说明X的金属性比锂更强,则X为Na(即a);由Y的电离能数据可以看出,它的I1、I2、I3比I4小得多,故Y原子属于ⅢA族元素。
考点:元素周期表
点评:本题综合考查了元素周期表,周期律,电离能的知识点,难度不大,考生在平时在加强积累,熟练掌握基础知识,查漏补缺。
17.(15分)已知:化合物F是用于制备药品盐酸祛炎痛的中间产物,其合成路线为:
( http: / / www.21cnjy.com )
已知:(Ⅰ)RNH2+R/CH2Cl
RNHCH2
R/+HCl(R和R/代表烃基)
(Ⅱ)苯的同系物能被酸性高锰酸钾溶液氧化,如:
(Ⅲ)(苯胺,弱碱性,易氧化)
(Ⅳ)与浓硫酸、浓硝酸混合在不同温度下会得到不同产物。
回答下列问题:
(1)D中含有的官能团名称为
;E含有的官能团名称为
、
(2)反应①~⑤中,属于取代反应的是(填反应序号)
(3)检验D中官能团的实验操作如下:取少量D于试管中,
(4)C的结构简式是
(5)D+E→F的化学方程式:
(6)已知E的一种同分异构体(对位氨基)在
( http: / / www.21cnjy.com )一定条件下,可聚合成热固性很好的高分子,写出合成此高聚物的化学方程式:
(7)已知某有机物M的分子式为C9H11Cl,符合下列条件的M的同分异构体有
种。①与D互为同系物
②M为二取代苯化合物。
【答案】(1)氯原子(1分);氨基(1分)、羧基(1分)
(2)①②⑤(2分)
(3)加入氢氧化钠溶液,加热,冷却后取上层清液,加入稀硝酸酸化,再加入硝酸银
溶液,若产生白色沉淀,则含有氯原子。(2分)
(4)(2分)
(5)
( http: / / www.21cnjy.com )(2分)
(6)(2分)
(7)15(2分)
【解析】
试题分析:(1)D中含有的官能团名称为氯原子,E中含有的官能团名称为氨基、羧基
(2)根据取代反应的特征“有上有下”及反应条件,
反应①~⑤中,属于取代反应的是①②⑤
(3)检验氯原子的存在,需使
( http: / / www.21cnjy.com )其成为氯离子再加如硝酸银溶液进行检验,注意加入硝酸银前应使其溶液为中性或酸性,一般步骤为:取少量D于试管中,加入氢氧化钠溶液,加热,冷却后取上层清液,加入稀硝酸酸化,再加入硝酸银溶液,若产生白色沉淀,则含有氯原子。
(4)A甲苯与浓硫酸、浓硝酸共热发生取代反应,生成B邻硝基甲苯(根据E的结
构简式可知硝基在邻位),因为氨基也易被氧化,所以B中的甲基先被氧化,生成C,所以C为,然后硝基再被还原为氨基
(5)由题目所给已知得D、E发生取代反应,D中的氯原子取代E中氨基上的氢原子,化学方程式为
(6)氨基与羧基可发生缩聚反应生成多肽或蛋白质,所以对氨基苯甲酸的缩聚反应方程式为
(7)M比D分子式多了2个-CH2,且
( http: / / www.21cnjy.com )M中有两个取代基,与D互为同系物,则M两个取代基的形式可以①是-Cl、丙基,丙基有两种;②-CH2-CH2-
Cl、-CH3;③-CHCl-CH3、-CH3;④-CH2Cl、-CH2-CH3,苯的二取代物都有邻、间、对三种形式,所以共有15种。
考点:考查官能团的名称及检验,反应类型,物质的推断,化学方程式的书写,同分异构体的判断等
18.草酸晶体的组成可表示为H2C2O4·xH2O。实验室常用其加热分解制取CO气体,反应方程式为:H2C2O4·xH2O
CO+CO2+(x+1)H2O。下图为分解草酸晶体,用干燥纯净的CO还原CuO制取Cu,并收集CO的实验装置(略去铁架台、铁夹等支撑加持装置),回答下列问题。
( http: / / www.21cnjy.com )
(1)A装置为加热分解草酸的装置,该装
( http: / / www.21cnjy.com )置错误是______________,C装置中盛放的试剂是______
_
,E装置的作用是__________
。
(2)实验过程中涉及到如下操作:①点燃A
( http: / / www.21cnjy.com )处的酒精灯
②熄灭A处的酒精灯
③点燃D处的酒精灯
④熄灭D处的酒精灯。这4步操作由先到后的顺序为________
(填序号)。点燃D处酒精灯前必须要进行的操作名称是__________。
(3)用酸性高锰酸钾溶液滴定草酸晶体,求x的值。
实验步骤:准确称取1.26g
草酸晶体,配成
( http: / / www.21cnjy.com )100mL溶液;取出20.00mL于锥形瓶中,再向瓶中加入足量稀H2SO4;用0.0500mol/L酸性高锰酸钾溶液滴定,滴定至终点时消耗高锰酸钾溶液16.00mL。滴定时,所发生的反应为:
2MnO4-+5H2C2O4+6H+
=
10CO2 +2Mn2++8H2O。
①配制草酸溶液除需要玻璃棒、烧杯,还一定需要的玻璃仪器有_____________。
②
x=________。
【答案】(1)试管口应向上倾斜(或应向下倾斜),浓硫酸,安全瓶(或防倒吸)
(2)①③④②,验纯
(3)①100mL容量瓶,胶头滴管;
②
2
【解析】
试题分析:(1)反应中有水生成,容易
( http: / / www.21cnjy.com )导致试管炸裂,所以A装置中试管口应向下倾斜;B为澄清石灰水,目的是除去混合气体中二氧化碳,C为浓硫酸,目的是干燥CO气体;D中CuO与CO反应制取Cu;E为安全瓶,起到防止倒吸的作用;F为澄清石灰水,除去二氧化碳气体;
(2)CO气体的纯度不足时会发生爆炸现
( http: / / www.21cnjy.com )象,所以应该先点燃A处酒精灯,用生成的CO将装置中空气排净,然后再点燃D处的酒精灯;熄灭酒精灯时恰好相反,先熄灭D处酒精灯,然后再熄灭A处酒精灯,所以正确的操作方法为:①③④②;避免发生爆炸现象,所以点燃D处酒精灯前必须要进行检验CO纯度;(3)①配制草酸溶液除需要玻璃棒、烧杯,配制100mL溶液需要选用100mL容量瓶,定容时还需要胶头滴管;②16mL
0.0500mol/L高锰酸钾溶液中含有高锰酸钾的物质的量为:0.0500mol/L×0.016L=0.0008mol,100mL该草酸溶液能够消耗高锰酸钾的物质的量为:0.0008mol×100ml/2omL=0.004mol,根据反应2MnO4-+5H2C2O4+6H+=10CO2+2Mn2++8H2O可知1.26g样品中含有草酸的物质的量为:0.004mol×5/2=0.01mol,草酸的质量为:90g/mol×0.01mol=0.9g,含有结晶水的物质的量为:(1.26g-0.9g)
÷18g/mol=0.02mol,则该草酸晶体中x=0.02mol/0.01mol=2。
考点:考查探究物质组成的实验方案设计。
19.亚硝酸钠是一种工业盐,在生产、生活
( http: / / www.21cnjy.com )中应用广泛.现用下图所示仪器(夹持装置已省略)及药品,探究亚硝酸钠与硫酸的反应及生成气体产物的成分.
已知:①NO+NO2+2OH-=2NO2-+H2O
②气体液化的温度:NO2:21℃、NO:-152℃
( http: / / www.21cnjy.com )
(1)为了检验装置A中生成的气体产物,仪器的连接顺序为(按左→右连接):A→C→
→
→B.
(2)关闭弹簧夹K1,打开分液漏斗活塞,滴入70%硫酸后,A中产生红棕色气体.
①确认A中产生的气体中含有NO,依据的现象是___________________.
②装置E的作用是__________________________.
(3)如果向D中通入过量O2,则装置B中发生反应的化学方程式为
.
如果没有装置C,对实验结论造成的影响是_________________________.
(4)通过上述实验探究过程,可得出装置A中反应的化学方程式是
.
【答案】(1)E;D;(2)①D中出现红棕色气体;②冷凝使NO2完全液化;(3)4NO2+O2+4NaOH=4NaNO3
+2H2O;水会与NO2反生成应NO,影响后面NO的检验;(4)2NaNO2+H2SO4=Na2SO4+NO2↑+NO↑+H2O.
【解析】
试题分析:(1)A是发生装置,C是干燥除水装置,因为NO2更易液化先分离NO2.所以接E,NO2分离
后再检验NO,需通氧气,接D.观察
( http: / / www.21cnjy.com )到气体从无色变成红棕色.所以说明是NO.B是尾气处理.为了检验装置A中生成的气体产物,仪器的连接顺序为(从左向右连接):A、C、E、D、B;(2)关闭弹簧夹,打开分液漏斗活塞,滴入70%的硫酸后,
A中产生红棕色气体.说明生成了NO2气体.①确认A中产生气体含有NO,通过在D装置中通O2来检验.观察气体是否变红棕色.②装置E的作用是冷凝,使NO2完全液化.(3)如果向D中通入过量O2,有过量的O2会与NO2发生氧化还原反应,所以可推断出反应方程式为:4NO2+O2+4NaOH=
4NaNO3+2H2O.如不干燥,水
( http: / / www.21cnjy.com )会与NO2反应产生NO,影响NO的检验.(4)通过上述实验探究过程,可得出装置A中反应应产生两种气体.发生歧化反应.化学方程式是2NaNO2+H2SO4
=Na2SO4+NO2↑+NO↑+H2O.
考点:实验探究和评价.
20.(12分)某同学预设计实验测定H2在通常状况下的摩尔体积,设计如下实验步骤:①连接如图所示装置,并检查装置的气密性
( http: / / www.21cnjy.com )
②向a仪器中装入VmL稀盐酸,锥形瓶中加入锌粒,B中加入碱石灰;
③称取A装置和B仪器和药品的总质量,记为a
g;
④采取措施使装置A中发生反应;
⑤反应停止后,测得在通常状况下收集的气体体积为b
mL;
⑥再次称量A装置和B仪器得总质量(含内装物质),记为c
g;
⑦处理数据等。
(1)写出A仪器中发生反应的化学方程式
(2)写出检查该装置气密性的方法
(3)A装置中仪器a的名称为
(4)若拆除B仪器(其他仪器不变),
(填“会”或“不会”)
对本实验产生影响,理由是
(5)根据上述数据,计算在通常状况下,H2的摩尔体积Vm=
(用含a、b、c等字母的代数式表示)
【答案】(1)Zn+2HCl=ZnCl
( http: / / www.21cnjy.com )2+H2↑;(2)关闭分液漏斗的活塞,把导管插入水中,微热锥形瓶,若导管口有气泡冒出,停止微热后,导管内形成一段液柱,且在一段时间内液柱高度不变,则说明气密性良好;(3)分液漏斗;(4)会,H2中混有的HCl气体和水蒸气的质量会被当成是H2的质量而导致c偏小,对实验产生影响;(5)Vm=2b×10-3/(a-c)L·mol-1。
【解析】
试题分析:(1)装置A中是盐
( http: / / www.21cnjy.com )酸和锌粒发生置换反应产生氢气,即Zn+2HCl=ZnCl2+H2↑;(2)检验此装置的气密性,类似于制氧气装置气密性的检验,因此操作是:关闭分液漏斗的活塞,把导管插入水中,微热锥形瓶,若导管口有气泡冒出,停止微热后,导管内形成一段液柱,且在一段时间内液柱高度不变,则说明气密性良好;(3)a为分液漏斗;(4)因为盐酸具有挥发性,也就是从A装置中出来的气体除H2外,还有H2O、HCl,碱石灰的作用是:干燥氢气、除去HCl,否则对氢气的质量产生影响,因此填“会”,因为此气体的物质的量为(a-c)/2mol,根据Vm=V/n,则Vm=2b×10-3/(a-c)
L·mol-1,不除去水蒸气和氯化氢,造成(a-c)偏大,即理由是:H2中混有的HCl气体和水蒸气的质量会被当成是H2的质量而导致c偏小,对实验产生影响;⑸根据(4)的分析得出:Vm=2b×10-3/(a-c)L·mol-1。
考点:考查反应原理、气密性检验、仪器名称等知识。
21.(10分)铁是应用最广泛的金属,铁的卤化物、氧化物等均为重要化合物。
(1)要确定铁的某氯化物F
( http: / / www.21cnjy.com )eClx的化学式,可用实验的方法。实验中称取0.54
g的FeClx样品,溶解后加入足量硝酸银溶液,得沉淀1.435g。求出FeClx中x值
(列出计算过程);
(2)现有一含有FeCl2和FeCl3的混
( http: / / www.21cnjy.com )合物样品,采用上述方法测得n(Fe):n(C1)=1:2.1,则该样品中FeCl3的物质的量分数为__________。在实验室中,FeCl2可用铁粉和__________反应制备
(3)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为____________;
【答案】(1)n(Cl)=
1.435g
/143.5g·mol-1==0.010mol
0.54g-0.010mol×35.5g·mol-1=0.19g
n(Fe)=0.19g/56g·mol-1=0.0034mol
n(Fe):
n(Cl)=0.0034:0.010≈1:3,x=3
(2)0.10或10%;盐酸或氯化铁溶液
(3)2Fe3++2I-=2Fe2++I2
【解析】
试题分析:(1)n(Cl)=n(H+)=n(OH-)=0.0250L×0.40
mol L-1=0.010
mol,0.54g
FeClx样品中含有氯离子物质的量为=0.010
mol,解得x=3,(2)FeCl2和FeCl3的混合物的样品中FeCl2物质的量为x,FeCl3的物质的量为y,则(x+y):(2x+3y)=1:2.1,得到x:y=9:1,氯化铁物质的量分数=×100%=10%;
在实验室中,FeCl2可用铁粉和盐酸反应得到
( http: / / www.21cnjy.com ),或可用铁粉和FeCl3反应生成;(3)氯化铁具有氧化性,碘化氢具有还原性,二者发生氧化还原反应生成氯化亚铁和碘单质,反应离子方程式为:2Fe3++2I-=2Fe2++I2。
考点:考查铁及其化合物。
22.某混合物A含有Al2
(SO4)3、Al2O3和Fe2O3,在一定条件下可实现下列物质之间的变化:
( http: / / www.21cnjy.com )
据此判断:
(1)固体E所含物质的化学式为
。
(2)反应③可用来焊接钢轨,化学方程式为
;
该反应称为:
。
(3)反应①的离子方程式为
。
(4)反应②的离子方程式为
。
【答案】(1)K2SO4
(NH4)2SO4
(2)2Al+Fe2O3Al2O3+2Fe
铝热反应
(3)Al2O3+2OH-+3H2O=2[Al(OH)4]-
(4)Al3++3NH3·H2O=Al(OH)3↓+3NH4+
【解析】
试题分析:
考点:KAl(SO4)2溶于水,Al2O3和Fe2O3均不溶于水,混合物A加水溶解后,溶液中是KAl(SO4)2,沉淀是Al2O3和Fe2O3;向沉淀中加NaOH溶液,Fe2O3不反应,Al2O3可与NaOH溶液反应生成NaAlO2,则B为Fe2O3,向NaAlO2溶液中通入CO2可得Al(OH)3沉淀,Al(OH)3受热分解生成Al2O3,则D为Al2O3,反应③为铝热反应,C为Al,向溶液中加过量氨水,溶液与过量氨水反应,Al3+被沉淀,得到氢氧化铝沉淀,溶液中剩余的是K2SO4和(NH4)2SO4,经过蒸发、结晶,得到K2SO4和(NH4)2SO4,(1)由以上分析可知固体E是K2SO4
和(NH4)2SO4;(2)反应③为铝热反应,方程式为2Al+Fe2O32Fe+Al2O3,该反应称为铝热反应;(3)反应①为Al2O3和氢氧化钠的反应,离子方程式为Al2O3+2OH-+3H2O═2[Al(OH)4]--;(4)反应②为Al3+和氨水的反应,反应的离子方程式为Al3++3NH3 H2O═Al(OH)3↓+3NH4+。
【考点定位】考查无机推断,涉及元素及化合物的性质。
【名师点晴】KAl(SO4)2溶于水,Al2
( http: / / www.21cnjy.com )O3和Fe2O3均不溶于水,混合物A加水溶解后,溶液中是KAl(SO4)2,沉淀是Al2O3和Fe2O3;向沉淀中加NaOH溶液,Fe2O3不反应,Al2O3可与NaOH溶液反应生成NaAlO2,则B为Fe2O3,向NaAlO2溶液中通入CO2可得Al(OH)3沉淀,Al(OH)3受热分解生成Al2O3,则D为Al2O3,反应③为铝热反应,C为Al,向溶液中加过量氨水,溶液与过量氨水反应,Al3+被沉淀,得到氢氧化铝沉淀,溶液中剩余的是K2SO4
和(NH4)2SO4,经过蒸发、结晶,得到的是K2SO4
和(NH4)2SO4,以此解答该题。
23.已知:
如上式烯烃的氧化反应,双键能被高锰酸钾酸性溶液氧化而断裂,在断键两端的碳原子能被氧化成为羧基(-COOH)或酮羰基()。由氧化所得的产物,可以推测反应物烯烃的结构。今有A、B、C三种含有碳碳双键的化合物,它们被上述溶液氧化。
1molA(分子式C8H16)氧化得到2mol酮D;
1molB(分子式为C8H14)氧化得到2mol酮E和1mol二元羧酸
1molC(分子式C8H14)氧化只得到一种产物,它是一种没有支链的二元羧酸。请据此推断B、C、D、E的结构简式
B.
C.
D.
E.
【答案】B.(CH3)2C=CH-CH=C(CH3)2;C.;D.CH3COCH2CH3;E.(CH3)2C=O;
【解析】
试题分析:1molA(分子式C8H16),氧化得到2mol酮D,A中含有1个C=C双键,为对称结构,不饱和C原子上没有H原子,A为:CH3CH2C(CH3)=C(CH3)CH2CH3,结合信息可知,D为CH3COCH2CH3;1molB(分子式C8H14),氧化得到2mol酮E和1mol二元羧酸,分子中含有2个C=C双键,且为对称结构,故B为:(CH3)2C=CH-CH=C(CH3)2,结合信息可知E为(CH3)2C=O;1molC(分子式C8H14),氧化只得到一种产物,它是一种没有支链的二元羧酸,则C为环烯,C的结构简式为;故答案为:(CH3)2C=CH-CH=C(CH3)2,,CH3COCH2CH3,(CH3)2C=O。
考点:考查了有机物的推断;有机物分子中的官能团及其结构的相关知识。
1.已知某元素的最高化合价为+7价,下列说法中正确的是
A.该元素在元素周期表中一定处于ⅦA族
B.该元素可能是氟元素
C.该元素的某种化合物可能具有漂白性
D.该元素的单质没有还原性
【答案】C
【解析】C最高化合价为+7价的也可能是副
( http: / / www.21cnjy.com )族的锰元素(KMnO4),
氟元素是自然界氧化性最强的元素,最高价为0价,除氟元素外的
其他卤族元素兼有氧化性和还原性,以氧化性为主。
2.下列有关能量或反应热的说法正确的是(
)
A、化石燃料和植物燃料燃烧时放出的能量均来源于太阳能
B、牺牲阳极保护法是电能转化为化学能的过程
C、CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)===2CO(g)+O2(g)反应的△H=+2×283.0kJ/mol
D、放热反应一定比吸热反应更容易发生。
【答案】A、C
【解析】A、正确。
B、牺牲阳极保护法是活泼金属失去电子被氧化是过程,属于化学能转变成为电能的过程。
C、燃烧热的定义是1mol物质完全反应释放的能量,所以C正确。
D、错误
3.化合物分子中的所有原子都处于同一平面的是
A.甲苯
B.对二甲苯
C.氯乙烯
D.丙烯
【答案】C
【解析】
试题分析:A、甲苯中含有-CH3,甲基是四面体结构,故甲苯分子中所有原子不可能都处于同一平面,故A错误;
B、对二甲苯()是2个-CH3取代了苯分子中的2个H原子,因烷烃中C、H原子是四面体结构,故-CH3中C原子与3个H原子不可能全部处于同一平面,所以对二甲苯分子中所有原子不可能都处于同一平面,故B错误;C、乙烯是平面结构,氯乙烯分子中有一个氯原子代替了乙烯分子中的氢,位置关系不变,所有原子处于同一平面,故C正确;D、丙烯分子中也含有-CH3,故丙烯分子中所有原子不可能都处于同一平面,故D错误;故选C。
【考点定位】考查常见有机化合物的结构
【名师点晴】本题主要考查有机化合物的结构特
( http: / / www.21cnjy.com )点,做题时注意从甲烷、乙烯、苯和乙炔的结构特点判断有机分子的空间结构,在常见的有机化合物中甲烷是正四面体结构,乙烯和苯是平面型结构,乙炔是直线型结构,其它有机物可在此基础上进行判断,对有机物进行肢解,分部分析,另外要重点掌握碳碳单键可旋转、双键和三键不可旋转。
4.下列关于原子的叙述不正确的是(
)
A.中子数为33
B.电子数为33
C.质量数为60
D.质子数为27
【答案】B
【解析】
试题分析:在表示原子组成时元素符号的左下角
( http: / / www.21cnjy.com )表示质子数,左上角表示质量数。因为质子数和中子数之和是质量数,核外电子数=质子数,则该微粒的中子数是60—27=33,电子数是27,质量数是60,质子数是27,A、中子数是33,A项正确;B、电子数是27,B项错误;C、质量数是60,C项正确;D、质子数是27,D项正确;答案选B。
考点:考查原子结构
5.某溶液中加入铝粉有氢气产生,该溶液中一定可以大量共存的离子组是:
A.Na+、NO3-、Cl-、SO42-
B.Na+、K+、Ba2+、HCO3-
C.Fe3+、H+、SO42-、Cl-
D.Na+、K+、Cl-、SO42-
【答案】D
【解析】加入铝粉产生氢气,该溶液既可能是酸性,又可能为碱性;A、有硝酸根,物氢气产生;B、碳酸氢根不能共存;C、若为碱性,氢离子不能共存。
6.下列实验能够成功的是
A.用重结晶的方法分离苯甲酸和氯化钠的混合物
B.用苯和溴水在Fe催化下可制得溴苯
C.用乙醇、冰醋酸和pH=1的H2SO4溶液混合加热可制备乙酸乙酯
D.将电石与水反应后的气体直接通入到溴水中,可以验证乙炔能使溴水褪色的性质
【答案】A
【解析】
试题分析:A.苯甲酸与氯化
( http: / / www.21cnjy.com )钠的溶解度随温度变化不同,可用重结晶的方法分离,A正确;B.用苯和液溴在Fe催化下可制得溴苯,B错误;C.用乙醇、冰醋酸和浓硫酸混合加热可制备乙酸乙酯,C错误;D.将电石与水反应后的气体乙炔中还含有H2S等杂质,H2S等杂质也能使溴水褪色,则如果直接通入到溴水中,不能验证乙炔能使溴水褪色的性质,D错误,答案选A。
考点:考查有机化学实验方案设计与评价
7.下列各组中的两种物质相互反应时,无论哪种过量,都可用同一个离子方程式表示的是
①碳酸钠溶液与盐酸
②硫化氢气体与氯
( http: / / www.21cnjy.com )化铁溶液
③硫酸铝溶液与氨水
④硝酸银溶液与氨水
⑤碘化亚铁溶液与氯水
⑥碳酸氢钙溶液与澄清石灰水
A.②③⑥
B.①③⑥
C.②④
D.③⑤
【答案】A
【解析】
试题分析:①碳酸钠溶液与盐酸反应如
( http: / / www.21cnjy.com )果盐酸不足,则生成碳酸氢钠和氯化钠,如果盐酸过量则生成氯化钠、H2O和CO2,离子方程式不同;②硫化氢气体与氯化铁溶液反应生成物只能是氯化亚铁、S和氯化氢,离子方程式相同;③硫酸铝溶液与氨水反应生成物只有氢氧化铝和硫酸铵,离子方程式相同;④硝酸银溶液与氨水反应如果氨水过量则生成氢氧化二铵合银,如果硝酸银过量则生成氢氧化银沉淀,离子方程式不同;⑤碘化亚铁溶液与氯水反应如果氯水不足,则只氧化碘离子。氯水过量两种离子均被氧化,离子方程式不同;⑥碳酸氢钙溶液与澄清石灰水生成物是碳酸钙和水,离子方程式相同,答案选A。
考点:考查元素及其化合物转化的判断
8.下列各组离子一定能大量共存的是
(
)
A.加入铝粉有氢气产生的溶液中:Na+、K+、SO42-、Cl-
B.含有大量硝酸根离子的溶液中:H+、Fe2+、SO42-、Cl-
C.C(H+)/c(OH-)=l×10-10的溶液中:.NH4+、K+、Ca2+、Cl-
D.水电离的c(H+)=l×l0-12mol·L-1的溶液中:Na+、K+、HCO3-、Cl-
【答案】A
【解析】略
9.下列所示的实验操作,不能达到相应目的的是(
)
( http: / / www.21cnjy.com )
A.干燥Cl2
B.检验K2CO3中的K+
C.证明氨气极易溶于水
D.实验室制取氨气
【答案】D
【解析】
试题分析:A.用浓硫酸干燥氯气,应
( http: / / www.21cnjy.com )从长管进气,短管出气,A项正确;B.通过蓝色钴玻璃观察K的焰色反应,可将黄光滤去,B项正确;C.挤压胶头滴管,气球膨胀,说明烧瓶内压强减小,则氨气极易溶于水,C项正确;D.氯化铵加热分解生成氨气和氯化氢,二者在温度较低时重新反应生成氯化铵,应用氯化铵和熟石灰制备氨气,D项错误;答案选D。
【考点定位】考查化学实验基本操作的正误判断
【名师点睛】本题考查化学实验基本操作的正误判
( http: / / www.21cnjy.com )断。①干燥气体应长进短出;②通过蓝色钴玻璃观察K的焰色反应;③氨气极易溶于水,烧瓶内压强减小;④不能用加热氯化铵的方法制备氨气。
10.PVDC是聚偏二氯乙烯的英文缩写,可作为保鲜食品的包装材料,它的结构简式为。下列说法中错误的是
A.PVDC由单体CCl2=CH2发生加聚反应合成
B.PVDC由单体CCl3CH3发生缩聚反应合成
C.PVDC有很大缺点,如在空气中熔融可分解出HCl等,会污染空气
D.PVDC的单体可发生加成、取代、氧化、消去等反应
【答案】B
【解析】
试题分析:A.PVDC由单
( http: / / www.21cnjy.com )体CCl2=CH2发生加聚反应合成是正确的,故B错误;由于该有机物属于氯代烃性质比较稳定,但如在空气中熔融可分解出HCl等,会污染空气,正确;D.PVDC的单体中含有双键和氯原子,具有氯代烃的性质,可发生加成、取代、氧化、消去等反应,正确。
考点:考查高聚物和其单体的性质,同时对有机物官能团推断性质进行了考查。
11.如图所示,大试管里充满某混合气体,置于光亮处,将滴管里的水挤入大试管后,烧杯中的水会进入大试管,大试管里的气体可能是
( http: / / www.21cnjy.com )
①N2、H2;②CO、O2;
③NO2、O2;④CH4、Cl2
A.①或③
B.②或④
C.①或③或④
D.③或④
【答案】D
【解析】
试题分析:烧杯中的水会进
( http: / / www.21cnjy.com )入大试管,说明大试管中气体体积减少,压强减小造成的;①N2和H2不反应;②CO和O2不反应;③NO2、O2和水能反应,气体体积减小;④CH4和Cl2在光照条件下,发生取代反应,生成液体氯代烃,气体体积减少;满足题意的是③或④,选D。
考点:常见气体的性质。
12.设NA表示阿伏加德罗常数的值。下列叙述正确的是
A.1.7
g
NH3中含有的电子数为NA
B.22.4
L
H2中含有的氢分子数为NA
C.标准状况下,22.4
L水中含有的原子数为3NA
D.1
L
2
mol/L
Na2SO4溶液中含有的钠离子数为2NA
【答案】A
【解析】
试题分析:A、1.7克氨气为0.1摩尔
( http: / / www.21cnjy.com ),含有的电子数为0.1
10=1摩尔,正确,选A;B、没有说明气体是在标准状况下,所以22.4升氢气不能计算物质的量,所以不选B;C、标准状况下,水不是气体,22.4升水为22.4千克,不是1摩尔,所以含有的原子数不是3摩尔,不选C;D、硫酸钠溶液中硫酸钠的物质的量为2摩尔,含有的钠离子为4摩尔,所以不选D。
考点:阿伏伽德罗常数。
13.根据反应式:(1)2Fe3++2
( http: / / www.21cnjy.com )I-=2Fe2++I2,(2)Br2+2Fe2+=2Fe3++2Br-,判断下列离子的还原性由强到弱的顺序是(
)
A.Br-、Fe2+、I-
( http: / / www.21cnjy.com )
B.I-、Fe2+、Br-
C.Br-、I-、Fe2+
D.Fe2+、I-、Br-
【答案】B
【解析】
试题分析:在氧化还原反应中。还原剂的还原
( http: / / www.21cnjy.com )性大于还原产物。所以根据(1)可知还原性:I->Fe2+;根据(2)可知还原性:Fe2+>Br-;所以离子的还原性由强到弱的顺序是I->Fe2+>Br-.故选项是B。
考点:考查微粒的还原性大小的比较的知识。
14.分子式为C6H12的烯烃含有3个甲基的同分异构体有(不考虑立体异构)
A.5种
B.6种
C.7种
D.8种
【答案】A
【解析】
试题分析:分子式为C6H12的烯烃含
( http: / / www.21cnjy.com )有3个甲基的同分异构体有2-甲基-2-戊烯,3-甲基-2-戊烯,4-甲基-2-戊烯,2,3-二甲基-1-丁烯,3,3-二甲基-1-丁烯,共5种。选A。
考点:考查同分异构体数目的判断
15.在2
L的密闭容器中,发生反应3A(g)+B(g)
2C(g),若最初加入的A和B都是4
mol,测得10
s内A的平均速率v(A)=?0.12
则反应进行到10
s时容器中B的物质的量是(
)
A.1.6
mol
B.2.8
mol
C.3.2
mol
D.3.6
mol
【答案】C
【解析】
试题分析:10
s内A的平均速率v(A)=?0.12
则消耗A的物质的量是0.12×10s×2L=2.4mol,所以根据化学方程式可知,此时消耗B的物质的量是2.4mol÷3=0.8mol,则还剩余B是4mol-0.8mol=3.2mol,答案选C。
考点:考查反应速率的有关计算
点评:该题也可以利用反应速率之比是相应的化学计量数之比计算出B的反应速率,然后再带入有关数据计算也可。
16.下表是元素周期表的一部分,表中所列的字母分别代表某一种化学元素。
(1)上述第三周期元素中第一电离能(I
( http: / / www.21cnjy.com )1)最大的是________(用字母表示,下同),c和f的I1大小关系是________大于________。
(2)上述元素中,原子中未成对电子数最多的是________,写出该元素的电子排布式:________________。
(3)根据下表所提供的电离能数据,回答下列问题。
锂
X
Y
I1
519
502
580
I2
7296
4570
1820
I3
11799
6920
2750
I4
9550
11600
①表中X可能为以上13种元素中的________元素。用元素符号表示X和j形成的化合物的化学式____
____。
②Y是周期表中的________族的元素。
【答案】1)m
c
f
(2)i
1s22s22p63s23p3
(3)①a
Na2O、Na2O2(2分,其余每空1分)
②ⅢA
【解析】
试题分析:(1)周期表中所列1
( http: / / www.21cnjy.com )3种元素分别是:Na、H、Mg、Sr、Sc、Al、Ge、C、P、O、Te、Cl、Ar,其中Na、Mg、Al、P、Cl、Ar属于第三周期,原子最稳定的是Ar,故其I1最大,Mg、Al的核外电子排布分别为1s22s22p63s2、1s22s22p63s23p1,Mg中3s2为全满状态,故其I1比Al的I1大。
(2)i元素最外层电子排布为3s23p3,有3个未成对电子,是最多的。
(3)由表中数据可以看出,锂和X的I1
( http: / / www.21cnjy.com )均比I2、I3小很多,说明X与Li同主族,且X的I1比Li的I1更小,说明X的金属性比锂更强,则X为Na(即a);由Y的电离能数据可以看出,它的I1、I2、I3比I4小得多,故Y原子属于ⅢA族元素。
考点:元素周期表
点评:本题综合考查了元素周期表,周期律,电离能的知识点,难度不大,考生在平时在加强积累,熟练掌握基础知识,查漏补缺。
17.(15分)已知:化合物F是用于制备药品盐酸祛炎痛的中间产物,其合成路线为:
( http: / / www.21cnjy.com )
已知:(Ⅰ)RNH2+R/CH2Cl
RNHCH2
R/+HCl(R和R/代表烃基)
(Ⅱ)苯的同系物能被酸性高锰酸钾溶液氧化,如:
(Ⅲ)(苯胺,弱碱性,易氧化)
(Ⅳ)与浓硫酸、浓硝酸混合在不同温度下会得到不同产物。
回答下列问题:
(1)D中含有的官能团名称为
;E含有的官能团名称为
、
(2)反应①~⑤中,属于取代反应的是(填反应序号)
(3)检验D中官能团的实验操作如下:取少量D于试管中,
(4)C的结构简式是
(5)D+E→F的化学方程式:
(6)已知E的一种同分异构体(对位氨基)在
( http: / / www.21cnjy.com )一定条件下,可聚合成热固性很好的高分子,写出合成此高聚物的化学方程式:
(7)已知某有机物M的分子式为C9H11Cl,符合下列条件的M的同分异构体有
种。①与D互为同系物
②M为二取代苯化合物。
【答案】(1)氯原子(1分);氨基(1分)、羧基(1分)
(2)①②⑤(2分)
(3)加入氢氧化钠溶液,加热,冷却后取上层清液,加入稀硝酸酸化,再加入硝酸银
溶液,若产生白色沉淀,则含有氯原子。(2分)
(4)(2分)
(5)
( http: / / www.21cnjy.com )(2分)
(6)(2分)
(7)15(2分)
【解析】
试题分析:(1)D中含有的官能团名称为氯原子,E中含有的官能团名称为氨基、羧基
(2)根据取代反应的特征“有上有下”及反应条件,
反应①~⑤中,属于取代反应的是①②⑤
(3)检验氯原子的存在,需使
( http: / / www.21cnjy.com )其成为氯离子再加如硝酸银溶液进行检验,注意加入硝酸银前应使其溶液为中性或酸性,一般步骤为:取少量D于试管中,加入氢氧化钠溶液,加热,冷却后取上层清液,加入稀硝酸酸化,再加入硝酸银溶液,若产生白色沉淀,则含有氯原子。
(4)A甲苯与浓硫酸、浓硝酸共热发生取代反应,生成B邻硝基甲苯(根据E的结
构简式可知硝基在邻位),因为氨基也易被氧化,所以B中的甲基先被氧化,生成C,所以C为,然后硝基再被还原为氨基
(5)由题目所给已知得D、E发生取代反应,D中的氯原子取代E中氨基上的氢原子,化学方程式为
(6)氨基与羧基可发生缩聚反应生成多肽或蛋白质,所以对氨基苯甲酸的缩聚反应方程式为
(7)M比D分子式多了2个-CH2,且
( http: / / www.21cnjy.com )M中有两个取代基,与D互为同系物,则M两个取代基的形式可以①是-Cl、丙基,丙基有两种;②-CH2-CH2-
Cl、-CH3;③-CHCl-CH3、-CH3;④-CH2Cl、-CH2-CH3,苯的二取代物都有邻、间、对三种形式,所以共有15种。
考点:考查官能团的名称及检验,反应类型,物质的推断,化学方程式的书写,同分异构体的判断等
18.草酸晶体的组成可表示为H2C2O4·xH2O。实验室常用其加热分解制取CO气体,反应方程式为:H2C2O4·xH2O
CO+CO2+(x+1)H2O。下图为分解草酸晶体,用干燥纯净的CO还原CuO制取Cu,并收集CO的实验装置(略去铁架台、铁夹等支撑加持装置),回答下列问题。
( http: / / www.21cnjy.com )
(1)A装置为加热分解草酸的装置,该装
( http: / / www.21cnjy.com )置错误是______________,C装置中盛放的试剂是______
_
,E装置的作用是__________
。
(2)实验过程中涉及到如下操作:①点燃A
( http: / / www.21cnjy.com )处的酒精灯
②熄灭A处的酒精灯
③点燃D处的酒精灯
④熄灭D处的酒精灯。这4步操作由先到后的顺序为________
(填序号)。点燃D处酒精灯前必须要进行的操作名称是__________。
(3)用酸性高锰酸钾溶液滴定草酸晶体,求x的值。
实验步骤:准确称取1.26g
草酸晶体,配成
( http: / / www.21cnjy.com )100mL溶液;取出20.00mL于锥形瓶中,再向瓶中加入足量稀H2SO4;用0.0500mol/L酸性高锰酸钾溶液滴定,滴定至终点时消耗高锰酸钾溶液16.00mL。滴定时,所发生的反应为:
2MnO4-+5H2C2O4+6H+
=
10CO2 +2Mn2++8H2O。
①配制草酸溶液除需要玻璃棒、烧杯,还一定需要的玻璃仪器有_____________。
②
x=________。
【答案】(1)试管口应向上倾斜(或应向下倾斜),浓硫酸,安全瓶(或防倒吸)
(2)①③④②,验纯
(3)①100mL容量瓶,胶头滴管;
②
2
【解析】
试题分析:(1)反应中有水生成,容易
( http: / / www.21cnjy.com )导致试管炸裂,所以A装置中试管口应向下倾斜;B为澄清石灰水,目的是除去混合气体中二氧化碳,C为浓硫酸,目的是干燥CO气体;D中CuO与CO反应制取Cu;E为安全瓶,起到防止倒吸的作用;F为澄清石灰水,除去二氧化碳气体;
(2)CO气体的纯度不足时会发生爆炸现
( http: / / www.21cnjy.com )象,所以应该先点燃A处酒精灯,用生成的CO将装置中空气排净,然后再点燃D处的酒精灯;熄灭酒精灯时恰好相反,先熄灭D处酒精灯,然后再熄灭A处酒精灯,所以正确的操作方法为:①③④②;避免发生爆炸现象,所以点燃D处酒精灯前必须要进行检验CO纯度;(3)①配制草酸溶液除需要玻璃棒、烧杯,配制100mL溶液需要选用100mL容量瓶,定容时还需要胶头滴管;②16mL
0.0500mol/L高锰酸钾溶液中含有高锰酸钾的物质的量为:0.0500mol/L×0.016L=0.0008mol,100mL该草酸溶液能够消耗高锰酸钾的物质的量为:0.0008mol×100ml/2omL=0.004mol,根据反应2MnO4-+5H2C2O4+6H+=10CO2+2Mn2++8H2O可知1.26g样品中含有草酸的物质的量为:0.004mol×5/2=0.01mol,草酸的质量为:90g/mol×0.01mol=0.9g,含有结晶水的物质的量为:(1.26g-0.9g)
÷18g/mol=0.02mol,则该草酸晶体中x=0.02mol/0.01mol=2。
考点:考查探究物质组成的实验方案设计。
19.亚硝酸钠是一种工业盐,在生产、生活
( http: / / www.21cnjy.com )中应用广泛.现用下图所示仪器(夹持装置已省略)及药品,探究亚硝酸钠与硫酸的反应及生成气体产物的成分.
已知:①NO+NO2+2OH-=2NO2-+H2O
②气体液化的温度:NO2:21℃、NO:-152℃
( http: / / www.21cnjy.com )
(1)为了检验装置A中生成的气体产物,仪器的连接顺序为(按左→右连接):A→C→
→
→B.
(2)关闭弹簧夹K1,打开分液漏斗活塞,滴入70%硫酸后,A中产生红棕色气体.
①确认A中产生的气体中含有NO,依据的现象是___________________.
②装置E的作用是__________________________.
(3)如果向D中通入过量O2,则装置B中发生反应的化学方程式为
.
如果没有装置C,对实验结论造成的影响是_________________________.
(4)通过上述实验探究过程,可得出装置A中反应的化学方程式是
.
【答案】(1)E;D;(2)①D中出现红棕色气体;②冷凝使NO2完全液化;(3)4NO2+O2+4NaOH=4NaNO3
+2H2O;水会与NO2反生成应NO,影响后面NO的检验;(4)2NaNO2+H2SO4=Na2SO4+NO2↑+NO↑+H2O.
【解析】
试题分析:(1)A是发生装置,C是干燥除水装置,因为NO2更易液化先分离NO2.所以接E,NO2分离
后再检验NO,需通氧气,接D.观察
( http: / / www.21cnjy.com )到气体从无色变成红棕色.所以说明是NO.B是尾气处理.为了检验装置A中生成的气体产物,仪器的连接顺序为(从左向右连接):A、C、E、D、B;(2)关闭弹簧夹,打开分液漏斗活塞,滴入70%的硫酸后,
A中产生红棕色气体.说明生成了NO2气体.①确认A中产生气体含有NO,通过在D装置中通O2来检验.观察气体是否变红棕色.②装置E的作用是冷凝,使NO2完全液化.(3)如果向D中通入过量O2,有过量的O2会与NO2发生氧化还原反应,所以可推断出反应方程式为:4NO2+O2+4NaOH=
4NaNO3+2H2O.如不干燥,水
( http: / / www.21cnjy.com )会与NO2反应产生NO,影响NO的检验.(4)通过上述实验探究过程,可得出装置A中反应应产生两种气体.发生歧化反应.化学方程式是2NaNO2+H2SO4
=Na2SO4+NO2↑+NO↑+H2O.
考点:实验探究和评价.
20.(12分)某同学预设计实验测定H2在通常状况下的摩尔体积,设计如下实验步骤:①连接如图所示装置,并检查装置的气密性
( http: / / www.21cnjy.com )
②向a仪器中装入VmL稀盐酸,锥形瓶中加入锌粒,B中加入碱石灰;
③称取A装置和B仪器和药品的总质量,记为a
g;
④采取措施使装置A中发生反应;
⑤反应停止后,测得在通常状况下收集的气体体积为b
mL;
⑥再次称量A装置和B仪器得总质量(含内装物质),记为c
g;
⑦处理数据等。
(1)写出A仪器中发生反应的化学方程式
(2)写出检查该装置气密性的方法
(3)A装置中仪器a的名称为
(4)若拆除B仪器(其他仪器不变),
(填“会”或“不会”)
对本实验产生影响,理由是
(5)根据上述数据,计算在通常状况下,H2的摩尔体积Vm=
(用含a、b、c等字母的代数式表示)
【答案】(1)Zn+2HCl=ZnCl
( http: / / www.21cnjy.com )2+H2↑;(2)关闭分液漏斗的活塞,把导管插入水中,微热锥形瓶,若导管口有气泡冒出,停止微热后,导管内形成一段液柱,且在一段时间内液柱高度不变,则说明气密性良好;(3)分液漏斗;(4)会,H2中混有的HCl气体和水蒸气的质量会被当成是H2的质量而导致c偏小,对实验产生影响;(5)Vm=2b×10-3/(a-c)L·mol-1。
【解析】
试题分析:(1)装置A中是盐
( http: / / www.21cnjy.com )酸和锌粒发生置换反应产生氢气,即Zn+2HCl=ZnCl2+H2↑;(2)检验此装置的气密性,类似于制氧气装置气密性的检验,因此操作是:关闭分液漏斗的活塞,把导管插入水中,微热锥形瓶,若导管口有气泡冒出,停止微热后,导管内形成一段液柱,且在一段时间内液柱高度不变,则说明气密性良好;(3)a为分液漏斗;(4)因为盐酸具有挥发性,也就是从A装置中出来的气体除H2外,还有H2O、HCl,碱石灰的作用是:干燥氢气、除去HCl,否则对氢气的质量产生影响,因此填“会”,因为此气体的物质的量为(a-c)/2mol,根据Vm=V/n,则Vm=2b×10-3/(a-c)
L·mol-1,不除去水蒸气和氯化氢,造成(a-c)偏大,即理由是:H2中混有的HCl气体和水蒸气的质量会被当成是H2的质量而导致c偏小,对实验产生影响;⑸根据(4)的分析得出:Vm=2b×10-3/(a-c)L·mol-1。
考点:考查反应原理、气密性检验、仪器名称等知识。
21.(10分)铁是应用最广泛的金属,铁的卤化物、氧化物等均为重要化合物。
(1)要确定铁的某氯化物F
( http: / / www.21cnjy.com )eClx的化学式,可用实验的方法。实验中称取0.54
g的FeClx样品,溶解后加入足量硝酸银溶液,得沉淀1.435g。求出FeClx中x值
(列出计算过程);
(2)现有一含有FeCl2和FeCl3的混
( http: / / www.21cnjy.com )合物样品,采用上述方法测得n(Fe):n(C1)=1:2.1,则该样品中FeCl3的物质的量分数为__________。在实验室中,FeCl2可用铁粉和__________反应制备
(3)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为____________;
【答案】(1)n(Cl)=
1.435g
/143.5g·mol-1==0.010mol
0.54g-0.010mol×35.5g·mol-1=0.19g
n(Fe)=0.19g/56g·mol-1=0.0034mol
n(Fe):
n(Cl)=0.0034:0.010≈1:3,x=3
(2)0.10或10%;盐酸或氯化铁溶液
(3)2Fe3++2I-=2Fe2++I2
【解析】
试题分析:(1)n(Cl)=n(H+)=n(OH-)=0.0250L×0.40
mol L-1=0.010
mol,0.54g
FeClx样品中含有氯离子物质的量为=0.010
mol,解得x=3,(2)FeCl2和FeCl3的混合物的样品中FeCl2物质的量为x,FeCl3的物质的量为y,则(x+y):(2x+3y)=1:2.1,得到x:y=9:1,氯化铁物质的量分数=×100%=10%;
在实验室中,FeCl2可用铁粉和盐酸反应得到
( http: / / www.21cnjy.com ),或可用铁粉和FeCl3反应生成;(3)氯化铁具有氧化性,碘化氢具有还原性,二者发生氧化还原反应生成氯化亚铁和碘单质,反应离子方程式为:2Fe3++2I-=2Fe2++I2。
考点:考查铁及其化合物。
22.某混合物A含有Al2
(SO4)3、Al2O3和Fe2O3,在一定条件下可实现下列物质之间的变化:
( http: / / www.21cnjy.com )
据此判断:
(1)固体E所含物质的化学式为
。
(2)反应③可用来焊接钢轨,化学方程式为
;
该反应称为:
。
(3)反应①的离子方程式为
。
(4)反应②的离子方程式为
。
【答案】(1)K2SO4
(NH4)2SO4
(2)2Al+Fe2O3Al2O3+2Fe
铝热反应
(3)Al2O3+2OH-+3H2O=2[Al(OH)4]-
(4)Al3++3NH3·H2O=Al(OH)3↓+3NH4+
【解析】
试题分析:
考点:KAl(SO4)2溶于水,Al2O3和Fe2O3均不溶于水,混合物A加水溶解后,溶液中是KAl(SO4)2,沉淀是Al2O3和Fe2O3;向沉淀中加NaOH溶液,Fe2O3不反应,Al2O3可与NaOH溶液反应生成NaAlO2,则B为Fe2O3,向NaAlO2溶液中通入CO2可得Al(OH)3沉淀,Al(OH)3受热分解生成Al2O3,则D为Al2O3,反应③为铝热反应,C为Al,向溶液中加过量氨水,溶液与过量氨水反应,Al3+被沉淀,得到氢氧化铝沉淀,溶液中剩余的是K2SO4和(NH4)2SO4,经过蒸发、结晶,得到K2SO4和(NH4)2SO4,(1)由以上分析可知固体E是K2SO4
和(NH4)2SO4;(2)反应③为铝热反应,方程式为2Al+Fe2O32Fe+Al2O3,该反应称为铝热反应;(3)反应①为Al2O3和氢氧化钠的反应,离子方程式为Al2O3+2OH-+3H2O═2[Al(OH)4]--;(4)反应②为Al3+和氨水的反应,反应的离子方程式为Al3++3NH3 H2O═Al(OH)3↓+3NH4+。
【考点定位】考查无机推断,涉及元素及化合物的性质。
【名师点晴】KAl(SO4)2溶于水,Al2
( http: / / www.21cnjy.com )O3和Fe2O3均不溶于水,混合物A加水溶解后,溶液中是KAl(SO4)2,沉淀是Al2O3和Fe2O3;向沉淀中加NaOH溶液,Fe2O3不反应,Al2O3可与NaOH溶液反应生成NaAlO2,则B为Fe2O3,向NaAlO2溶液中通入CO2可得Al(OH)3沉淀,Al(OH)3受热分解生成Al2O3,则D为Al2O3,反应③为铝热反应,C为Al,向溶液中加过量氨水,溶液与过量氨水反应,Al3+被沉淀,得到氢氧化铝沉淀,溶液中剩余的是K2SO4
和(NH4)2SO4,经过蒸发、结晶,得到的是K2SO4
和(NH4)2SO4,以此解答该题。
23.已知:
如上式烯烃的氧化反应,双键能被高锰酸钾酸性溶液氧化而断裂,在断键两端的碳原子能被氧化成为羧基(-COOH)或酮羰基()。由氧化所得的产物,可以推测反应物烯烃的结构。今有A、B、C三种含有碳碳双键的化合物,它们被上述溶液氧化。
1molA(分子式C8H16)氧化得到2mol酮D;
1molB(分子式为C8H14)氧化得到2mol酮E和1mol二元羧酸
1molC(分子式C8H14)氧化只得到一种产物,它是一种没有支链的二元羧酸。请据此推断B、C、D、E的结构简式
B.
C.
D.
E.
【答案】B.(CH3)2C=CH-CH=C(CH3)2;C.;D.CH3COCH2CH3;E.(CH3)2C=O;
【解析】
试题分析:1molA(分子式C8H16),氧化得到2mol酮D,A中含有1个C=C双键,为对称结构,不饱和C原子上没有H原子,A为:CH3CH2C(CH3)=C(CH3)CH2CH3,结合信息可知,D为CH3COCH2CH3;1molB(分子式C8H14),氧化得到2mol酮E和1mol二元羧酸,分子中含有2个C=C双键,且为对称结构,故B为:(CH3)2C=CH-CH=C(CH3)2,结合信息可知E为(CH3)2C=O;1molC(分子式C8H14),氧化只得到一种产物,它是一种没有支链的二元羧酸,则C为环烯,C的结构简式为;故答案为:(CH3)2C=CH-CH=C(CH3)2,,CH3COCH2CH3,(CH3)2C=O。
考点:考查了有机物的推断;有机物分子中的官能团及其结构的相关知识。
同课章节目录
