专题强化练1 突破速率常数-《精讲精练》26版高中同步新教材化学人教A版(2019)选必修1
文档属性
| 名称 | 专题强化练1 突破速率常数-《精讲精练》26版高中同步新教材化学人教A版(2019)选必修1 |  | |
| 格式 | zip | ||
| 文件大小 | 151.0KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-11 10:52:11 | ||
图片预览



文档简介
第二章 化学反应速率与化学平衡
专题强化练1 突破速率常数
1.温度为T ℃时,反应2HI(g) H2(g)+I2(g)在体积为1 L的密闭容器中进行,起始时充入1 mol HI,气体混合物中HI的物质的量分数w(HI)与反应时间t的关系如表所示:
t/min 0 20 40 60 80 100
w(HI)/% 100 91 84 81 80 80
该反应的正反应速率v正=k正·c2(HI),逆反应速率v逆=k逆·c(H2)·c(I2),k正、k逆为速率常数,则为 ( )
A. D.8
2.某反应A(g)+B(g) C(g)+D(g)的速率方程为v=k·cm(A)·cn(B),改变反应物浓度时,反应的瞬时速率如下表所示:
组号 1 2 3 4 5 6
c(A)/(mol·L-1) 0.25 0.50 1.00 0.50 1.00 c1
c(B)/(mol·L-1) 0.050 0.050 0.100 0.100 0.200 c2
v/(×10-3mol· L-1·min-1) 1.6 3.2 v1 3.2 v2 4.8
下列说法不正确的是 ( )
A.表格中的c1=0.75、v2=6.4
B.该反应的速率常数k=6.4×10-3 min-1
C.由以上数据可知浓度对速率的影响是实验测得的,无法通过化学方程式直接得出
D.升温、缩小容积(加压),使k增大导致反应的瞬时速率加快
3.反应S2的反应机理:
①S2+I- S2O8I3-
②……
③I2+I-(快反应)
改变反应物浓度时,反应速率如表所示:
组号 c(S2)/ mol·L-1 c(I-)/ mol·L-1 v/mol·L-1· min-1
1 0.038 0.060 1.4×10-5
2 0.076 0.060 2.8×10-5
3 0.076 0.030 1.4×10-5
下列说法正确的是 ( )
A.该反应的速率方程为v=k·c(S2)·c3(I-)
B.该反应的速率常数k的值约为6.14×10-3
C.第②步反应为S2O8I3-+I2 2S+3I-
D.3步反应中反应③的活化能最大
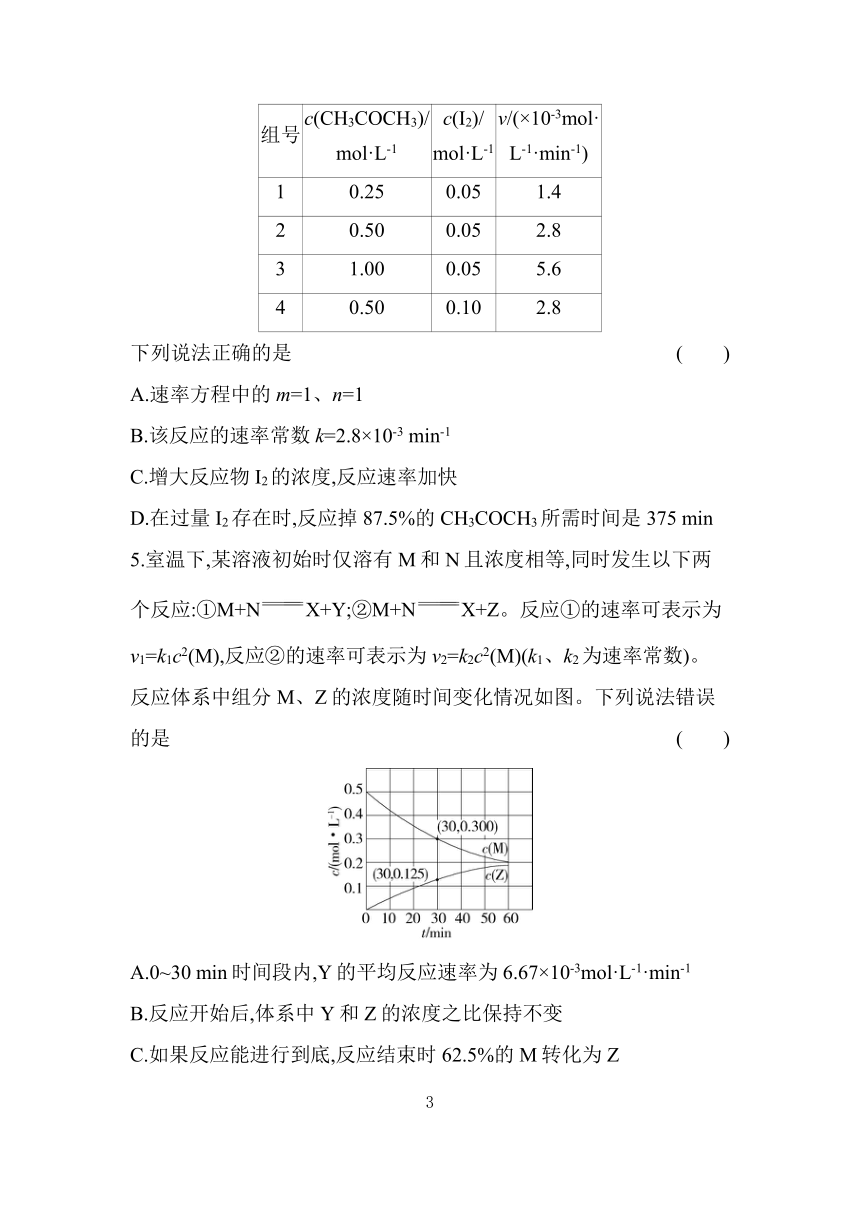
4.丙酮碘代反应CH3COCH3+I2 CH3COCH2I+HI的速率方程为v=kcm(CH3COCH3)cn(I2)。其半衰期(当剩余反应物恰好是起始的一半时所需的时间)为0.7/k,改变反应物浓度时,反应速率如表所示。
组号 c(CH3COCH3)/ mol·L-1 c(I2)/ mol·L-1 v/(×10-3mol· L-1·min-1)
1 0.25 0.05 1.4
2 0.50 0.05 2.8
3 1.00 0.05 5.6
4 0.50 0.10 2.8
下列说法正确的是 ( )
A.速率方程中的m=1、n=1
B.该反应的速率常数k=2.8×10-3 min-1
C.增大反应物I2的浓度,反应速率加快
D.在过量I2存在时,反应掉87.5%的CH3COCH3所需时间是375 min
5.室温下,某溶液初始时仅溶有M和N且浓度相等,同时发生以下两个反应:①M+NX+Y;②M+NX+Z。反应①的速率可表示为v1=k1c2(M),反应②的速率可表示为v2=k2c2(M)(k1、k2为速率常数)。反应体系中组分M、Z的浓度随时间变化情况如图。下列说法错误的是 ( )
A.0~30 min时间段内,Y的平均反应速率为6.67×10-3mol·L-1·min-1
B.反应开始后,体系中Y和Z的浓度之比保持不变
C.如果反应能进行到底,反应结束时62.5%的M转化为Z
D.反应①的活化能比反应②的活化能大
6.化学反应的速率方程中各物质浓度的指数称为各物质的分级数,所有指数的总和称为反应总级数,用n表示。298 K时,测定反应2H2(g)+2NO(g) 2H2O(g)+N2(g)在不同反应物浓度时的化学反应速率,结果见下表。
实验编号 1 2 3 4
c(H2)/ (mol·L-1) 1×10-3 2×10-3 6×10-3 6×10-3
c(NO)/ (mol·L-1) 6×10-3 6×10-3 0.100 0.200
v/(mol·L-1· s-1) 2.88× 10-9 5.76× 10-9 4.8× 10-6 1.92× 10-5
已知:v=kcα(H2)·cβ(NO),其中k不因反应物浓度的变化而变化。回答下列问题:
(1)α= ,β= ,n= 。由该实验可知,反应总级数与反应物的化学计量数的和 (填“有”或“没有”)必然的联系。
(2)k= mol-2·L2·s-1。若升高温度,k将 (填“增大”“减小”或“不变”);当c(H2)=4 mol·L-1、c(NO)=5×10-2 mol·L-1时,反应速率v= mol·L-1·s-1。
7.H2(g)+I2(g) 2HI(g) ΔH=-15 kJ·mol-1的反应机理如下:
反应ⅰ:I2(g) 2I(g) ΔH1
反应ⅱ:H2(g)+2I(g) 2HI(g) ΔH2
其能量与反应过程的关系如图所示。
已知:对于基元反应aA(g)+bB(g)cC(g)+dD(g),其速率方程为v=kca(A)·cb(B)。
回答下列问题:
(1)ΔH1 0(填“>”或“<”)。
(2)反应ⅰ逆反应的活化能为 kJ·mol-1(用含a、b、c的代数式表示)。
(3)决定总反应速率快慢的是 (填“反应ⅰ”或“反应ⅱ”)。
(4)各步反应速率方程如表,其中k1、k2、k3、k4分别为v1(正)、v1(逆)、v2(正)、v2(逆)的速率常数,且与温度有关。
反应ⅰ 反应ⅱ
v1(正)=k1c(I2) v1(逆)=k2c2(I) v2(正)=k3c(H2)· c2(I) v2(逆)=k4c2(HI)
实验测得总反应的速率方程为v(正)=kc(I2)·c(H2),则k= (用仅含k1、k2、k3的代数式表示)。
答案与分层梯度式解析
1.A 2.D 3.B 4.D 5.A
1.A 温度为T ℃时,体积为1 L的密闭容器中,2HI(g) H2(g)+I2(g)达到平衡时,v正=v逆,即k正·c2(HI)=k逆·c(H2)·c(I2),故==K。由表格数据可知,平衡时w(HI)=80%,即c(HI)=0.8 mol/L,则平衡时c(H2)=c(I2)=0.1 mol/L,所以K==,即=。
2.D 将1、2两组数据代入速率方程:1.6×10-3 mol·L-1·min-1=k×(0.25 mol·L-1)m×(0.05 mol·L-1)n、3.2×10-3 mol·L-1·min-1=k×(0.5 mol·L-1)m×(0.05 mol·L-1)n,联立二式得m=1;同理,将2、4两组数据代入速率方程,可得n=0;将m=1、n=0代入速率方程得1.6×·min-1=k×0.25 mol·L-1,该反应的速率常数k=6.4×10-3 min-1;由此可知反应速率与A的浓度成正比,则=,c1=0.75,将5组数据代入速率方程,v2×10-3mol·L-1·min-1=6.4×10-3 min-1×1.00 mol·L-1,解得v2=6.4,A、B正确。由m=1,n=0可知浓度对速率的影响是实验测得的,无法通过化学方程式直接得出,C正确。速率常数与浓度无关,缩小容积(加压)不会使k增大,D错误。
3.B 由1、2两组数据可知,c(S2)增大1倍,反应速率增大1倍,由2、3两组数据可知,c(I-)增大1倍,反应速率增大1倍,可得出反应的速率方程为v=k·c(S2)·c(I-),A错误;将1组数据代入v=k·c(S2)·c(I-),解得速率常数k的值约为6.14×10-3,B正确;用总反应-①-③得第②步反应,即S2O8I3-+I- 2S+I2,C错误;3步反应中反应③为快反应,其活化能不是最大的,D错误。
4.D 将题目数据代入速率方程v=kcm(CH3COCH3)cn(I2),确定m、n的数值,然后根据速率方程讨论速率的影响因素(解题技法)。由题表数据知,当c(I2)相同时,c(CH3COCH3)增大一定倍数时,反应速率也增大相应的倍数,故m=1;当c(CH3COCH3)相同时,c(I2)改变对反应速率无影响,故n=0,A、C错误。由上述分析知m=1,n=0,则速率方程v=k·c(CH3OCH3),代入1组数据计算可得k=5.6×10-3 min-1,B错误;在过量I2存在时,反应掉87.5%的CH3COCH3,可以看作经历3个半衰期,即50%+25%+12.5%,因此所需时间为=375 min,D正确。
5.A 0~30 min时间段内,Δc(Z)=0.125 mol·L-1,Δc(M)=0.500 mol·L-1-0.300 mol·L-1=0.200 mol·L-1,反应①中Δc(M)=0.200 mol·L-1-0.125 mol·L-1=0.075 mol·L-1,则Δc(Y)=0.075 mol·L-1,v(Y)===2.5×10-3 mol·L-1·min-1,A错误;反应①②速率之比为==,为定值,则Y、Z的浓度变化量之比也为定值,故反应开始后,体系中Y和Z的浓度之比保持不变,B正确;由上述分析可知,===,如果反应能进行到底,反应结束时,①②的转化率之比为3∶5,因此有(即62.5%)的M转化为Z,C正确;结合C选项,反应①的速率小于反应②的速率,所以反应①的活化能比反应②的活化能大,D正确。
解题技法
6.答案 (1)1 2 3 没有 (2)0.08 增大 8×10-4
解析 (1)将实验1,2中数据带入,得到α=1,可以将实验3,4中数据带入,得到β=2,反应总级数n=1+2=3。反应物的化学计量数之和是4,反应总级数是3,反应总级数与反应物的化学计量数之和没有必然的联系。
(2)将第1组数据代入,可得k==
=0.08 mol-2·L2·s-1,升高温度,反应速率v增大,k将增大。v=kc(H2)·c2(NO),将数据带入,得v=[0.08×4×(5×10-2)2] mol·L-1·s-1=8×10-4 mol·L-1·s-1。
7.答案 (1)> (2)(a+b-c+15) (3)反应ⅱ (4)
解析 (1)从题图中可以看出,1 mol I2(g)的能量低于2 mol I(g)的能量,所以ΔH1>0。
(2)设反应ⅰ逆反应的活化能为x kJ·mol-1,根据题图可知,I2(g)2I(g)的ΔH1=(a-x) kJ·mol-1,反应ⅱH2(g)+2I(g) 2HI(g)的ΔH2=(b-c) kJ·mol-1,总反应H2(g)+I2(g) 2HI(g)的ΔH=ΔH1+ΔH2=(a-x) kJ·mol-1+(b-c) kJ·mol-1=-15 kJ·mol-1,所以x=a+b-c+15。
(3)由题图可知,反应ⅱ的活化能大于反应ⅰ的活化能,所以反应ⅱ的速率慢,决定总反应速率快慢的是反应ⅱ。
(4)该反应的决速步骤是反应ⅱ。反应ⅰ达到平衡时,正、逆反应速率相等,k1c(I2)=k2c2(I),所以c2(I)=,代入v2(正)=k3c(H2)·c2(I)中,得v2(正)=k3c(H2),和v(正)=kc(I2)·c(H2)比较可知k=。
9
专题强化练1 突破速率常数
1.温度为T ℃时,反应2HI(g) H2(g)+I2(g)在体积为1 L的密闭容器中进行,起始时充入1 mol HI,气体混合物中HI的物质的量分数w(HI)与反应时间t的关系如表所示:
t/min 0 20 40 60 80 100
w(HI)/% 100 91 84 81 80 80
该反应的正反应速率v正=k正·c2(HI),逆反应速率v逆=k逆·c(H2)·c(I2),k正、k逆为速率常数,则为 ( )
A. D.8
2.某反应A(g)+B(g) C(g)+D(g)的速率方程为v=k·cm(A)·cn(B),改变反应物浓度时,反应的瞬时速率如下表所示:
组号 1 2 3 4 5 6
c(A)/(mol·L-1) 0.25 0.50 1.00 0.50 1.00 c1
c(B)/(mol·L-1) 0.050 0.050 0.100 0.100 0.200 c2
v/(×10-3mol· L-1·min-1) 1.6 3.2 v1 3.2 v2 4.8
下列说法不正确的是 ( )
A.表格中的c1=0.75、v2=6.4
B.该反应的速率常数k=6.4×10-3 min-1
C.由以上数据可知浓度对速率的影响是实验测得的,无法通过化学方程式直接得出
D.升温、缩小容积(加压),使k增大导致反应的瞬时速率加快
3.反应S2的反应机理:
①S2+I- S2O8I3-
②……
③I2+I-(快反应)
改变反应物浓度时,反应速率如表所示:
组号 c(S2)/ mol·L-1 c(I-)/ mol·L-1 v/mol·L-1· min-1
1 0.038 0.060 1.4×10-5
2 0.076 0.060 2.8×10-5
3 0.076 0.030 1.4×10-5
下列说法正确的是 ( )
A.该反应的速率方程为v=k·c(S2)·c3(I-)
B.该反应的速率常数k的值约为6.14×10-3
C.第②步反应为S2O8I3-+I2 2S+3I-
D.3步反应中反应③的活化能最大
4.丙酮碘代反应CH3COCH3+I2 CH3COCH2I+HI的速率方程为v=kcm(CH3COCH3)cn(I2)。其半衰期(当剩余反应物恰好是起始的一半时所需的时间)为0.7/k,改变反应物浓度时,反应速率如表所示。
组号 c(CH3COCH3)/ mol·L-1 c(I2)/ mol·L-1 v/(×10-3mol· L-1·min-1)
1 0.25 0.05 1.4
2 0.50 0.05 2.8
3 1.00 0.05 5.6
4 0.50 0.10 2.8
下列说法正确的是 ( )
A.速率方程中的m=1、n=1
B.该反应的速率常数k=2.8×10-3 min-1
C.增大反应物I2的浓度,反应速率加快
D.在过量I2存在时,反应掉87.5%的CH3COCH3所需时间是375 min
5.室温下,某溶液初始时仅溶有M和N且浓度相等,同时发生以下两个反应:①M+NX+Y;②M+NX+Z。反应①的速率可表示为v1=k1c2(M),反应②的速率可表示为v2=k2c2(M)(k1、k2为速率常数)。反应体系中组分M、Z的浓度随时间变化情况如图。下列说法错误的是 ( )
A.0~30 min时间段内,Y的平均反应速率为6.67×10-3mol·L-1·min-1
B.反应开始后,体系中Y和Z的浓度之比保持不变
C.如果反应能进行到底,反应结束时62.5%的M转化为Z
D.反应①的活化能比反应②的活化能大
6.化学反应的速率方程中各物质浓度的指数称为各物质的分级数,所有指数的总和称为反应总级数,用n表示。298 K时,测定反应2H2(g)+2NO(g) 2H2O(g)+N2(g)在不同反应物浓度时的化学反应速率,结果见下表。
实验编号 1 2 3 4
c(H2)/ (mol·L-1) 1×10-3 2×10-3 6×10-3 6×10-3
c(NO)/ (mol·L-1) 6×10-3 6×10-3 0.100 0.200
v/(mol·L-1· s-1) 2.88× 10-9 5.76× 10-9 4.8× 10-6 1.92× 10-5
已知:v=kcα(H2)·cβ(NO),其中k不因反应物浓度的变化而变化。回答下列问题:
(1)α= ,β= ,n= 。由该实验可知,反应总级数与反应物的化学计量数的和 (填“有”或“没有”)必然的联系。
(2)k= mol-2·L2·s-1。若升高温度,k将 (填“增大”“减小”或“不变”);当c(H2)=4 mol·L-1、c(NO)=5×10-2 mol·L-1时,反应速率v= mol·L-1·s-1。
7.H2(g)+I2(g) 2HI(g) ΔH=-15 kJ·mol-1的反应机理如下:
反应ⅰ:I2(g) 2I(g) ΔH1
反应ⅱ:H2(g)+2I(g) 2HI(g) ΔH2
其能量与反应过程的关系如图所示。
已知:对于基元反应aA(g)+bB(g)cC(g)+dD(g),其速率方程为v=kca(A)·cb(B)。
回答下列问题:
(1)ΔH1 0(填“>”或“<”)。
(2)反应ⅰ逆反应的活化能为 kJ·mol-1(用含a、b、c的代数式表示)。
(3)决定总反应速率快慢的是 (填“反应ⅰ”或“反应ⅱ”)。
(4)各步反应速率方程如表,其中k1、k2、k3、k4分别为v1(正)、v1(逆)、v2(正)、v2(逆)的速率常数,且与温度有关。
反应ⅰ 反应ⅱ
v1(正)=k1c(I2) v1(逆)=k2c2(I) v2(正)=k3c(H2)· c2(I) v2(逆)=k4c2(HI)
实验测得总反应的速率方程为v(正)=kc(I2)·c(H2),则k= (用仅含k1、k2、k3的代数式表示)。
答案与分层梯度式解析
1.A 2.D 3.B 4.D 5.A
1.A 温度为T ℃时,体积为1 L的密闭容器中,2HI(g) H2(g)+I2(g)达到平衡时,v正=v逆,即k正·c2(HI)=k逆·c(H2)·c(I2),故==K。由表格数据可知,平衡时w(HI)=80%,即c(HI)=0.8 mol/L,则平衡时c(H2)=c(I2)=0.1 mol/L,所以K==,即=。
2.D 将1、2两组数据代入速率方程:1.6×10-3 mol·L-1·min-1=k×(0.25 mol·L-1)m×(0.05 mol·L-1)n、3.2×10-3 mol·L-1·min-1=k×(0.5 mol·L-1)m×(0.05 mol·L-1)n,联立二式得m=1;同理,将2、4两组数据代入速率方程,可得n=0;将m=1、n=0代入速率方程得1.6×·min-1=k×0.25 mol·L-1,该反应的速率常数k=6.4×10-3 min-1;由此可知反应速率与A的浓度成正比,则=,c1=0.75,将5组数据代入速率方程,v2×10-3mol·L-1·min-1=6.4×10-3 min-1×1.00 mol·L-1,解得v2=6.4,A、B正确。由m=1,n=0可知浓度对速率的影响是实验测得的,无法通过化学方程式直接得出,C正确。速率常数与浓度无关,缩小容积(加压)不会使k增大,D错误。
3.B 由1、2两组数据可知,c(S2)增大1倍,反应速率增大1倍,由2、3两组数据可知,c(I-)增大1倍,反应速率增大1倍,可得出反应的速率方程为v=k·c(S2)·c(I-),A错误;将1组数据代入v=k·c(S2)·c(I-),解得速率常数k的值约为6.14×10-3,B正确;用总反应-①-③得第②步反应,即S2O8I3-+I- 2S+I2,C错误;3步反应中反应③为快反应,其活化能不是最大的,D错误。
4.D 将题目数据代入速率方程v=kcm(CH3COCH3)cn(I2),确定m、n的数值,然后根据速率方程讨论速率的影响因素(解题技法)。由题表数据知,当c(I2)相同时,c(CH3COCH3)增大一定倍数时,反应速率也增大相应的倍数,故m=1;当c(CH3COCH3)相同时,c(I2)改变对反应速率无影响,故n=0,A、C错误。由上述分析知m=1,n=0,则速率方程v=k·c(CH3OCH3),代入1组数据计算可得k=5.6×10-3 min-1,B错误;在过量I2存在时,反应掉87.5%的CH3COCH3,可以看作经历3个半衰期,即50%+25%+12.5%,因此所需时间为=375 min,D正确。
5.A 0~30 min时间段内,Δc(Z)=0.125 mol·L-1,Δc(M)=0.500 mol·L-1-0.300 mol·L-1=0.200 mol·L-1,反应①中Δc(M)=0.200 mol·L-1-0.125 mol·L-1=0.075 mol·L-1,则Δc(Y)=0.075 mol·L-1,v(Y)===2.5×10-3 mol·L-1·min-1,A错误;反应①②速率之比为==,为定值,则Y、Z的浓度变化量之比也为定值,故反应开始后,体系中Y和Z的浓度之比保持不变,B正确;由上述分析可知,===,如果反应能进行到底,反应结束时,①②的转化率之比为3∶5,因此有(即62.5%)的M转化为Z,C正确;结合C选项,反应①的速率小于反应②的速率,所以反应①的活化能比反应②的活化能大,D正确。
解题技法
6.答案 (1)1 2 3 没有 (2)0.08 增大 8×10-4
解析 (1)将实验1,2中数据带入,得到α=1,可以将实验3,4中数据带入,得到β=2,反应总级数n=1+2=3。反应物的化学计量数之和是4,反应总级数是3,反应总级数与反应物的化学计量数之和没有必然的联系。
(2)将第1组数据代入,可得k==
=0.08 mol-2·L2·s-1,升高温度,反应速率v增大,k将增大。v=kc(H2)·c2(NO),将数据带入,得v=[0.08×4×(5×10-2)2] mol·L-1·s-1=8×10-4 mol·L-1·s-1。
7.答案 (1)> (2)(a+b-c+15) (3)反应ⅱ (4)
解析 (1)从题图中可以看出,1 mol I2(g)的能量低于2 mol I(g)的能量,所以ΔH1>0。
(2)设反应ⅰ逆反应的活化能为x kJ·mol-1,根据题图可知,I2(g)2I(g)的ΔH1=(a-x) kJ·mol-1,反应ⅱH2(g)+2I(g) 2HI(g)的ΔH2=(b-c) kJ·mol-1,总反应H2(g)+I2(g) 2HI(g)的ΔH=ΔH1+ΔH2=(a-x) kJ·mol-1+(b-c) kJ·mol-1=-15 kJ·mol-1,所以x=a+b-c+15。
(3)由题图可知,反应ⅱ的活化能大于反应ⅰ的活化能,所以反应ⅱ的速率慢,决定总反应速率快慢的是反应ⅱ。
(4)该反应的决速步骤是反应ⅱ。反应ⅰ达到平衡时,正、逆反应速率相等,k1c(I2)=k2c2(I),所以c2(I)=,代入v2(正)=k3c(H2)·c2(I)中,得v2(正)=k3c(H2),和v(正)=kc(I2)·c(H2)比较可知k=。
9
