第四章 突破多室带膜电池、多池串联电化学装置-《精讲精练》26版高中同步新教材化学人教A版(2019)选必修1
文档属性
| 名称 | 第四章 突破多室带膜电池、多池串联电化学装置-《精讲精练》26版高中同步新教材化学人教A版(2019)选必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 521.6KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-10-20 09:02:00 | ||
图片预览



文档简介
第四章 化学反应与电能
题型整合练 突破多室带膜电池、多池串联电化学装置
题型1 多室带膜电化学装置
1.锌溴液流电池具有高能量密度和长循环寿命的特点,适用于储能系统,其反应的化学方程式为Zn+Br2 ZnBr2,装置如图所示,其中Q·Br-能与单质溴结合生成Q·B。下列说法错误的是 ( )
A.正、负极电解液均为溴化锌溶液
B.Q·Br-能有效防止溴的挥发
C.充电时,阳极的电极反应为2Br--2e-+Q·Br- Q·B
D.为防止电池自放电,隔膜应为阴离子交换膜
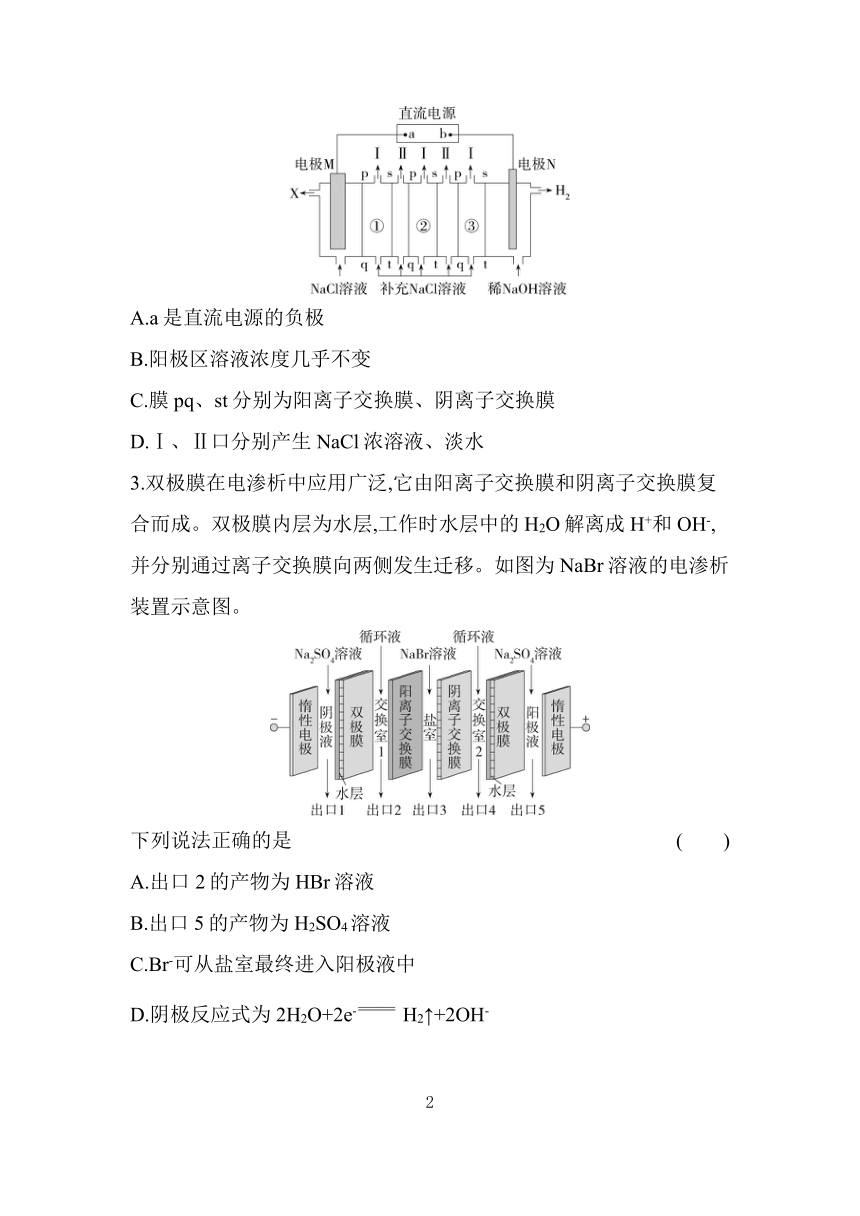
2.目前,应用电渗析法进行海水淡化是解决淡水资源匮乏的有效途径之一,该方法是利用电解原理通过多组电渗析膜实现,工作原理如图所示(以NaCl溶液代替海水),同时获得产品Cl2、H2、NaOH。下列说法正确的是 ( )
A.a是直流电源的负极
B.阳极区溶液浓度几乎不变
C.膜pq、st分别为阳离子交换膜、阴离子交换膜
D.Ⅰ、Ⅱ口分别产生NaCl浓溶液、淡水
3.双极膜在电渗析中应用广泛,它由阳离子交换膜和阴离子交换膜复合而成。双极膜内层为水层,工作时水层中的H2O解离成H+和OH-,并分别通过离子交换膜向两侧发生迁移。如图为NaBr溶液的电渗析装置示意图。
下列说法正确的是 ( )
A.出口2的产物为HBr溶液
B.出口5的产物为H2SO4溶液
C.Br-可从盐室最终进入阳极液中
D.阴极反应式为2H2O+2e- H2↑+2OH-
4.我国科学家设计如图所示的电解池,实现了海水直接制备氢气技术的绿色化。该装置工作时阳极无Cl2生成且KOH溶液的浓度不变,电解生成氢气的速率为x mol·h-1。下列说法错误的是 ( )
A.b电极反应式为2H2O+2e- H2↑+2OH-
B.离子交换膜为阴离子交换膜
C.电解时海水中动能高的水分子可穿过PTFE膜
D.海水为电解池补水的速率为2x mol·h-1
题型2 多池串联电化学装置
5.(经典题)下图为相互串联的三个装置,下列说法正确的是( )
A.甲池中A极的电极反应式为CH4-8e-+2H2O CO2+8H+
B.若利用乙池在铁片上镀银,则C是铁片
C.往丙池中滴加酚酞,石墨附近溶液先变红
D.若甲池消耗标准状况下1.4 L CH4,则丙池中阳极上产生气体的物质的量为0.15 mol
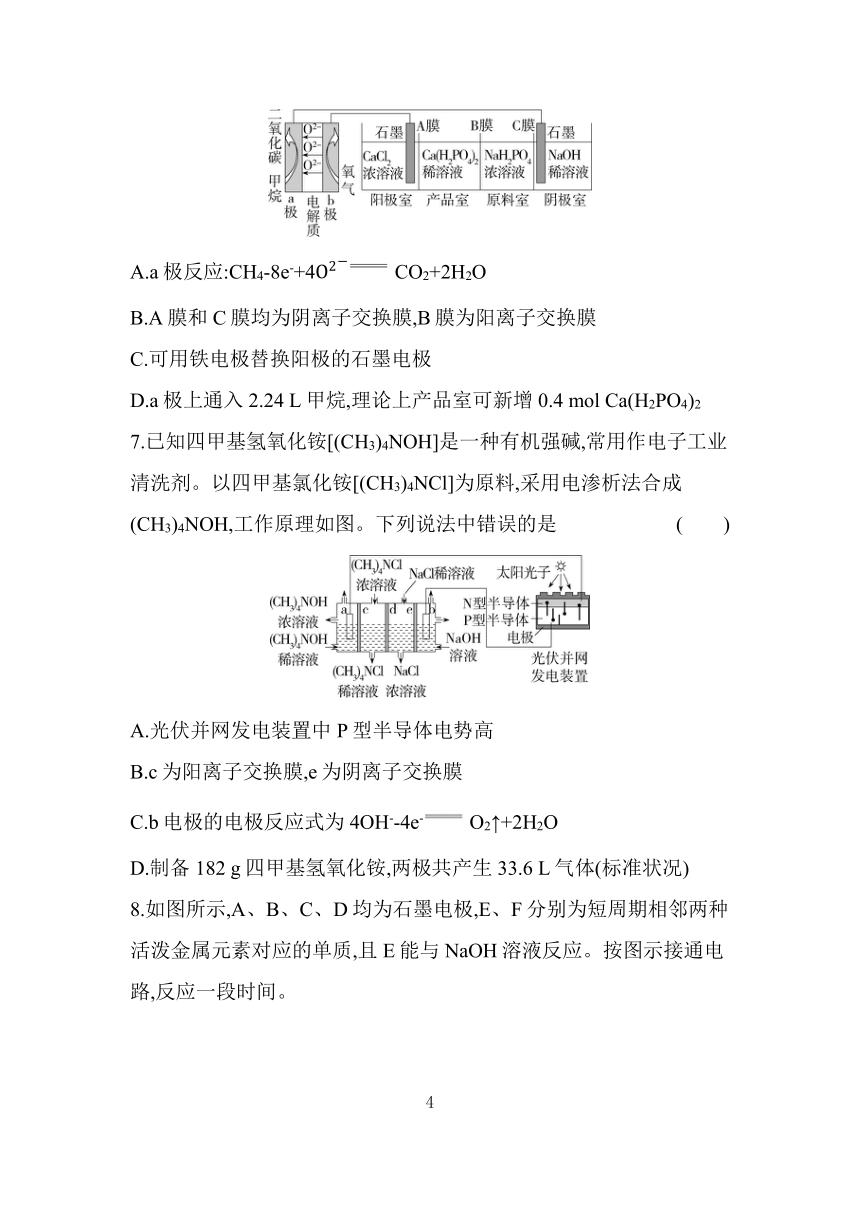
6.利用CH4燃料电池电解制备Ca(H2PO4)2并得到副产物NaOH、H2、Cl2,装置如图所示。下列说法正确的是 ( )
A.a极反应:CH4-8e-+4 CO2+2H2O
B.A膜和C膜均为阴离子交换膜,B膜为阳离子交换膜
C.可用铁电极替换阳极的石墨电极
D.a极上通入2.24 L甲烷,理论上产品室可新增0.4 mol Ca(H2PO4)2
7.已知四甲基氢氧化铵[(CH3)4NOH]是一种有机强碱,常用作电子工业清洗剂。以四甲基氯化铵[(CH3)4NCl]为原料,采用电渗析法合成(CH3)4NOH,工作原理如图。下列说法中错误的是 ( )
A.光伏并网发电装置中P型半导体电势高
B.c为阳离子交换膜,e为阴离子交换膜
C.b电极的电极反应式为4OH--4e- O2↑+2H2O
D.制备182 g四甲基氢氧化铵,两极共产生33.6 L气体(标准状况)
8.如图所示,A、B、C、D均为石墨电极,E、F分别为短周期相邻两种活泼金属元素对应的单质,且E能与NaOH溶液反应。按图示接通电路,反应一段时间。
回答下列问题:
(1)甲池是 (填“原电池”或“电解池”)装置,电极A的名称是 。
(2)C极为 (填“阴极”或“阳极”),电极反应式为 。
(3)烧杯中溶液会变蓝的是 (填“a”或“b”)。
(4)F极的名称是 (填“正极”或“负极”),电极反应式为 。
(5)甲池中总反应的离子方程式为 。
答案与分层梯度式解析
1.D 2.B 3.D 4.D 5.D 6.A 7.B
1.D 根据电池反应的化学方程式Zn+Br2 ZnBr2可知,正、负极电解液均为溴化锌溶液,A正确;Q·Br-能与单质溴结合生成Q·B,能有效防止溴挥发,B正确;充电时Br-在阳极放电,再与Q·Br-结合,阳极的电极反应为2Br--2e-+Q·Br- Q·B,C正确;充电时生成的Q·B向负极扩散,与负极的锌发生反应造成自放电,为防止Q·B向负极移动,隔膜应为阳离子交换膜,D错误。
2.B 电极N产生H2,则电极N为阴极,与电源负极相连,则b为直流电源负极,a为直流电源正极,A错误;阳极的电极反应为2Cl--2e- Cl2↑,①中氯离子通过阴离子交换膜pq进入阳极区,溶液浓度几乎不变,B正确;①中氯离子通过阴离子交换膜pq进入阳极区,③中钠离子通过阳离子交换膜st进入阴极区,C错误;①中氯离子向左侧移动,钠离子向右侧移动,氯化钠溶液浓度减小,使Ⅰ口对应区域形成淡水,Ⅱ口对应区域形成NaCl浓溶液,D错误。
解题技法
含“膜”电池中“隔膜”的常考点
(1)判断隔膜类型:根据电极反应式,判断隔膜两侧离子变化,根据溶液呈电中性判断离子迁移的方向。(2)分析隔膜作用:在产品制备中,隔膜的主要作用是提高产品纯度,避免产物之间发生反应。
3.D 电解时,溶液中的阳离子向阴极移动,阴离子向阳极移动,盐室中的Na+通过阳离子交换膜进入交换室1,双极膜提供的氢氧根离子进入交换室1,出口2的产物为NaOH溶液,A错误;盐室中的Br-通过阴离子交换膜进入交换室2,双极膜提供的氢离子进入交换室2,故出口4的产物为HBr溶液,钠离子不能通过双极膜,故出口5的产物不是H2SO4溶液,B错误;Br-不能通过双极膜,即Br-不会从盐室最终进入阳极液中,C错误;电解池阴极发生还原反应,电极反应式为2H2O+2e- H2↑+2OH-,D正确。
4.D 根据题意,该装置为电解池,在阴极制得H2;根据“该装置工作时阳极无Cl2生成”,可知阳极上不是Cl-失电子,而是OH-失电子得到O2。与电源负极相连的b电极为阴极,该极产物H2是由水电离出的氢离子得电子产生的,电极反应为2H2O+2e- H2↑+2OH-,A项正确;阳极OH-放电且阳极KOH溶液的浓度不变,所以阴极产生的OH-通过离子交换膜进入阳极区,在阳极失电子得到O2,则装置中的离子交换膜为阴离子交换膜,B项正确;PTFE膜透汽不透液态水,所以海水中动能高的水分子可穿过PTFE膜,C项正确;根据电解总反应2H2O 2H2↑+O2↑,生成H2的速率等于消耗水的速率,即补水的速率为x mol·h-1,D项错误。
5.D 结合图示装置可知甲池为燃料电池,乙池和丙池均为电解池。甲池中CH4在碱性条件下失电子发生氧化反应,电极反应式为CH4+10OH--8e- C+7H2O,A错误;若利用乙池在铁片上镀银,铁片作阴极,即D是铁片,B错误;丙池中Fe电极与电源负极相连,为阴极,石墨电极为阳极,在石墨电极生成Cl2,在Fe电极生成H2和NaOH,则往丙池中滴加酚酞,铁电极附近溶液先变红,C错误;若甲池消耗标准状况下1.4 L CH4,反应中失去电子的物质的量为×8=0.5 mol,串联电路中转移电子的物质的量相等,则丙池阳极也失去0.5 mol电子,丙池中阳极开始时的电极反应为2Cl--2e- Cl2↑,溶液中含n(Cl-)=0.1 L×1 mol/L=0.1 mol,产生0.05 mol Cl2,然后阳极水电离出的OH-放电,结合2H2O-4e- O2↑+4H+可知转移0.4 mol电子时生成0.1 mol O2,即阳极上共生成气体(0.05+0.1) mol=0.15 mol,D正确。
反思升华
串联类电池的解题流程
6.A 左侧装置为原电池,右侧装置为电解池,阳极接正极,阴极接负极,根据O2-移动方向可知b极为正极,a极为负极,负极上甲烷被氧化生成CO2,电极反应式为CH4-8e-+4O2- CO2+2H2O,A正确。阳极室Cl-被氧化生成Cl2,Ca2+向产品室移动;阴极室H2O得电子生成H2和OH-,原料室的Na+向阴极室移动,H2P向产品室移动,A膜和C膜均为阳离子交换膜,B膜为阴离子交换膜,B错误。若用铁电极替换阳极的石墨电极,电解时,铁电极失去电子生成Fe2+,影响Ca(H2PO4)2的制备,C错误。没有指明气体所处状况,2.24 L甲烷的物质的量不能确定,D错误。
7.B 电解池a极区溶液中四甲基氢氧化铵[(CH3)4NOH]浓度增大,可推出(CH3)4N+透过c向a电极移动,则c膜为阳离子交换膜,a电极为阴极,N型半导体为负极,P型半导体为正极,正极电势高于负极;Cl-透过d向右侧移动,则d为阴离子交换膜,Na+从阳极区透过e向左侧移动,则e为阳离子交换膜,A正确、B错误。b为阳极,溶液中的氢氧根离子失去电子生成氧气,电极反应式为4OH--4e- 2H2O+O2↑,C正确;182 g四甲基氢氧化铵的物质的量为=2 mol,则a极生成1 mol氢气,b极生成0.5 mol氧气,两极共产生1.5 mol气体,标准状况下气体体积为33.6 L,D正确。
8.答案 (1)电解池 阳极
(2)阳极 2Cl--2e- Cl2↑
(3)a
(4)正极 2H2O+2e- H2↑+2OH-
(5)2Cu2++2H2O 2Cu+O2↑+4H+
解析 E、F分别为短周期相邻两种活泼金属元素对应的单质,且E能与NaOH溶液反应,则E为Al,F为Mg。
(1)Al、Mg、NaOH溶液组成的原电池中,Al失去电子被氧化生成[Al(OH)4]-,则E(Al)电极为负极,F(Mg)电极为正极;甲池和中间U形管均为电解池,根据电极的连接方式可知,电极A为阳极。
(2)U形管是电解装置,D极连接Al电极(负极),作阴极,故电极C为阳极,Cl-在阳极上发生氧化反应生成Cl2,电极反应式为2Cl--2e- Cl2↑。
(3)电极C上Cl-发生氧化反应生成Cl2,Cl2通过导管进入淀粉-KI溶液,发生反应:2KI+Cl2 2KCl+I2,反应生成的I2遇淀粉溶液变蓝,故a烧杯中溶液会变蓝。
(4)F电极为原电池的正极,发生还原反应,电极反应式为2H2O+2e- H2↑+2OH-。
(5)甲池中A、B电极材料均为石墨,是惰性电极,电解CuSO4溶液时,阴极上Cu2+放电生成Cu,阳极上水电离出的OH-放电生成O2,故电池总反应为2Cu2++2H2O 2Cu+O2↑+4H+。
10
题型整合练 突破多室带膜电池、多池串联电化学装置
题型1 多室带膜电化学装置
1.锌溴液流电池具有高能量密度和长循环寿命的特点,适用于储能系统,其反应的化学方程式为Zn+Br2 ZnBr2,装置如图所示,其中Q·Br-能与单质溴结合生成Q·B。下列说法错误的是 ( )
A.正、负极电解液均为溴化锌溶液
B.Q·Br-能有效防止溴的挥发
C.充电时,阳极的电极反应为2Br--2e-+Q·Br- Q·B
D.为防止电池自放电,隔膜应为阴离子交换膜
2.目前,应用电渗析法进行海水淡化是解决淡水资源匮乏的有效途径之一,该方法是利用电解原理通过多组电渗析膜实现,工作原理如图所示(以NaCl溶液代替海水),同时获得产品Cl2、H2、NaOH。下列说法正确的是 ( )
A.a是直流电源的负极
B.阳极区溶液浓度几乎不变
C.膜pq、st分别为阳离子交换膜、阴离子交换膜
D.Ⅰ、Ⅱ口分别产生NaCl浓溶液、淡水
3.双极膜在电渗析中应用广泛,它由阳离子交换膜和阴离子交换膜复合而成。双极膜内层为水层,工作时水层中的H2O解离成H+和OH-,并分别通过离子交换膜向两侧发生迁移。如图为NaBr溶液的电渗析装置示意图。
下列说法正确的是 ( )
A.出口2的产物为HBr溶液
B.出口5的产物为H2SO4溶液
C.Br-可从盐室最终进入阳极液中
D.阴极反应式为2H2O+2e- H2↑+2OH-
4.我国科学家设计如图所示的电解池,实现了海水直接制备氢气技术的绿色化。该装置工作时阳极无Cl2生成且KOH溶液的浓度不变,电解生成氢气的速率为x mol·h-1。下列说法错误的是 ( )
A.b电极反应式为2H2O+2e- H2↑+2OH-
B.离子交换膜为阴离子交换膜
C.电解时海水中动能高的水分子可穿过PTFE膜
D.海水为电解池补水的速率为2x mol·h-1
题型2 多池串联电化学装置
5.(经典题)下图为相互串联的三个装置,下列说法正确的是( )
A.甲池中A极的电极反应式为CH4-8e-+2H2O CO2+8H+
B.若利用乙池在铁片上镀银,则C是铁片
C.往丙池中滴加酚酞,石墨附近溶液先变红
D.若甲池消耗标准状况下1.4 L CH4,则丙池中阳极上产生气体的物质的量为0.15 mol
6.利用CH4燃料电池电解制备Ca(H2PO4)2并得到副产物NaOH、H2、Cl2,装置如图所示。下列说法正确的是 ( )
A.a极反应:CH4-8e-+4 CO2+2H2O
B.A膜和C膜均为阴离子交换膜,B膜为阳离子交换膜
C.可用铁电极替换阳极的石墨电极
D.a极上通入2.24 L甲烷,理论上产品室可新增0.4 mol Ca(H2PO4)2
7.已知四甲基氢氧化铵[(CH3)4NOH]是一种有机强碱,常用作电子工业清洗剂。以四甲基氯化铵[(CH3)4NCl]为原料,采用电渗析法合成(CH3)4NOH,工作原理如图。下列说法中错误的是 ( )
A.光伏并网发电装置中P型半导体电势高
B.c为阳离子交换膜,e为阴离子交换膜
C.b电极的电极反应式为4OH--4e- O2↑+2H2O
D.制备182 g四甲基氢氧化铵,两极共产生33.6 L气体(标准状况)
8.如图所示,A、B、C、D均为石墨电极,E、F分别为短周期相邻两种活泼金属元素对应的单质,且E能与NaOH溶液反应。按图示接通电路,反应一段时间。
回答下列问题:
(1)甲池是 (填“原电池”或“电解池”)装置,电极A的名称是 。
(2)C极为 (填“阴极”或“阳极”),电极反应式为 。
(3)烧杯中溶液会变蓝的是 (填“a”或“b”)。
(4)F极的名称是 (填“正极”或“负极”),电极反应式为 。
(5)甲池中总反应的离子方程式为 。
答案与分层梯度式解析
1.D 2.B 3.D 4.D 5.D 6.A 7.B
1.D 根据电池反应的化学方程式Zn+Br2 ZnBr2可知,正、负极电解液均为溴化锌溶液,A正确;Q·Br-能与单质溴结合生成Q·B,能有效防止溴挥发,B正确;充电时Br-在阳极放电,再与Q·Br-结合,阳极的电极反应为2Br--2e-+Q·Br- Q·B,C正确;充电时生成的Q·B向负极扩散,与负极的锌发生反应造成自放电,为防止Q·B向负极移动,隔膜应为阳离子交换膜,D错误。
2.B 电极N产生H2,则电极N为阴极,与电源负极相连,则b为直流电源负极,a为直流电源正极,A错误;阳极的电极反应为2Cl--2e- Cl2↑,①中氯离子通过阴离子交换膜pq进入阳极区,溶液浓度几乎不变,B正确;①中氯离子通过阴离子交换膜pq进入阳极区,③中钠离子通过阳离子交换膜st进入阴极区,C错误;①中氯离子向左侧移动,钠离子向右侧移动,氯化钠溶液浓度减小,使Ⅰ口对应区域形成淡水,Ⅱ口对应区域形成NaCl浓溶液,D错误。
解题技法
含“膜”电池中“隔膜”的常考点
(1)判断隔膜类型:根据电极反应式,判断隔膜两侧离子变化,根据溶液呈电中性判断离子迁移的方向。(2)分析隔膜作用:在产品制备中,隔膜的主要作用是提高产品纯度,避免产物之间发生反应。
3.D 电解时,溶液中的阳离子向阴极移动,阴离子向阳极移动,盐室中的Na+通过阳离子交换膜进入交换室1,双极膜提供的氢氧根离子进入交换室1,出口2的产物为NaOH溶液,A错误;盐室中的Br-通过阴离子交换膜进入交换室2,双极膜提供的氢离子进入交换室2,故出口4的产物为HBr溶液,钠离子不能通过双极膜,故出口5的产物不是H2SO4溶液,B错误;Br-不能通过双极膜,即Br-不会从盐室最终进入阳极液中,C错误;电解池阴极发生还原反应,电极反应式为2H2O+2e- H2↑+2OH-,D正确。
4.D 根据题意,该装置为电解池,在阴极制得H2;根据“该装置工作时阳极无Cl2生成”,可知阳极上不是Cl-失电子,而是OH-失电子得到O2。与电源负极相连的b电极为阴极,该极产物H2是由水电离出的氢离子得电子产生的,电极反应为2H2O+2e- H2↑+2OH-,A项正确;阳极OH-放电且阳极KOH溶液的浓度不变,所以阴极产生的OH-通过离子交换膜进入阳极区,在阳极失电子得到O2,则装置中的离子交换膜为阴离子交换膜,B项正确;PTFE膜透汽不透液态水,所以海水中动能高的水分子可穿过PTFE膜,C项正确;根据电解总反应2H2O 2H2↑+O2↑,生成H2的速率等于消耗水的速率,即补水的速率为x mol·h-1,D项错误。
5.D 结合图示装置可知甲池为燃料电池,乙池和丙池均为电解池。甲池中CH4在碱性条件下失电子发生氧化反应,电极反应式为CH4+10OH--8e- C+7H2O,A错误;若利用乙池在铁片上镀银,铁片作阴极,即D是铁片,B错误;丙池中Fe电极与电源负极相连,为阴极,石墨电极为阳极,在石墨电极生成Cl2,在Fe电极生成H2和NaOH,则往丙池中滴加酚酞,铁电极附近溶液先变红,C错误;若甲池消耗标准状况下1.4 L CH4,反应中失去电子的物质的量为×8=0.5 mol,串联电路中转移电子的物质的量相等,则丙池阳极也失去0.5 mol电子,丙池中阳极开始时的电极反应为2Cl--2e- Cl2↑,溶液中含n(Cl-)=0.1 L×1 mol/L=0.1 mol,产生0.05 mol Cl2,然后阳极水电离出的OH-放电,结合2H2O-4e- O2↑+4H+可知转移0.4 mol电子时生成0.1 mol O2,即阳极上共生成气体(0.05+0.1) mol=0.15 mol,D正确。
反思升华
串联类电池的解题流程
6.A 左侧装置为原电池,右侧装置为电解池,阳极接正极,阴极接负极,根据O2-移动方向可知b极为正极,a极为负极,负极上甲烷被氧化生成CO2,电极反应式为CH4-8e-+4O2- CO2+2H2O,A正确。阳极室Cl-被氧化生成Cl2,Ca2+向产品室移动;阴极室H2O得电子生成H2和OH-,原料室的Na+向阴极室移动,H2P向产品室移动,A膜和C膜均为阳离子交换膜,B膜为阴离子交换膜,B错误。若用铁电极替换阳极的石墨电极,电解时,铁电极失去电子生成Fe2+,影响Ca(H2PO4)2的制备,C错误。没有指明气体所处状况,2.24 L甲烷的物质的量不能确定,D错误。
7.B 电解池a极区溶液中四甲基氢氧化铵[(CH3)4NOH]浓度增大,可推出(CH3)4N+透过c向a电极移动,则c膜为阳离子交换膜,a电极为阴极,N型半导体为负极,P型半导体为正极,正极电势高于负极;Cl-透过d向右侧移动,则d为阴离子交换膜,Na+从阳极区透过e向左侧移动,则e为阳离子交换膜,A正确、B错误。b为阳极,溶液中的氢氧根离子失去电子生成氧气,电极反应式为4OH--4e- 2H2O+O2↑,C正确;182 g四甲基氢氧化铵的物质的量为=2 mol,则a极生成1 mol氢气,b极生成0.5 mol氧气,两极共产生1.5 mol气体,标准状况下气体体积为33.6 L,D正确。
8.答案 (1)电解池 阳极
(2)阳极 2Cl--2e- Cl2↑
(3)a
(4)正极 2H2O+2e- H2↑+2OH-
(5)2Cu2++2H2O 2Cu+O2↑+4H+
解析 E、F分别为短周期相邻两种活泼金属元素对应的单质,且E能与NaOH溶液反应,则E为Al,F为Mg。
(1)Al、Mg、NaOH溶液组成的原电池中,Al失去电子被氧化生成[Al(OH)4]-,则E(Al)电极为负极,F(Mg)电极为正极;甲池和中间U形管均为电解池,根据电极的连接方式可知,电极A为阳极。
(2)U形管是电解装置,D极连接Al电极(负极),作阴极,故电极C为阳极,Cl-在阳极上发生氧化反应生成Cl2,电极反应式为2Cl--2e- Cl2↑。
(3)电极C上Cl-发生氧化反应生成Cl2,Cl2通过导管进入淀粉-KI溶液,发生反应:2KI+Cl2 2KCl+I2,反应生成的I2遇淀粉溶液变蓝,故a烧杯中溶液会变蓝。
(4)F电极为原电池的正极,发生还原反应,电极反应式为2H2O+2e- H2↑+2OH-。
(5)甲池中A、B电极材料均为石墨,是惰性电极,电解CuSO4溶液时,阴极上Cu2+放电生成Cu,阳极上水电离出的OH-放电生成O2,故电池总反应为2Cu2++2H2O 2Cu+O2↑+4H+。
10
