第四章 化学反应与电能 增分测评卷-《精讲精练》26版高中同步新教材化学人教A版(2019)选必修1
文档属性
| 名称 | 第四章 化学反应与电能 增分测评卷-《精讲精练》26版高中同步新教材化学人教A版(2019)选必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 748.4KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-11 10:52:11 | ||
图片预览


文档简介
(
密 ○ 封 ○ 装 ○ 订 ○ 线 密 ○ 封 ○ 装 ○ 订 ○ 线
密 封 线 内 不 要 答 题
)
(
姓名 班级 考号
密 ○ 封 ○ 装 ○ 订 ○ 线 密 ○ 封 ○ 装 ○ 订 ○ 线
密 封 线 内 不 要 答 题
)
第四章 化学反应与电能
注意事项
1.全卷满分100分。考试用时75分钟。
2.可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Al-27 Si-28 S-32 Fe-56 Cu-64 Ag-108 Pb-207。
一、选择题(本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一个是符合题目要求的)
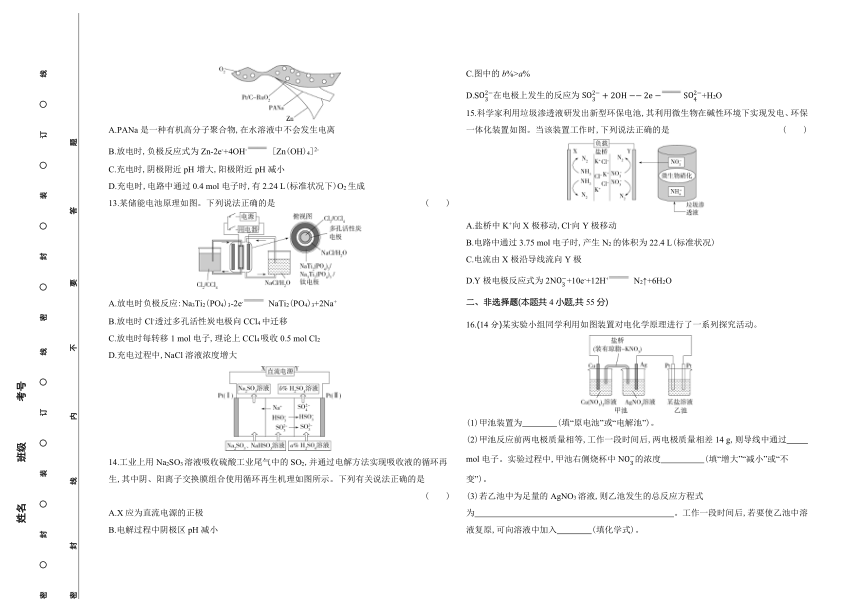
1.下列设备工作时,把化学能转化为电能的是 ( )
A.硅太阳能电池 B.燃气灶 C.太阳能集热器 D.锂离子电池
2.某装置示意图如图,下列说法正确的是( )
A.盐桥中阴离子进入CuSO4溶液
B.电流从铜电极流向锌电极
C.负极发生的反应是Zn2++2e- Zn
D.Zn2+既是电极反应物,也是离子导体
3.下列防止钢铁腐蚀的方法中,属于牺牲阳极法的是 ( )
A B
C D
4.下列叙述正确的是 ( )
A.对铅酸蓄电池充电时,Pb电极接电源负极
B.用铜作电极电解CuSO4溶液的阳极反应式为2H2O-4e- O2↑+4H+
C.锌铜原电池中,因为有电子通过电解质溶液,形成闭合回路,所以有电流产生
D.Mg-AgCl电池是一种以海水为电解质溶液的水激活电池,正极反应式为Ag++e- Ag
5.对下列各溶液进行电解,通电一段时间后,溶液颜色不会发生显著改变的是 ( )
A.以铜为电极,电解1 mol·L-1 H2SO4溶液
B.以石墨为电极,电解1 mol·L-1 KBr溶液(阴、阳两极之间用阳离子交换膜隔开)
C.以石墨为电极,电解含酚酞的饱和食盐水
D.以铜为电极,电解CuSO4溶液
6.电解原理具有广泛的应用。下列装置不正确的是 ( )
甲 乙
丙 丁
A.用装置甲制取Cl2和NaOH溶液 B.用装置乙在金属制品表面镀银
C.用装置丙电解精炼粗铜 D.用装置丁制取Na
7.某同学组装了如图所示的电化学装置,则下列说法正确的是 ( )
A.图中甲池为原电池装置,Cu电极发生还原反应
B.实验过程中,甲池左侧烧杯中N的浓度不变
C.若用铜制U形物代替“盐桥”,工作一段时间后取出U形物称量,质量不变
D.若甲池中Ag电极质量增加5.4 g时,乙池某电极析出1.6 g金属,则乙池中的盐溶液可能是足量的AgNO3溶液
8.以KOH溶液为离子导体,分别组成CH3OH-O2、N2H4-O2、(CH3)2NNH2-O2清洁燃料电池,下列说法正确的是 ( )
A.放电过程中,K+均向负极移动
B.放电过程中,KOH物质的量均减小
C.消耗等质量燃料,(CH3)2NNH2-O2燃料电池的理论放电量最大
D.消耗1 mol O2时,理论上N2H4-O2燃料电池气体产物的体积在标准状况下为11.2 L
9.一种“全氢电池”的工作原理如图所示,下列说法正确的是 ( )
A.该电池工作时,电子的移动方向为吸附层a→吸附层b→离子交换膜→吸附层a
B.吸附层a发生的电极反应为H2+2e-+2OH- 2H2O
C.该电池的总反应不是氧化还原反应
D.该电池工作时,Na+移向吸附层a
10.环氧乙烷()常用于医用消毒,它的一种制备方法为:使用惰性电极电解KCl溶液,用Cl-交换膜将电解液分为阴极区和阳极区,其中一区持续通入乙烯;电解结束后,移出Cl-交换膜,两区溶液混合发生反应:HOCH2CH2Cl+OH- Cl-+H2O+。下列说法错误的是( )
A.乙烯应通入阴极区
B.移出Cl-交换膜前存在反应Cl2+H2O HCl+HClO
C.使用Cl-交换膜阻止OH-通过,可使Cl2生成区的pH逐渐减小
D.制备过程的总反应为H2CCH2+H2O H2+
11.某研究机构使用Li-SO2Cl2电池作为电源电解制备Ni(H2PO2)2,其工作原理如图所示。已知电池反应为2Li+SO2Cl2 2LiCl+SO2↑,下列说法错误的是 ( )
A.电池的f接的是g电极
B.电解池中膜a、膜c均为阳离子交换膜
C.电池中C电极的电极反应为SO2Cl2+2e- 2Cl-+SO2↑
D.当Li-SO2Cl2电池生成1 mol SO2时,理论上电解池中产生2 mol Ni(H2PO2)2
12.我国科研工作者研制出基于PANa(聚丙烯酸钠)电解质的Zn-空气可充电电池,该电池具有高容量和超长循环稳定性。PANa是一种超强吸水聚合物,可吸收大量(CH3COO)2Zn和KOH溶液作为水和离子含量调节剂形成水凝胶电解质,示意图如图。已知:Zn2++4OH- [Zn(OH)4]2-。下列说法错误的是 ( )
A.PANa是一种有机高分子聚合物,在水溶液中不会发生电离
B.放电时,负极反应式为Zn-2e-+4OH- [Zn(OH)4]2-
C.充电时,阴极附近pH增大,阳极附近pH减小
D.充电时,电路中通过0.4 mol电子时,有2.24 L(标准状况下)O2生成
13.某储能电池原理如图。下列说法正确的是 ( )
A.放电时负极反应:Na3Ti2(PO4)3-2e- NaTi2(PO4)3+2Na+
B.放电时Cl-透过多孔活性炭电极向CCl4中迁移
C.放电时每转移1 mol电子,理论上CCl4吸收0.5 mol Cl2
D.充电过程中,NaCl溶液浓度增大
14.工业上用Na2SO3溶液吸收硫酸工业尾气中的SO2,并通过电解方法实现吸收液的循环再生,其中阴、阳离子交换膜组合使用循环再生机理如图所示。下列有关说法正确的是 ( )
A.X应为直流电源的正极
B.电解过程中阴极区pH减小
C.图中的b%>a%
D.S+H2O
15.科学家利用垃圾渗透液研发出新型环保电池,其利用微生物在碱性环境下实现发电、环保一体化装置如图。当该装置工作时,下列说法正确的是 ( )
A.盐桥中K+向X极移动,Cl-向Y极移动
B.电路中通过3.75 mol电子时,产生N2的体积为22.4 L(标准状况)
C.电流由X极沿导线流向Y极
D.Y极电极反应式为2N+10e-+12H+ N2↑+6H2O
二、非选择题(本题共4小题,共55分)
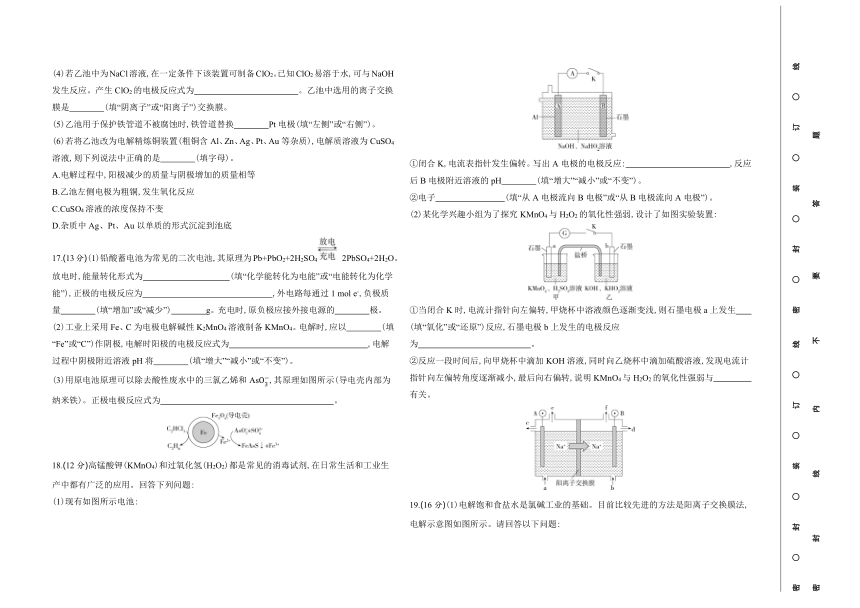
16.(14分)某实验小组同学利用如图装置对电化学原理进行了一系列探究活动。
(1)甲池装置为 (填“原电池”或“电解池”)。
(2)甲池反应前两电极质量相等,工作一段时间后,两电极质量相差14 g,则导线中通过 mol电子。实验过程中,甲池右侧烧杯中N的浓度 (填“增大”“减小”或“不变”)。
(3)若乙池中为足量的AgNO3溶液,则乙池发生的总反应方程式为 。工作一段时间后,若要使乙池中溶液复原,可向溶液中加入 (填化学式)。
(4)若乙池中为NaCl溶液,在一定条件下该装置可制备ClO2。已知ClO2易溶于水,可与NaOH发生反应。产生ClO2的电极反应式为 。乙池中选用的离子交换膜是 (填“阴离子”或“阳离子”)交换膜。
(5)乙池用于保护铁管道不被腐蚀时,铁管道替换 Pt电极(填“左侧”或“右侧”)。
(6)若将乙池改为电解精炼铜装置(粗铜含Al、Zn、Ag、Pt、Au等杂质),电解质溶液为CuSO4溶液,则下列说法中正确的是 (填字母)。
A.电解过程中,阳极减少的质量与阴极增加的质量相等
B.乙池左侧电极为粗铜,发生氧化反应
C.CuSO4溶液的浓度保持不变
D.杂质中Ag、Pt、Au以单质的形式沉淀到池底
17.(13分)(1)铅酸蓄电池为常见的二次电池,其原理为Pb+PbO2+2H2SO4 2PbSO4+2H2O。放电时,能量转化形式为 (填“化学能转化为电能”或“电能转化为化学能”),正极的电极反应为 ,外电路每通过1 mol e-,负极质量 (填“增加”或“减少”) g。充电时,原负极应接外接电源的 极。
(2)工业上采用Fe、C为电极电解碱性K2MnO4溶液制备KMnO4。电解时,应以 (填“Fe”或“C”)作阴极,电解时阳极的电极反应式为 ,电解过程中阴极附近溶液pH将 (填“增大”“减小”或“不变”)。
(3)用原电池原理可以除去酸性废水中的三氯乙烯和As,其原理如图所示(导电壳内部为纳米铁)。正极电极反应式为 。
18.(12分)高锰酸钾(KMnO4)和过氧化氢(H2O2)都是常见的消毒试剂,在日常生活和工业生产中都有广泛的应用。回答下列问题:
(1)现有如图所示电池:
①闭合K,电流表指针发生偏转。写出A电极的电极反应: ,反应后B电极附近溶液的pH (填“增大”“减小”或“不变”)。
②电子 (填“从A电极流向B电极”或“从B电极流向A电极”)。
(2)某化学兴趣小组为了探究KMnO4与H2O2的氧化性强弱,设计了如图实验装置:
①当闭合K时,电流计指针向左偏转,甲烧杯中溶液颜色逐渐变浅,则石墨电极a上发生 (填“氧化”或“还原”)反应,石墨电极b上发生的电极反应为 。
②反应一段时间后,向甲烧杯中滴加KOH溶液,同时向乙烧杯中滴加硫酸溶液,发现电流计指针向左偏转角度逐渐减小,最后向右偏转,说明KMnO4与H2O2的氧化性强弱与 有关。
19.(16分)(1)电解饱和食盐水是氯碱工业的基础。目前比较先进的方法是阳离子交换膜法,电解示意图如图所示。请回答以下问题:
①电解饱和食盐水的总反应的离子方程式是 。
②在b口加入的物质为 。
(2)全钒液流电池是一种新型的绿色环保储能装置,工作原理如图:
几种离子在水溶液中的颜色如表所示:
离子种类 V VO2+ V3+ V2+
颜色 黄色 蓝色 绿色 紫色
①全钒液流电池放电时V2+发生氧化反应,该电池放电时总反应式是 。
②当完成储能时,阴极室溶液的颜色是 。
(3)将PbO溶解在HCl和NaCl的混合溶液中,得到含Na2PbCl4的电解液,电解Na2PbCl4溶液生成Pb的装置如图所示。
①写出电解时阴极的电极反应式: 。
②电解过程中通过阳离子交换膜的离子主要为 。
答案与分层梯度式解析
1.D 2.B 3.B 4.A 5.D 6.A 7.C 8.C
9.C 10.A 11.D 12.A 13.A 14.C 15.B
1.D 硅太阳能电池是将太阳能转化为电能,A错误;燃气灶是将化学能主要转化为热能,B错误;太阳能集热器是将太阳能转化为热能,C错误;锂离子电池是将化学能转化为电能,D正确。
2.B 该装置为原电池装置,发生的总反应是Zn+Cu2+ Zn2++Cu,Zn为负极,Cu为正极。原电池中阴离子移向负极,所以盐桥中的阴离子移向ZnSO4溶液,A错误;电流从正极流向负极,即从铜电极流向锌电极,B正确;锌是负极,发生的电极反应为Zn-2e- Zn2+,C错误;Zn2+是电极生成物,是离子导体,D错误。
3.B A项属于外加电流法;B项属于牺牲阳极法;C项,钢闸门作阳极,发生氧化反应,加快钢闸门腐蚀,不能起到防腐蚀的作用;D项,喷油漆属于隔绝氧气保护法。
4.A 铅酸蓄电池的总反应为PbO2+Pb+2H2SO4 2PbSO4+2H2O,放电时,Pb作负极,发生氧化反应,充电时,Pb电极发生还原反应,所以对铅酸蓄电池充电时,Pb电极接电源负极,A正确;金属铜作阳极,在阳极Cu失电子发生氧化反应,电极反应式为Cu-2e- Cu2+,B错误;原电池中,电子由负极流出,经过导线流入正极,电子不能进入电解质溶液,C错误;金属镁作负极,发生氧化反应,氯化银是氧化剂,在正极发生还原反应,正极反应式为AgCl+e- Ag+Cl-,D错误。
5.D 铜作阳极,铜失电子生成铜离子,使溶液呈蓝色,阴极H+得电子生成H2,溶液颜色发生明显变化,A不符合题意;以石墨为电极,电解溴化钾溶液过程中生成溴单质,溴溶于水,溶液呈橙色,溶液颜色发生明显变化,B不符合题意;以石墨为电极,电解含酚酞的饱和食盐水,阴极上水电离出的氢离子得到电子生成氢气,附近溶液中氢氧根离子浓度增大,溶液变红,溶液颜色发生明显变化,C不符合题意;以铜为电极,电解CuSO4溶液,阳极铜失电子生成铜离子,阴极铜离子得电子生成铜单质,溶液浓度不变,溶液颜色无明显变化,D符合题意。
6.A 电解饱和NaCl溶液,饱和NaCl溶液应从阳极进入,氯气在阳极产生,且应选用阳离子交换膜,A错误;在金属制品表面镀银,Ag为阳极,与电源正极相连,金属制品为阴极,与电源负极相连,B正确;粗铜精炼时,粗铜为阳极,与电源正极相连,精铜为阴极,与电源负极相连,电解质溶液为CuSO4溶液,C正确;用惰性电极电解熔融的氯化钠,制取金属钠,D正确。
7.C 图中甲池为原电池装置,Cu电极发生氧化反应,作原电池的负极,A错误;甲池工作时,Cu在负极失电子被氧化为Cu2+,盐桥中的N向左侧烧杯中移动,即左侧烧杯中c(N)增大,B错误;用铜制U形物代替“盐桥”,中间烧杯构成原电池,在中间烧杯中Cu作负极而溶解,左侧烧杯中原Cu电极作阳极,铜制U形物左侧作阴极,其质量增加,电路中转移电子数相等,故铜制U形物减少的质量与增加的质量相等,即工作一段时间后铜制U形物的质量不变,C正确;若甲池中Ag电极质量增加5.4 g,即生成5.4 g Ag,物质的量为0.05 mol,整个电路转移0.05 mol电子,如果乙池中盐溶液是足量AgNO3溶液,应析出5.4 g Ag,而实际乙池中某电极析出1.6 g金属,D错误。
8.C 原电池放电时,阳离子向正极移动,故K+均向正极移动,A项错误;CH3OH-O2和(CH3)2NNH2-O2放电时产生的二氧化碳与KOH反应,KOH的物质的量减小,N2H4-O2放电时电池总反应式为N2H4+O2 N2+2H2O,放电过程中溶液中KOH的物质的量不变,B项错误;三种燃料转移电子数关系为CH3OH~6e-,N2H4~4e-,(CH3)2NNH2~16e-,1 g CH3OH、N2H4、(CH3)2NNH2分别转移 mol、 mol、 mol电子,故消耗等质量燃料,(CH3)2NNH2-O2燃料电池的理论放电量最大,C项正确;根据N2H4-O2放电时电池总反应式:N2H4+O2 N2+2H2O,可知消耗1 mol O2时,理论上气体产物的体积在标准状况下为22.4 L,D项错误。
9.C 由图示装置可知吸附层a为负极,吸附层b为正极。该电池工作时,电子流向为吸附层a→导线(含电流表)→吸附层b,A错误;H2在吸附层a上发生氧化反应生成H2O,电极反应为H2-2e-+2OH- 2H2O,B错误;H+在正极发生还原反应生成H2,电极反应为2H++2e- H2↑,由正、负极的电极反应式可得该电池的总反应为H++OH- H2O,不是氧化还原反应,C正确;吸附层b是正极,该电池工作时,Na+移向吸附层b,D错误。
10.A 环氧乙烷的制备原理:Cl-在阳极放电生成Cl2,Cl2与水反应生成HCl、HClO,HClO与乙烯发生反应生成HOCH2CH2Cl;阴极区水放电生成氢气,同时产生氢氧根离子,电解结束后,移出Cl-交换膜,两区溶液混合发生反应:HOCH2CH2Cl+OH- Cl-+H2O+。阳极区产生HClO,所以乙烯通入阳极区,A错误;阳极生成的氯气会与水发生反应Cl2+H2O HCl+HClO,B正确;阳极区会产生HCl,使用Cl-交换膜阻止OH-通过,HCl的浓度不断增大,pH逐渐减小,C正确;该反应过程中KCl并没有被消耗,实际上是水与乙烯反应,总反应为H2CCH2+H2O H2+,D正确。
11.D 结合Li-SO2Cl2电池总反应可知,Li作负极,C作正极。电解制备Ni(H2PO2)2时,g为阳极,g应接电源的正极,A正确;阳极上Ni失电子生成Ni2+并通过膜a进入Ⅱ室,即膜a为阳离子交换膜,H2P通过膜b进入Ⅱ室,膜b为阴离子交换膜,Na+通过膜c进入Ⅳ室,膜c为阳离子交换膜,B正确;由电池总反应可知,正极反应为SO2Cl2+2e- 2Cl-+SO2↑,C正确;当Li-SO2Cl2电池生成1 mol SO2时转移2 mol电子,电解池中生成1 mol Ni2+,理论上电解池中产生1 mol Ni(H2PO2)2,D错误。
12.A PANa在水溶液中电离出聚丙烯酸根离子和Na+,A错误;放电时,负极锌失去电子后结合OH-生成[Zn(OH)4]2-,负极反应式为Zn-2e-+4OH- [Zn(OH)4]2-,B正确;充电时,阴极反应式为[Zn(OH)4]2-+2e- Zn+4OH-,阴极附近OH-浓度增大,pH增大,阳极反应式为4OH--4e- O2↑+2H2O,阳极附近OH-浓度减小,pH减小,C正确;充电时,阳极反应式为4OH--4e- O2↑+2H2O,电路中通过0.4 mol电子时,有0.1 mol O2生成,在标准状况下体积为0.1 mol×22.4 L/mol=2.24 L,D正确。
13.A 结合图示装置可知钛电极为负极,多孔活性炭电极为正极,根据反应中Ti元素化合价变化可写出负极反应为Na3Ti2(PO4)3-2e- NaTi2(PO4)3+2Na+,A正确;电池放电时,阴离子移向负极,即Cl-通过多孔活性炭电极向NaCl溶液中迁移,B错误;放电时每转移1 mol电子,结合正极反应Cl2+2e- 2Cl-,则理论上CCl4释放0.5 mol Cl2,C错误;充电过程中,阳极反应为2Cl--2e- Cl2↑,反应中消耗Cl-,故NaCl溶液浓度减小,D错误。
14.C 根据阴、阳离子的移动方向得知,阳离子向Pt(Ⅰ)电极移动,阴离子向Pt(Ⅱ)电极移动,因此Pt(Ⅰ)为阴极,Pt(Ⅱ)为阳极,所以X为直流电源负极,Y为直流电源正极,A错误; Pt(Ⅰ)为阴极,阴极上HS中氢离子得电子放出氢气,故Pt(Ⅰ)附近溶液的pH增大,B错误;阳极室中,电极反应式为S-2e-+H2O S+2H+,HS-2e-+H2O S+3H+,所以b%>a%,C正确;阳极上亚硫酸根离子在酸性条件下失电子发生氧化反应,故电极反应式为S+H2O-2e- S+2H+,D错误。
15.B 在X电极上NH3失去电子被氧化为N2,所以X极为负极;在Y电极上N得到电子被还原为N2,所以Y电极为正极。原电池中,阳离子向正极移动,阴离子向负极移动,所以盐桥中的K+向Y极移动,Cl-向X极移动,A错误;该电池的总反应为5NH3+3N 4N2+6H2O+3OH-,转移15 mol电子时,反应生成4 mol N2,若转移3.75 mol电子,则产生N2的物质的量为×4 mol=1 mol,其在标准状况下的体积为22.4 L,B正确;电流由正极(Y极)沿导线流向负极(X极),C错误;Y极的电极反应式为2N+10e-+6H2O N2↑+12OH-,D错误。
16.答案 (除标注外,每空2分)(1)原电池(1分)
(2)0.1 不变(1分)
(3)4AgNO3+2H2O 4Ag+4HNO3+O2↑ Ag2O
(4)Cl--5e-+2H2O ClO2↑+4H+ 阳离子
(5)右侧(1分)
(6)BD(1分)
解析 由题图可知,甲池为原电池,Cu比Ag活泼,Cu为负极,Ag为正极,乙池为电解池,左侧Pt电极为阳极,右侧Pt电极为阴极。
(2)反应前两电极质量相等,甲池中总反应为2Ag++Cu Cu2++2Ag,当1 mol Cu反应时,转移2 mol电子,生成2 mol Ag,此时两电极质量相差108 g/mol×2 mol+64 g/mol×1 mol=280 g,当两电极质量相差14 g时,导线中通过电子的物质的量为×2 mol=0.1 mol。实验过程中,盐桥中N向甲池左侧烧杯(即负极)迁移,甲池左侧烧杯中N的浓度增大,甲池右侧烧杯中N的浓度不变。
(3)用惰性电极电解AgNO3溶液,阳极上H2O失电子生成O2和H+,阴极上Ag+得电子生成Ag,总反应为4AgNO3+2H2O 4Ag+4HNO3+O2↑;若乙池中溶液为足量的硝酸银溶液,阴极生成Ag,阳极生成氧气,工作一段时间后,若要使乙池中溶液复原,可向溶液中加入Ag2O。
(4)产生ClO2的电极反应式为Cl--5e-+2H2O ClO2↑+4H+,已知ClO2可与NaOH发生反应,为防止OH-移至阳极,乙池中选用的离子交换膜应是阳离子交换膜。
(5)乙池为电解池,为保护铁管道不被腐蚀,铁管道应做阴极,与原电池的负极相连,即与Cu电极相连,故替换右侧Pt电极。
(6)电解过程中,阳极为粗铜,阴极为纯铜,CuSO4溶液为电解质溶液,阳极上Cu及比Cu活泼的金属(如Al、Zn等)放电变成离子进入电解质溶液,阴极只有铜离子得电子,故阳极减少的质量与阴极增加的质量不相等,CuSO4溶液的浓度减小,A、C错误;乙池左侧电极为阳极,电极材料为粗铜,发生氧化反应,B正确;比铜活泼性差的金属(如Pt、Au等)形成阳极泥,以单质的形式沉淀到池底,D正确。
17.答案 (除标注外,每空2分)(1)化学能转化为电能(1分) PbO2+2e-+S+4H+ PbSO4+2H2O 增加(1分) 48 负(1分)
(2)Fe(1分) Mn-e- Mn 增大(1分)
(3)C2HCl3+8e-+5H+ C2H6+3Cl-
解析 (1)铅酸蓄电池为可充电电池,放电时为原电池,将化学能转化为电能;放电时,PbO2为正极,得电子发生还原反应,电极反应式为PbO2+2e-+S+4H+ PbSO4+2H2O,Pb为负极,电极反应式为Pb-2e-+S PbSO4,外电路每通过1 mol e-,负极增加的质量为0.5 mol S的质量,即0.5 mol×96 g/mol=48 g;充电时为电解池,原负极应接外接电源的负极。
(2)电解时,K2MnO4→KMnO4,Mn元素化合价升高,K2MnO4在阳极被氧化,阳极应为C,Fe为阴极;电解时,阳极的电极反应式为Mn-e- Mn,阴极的电极反应式为2H2O+2e- H2↑+2OH-,因此阴极附近溶液pH将会增大。
(3)根据题图可知,纳米铁为负极,四氧化三铁为正极,正极上C2HCl3得电子生成C2H6,则正极的电极反应式为C2HCl3+8e-+5H+ C2H6+3Cl-。
18.答案 (每空2分)(1)①Al+4OH--3e- [Al(OH)4]- 增大
②从A电极流向B电极
(2)①还原 H-2e-+OH- O2↑+H2O ②溶液的酸碱性
解析 (1)①闭合K,形成原电池,Al在负极发生氧化反应,碱性条件下电极反应为Al+4OH--3e- [Al(OH)4]-;B电极为正极,电极反应为H+2e-+H2O 3OH-,c(OH-)增大,则B极附近溶液的pH增大。②电池工作时,电子从负极(A电极)流出经外电路流向正极(B电极)。
(2)①根据闭合K,甲烧杯中溶液颜色逐渐变浅,可知甲烧杯中KMnO4发生还原反应,则石墨电极b为负极,H发生氧化反应生成O2,其电极反应为H-2e-+OH- O2↑+H2O。②向甲烧杯中滴加KOH溶液,向乙烧杯中滴加硫酸溶液,根据电流计指针的变化可知,KMnO4与H2O2的氧化性强弱与溶液的酸碱性有关。
19.答案 (除标注外,每空3分)(1)①2Cl-+2H2O 2OH-+Cl2↑+H2↑
②NaOH稀溶液
(2)①V2++V+2H+ V3++VO2++H2O ②紫色(2分)
(3)①PbC+2e- Pb+4Cl- ②H+(2分)
解析 (2)①全钒液流电池放电时V2+发生氧化反应生成V3+,则V发生还原反应生成VO2+,据此书写放电时的总反应式。②电池储能时为电解池,阴极的电极反应式为V3++e- V2+,则阴极室溶液的颜色为紫色。
(3)电解Na2PbCl4溶液生成Pb,PbC在阴极发生还原反应生成Pb,水电离出的OH-在阳极放电生成氧气。
密 ○ 封 ○ 装 ○ 订 ○ 线 密 ○ 封 ○ 装 ○ 订 ○ 线
密 封 线 内 不 要 答 题
)
(
姓名 班级 考号
密 ○ 封 ○ 装 ○ 订 ○ 线 密 ○ 封 ○ 装 ○ 订 ○ 线
密 封 线 内 不 要 答 题
)
第四章 化学反应与电能
注意事项
1.全卷满分100分。考试用时75分钟。
2.可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Al-27 Si-28 S-32 Fe-56 Cu-64 Ag-108 Pb-207。
一、选择题(本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一个是符合题目要求的)
1.下列设备工作时,把化学能转化为电能的是 ( )
A.硅太阳能电池 B.燃气灶 C.太阳能集热器 D.锂离子电池
2.某装置示意图如图,下列说法正确的是( )
A.盐桥中阴离子进入CuSO4溶液
B.电流从铜电极流向锌电极
C.负极发生的反应是Zn2++2e- Zn
D.Zn2+既是电极反应物,也是离子导体
3.下列防止钢铁腐蚀的方法中,属于牺牲阳极法的是 ( )
A B
C D
4.下列叙述正确的是 ( )
A.对铅酸蓄电池充电时,Pb电极接电源负极
B.用铜作电极电解CuSO4溶液的阳极反应式为2H2O-4e- O2↑+4H+
C.锌铜原电池中,因为有电子通过电解质溶液,形成闭合回路,所以有电流产生
D.Mg-AgCl电池是一种以海水为电解质溶液的水激活电池,正极反应式为Ag++e- Ag
5.对下列各溶液进行电解,通电一段时间后,溶液颜色不会发生显著改变的是 ( )
A.以铜为电极,电解1 mol·L-1 H2SO4溶液
B.以石墨为电极,电解1 mol·L-1 KBr溶液(阴、阳两极之间用阳离子交换膜隔开)
C.以石墨为电极,电解含酚酞的饱和食盐水
D.以铜为电极,电解CuSO4溶液
6.电解原理具有广泛的应用。下列装置不正确的是 ( )
甲 乙
丙 丁
A.用装置甲制取Cl2和NaOH溶液 B.用装置乙在金属制品表面镀银
C.用装置丙电解精炼粗铜 D.用装置丁制取Na
7.某同学组装了如图所示的电化学装置,则下列说法正确的是 ( )
A.图中甲池为原电池装置,Cu电极发生还原反应
B.实验过程中,甲池左侧烧杯中N的浓度不变
C.若用铜制U形物代替“盐桥”,工作一段时间后取出U形物称量,质量不变
D.若甲池中Ag电极质量增加5.4 g时,乙池某电极析出1.6 g金属,则乙池中的盐溶液可能是足量的AgNO3溶液
8.以KOH溶液为离子导体,分别组成CH3OH-O2、N2H4-O2、(CH3)2NNH2-O2清洁燃料电池,下列说法正确的是 ( )
A.放电过程中,K+均向负极移动
B.放电过程中,KOH物质的量均减小
C.消耗等质量燃料,(CH3)2NNH2-O2燃料电池的理论放电量最大
D.消耗1 mol O2时,理论上N2H4-O2燃料电池气体产物的体积在标准状况下为11.2 L
9.一种“全氢电池”的工作原理如图所示,下列说法正确的是 ( )
A.该电池工作时,电子的移动方向为吸附层a→吸附层b→离子交换膜→吸附层a
B.吸附层a发生的电极反应为H2+2e-+2OH- 2H2O
C.该电池的总反应不是氧化还原反应
D.该电池工作时,Na+移向吸附层a
10.环氧乙烷()常用于医用消毒,它的一种制备方法为:使用惰性电极电解KCl溶液,用Cl-交换膜将电解液分为阴极区和阳极区,其中一区持续通入乙烯;电解结束后,移出Cl-交换膜,两区溶液混合发生反应:HOCH2CH2Cl+OH- Cl-+H2O+。下列说法错误的是( )
A.乙烯应通入阴极区
B.移出Cl-交换膜前存在反应Cl2+H2O HCl+HClO
C.使用Cl-交换膜阻止OH-通过,可使Cl2生成区的pH逐渐减小
D.制备过程的总反应为H2CCH2+H2O H2+
11.某研究机构使用Li-SO2Cl2电池作为电源电解制备Ni(H2PO2)2,其工作原理如图所示。已知电池反应为2Li+SO2Cl2 2LiCl+SO2↑,下列说法错误的是 ( )
A.电池的f接的是g电极
B.电解池中膜a、膜c均为阳离子交换膜
C.电池中C电极的电极反应为SO2Cl2+2e- 2Cl-+SO2↑
D.当Li-SO2Cl2电池生成1 mol SO2时,理论上电解池中产生2 mol Ni(H2PO2)2
12.我国科研工作者研制出基于PANa(聚丙烯酸钠)电解质的Zn-空气可充电电池,该电池具有高容量和超长循环稳定性。PANa是一种超强吸水聚合物,可吸收大量(CH3COO)2Zn和KOH溶液作为水和离子含量调节剂形成水凝胶电解质,示意图如图。已知:Zn2++4OH- [Zn(OH)4]2-。下列说法错误的是 ( )
A.PANa是一种有机高分子聚合物,在水溶液中不会发生电离
B.放电时,负极反应式为Zn-2e-+4OH- [Zn(OH)4]2-
C.充电时,阴极附近pH增大,阳极附近pH减小
D.充电时,电路中通过0.4 mol电子时,有2.24 L(标准状况下)O2生成
13.某储能电池原理如图。下列说法正确的是 ( )
A.放电时负极反应:Na3Ti2(PO4)3-2e- NaTi2(PO4)3+2Na+
B.放电时Cl-透过多孔活性炭电极向CCl4中迁移
C.放电时每转移1 mol电子,理论上CCl4吸收0.5 mol Cl2
D.充电过程中,NaCl溶液浓度增大
14.工业上用Na2SO3溶液吸收硫酸工业尾气中的SO2,并通过电解方法实现吸收液的循环再生,其中阴、阳离子交换膜组合使用循环再生机理如图所示。下列有关说法正确的是 ( )
A.X应为直流电源的正极
B.电解过程中阴极区pH减小
C.图中的b%>a%
D.S+H2O
15.科学家利用垃圾渗透液研发出新型环保电池,其利用微生物在碱性环境下实现发电、环保一体化装置如图。当该装置工作时,下列说法正确的是 ( )
A.盐桥中K+向X极移动,Cl-向Y极移动
B.电路中通过3.75 mol电子时,产生N2的体积为22.4 L(标准状况)
C.电流由X极沿导线流向Y极
D.Y极电极反应式为2N+10e-+12H+ N2↑+6H2O
二、非选择题(本题共4小题,共55分)
16.(14分)某实验小组同学利用如图装置对电化学原理进行了一系列探究活动。
(1)甲池装置为 (填“原电池”或“电解池”)。
(2)甲池反应前两电极质量相等,工作一段时间后,两电极质量相差14 g,则导线中通过 mol电子。实验过程中,甲池右侧烧杯中N的浓度 (填“增大”“减小”或“不变”)。
(3)若乙池中为足量的AgNO3溶液,则乙池发生的总反应方程式为 。工作一段时间后,若要使乙池中溶液复原,可向溶液中加入 (填化学式)。
(4)若乙池中为NaCl溶液,在一定条件下该装置可制备ClO2。已知ClO2易溶于水,可与NaOH发生反应。产生ClO2的电极反应式为 。乙池中选用的离子交换膜是 (填“阴离子”或“阳离子”)交换膜。
(5)乙池用于保护铁管道不被腐蚀时,铁管道替换 Pt电极(填“左侧”或“右侧”)。
(6)若将乙池改为电解精炼铜装置(粗铜含Al、Zn、Ag、Pt、Au等杂质),电解质溶液为CuSO4溶液,则下列说法中正确的是 (填字母)。
A.电解过程中,阳极减少的质量与阴极增加的质量相等
B.乙池左侧电极为粗铜,发生氧化反应
C.CuSO4溶液的浓度保持不变
D.杂质中Ag、Pt、Au以单质的形式沉淀到池底
17.(13分)(1)铅酸蓄电池为常见的二次电池,其原理为Pb+PbO2+2H2SO4 2PbSO4+2H2O。放电时,能量转化形式为 (填“化学能转化为电能”或“电能转化为化学能”),正极的电极反应为 ,外电路每通过1 mol e-,负极质量 (填“增加”或“减少”) g。充电时,原负极应接外接电源的 极。
(2)工业上采用Fe、C为电极电解碱性K2MnO4溶液制备KMnO4。电解时,应以 (填“Fe”或“C”)作阴极,电解时阳极的电极反应式为 ,电解过程中阴极附近溶液pH将 (填“增大”“减小”或“不变”)。
(3)用原电池原理可以除去酸性废水中的三氯乙烯和As,其原理如图所示(导电壳内部为纳米铁)。正极电极反应式为 。
18.(12分)高锰酸钾(KMnO4)和过氧化氢(H2O2)都是常见的消毒试剂,在日常生活和工业生产中都有广泛的应用。回答下列问题:
(1)现有如图所示电池:
①闭合K,电流表指针发生偏转。写出A电极的电极反应: ,反应后B电极附近溶液的pH (填“增大”“减小”或“不变”)。
②电子 (填“从A电极流向B电极”或“从B电极流向A电极”)。
(2)某化学兴趣小组为了探究KMnO4与H2O2的氧化性强弱,设计了如图实验装置:
①当闭合K时,电流计指针向左偏转,甲烧杯中溶液颜色逐渐变浅,则石墨电极a上发生 (填“氧化”或“还原”)反应,石墨电极b上发生的电极反应为 。
②反应一段时间后,向甲烧杯中滴加KOH溶液,同时向乙烧杯中滴加硫酸溶液,发现电流计指针向左偏转角度逐渐减小,最后向右偏转,说明KMnO4与H2O2的氧化性强弱与 有关。
19.(16分)(1)电解饱和食盐水是氯碱工业的基础。目前比较先进的方法是阳离子交换膜法,电解示意图如图所示。请回答以下问题:
①电解饱和食盐水的总反应的离子方程式是 。
②在b口加入的物质为 。
(2)全钒液流电池是一种新型的绿色环保储能装置,工作原理如图:
几种离子在水溶液中的颜色如表所示:
离子种类 V VO2+ V3+ V2+
颜色 黄色 蓝色 绿色 紫色
①全钒液流电池放电时V2+发生氧化反应,该电池放电时总反应式是 。
②当完成储能时,阴极室溶液的颜色是 。
(3)将PbO溶解在HCl和NaCl的混合溶液中,得到含Na2PbCl4的电解液,电解Na2PbCl4溶液生成Pb的装置如图所示。
①写出电解时阴极的电极反应式: 。
②电解过程中通过阳离子交换膜的离子主要为 。
答案与分层梯度式解析
1.D 2.B 3.B 4.A 5.D 6.A 7.C 8.C
9.C 10.A 11.D 12.A 13.A 14.C 15.B
1.D 硅太阳能电池是将太阳能转化为电能,A错误;燃气灶是将化学能主要转化为热能,B错误;太阳能集热器是将太阳能转化为热能,C错误;锂离子电池是将化学能转化为电能,D正确。
2.B 该装置为原电池装置,发生的总反应是Zn+Cu2+ Zn2++Cu,Zn为负极,Cu为正极。原电池中阴离子移向负极,所以盐桥中的阴离子移向ZnSO4溶液,A错误;电流从正极流向负极,即从铜电极流向锌电极,B正确;锌是负极,发生的电极反应为Zn-2e- Zn2+,C错误;Zn2+是电极生成物,是离子导体,D错误。
3.B A项属于外加电流法;B项属于牺牲阳极法;C项,钢闸门作阳极,发生氧化反应,加快钢闸门腐蚀,不能起到防腐蚀的作用;D项,喷油漆属于隔绝氧气保护法。
4.A 铅酸蓄电池的总反应为PbO2+Pb+2H2SO4 2PbSO4+2H2O,放电时,Pb作负极,发生氧化反应,充电时,Pb电极发生还原反应,所以对铅酸蓄电池充电时,Pb电极接电源负极,A正确;金属铜作阳极,在阳极Cu失电子发生氧化反应,电极反应式为Cu-2e- Cu2+,B错误;原电池中,电子由负极流出,经过导线流入正极,电子不能进入电解质溶液,C错误;金属镁作负极,发生氧化反应,氯化银是氧化剂,在正极发生还原反应,正极反应式为AgCl+e- Ag+Cl-,D错误。
5.D 铜作阳极,铜失电子生成铜离子,使溶液呈蓝色,阴极H+得电子生成H2,溶液颜色发生明显变化,A不符合题意;以石墨为电极,电解溴化钾溶液过程中生成溴单质,溴溶于水,溶液呈橙色,溶液颜色发生明显变化,B不符合题意;以石墨为电极,电解含酚酞的饱和食盐水,阴极上水电离出的氢离子得到电子生成氢气,附近溶液中氢氧根离子浓度增大,溶液变红,溶液颜色发生明显变化,C不符合题意;以铜为电极,电解CuSO4溶液,阳极铜失电子生成铜离子,阴极铜离子得电子生成铜单质,溶液浓度不变,溶液颜色无明显变化,D符合题意。
6.A 电解饱和NaCl溶液,饱和NaCl溶液应从阳极进入,氯气在阳极产生,且应选用阳离子交换膜,A错误;在金属制品表面镀银,Ag为阳极,与电源正极相连,金属制品为阴极,与电源负极相连,B正确;粗铜精炼时,粗铜为阳极,与电源正极相连,精铜为阴极,与电源负极相连,电解质溶液为CuSO4溶液,C正确;用惰性电极电解熔融的氯化钠,制取金属钠,D正确。
7.C 图中甲池为原电池装置,Cu电极发生氧化反应,作原电池的负极,A错误;甲池工作时,Cu在负极失电子被氧化为Cu2+,盐桥中的N向左侧烧杯中移动,即左侧烧杯中c(N)增大,B错误;用铜制U形物代替“盐桥”,中间烧杯构成原电池,在中间烧杯中Cu作负极而溶解,左侧烧杯中原Cu电极作阳极,铜制U形物左侧作阴极,其质量增加,电路中转移电子数相等,故铜制U形物减少的质量与增加的质量相等,即工作一段时间后铜制U形物的质量不变,C正确;若甲池中Ag电极质量增加5.4 g,即生成5.4 g Ag,物质的量为0.05 mol,整个电路转移0.05 mol电子,如果乙池中盐溶液是足量AgNO3溶液,应析出5.4 g Ag,而实际乙池中某电极析出1.6 g金属,D错误。
8.C 原电池放电时,阳离子向正极移动,故K+均向正极移动,A项错误;CH3OH-O2和(CH3)2NNH2-O2放电时产生的二氧化碳与KOH反应,KOH的物质的量减小,N2H4-O2放电时电池总反应式为N2H4+O2 N2+2H2O,放电过程中溶液中KOH的物质的量不变,B项错误;三种燃料转移电子数关系为CH3OH~6e-,N2H4~4e-,(CH3)2NNH2~16e-,1 g CH3OH、N2H4、(CH3)2NNH2分别转移 mol、 mol、 mol电子,故消耗等质量燃料,(CH3)2NNH2-O2燃料电池的理论放电量最大,C项正确;根据N2H4-O2放电时电池总反应式:N2H4+O2 N2+2H2O,可知消耗1 mol O2时,理论上气体产物的体积在标准状况下为22.4 L,D项错误。
9.C 由图示装置可知吸附层a为负极,吸附层b为正极。该电池工作时,电子流向为吸附层a→导线(含电流表)→吸附层b,A错误;H2在吸附层a上发生氧化反应生成H2O,电极反应为H2-2e-+2OH- 2H2O,B错误;H+在正极发生还原反应生成H2,电极反应为2H++2e- H2↑,由正、负极的电极反应式可得该电池的总反应为H++OH- H2O,不是氧化还原反应,C正确;吸附层b是正极,该电池工作时,Na+移向吸附层b,D错误。
10.A 环氧乙烷的制备原理:Cl-在阳极放电生成Cl2,Cl2与水反应生成HCl、HClO,HClO与乙烯发生反应生成HOCH2CH2Cl;阴极区水放电生成氢气,同时产生氢氧根离子,电解结束后,移出Cl-交换膜,两区溶液混合发生反应:HOCH2CH2Cl+OH- Cl-+H2O+。阳极区产生HClO,所以乙烯通入阳极区,A错误;阳极生成的氯气会与水发生反应Cl2+H2O HCl+HClO,B正确;阳极区会产生HCl,使用Cl-交换膜阻止OH-通过,HCl的浓度不断增大,pH逐渐减小,C正确;该反应过程中KCl并没有被消耗,实际上是水与乙烯反应,总反应为H2CCH2+H2O H2+,D正确。
11.D 结合Li-SO2Cl2电池总反应可知,Li作负极,C作正极。电解制备Ni(H2PO2)2时,g为阳极,g应接电源的正极,A正确;阳极上Ni失电子生成Ni2+并通过膜a进入Ⅱ室,即膜a为阳离子交换膜,H2P通过膜b进入Ⅱ室,膜b为阴离子交换膜,Na+通过膜c进入Ⅳ室,膜c为阳离子交换膜,B正确;由电池总反应可知,正极反应为SO2Cl2+2e- 2Cl-+SO2↑,C正确;当Li-SO2Cl2电池生成1 mol SO2时转移2 mol电子,电解池中生成1 mol Ni2+,理论上电解池中产生1 mol Ni(H2PO2)2,D错误。
12.A PANa在水溶液中电离出聚丙烯酸根离子和Na+,A错误;放电时,负极锌失去电子后结合OH-生成[Zn(OH)4]2-,负极反应式为Zn-2e-+4OH- [Zn(OH)4]2-,B正确;充电时,阴极反应式为[Zn(OH)4]2-+2e- Zn+4OH-,阴极附近OH-浓度增大,pH增大,阳极反应式为4OH--4e- O2↑+2H2O,阳极附近OH-浓度减小,pH减小,C正确;充电时,阳极反应式为4OH--4e- O2↑+2H2O,电路中通过0.4 mol电子时,有0.1 mol O2生成,在标准状况下体积为0.1 mol×22.4 L/mol=2.24 L,D正确。
13.A 结合图示装置可知钛电极为负极,多孔活性炭电极为正极,根据反应中Ti元素化合价变化可写出负极反应为Na3Ti2(PO4)3-2e- NaTi2(PO4)3+2Na+,A正确;电池放电时,阴离子移向负极,即Cl-通过多孔活性炭电极向NaCl溶液中迁移,B错误;放电时每转移1 mol电子,结合正极反应Cl2+2e- 2Cl-,则理论上CCl4释放0.5 mol Cl2,C错误;充电过程中,阳极反应为2Cl--2e- Cl2↑,反应中消耗Cl-,故NaCl溶液浓度减小,D错误。
14.C 根据阴、阳离子的移动方向得知,阳离子向Pt(Ⅰ)电极移动,阴离子向Pt(Ⅱ)电极移动,因此Pt(Ⅰ)为阴极,Pt(Ⅱ)为阳极,所以X为直流电源负极,Y为直流电源正极,A错误; Pt(Ⅰ)为阴极,阴极上HS中氢离子得电子放出氢气,故Pt(Ⅰ)附近溶液的pH增大,B错误;阳极室中,电极反应式为S-2e-+H2O S+2H+,HS-2e-+H2O S+3H+,所以b%>a%,C正确;阳极上亚硫酸根离子在酸性条件下失电子发生氧化反应,故电极反应式为S+H2O-2e- S+2H+,D错误。
15.B 在X电极上NH3失去电子被氧化为N2,所以X极为负极;在Y电极上N得到电子被还原为N2,所以Y电极为正极。原电池中,阳离子向正极移动,阴离子向负极移动,所以盐桥中的K+向Y极移动,Cl-向X极移动,A错误;该电池的总反应为5NH3+3N 4N2+6H2O+3OH-,转移15 mol电子时,反应生成4 mol N2,若转移3.75 mol电子,则产生N2的物质的量为×4 mol=1 mol,其在标准状况下的体积为22.4 L,B正确;电流由正极(Y极)沿导线流向负极(X极),C错误;Y极的电极反应式为2N+10e-+6H2O N2↑+12OH-,D错误。
16.答案 (除标注外,每空2分)(1)原电池(1分)
(2)0.1 不变(1分)
(3)4AgNO3+2H2O 4Ag+4HNO3+O2↑ Ag2O
(4)Cl--5e-+2H2O ClO2↑+4H+ 阳离子
(5)右侧(1分)
(6)BD(1分)
解析 由题图可知,甲池为原电池,Cu比Ag活泼,Cu为负极,Ag为正极,乙池为电解池,左侧Pt电极为阳极,右侧Pt电极为阴极。
(2)反应前两电极质量相等,甲池中总反应为2Ag++Cu Cu2++2Ag,当1 mol Cu反应时,转移2 mol电子,生成2 mol Ag,此时两电极质量相差108 g/mol×2 mol+64 g/mol×1 mol=280 g,当两电极质量相差14 g时,导线中通过电子的物质的量为×2 mol=0.1 mol。实验过程中,盐桥中N向甲池左侧烧杯(即负极)迁移,甲池左侧烧杯中N的浓度增大,甲池右侧烧杯中N的浓度不变。
(3)用惰性电极电解AgNO3溶液,阳极上H2O失电子生成O2和H+,阴极上Ag+得电子生成Ag,总反应为4AgNO3+2H2O 4Ag+4HNO3+O2↑;若乙池中溶液为足量的硝酸银溶液,阴极生成Ag,阳极生成氧气,工作一段时间后,若要使乙池中溶液复原,可向溶液中加入Ag2O。
(4)产生ClO2的电极反应式为Cl--5e-+2H2O ClO2↑+4H+,已知ClO2可与NaOH发生反应,为防止OH-移至阳极,乙池中选用的离子交换膜应是阳离子交换膜。
(5)乙池为电解池,为保护铁管道不被腐蚀,铁管道应做阴极,与原电池的负极相连,即与Cu电极相连,故替换右侧Pt电极。
(6)电解过程中,阳极为粗铜,阴极为纯铜,CuSO4溶液为电解质溶液,阳极上Cu及比Cu活泼的金属(如Al、Zn等)放电变成离子进入电解质溶液,阴极只有铜离子得电子,故阳极减少的质量与阴极增加的质量不相等,CuSO4溶液的浓度减小,A、C错误;乙池左侧电极为阳极,电极材料为粗铜,发生氧化反应,B正确;比铜活泼性差的金属(如Pt、Au等)形成阳极泥,以单质的形式沉淀到池底,D正确。
17.答案 (除标注外,每空2分)(1)化学能转化为电能(1分) PbO2+2e-+S+4H+ PbSO4+2H2O 增加(1分) 48 负(1分)
(2)Fe(1分) Mn-e- Mn 增大(1分)
(3)C2HCl3+8e-+5H+ C2H6+3Cl-
解析 (1)铅酸蓄电池为可充电电池,放电时为原电池,将化学能转化为电能;放电时,PbO2为正极,得电子发生还原反应,电极反应式为PbO2+2e-+S+4H+ PbSO4+2H2O,Pb为负极,电极反应式为Pb-2e-+S PbSO4,外电路每通过1 mol e-,负极增加的质量为0.5 mol S的质量,即0.5 mol×96 g/mol=48 g;充电时为电解池,原负极应接外接电源的负极。
(2)电解时,K2MnO4→KMnO4,Mn元素化合价升高,K2MnO4在阳极被氧化,阳极应为C,Fe为阴极;电解时,阳极的电极反应式为Mn-e- Mn,阴极的电极反应式为2H2O+2e- H2↑+2OH-,因此阴极附近溶液pH将会增大。
(3)根据题图可知,纳米铁为负极,四氧化三铁为正极,正极上C2HCl3得电子生成C2H6,则正极的电极反应式为C2HCl3+8e-+5H+ C2H6+3Cl-。
18.答案 (每空2分)(1)①Al+4OH--3e- [Al(OH)4]- 增大
②从A电极流向B电极
(2)①还原 H-2e-+OH- O2↑+H2O ②溶液的酸碱性
解析 (1)①闭合K,形成原电池,Al在负极发生氧化反应,碱性条件下电极反应为Al+4OH--3e- [Al(OH)4]-;B电极为正极,电极反应为H+2e-+H2O 3OH-,c(OH-)增大,则B极附近溶液的pH增大。②电池工作时,电子从负极(A电极)流出经外电路流向正极(B电极)。
(2)①根据闭合K,甲烧杯中溶液颜色逐渐变浅,可知甲烧杯中KMnO4发生还原反应,则石墨电极b为负极,H发生氧化反应生成O2,其电极反应为H-2e-+OH- O2↑+H2O。②向甲烧杯中滴加KOH溶液,向乙烧杯中滴加硫酸溶液,根据电流计指针的变化可知,KMnO4与H2O2的氧化性强弱与溶液的酸碱性有关。
19.答案 (除标注外,每空3分)(1)①2Cl-+2H2O 2OH-+Cl2↑+H2↑
②NaOH稀溶液
(2)①V2++V+2H+ V3++VO2++H2O ②紫色(2分)
(3)①PbC+2e- Pb+4Cl- ②H+(2分)
解析 (2)①全钒液流电池放电时V2+发生氧化反应生成V3+,则V发生还原反应生成VO2+,据此书写放电时的总反应式。②电池储能时为电解池,阴极的电极反应式为V3++e- V2+,则阴极室溶液的颜色为紫色。
(3)电解Na2PbCl4溶液生成Pb,PbC在阴极发生还原反应生成Pb,水电离出的OH-在阳极放电生成氧气。
