第一章 化学反应的热效应 增分测评卷-《精讲精练》26版高中同步新教材化学人教A版(2019)选必修1
文档属性
| 名称 | 第一章 化学反应的热效应 增分测评卷-《精讲精练》26版高中同步新教材化学人教A版(2019)选必修1 |

|
|
| 格式 | docx | ||
| 文件大小 | 446.9KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-12-04 16:08:31 | ||
图片预览

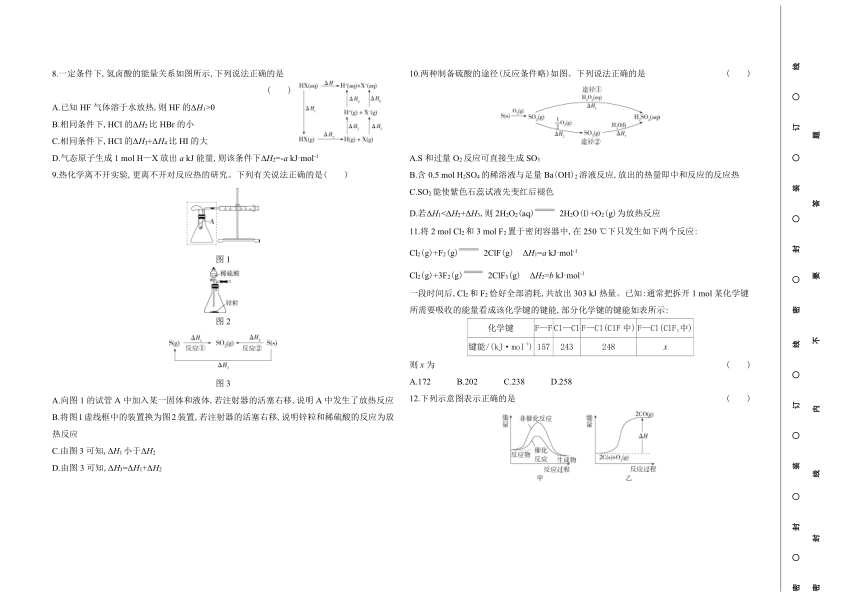


文档简介
(
密
○
封
○
装
○
订
○
线
密
○
封
○
装
○
订
○
线
密
封
线
内
不
要
答
题
)
(
姓名
班级
考号
密
○
封
○
装
○
订
○
线
密
○
封
○
装
○
订
○
线
密
封
线
内
不
要
答
题
)
第一章 化学反应的热效应
注意事项
1.全卷满分100分。考试用时75分钟。
2.可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Al-27 Si-28 S-32 Fe-56。
一、选择题(本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的)
1.中华传统文化蕴含着丰富的化学知识,下列各项中主要涉及吸热反应的是 ( )
A.野火烧不尽,春风吹又生 B.投泥泼水愈光明,烁玉流金见精悍
C.爝火燃回春浩浩,烘炉照破夜沉沉 D.春蚕到死丝方尽,蜡炬成灰泪始干
2.已知:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1。若断裂1 mol H—H、1 mol N—H需要吸收的能量分别为436 kJ、391 kJ,则断裂1 mol 需要吸收的能量为 ( )
A.431 kJ B.945.6 kJ C.649 kJ D.869 kJ
3.用稀盐酸与稀NaOH溶液(碱稍过量)测定中和反应的反应热时,下列有关说法错误的是 ( )
A.酸、碱混合前应分别测量其温度
B.酸、碱混合时,应将碱溶液一次性快速加入酸中
C.实验中应上下拉动玻璃搅拌器
D.用量筒取盐酸时若仰视读数,则测得的反应热ΔH偏大
4.下列说法错误的是 ( )
A.需要加热才能发生的反应可能是吸热反应,也可能是放热反应
B.已知4P(红磷,s) P4(白磷,s) ΔH>0,则红磷比白磷稳定
C.“冰,水为之,而寒于水”,说明相同质量的水和冰相比较,冰的能量低
D.已知2H2(g)+O2(g) 2H2O(g) ΔH=-483.6 kJ·mol-1,则氢气的燃烧热为241.8 kJ·mol-1
5.已知几种离子反应如下,下列推断正确的是 ( )
①NH3·H2O(aq)+H+(aq) N(aq)+H2O(l) ΔH1
②Ba2+(aq)+S(aq) BaSO4(s) ΔH2
③Ba2+(aq)+2H+(aq)+2OH-(aq)+S(aq) BaSO4(s)+2H2O(l) ΔH3
④H+(aq)+OH-(aq) H2O(l) ΔH4
A.ΔH1>0 ΔH2<0 B.ΔH2<ΔH3
C.ΔH3=ΔH2+ΔH4 D.ΔH1>ΔH4
6.光照条件下,在催化剂(Nb2O5)表面进行反应:H2(g)+CO2(g) CO(g)+H2O(g)。已知下列反应:
①2H2(g)+O2(g) 2H2O(g) ΔH1
②C(s)+O2(g) CO(g) ΔH2
③C(s)+O2(g) CO2(g) ΔH3
下列说法不正确的是 ( )
A.ΔH2<ΔH3
B.在催化剂(Nb2O5)表面进行的反应,其能量转化方式主要为太阳能转化为化学能
C.反应2CO(g)+O2(g) 2CO2(g)的ΔH=2(ΔH3-ΔH2)
D.反应H2(g)+CO2(g) CO(g)+H2O(g)的ΔH=ΔH2-ΔH3+ΔH1
7.下列关于反应与能量的说法正确的是 ( )
A.Zn(s)+CuSO4(aq) ZnSO4(aq)+Cu(s) ΔH=-216 kJ·mol-1,E反应物B.CaCO3(s) CaO(s)+CO2(g) ΔH=+178.2 kJ·mol-1,E反应物C.HCl(g) H2(g)+Cl2(g) ΔH=+92.3 kJ·mol-1,1 mol HCl(g)在密闭容器中完全分解后放出92.3 kJ的能量
D.将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g) 2NH3(g) ΔH=-38.6 kJ·mol-1
8.一定条件下,氢卤酸的能量关系如图所示,下列说法正确的是 ( )
A.已知HF气体溶于水放热,则HF的ΔH1>0
B.相同条件下,HCl的ΔH2比HBr的小
C.相同条件下,HCl的ΔH3+ΔH4比HI的大
D.气态原子生成1 mol H—X放出a kJ能量,则该条件下ΔH2=-a kJ·mol-1
9.热化学离不开实验,更离不开对反应热的研究。下列有关说法正确的是( )
图1
图2
图3
A.向图1的试管A中加入某一固体和液体,若注射器的活塞右移,说明A中发生了放热反应
B.将图1虚线框中的装置换为图2装置,若注射器的活塞右移,说明锌粒和稀硫酸的反应为放热反应
C.由图3可知,ΔH1小于ΔH2
D.由图3可知,ΔH3=ΔH1+ΔH2
10.两种制备硫酸的途径(反应条件略)如图。下列说法正确的是 ( )
A.S和过量O2反应可直接生成SO3
B.含0.5 mol H2SO4的稀溶液与足量Ba(OH)2溶液反应,放出的热量即中和反应的反应热
C.SO2能使紫色石蕊试液先变红后褪色
D.若ΔH1<ΔH2+ΔH3,则2H2O2(aq) 2H2O(l)+O2(g)为放热反应
11.将2 mol Cl2和3 mol F2置于密闭容器中,在250 ℃下只发生如下两个反应:
Cl2(g)+F2(g) 2ClF(g) ΔH1=a kJ·mol-1
Cl2(g)+3F2(g) 2ClF3(g) ΔH2=b kJ·mol-1
一段时间后,Cl2和F2恰好全部消耗,共放出303 kJ热量。已知:通常把拆开1 mol某化学键所需要吸收的能量看成该化学键的键能,部分化学键的键能如表所示:
化学键 F—F Cl—Cl F—Cl(ClF中) F—Cl(ClF3中)
键能/(kJ·mol-1) 157 243 248 x
则x为 ( )
A.172 B.202 C.238 D.258
12.下列示意图表示正确的是 ( )
A.甲图表示Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g)(ΔH>0)的能量变化
B.乙图表示碳完全燃烧的反应中能量的变化
C.实验的环境温度为20 ℃,将物质的量浓度相等、体积分别为V1 mL、V2 mL的H2SO4溶液、NaOH溶液混合,测量混合液温度,结果如丙图(已知V1+V2=60)
D.由丁图可知A生成B的反应为吸热反应,B生成C的反应为放热反应
13.碳酸钠晶体(Na2CO3·10H2O)失水可得到Na2CO3·H2O(s)或Na2CO3(s),两个化学反应的能量变化如图所示,下列说法正确的是 ( )
反应1 反应2
A.ΔH1<0
B.碳酸钠晶体(Na2CO3·10H2O)失水是物理变化
C.Na2CO3·H2O(s)失水生成Na2CO3(s):ΔH=ΔH1-ΔH2
D.向Na2CO3(s)中滴加几滴水,温度升高
14.用CH4催化还原NOx,可以减少氮氧化物的污染。已知:
①CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
②CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(g) ΔH=-1 160 kJ·mol-1
下列说法不正确的是 ( )
A.若标准状况下4.48 L CH4与一定量NO2完全反应生成N2、CO2和水蒸气,放出的热量为173.4 kJ
B.由反应①可推知:CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2O(l) ΔH<-574 kJ·mol-1
C.反应①②中,相同物质的量的CH4发生反应,转移的电子数相同
D.反应②中当4.48 L CH4反应完全时转移的电子为1.60 mol
15.在298 K、1.01×105 Pa条件下,将22 g CO2通入375 mL 2 mol·L-1 NaOH溶液中充分反应,测得反应放出x kJ热量;已知在该条件下,1 mol CO2通入1 L 2 mol·L-1 NaOH溶液中充分反应放出y kJ热量,则CO2与NaOH溶液反应生成NaHCO3的热化学方程式正确的是 ( )
A.CO2(g)+NaOH(aq) NaHCO3(aq) ΔH=-(2x-y) kJ·mol-1
B.CO2(g)+NaOH(aq) NaHCO3(aq) ΔH=-(2y-x) kJ·mol-1
C.CO2(g)+NaOH(aq) NaHCO3(aq) ΔH=-(4y-x) kJ·mol-1
D.CO2(g)+NaOH(aq) NaHCO3(aq) ΔH=-(4x-y) kJ·mol-1
二、非选择题(本题共4小题,共55分)
16.(9分)研究化学反应中的能量变化对生产、生活有重要的意义。
(1)某氮肥厂含氮废水中的氮元素多以N和NH3·H2O形式存在,处理过程中N,这两步反应过程中的能量变化如图所示:
1 mol N(aq)全部被氧化成N(aq) (填“吸收”或“放出”)的热量是 kJ。
(2)已知H2(g)+Br2(l) 2HBr(g) ΔH1=-72 kJ·mol-1,蒸发1 mol Br2(l)吸收的能量为30 kJ,其他相关数据如表:
化学键 H—H Br—Br(气态) H—Br
键能/kJ·mol-1 436 200 a
则表中a= 。
17.(16分)煤、石油等传统能源使用时会污染环境,科学家们正积极寻找其他清洁能源作为替代品。根据所学知识,回答下列问题:
(1)下列反应中,属于放热反应的是 (填字母)。
A.灼热的碳与CO2反应 B.铝和氧化铁反应
C.CaCO3受热分解 D.锌与盐酸反应
(2)通常把拆开1 mol某化学键所需要吸收的能量看成该化学键的键能,键能用E表示。已知:
化学键 H—H O O O—H
E/(kJ·mol-1) 436 497.3 462.8
计算:2H2(g)+O2(g) 2H2O(g) ΔH= 。
(3)已知在25 ℃、101 kPa时:
Ⅰ.2Na(s)+O2(g) Na2O(s) ΔH=-412 kJ·mol-1
Ⅱ.2Na(s)+O2(g) Na2O2(s) ΔH=-511 kJ·mol-1
写出Na2O2与Na反应生成Na2O的热化学方程式: 。
(4)二甲醚(CH3OCH3)是重要的化工原料,可由CO和H2反应制得,反应的热化学方程式为2CO(g)+4H2(g) CH3OCH3(g)+H2O(g) ΔH=-206.0 kJ·mol-1,起始时向容器中充入2 mol CO和4 mol H2,某时刻测得该反应放出的热量为51.5 kJ,此时CO的转化率为 。
(5)某同学设计如图所示实验,探究反应中的能量变化。
(a) (b)
①利用实验装置(b)测定盐酸与NaOH溶液发生中和反应的反应热,若取50 mL 0.50 mol·L-1的盐酸,则还需加入 (填字母)。
A.1.0 g NaOH固体
B.50 mL 0.50 mol·L-1氨水
C.50 mL 0.55 mol·L-1 NaOH溶液
②分析下列操作可能对结果造成的影响。
将实验(a)中的铝片更换为等质量的铝粉后,释放出的能量将 (填“偏大”“偏小”或“不变”,下同);将实验(b)中玻璃搅拌器改为铁质搅拌器后,实验测得的ΔH 。
18.(15分)(1)S8分子可形成单斜硫和斜方硫,转化过程如下:S(单斜,s) S(斜方,s) ΔH=-0.398 kJ·mol-1,则常温下,S(单斜)与S(斜方)中较稳定的是 。
(2)0.3 mol C2H2(g)在O2(g)中完全燃烧生成CO2(g)和H2O(l),放出389.7 kJ热量,请写出表示C2H2燃烧热的热化学方程式: 。
(3)由N2O和NO反应生成N2和NO2的能量变化如图所示。则反应过程中,每生成2 mol N2理论上放出的热量为 。
(4)已知:C(石墨,s)+O2(g) CO2(g) ΔH1=-a kJ·mol-1;
H2(g)+O2(g) H2O(l) ΔH2=-b kJ·mol-1;
CH4(g)+2O2(g) CO2(g)+2H2O(l) ΔH3=-c kJ·mol-1。
计算C(石墨,s)与H2(g)反应生成1 mol CH4(g)的ΔH为 kJ·mol-1(用含a、b、c的式子表示)。
(5)由金红石(TiO2)制取单质Ti的步骤为TiO2 TiCl4 Ti。
已知:Ⅰ.C(s)+O2(g) CO2(g) ΔH=-393.5 kJ·mol-1
Ⅱ.2CO(g)+O2(g) 2CO2(g) ΔH=-566 kJ·mol-1
Ⅲ.TiO2(s)+2Cl2(g) TiCl4(s)+O2(g) ΔH=+141 kJ·mol-1
①TiO2(s)+2Cl2(g)+2C(s) TiCl4(s)+2CO(g)的ΔH= 。
②反应TiCl4+2Mg 2MgCl2+Ti在Ar气氛中进行的理由是 。
19.(15分)(1)一定条件下,由SO2和CO反应生成S和CO2的能量变化如图所示,每生成16 g S(s),该反应 (填“放出”或“吸收”)的热量为 kJ。
(2)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:
反应Ⅰ:2H2SO4(l) 2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应Ⅲ:S(s)+O2(g) SO2(g) ΔH3=-297 kJ·mol-1
反应Ⅱ的热化学方程式为 。
(3)为减少汽车尾气的污染,可采取NO和CO在催化转换器中发生如下反应:
2NO(g)+2CO(g) 2CO2(g)+N2(g) ΔH1;
已知:2NO(g)+O2(g) 2NO2(g) ΔH2;
CO(g)+O2(g) CO2(g) ΔH3;
NO2与CO发生反应的热化学方程式为2NO2(g)+4CO(g) 4CO2(g)+N2(g) ΔH= (用ΔH1、ΔH2、ΔH3表示)。
(4)工业上接触法生产硫酸的主要反应之一是在一定的温度、压强和钒催化剂存在的条件下,SO2被O2氧化为SO3。V2O5是钒催化剂的活性成分,其在对反应Ⅰ的催化循环过程中,经历了Ⅱ、Ⅲ两个反应阶段,图示如下:
反应Ⅱ、Ⅲ的化学方程式为 、 。
答案与分层梯度式解析
1.B 2.B 3.D 4.D 5.D 6.A 7.B 8.A
9.C 10.D 11.A 12.D 13.D 14.D 15.D
1.B B项涉及高温时碳与水蒸气的反应,此反应为吸热反应。
2.B ΔH=反应物断键吸收的总能量-生成物成键放出的总能量,设断裂1 mol 需要吸收x kJ的能量,ΔH=[(x+3×436)-6×391] kJ·mol-1=-92.4 kJ·mol-1,则x=945.6。
3.D 酸、碱混合前应分别测量其温度,A正确;酸、碱混合时,应将碱溶液一次性快速加入酸中,避免热量损失,B正确;在测定中和反应反应热的实验中,通过上下拉动玻璃搅拌器来使溶液充分反应,C正确;在测定中和反应反应热的实验中,一般NaOH溶液稍过量,用量筒取盐酸时若仰视读数,量得盐酸偏多,导致反应放出更多热量,ΔH为负值,放热越多ΔH越小,D错误。
4.D 反应是吸热还是放热与反应条件无关,而是取决于反应物和生成物能量的相对高低,A正确;已知4P(红磷,s) P4(白磷,s) ΔH>0,则白磷能量高于红磷,能量越低越稳定,红磷比白磷稳定,B正确;“冰,水为之,而寒于水”说明水结冰是一个放热过程,故等质量的水和冰相比,冰的能量更低,C正确;氢气的燃烧热为1 mol氢气完全燃烧生成液态水放出的热量,题给方程式中水为气态,则氢气的燃烧热不可能是241.8 kJ·mol-1,D错误。
5.D 中和反应为放热反应,则①NH3·H2O(aq)+H+(aq) N(aq)+H2O(l)为放热反应,ΔH1<0,A错误;由盖斯定律可知,反应②+2×反应④=反应③,则反应②=反应③-2×反应④,ΔH2=ΔH3-2×ΔH4,由于反应④为放热反应,ΔH4<0,所以ΔH2>ΔH3,B错误;根据盖斯定律可知,反应③=反应②+2×反应④,所以ΔH3=ΔH2+2ΔH4,C错误;反应①和反应④均为放热反应,且反应①中NH3·H2O的电离过程吸热,所以反应①放出的热量比反应④少,放热反应的焓变为负值,则ΔH1>ΔH4,D正确。
6.A 碳在氧气中燃烧为放热反应,等质量的碳燃烧生成CO2(g)放出的热量比生成CO(g)放出的热量多,放出的热量越多,焓变越小,即ΔH3<ΔH2,A错误;根据光照条件下,在催化剂(Nb2O5)表面发生反应:H2(g)+CO2(g) CO(g)+H2O(g),可得到能量转化方式主要为太阳能转化为化学能,B正确;根据盖斯定律,将③×2-②×2得2CO(g)+O2(g) 2CO2(g) ΔH=2(ΔH3-ΔH2),C正确;根据盖斯定律,将②-③+①×得H2(g)+CO2(g) CO(g)+H2O(g) ΔH=ΔH2-ΔH3+ΔH1,D正确。
7.B A项,该反应为放热反应,即E反应物>E生成物,错误;B项,该反应为吸热反应,即E反应物8.A 已知HF气体溶于水放热,则其逆过程吸热,即HF的ΔH1>0,A正确;断键吸收能量,则ΔH2>0,相同条件下,HCl比HBr稳定,断裂H—Cl键吸收的能量多,HCl的ΔH2比HBr的大,B错误;ΔH3+ΔH4代表H(g)→H+(aq)的焓变,其大小与氢卤酸的种类无关,C错误;一定条件下,气态原子生成1 mol H—X放出a kJ能量,则断开1 mol H—X生成气态原子吸收a kJ能量,即ΔH2=+a kJ·mol-1,D错误。
9.C 很多物质溶解过程也是放热的,向题图1的试管A中加入某一固体和液体,若注射器的活塞右移,不能说明A中发生了放热反应,A错误;将题图1虚线框中的装置换为题图2装置,由于锌粒与稀硫酸反应生成H2,生成的H2可使注射器的活塞右移,所以若注射器的活塞右移,不能说明锌粒和稀硫酸的反应为放热反应,B错误;等质量气态硫的能量比固态硫的高,反应①放出的热量比反应②的多,放热反应的焓变为负值,因此ΔH1小于ΔH2,C正确;由题图3可知,ΔH2=ΔH1+ΔH3,D错误。
10.D 不管O2是否过量,S和O2反应都只生成SO2,不能直接生成SO3,A错误;反应生成BaSO4沉淀,会放出热量,故含0.5 mol H2SO4的稀溶液与足量Ba(OH)2溶液反应,放出的热量不是中和反应的反应热,B错误;SO2能使紫色石蕊试液变红但不褪色,C错误;据图可知,ⅰ.SO2(g)+H2O2(aq) H2SO4(aq) ΔH1,ⅱ.SO2(g)+O2(g) SO3(g) ΔH2,ⅲ.SO3(g)+H2O(l) H2SO4(aq) ΔH3,根据盖斯定律,(ⅰ-ⅱ-ⅲ)×2可得2H2O2(aq) 2H2O(l)+O2(g) ΔH=2[ΔH1-(ΔH2+ΔH3)],若ΔH1<ΔH2+ΔH3,则ΔH<0,为放热反应,D正确。
11.A ΔH=反应物的键能总和-生成物的键能总和,由题意Cl2(g)+F2(g) 2ClF(g) ΔH1=a kJ·mol-1;Cl2(g)+3F2(g) 2ClF3(g) ΔH2=b kJ·mol-1可知;ΔH1=(243+157-2×248) kJ·mol-1=-96 kJ·mol-1,ΔH2=(243+3×157-2×3x) kJ·mol-1=(714-6x) kJ·mol-1,即a=-96,b=714-6x,设参与反应Cl2(g)+F2(g) 2ClF(g)的Cl2的物质的量为m,则消耗的F2也为m,剩下的Cl2和F2正好发生反应Cl2(g)+3F2(g) 2ClF3(g),即=,解得m=1.5 mol,则1.5 mol Cl2发生反应Cl2(g)+F2(g) 2ClF(g),放热1.5 mol×96 kJ·mol-1=144 kJ,0.5 mol Cl2发生反应Cl2(g)+3F2(g) 2ClF3(g),放热303 kJ-144 kJ=159 kJ,即(714-6x) kJ·mol-1=- kJ·mol-1,解得x=172,故选A。
12.D 甲图中反应物的总能量比生成物的总能量高,为放热反应,与ΔH>0矛盾,A错误;C(s)完全燃烧生成二氧化碳,且应为放热反应,B错误;物质的量浓度相等的H2SO4、NaOH溶液混合,当V1=20,V2=40时硫酸与氢氧化钠恰好完全反应,放出热量最多,温度最高,与图像不符,C错误。
13.D 从反应1的能量变化图可看出反应物能量低,生成物能量高,Na2CO3·10H2O(s) Na2CO3·H2O(s)+9H2O(g)是吸热反应,ΔH1>0,A错误;失水过程有新物质生成,是化学变化,B错误;由反应1得①Na2CO3·10H2O(s) Na2CO3·H2O(s)+9H2O(g) ΔH1,由反应2得②Na2CO3·10H2O(s) Na2CO3(s)+10H2O(g),②-①得Na2CO3·H2O(s) Na2CO3(s)+H2O(g) ΔH=ΔH2-ΔH1,C错误;向Na2CO3(s)中滴加几滴水,Na2CO3(s)和水反应过程中会放热,温度升高,D正确。
14.D 根据盖斯定律,(①+②)×得:CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g) ΔH=-867 kJ·mol-1,标准状况下4.48 L CH4的物质的量为0.2 mol,放出的热量为0.2 mol×867 kJ·mol-1=173.4 kJ,A正确;由于液态水转化为气态水需要吸收热量,所以生成液态水的反应放出的热量多,放热越多,ΔH越小,即ΔH<-574 kJ·mol-1,B正确;反应①②中CH4均转化为CO2,相同物质的量的CH4发生反应,转移的电子数相同,C正确;因为没有指明气体所处的状况,4.48 L CH4的物质的量无法求算,转移电子数也无法计算,D错误。
15.D 设22 g CO2与375 mL 2 mol·L-1氢氧化钠溶液充分反应生成a mol Na2CO3、b mol NaHCO3,由碳原子守恒可得:a+b=,由钠原子守恒可得:2a+b=2×0.375,解得a=b=0.25,由反应放出x kJ热量可知,反应的热化学方程式为①2CO2(g)+3NaOH(aq) Na2CO3(aq)+NaHCO3(aq)+H2O(l) ΔH1=-=-4x kJ·mol-1,由1 mol CO2与1 L 2 mol·L-1氢氧化钠溶液充分反应放出y kJ热量可知,反应的热化学方程式为②CO2(g)+2NaOH(aq) Na2CO3(aq)+H2O(l) ΔH2=-y kJ·mol-1,由盖斯定律可知,反应①-②可得反应CO2(g)+NaOH(aq) NaHCO3(aq) ΔH=ΔH1-ΔH2=-(4x-y) kJ·mol-1。
16.答案 (每空3分)(1)放出 346
(2)369
解析 (1)N(aq)+O2(g) N(aq)+2H+(aq)+H2O(l) ΔH=-273 kJ·mol-1,N(aq)+O2(g) N(aq) ΔH=-73 kJ·mol-1,两式相加得到N(aq)+2O2(g) N(aq)+2H+(aq)+H2O(l) ΔH=-346 kJ·mol-1,则1 mol N(aq)全部被氧化成N(aq)放出的热量是346 kJ。
(2)H2(g)+Br2(l) 2HBr(g) ΔH1=-72 kJ·mol-1,Br2(l) Br2(g) ΔH2=+30 kJ·mol-1,则H2(g)+Br2(g) 2HBr(g) ΔH=ΔH1-ΔH2=-102 kJ·mol-1,ΔH=反应物的键能之和-生成物的键能之和=(436+200-2a) kJ·mol-1=-102 kJ·mol-1,解得a=369。
17.答案 (除标注外,每空2分)(1)BD
(2)-481.9 kJ·mol-1
(3)Na2O2(s)+2Na(s) 2Na2O(s) ΔH=-313 kJ·mol-1(3分)
(4)25%(3分)
(5)①C ②不变 偏大
解析 (1)灼热的碳与CO2的反应为吸热反应;铝热反应为放热反应;CaCO3受热分解的反应为吸热反应;活泼金属与酸的反应为放热反应;B、D符合题意。
(2)ΔH=反应物的键能之和-生成物键能之和=436 kJ·mol-1×2+497.3 kJ·mol-1-462.8 kJ·mol-1×4=-481.9 kJ·mol-1。
(3)由盖斯定律可知,反应Ⅰ×2-反应Ⅱ可得2Na(s)+Na2O2(s) 2Na2O(s) ΔH=(-412 kJ·mol-1)×2-(-511 kJ·mol-1)=-313 kJ·mol-1。
(4)由反应放出的热量为51.5 kJ可知,反应中一氧化碳的转化率为×100%=25%。
(5)①利用实验装置(b)测定盐酸与氢氧化钠溶液发生中和反应的反应热,若取50 mL 0.50 mol·L-1盐酸,应向盐酸中加入过量的氢氧化钠溶液,以确保盐酸完全反应,减少实验误差,最符合的为C项。②将实验(a)中的铝片更换为等质量的铝粉后,反应消耗铝的物质的量不变,反应释放出的能量不变;将实验(b)中玻璃搅拌器改为具有良好导热性的铁质搅拌器会造成热量散失,导致实验测得的ΔH偏大。
18.答案 (除标注外,每空2分)(1)S(斜方)
(2)C2H2(g)+O2(g) 2CO2(g)+H2O(l) ΔH=-1 299 kJ·mol-1
(3)278 kJ
(4)+(c-2b-a)(3分)
(5)①-80 kJ·mol-1(3分) ②防止高温下Mg、Ti与空气中的O2或N2作用(3分)
解析 (1)S(单斜,s) S(斜方,s) ΔH=-0.398 kJ·mol-1,说明S(单斜)比S(斜方)所具有的能量高,能量越低物质越稳定,所以S(单斜)与S(斜方)中较稳定的是S(斜方)。
(2)0.3 mol C2H2(g)在O2(g)中完全燃烧生成CO2(g)和H2O(l),放出389.7 kJ热量,则其燃烧热的热化学方程式为C2H2(g)+O2(g) 2CO2(g)+H2O(l) ΔH=-1 299 kJ·mol-1。
(3)根据能量变化图可知,热化学方程式为N2O(g)+NO(g) N2(g)+NO2(g) ΔH=209 kJ·mol-1-348 kJ·mol-1=-139 kJ·mol-1,则生成2 mol N2放出的热量为139 kJ·mol-1×2 mol=278 kJ。
(4)①C(石墨,s)+O2(g) CO2(g) ΔH1=-a kJ·mol-1;
②H2(g)+O2(g) H2O(l) ΔH2=-b kJ·mol-1;
③CH4(g)+2O2(g) CO2(g)+2H2O(l) ΔH3=-c kJ·mol-1;根据盖斯定律,①+②×2-③,得C(石墨,s)+2H2(g) CH4(g) ΔH=+(c-2b-a) kJ·mol-1。
(5)①根据盖斯定律,Ⅰ×2-Ⅱ+Ⅲ得TiO2(s)+2Cl2(g)+2C(s) TiCl4(s)+2CO(g) ΔH=-80 kJ·mol-1;②反应TiCl4+2Mg 2MgCl2+Ti在Ar气氛中进行的理由是防止高温下Mg、Ti与空气中的O2或N2作用。
19.答案 (除标注外,每空3分)(1)放出(1分) 135(2分)
(2)3SO2(g)+2H2O(g) 2H2SO4(l)+S(s) ΔH=-254 kJ·mol-1
(3)ΔH1-ΔH2+2ΔH3
(4)SO2+V2O5 V2O4·SO3 2(V2O4·SO3)+O2 2V2O5+2SO3
解析 (1)SO2和CO反应生成S和CO2:SO2(g)+2CO(g) S(s)+2CO2(g),由题图可知,每生成1 mol S(s)放出热量为(679-409) kJ=270 kJ,16 g S(s)的物质的量为0.5 mol,生成16 g S(s)放出热量为135 kJ。
(2)根据题图知,反应Ⅱ为3SO2(g)+2H2O(g) 2H2SO4(l)+S(s),根据盖斯定律可知-Ⅰ-Ⅲ即得3SO2(g)+2H2O(g) 2H2SO4(l)+S(s) ΔH=-(+551 kJ·mol-1)-(-297 kJ·mol-1)=-254 kJ·mol-1。
(3)根据给定的反应①2NO(g)+2CO(g) 2CO2(g)+N2(g) ΔH1;②2NO(g)+O2(g) 2NO2(g) ΔH2,③CO(g)+O2(g) CO2(g) ΔH3,由盖斯定律可知①-②+2×③可得2NO2(g)+4CO(g) 4CO2(g)+N2(g) ΔH=ΔH1-ΔH2+2ΔH3。
(4)反应Ⅱ生成V2O4·SO3,化学方程式为SO2+V2O5 V2O4·SO3,反应Ⅲ是V2O4·SO3与氧气反应生成V2O5和SO3,化学方程式为2(V2O4·SO3)+O2 2V2O5+2SO3。
密
○
封
○
装
○
订
○
线
密
○
封
○
装
○
订
○
线
密
封
线
内
不
要
答
题
)
(
姓名
班级
考号
密
○
封
○
装
○
订
○
线
密
○
封
○
装
○
订
○
线
密
封
线
内
不
要
答
题
)
第一章 化学反应的热效应
注意事项
1.全卷满分100分。考试用时75分钟。
2.可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Al-27 Si-28 S-32 Fe-56。
一、选择题(本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的)
1.中华传统文化蕴含着丰富的化学知识,下列各项中主要涉及吸热反应的是 ( )
A.野火烧不尽,春风吹又生 B.投泥泼水愈光明,烁玉流金见精悍
C.爝火燃回春浩浩,烘炉照破夜沉沉 D.春蚕到死丝方尽,蜡炬成灰泪始干
2.已知:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1。若断裂1 mol H—H、1 mol N—H需要吸收的能量分别为436 kJ、391 kJ,则断裂1 mol 需要吸收的能量为 ( )
A.431 kJ B.945.6 kJ C.649 kJ D.869 kJ
3.用稀盐酸与稀NaOH溶液(碱稍过量)测定中和反应的反应热时,下列有关说法错误的是 ( )
A.酸、碱混合前应分别测量其温度
B.酸、碱混合时,应将碱溶液一次性快速加入酸中
C.实验中应上下拉动玻璃搅拌器
D.用量筒取盐酸时若仰视读数,则测得的反应热ΔH偏大
4.下列说法错误的是 ( )
A.需要加热才能发生的反应可能是吸热反应,也可能是放热反应
B.已知4P(红磷,s) P4(白磷,s) ΔH>0,则红磷比白磷稳定
C.“冰,水为之,而寒于水”,说明相同质量的水和冰相比较,冰的能量低
D.已知2H2(g)+O2(g) 2H2O(g) ΔH=-483.6 kJ·mol-1,则氢气的燃烧热为241.8 kJ·mol-1
5.已知几种离子反应如下,下列推断正确的是 ( )
①NH3·H2O(aq)+H+(aq) N(aq)+H2O(l) ΔH1
②Ba2+(aq)+S(aq) BaSO4(s) ΔH2
③Ba2+(aq)+2H+(aq)+2OH-(aq)+S(aq) BaSO4(s)+2H2O(l) ΔH3
④H+(aq)+OH-(aq) H2O(l) ΔH4
A.ΔH1>0 ΔH2<0 B.ΔH2<ΔH3
C.ΔH3=ΔH2+ΔH4 D.ΔH1>ΔH4
6.光照条件下,在催化剂(Nb2O5)表面进行反应:H2(g)+CO2(g) CO(g)+H2O(g)。已知下列反应:
①2H2(g)+O2(g) 2H2O(g) ΔH1
②C(s)+O2(g) CO(g) ΔH2
③C(s)+O2(g) CO2(g) ΔH3
下列说法不正确的是 ( )
A.ΔH2<ΔH3
B.在催化剂(Nb2O5)表面进行的反应,其能量转化方式主要为太阳能转化为化学能
C.反应2CO(g)+O2(g) 2CO2(g)的ΔH=2(ΔH3-ΔH2)
D.反应H2(g)+CO2(g) CO(g)+H2O(g)的ΔH=ΔH2-ΔH3+ΔH1
7.下列关于反应与能量的说法正确的是 ( )
A.Zn(s)+CuSO4(aq) ZnSO4(aq)+Cu(s) ΔH=-216 kJ·mol-1,E反应物
D.将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g) 2NH3(g) ΔH=-38.6 kJ·mol-1
8.一定条件下,氢卤酸的能量关系如图所示,下列说法正确的是 ( )
A.已知HF气体溶于水放热,则HF的ΔH1>0
B.相同条件下,HCl的ΔH2比HBr的小
C.相同条件下,HCl的ΔH3+ΔH4比HI的大
D.气态原子生成1 mol H—X放出a kJ能量,则该条件下ΔH2=-a kJ·mol-1
9.热化学离不开实验,更离不开对反应热的研究。下列有关说法正确的是( )
图1
图2
图3
A.向图1的试管A中加入某一固体和液体,若注射器的活塞右移,说明A中发生了放热反应
B.将图1虚线框中的装置换为图2装置,若注射器的活塞右移,说明锌粒和稀硫酸的反应为放热反应
C.由图3可知,ΔH1小于ΔH2
D.由图3可知,ΔH3=ΔH1+ΔH2
10.两种制备硫酸的途径(反应条件略)如图。下列说法正确的是 ( )
A.S和过量O2反应可直接生成SO3
B.含0.5 mol H2SO4的稀溶液与足量Ba(OH)2溶液反应,放出的热量即中和反应的反应热
C.SO2能使紫色石蕊试液先变红后褪色
D.若ΔH1<ΔH2+ΔH3,则2H2O2(aq) 2H2O(l)+O2(g)为放热反应
11.将2 mol Cl2和3 mol F2置于密闭容器中,在250 ℃下只发生如下两个反应:
Cl2(g)+F2(g) 2ClF(g) ΔH1=a kJ·mol-1
Cl2(g)+3F2(g) 2ClF3(g) ΔH2=b kJ·mol-1
一段时间后,Cl2和F2恰好全部消耗,共放出303 kJ热量。已知:通常把拆开1 mol某化学键所需要吸收的能量看成该化学键的键能,部分化学键的键能如表所示:
化学键 F—F Cl—Cl F—Cl(ClF中) F—Cl(ClF3中)
键能/(kJ·mol-1) 157 243 248 x
则x为 ( )
A.172 B.202 C.238 D.258
12.下列示意图表示正确的是 ( )
A.甲图表示Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g)(ΔH>0)的能量变化
B.乙图表示碳完全燃烧的反应中能量的变化
C.实验的环境温度为20 ℃,将物质的量浓度相等、体积分别为V1 mL、V2 mL的H2SO4溶液、NaOH溶液混合,测量混合液温度,结果如丙图(已知V1+V2=60)
D.由丁图可知A生成B的反应为吸热反应,B生成C的反应为放热反应
13.碳酸钠晶体(Na2CO3·10H2O)失水可得到Na2CO3·H2O(s)或Na2CO3(s),两个化学反应的能量变化如图所示,下列说法正确的是 ( )
反应1 反应2
A.ΔH1<0
B.碳酸钠晶体(Na2CO3·10H2O)失水是物理变化
C.Na2CO3·H2O(s)失水生成Na2CO3(s):ΔH=ΔH1-ΔH2
D.向Na2CO3(s)中滴加几滴水,温度升高
14.用CH4催化还原NOx,可以减少氮氧化物的污染。已知:
①CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
②CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(g) ΔH=-1 160 kJ·mol-1
下列说法不正确的是 ( )
A.若标准状况下4.48 L CH4与一定量NO2完全反应生成N2、CO2和水蒸气,放出的热量为173.4 kJ
B.由反应①可推知:CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2O(l) ΔH<-574 kJ·mol-1
C.反应①②中,相同物质的量的CH4发生反应,转移的电子数相同
D.反应②中当4.48 L CH4反应完全时转移的电子为1.60 mol
15.在298 K、1.01×105 Pa条件下,将22 g CO2通入375 mL 2 mol·L-1 NaOH溶液中充分反应,测得反应放出x kJ热量;已知在该条件下,1 mol CO2通入1 L 2 mol·L-1 NaOH溶液中充分反应放出y kJ热量,则CO2与NaOH溶液反应生成NaHCO3的热化学方程式正确的是 ( )
A.CO2(g)+NaOH(aq) NaHCO3(aq) ΔH=-(2x-y) kJ·mol-1
B.CO2(g)+NaOH(aq) NaHCO3(aq) ΔH=-(2y-x) kJ·mol-1
C.CO2(g)+NaOH(aq) NaHCO3(aq) ΔH=-(4y-x) kJ·mol-1
D.CO2(g)+NaOH(aq) NaHCO3(aq) ΔH=-(4x-y) kJ·mol-1
二、非选择题(本题共4小题,共55分)
16.(9分)研究化学反应中的能量变化对生产、生活有重要的意义。
(1)某氮肥厂含氮废水中的氮元素多以N和NH3·H2O形式存在,处理过程中N,这两步反应过程中的能量变化如图所示:
1 mol N(aq)全部被氧化成N(aq) (填“吸收”或“放出”)的热量是 kJ。
(2)已知H2(g)+Br2(l) 2HBr(g) ΔH1=-72 kJ·mol-1,蒸发1 mol Br2(l)吸收的能量为30 kJ,其他相关数据如表:
化学键 H—H Br—Br(气态) H—Br
键能/kJ·mol-1 436 200 a
则表中a= 。
17.(16分)煤、石油等传统能源使用时会污染环境,科学家们正积极寻找其他清洁能源作为替代品。根据所学知识,回答下列问题:
(1)下列反应中,属于放热反应的是 (填字母)。
A.灼热的碳与CO2反应 B.铝和氧化铁反应
C.CaCO3受热分解 D.锌与盐酸反应
(2)通常把拆开1 mol某化学键所需要吸收的能量看成该化学键的键能,键能用E表示。已知:
化学键 H—H O O O—H
E/(kJ·mol-1) 436 497.3 462.8
计算:2H2(g)+O2(g) 2H2O(g) ΔH= 。
(3)已知在25 ℃、101 kPa时:
Ⅰ.2Na(s)+O2(g) Na2O(s) ΔH=-412 kJ·mol-1
Ⅱ.2Na(s)+O2(g) Na2O2(s) ΔH=-511 kJ·mol-1
写出Na2O2与Na反应生成Na2O的热化学方程式: 。
(4)二甲醚(CH3OCH3)是重要的化工原料,可由CO和H2反应制得,反应的热化学方程式为2CO(g)+4H2(g) CH3OCH3(g)+H2O(g) ΔH=-206.0 kJ·mol-1,起始时向容器中充入2 mol CO和4 mol H2,某时刻测得该反应放出的热量为51.5 kJ,此时CO的转化率为 。
(5)某同学设计如图所示实验,探究反应中的能量变化。
(a) (b)
①利用实验装置(b)测定盐酸与NaOH溶液发生中和反应的反应热,若取50 mL 0.50 mol·L-1的盐酸,则还需加入 (填字母)。
A.1.0 g NaOH固体
B.50 mL 0.50 mol·L-1氨水
C.50 mL 0.55 mol·L-1 NaOH溶液
②分析下列操作可能对结果造成的影响。
将实验(a)中的铝片更换为等质量的铝粉后,释放出的能量将 (填“偏大”“偏小”或“不变”,下同);将实验(b)中玻璃搅拌器改为铁质搅拌器后,实验测得的ΔH 。
18.(15分)(1)S8分子可形成单斜硫和斜方硫,转化过程如下:S(单斜,s) S(斜方,s) ΔH=-0.398 kJ·mol-1,则常温下,S(单斜)与S(斜方)中较稳定的是 。
(2)0.3 mol C2H2(g)在O2(g)中完全燃烧生成CO2(g)和H2O(l),放出389.7 kJ热量,请写出表示C2H2燃烧热的热化学方程式: 。
(3)由N2O和NO反应生成N2和NO2的能量变化如图所示。则反应过程中,每生成2 mol N2理论上放出的热量为 。
(4)已知:C(石墨,s)+O2(g) CO2(g) ΔH1=-a kJ·mol-1;
H2(g)+O2(g) H2O(l) ΔH2=-b kJ·mol-1;
CH4(g)+2O2(g) CO2(g)+2H2O(l) ΔH3=-c kJ·mol-1。
计算C(石墨,s)与H2(g)反应生成1 mol CH4(g)的ΔH为 kJ·mol-1(用含a、b、c的式子表示)。
(5)由金红石(TiO2)制取单质Ti的步骤为TiO2 TiCl4 Ti。
已知:Ⅰ.C(s)+O2(g) CO2(g) ΔH=-393.5 kJ·mol-1
Ⅱ.2CO(g)+O2(g) 2CO2(g) ΔH=-566 kJ·mol-1
Ⅲ.TiO2(s)+2Cl2(g) TiCl4(s)+O2(g) ΔH=+141 kJ·mol-1
①TiO2(s)+2Cl2(g)+2C(s) TiCl4(s)+2CO(g)的ΔH= 。
②反应TiCl4+2Mg 2MgCl2+Ti在Ar气氛中进行的理由是 。
19.(15分)(1)一定条件下,由SO2和CO反应生成S和CO2的能量变化如图所示,每生成16 g S(s),该反应 (填“放出”或“吸收”)的热量为 kJ。
(2)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:
反应Ⅰ:2H2SO4(l) 2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应Ⅲ:S(s)+O2(g) SO2(g) ΔH3=-297 kJ·mol-1
反应Ⅱ的热化学方程式为 。
(3)为减少汽车尾气的污染,可采取NO和CO在催化转换器中发生如下反应:
2NO(g)+2CO(g) 2CO2(g)+N2(g) ΔH1;
已知:2NO(g)+O2(g) 2NO2(g) ΔH2;
CO(g)+O2(g) CO2(g) ΔH3;
NO2与CO发生反应的热化学方程式为2NO2(g)+4CO(g) 4CO2(g)+N2(g) ΔH= (用ΔH1、ΔH2、ΔH3表示)。
(4)工业上接触法生产硫酸的主要反应之一是在一定的温度、压强和钒催化剂存在的条件下,SO2被O2氧化为SO3。V2O5是钒催化剂的活性成分,其在对反应Ⅰ的催化循环过程中,经历了Ⅱ、Ⅲ两个反应阶段,图示如下:
反应Ⅱ、Ⅲ的化学方程式为 、 。
答案与分层梯度式解析
1.B 2.B 3.D 4.D 5.D 6.A 7.B 8.A
9.C 10.D 11.A 12.D 13.D 14.D 15.D
1.B B项涉及高温时碳与水蒸气的反应,此反应为吸热反应。
2.B ΔH=反应物断键吸收的总能量-生成物成键放出的总能量,设断裂1 mol 需要吸收x kJ的能量,ΔH=[(x+3×436)-6×391] kJ·mol-1=-92.4 kJ·mol-1,则x=945.6。
3.D 酸、碱混合前应分别测量其温度,A正确;酸、碱混合时,应将碱溶液一次性快速加入酸中,避免热量损失,B正确;在测定中和反应反应热的实验中,通过上下拉动玻璃搅拌器来使溶液充分反应,C正确;在测定中和反应反应热的实验中,一般NaOH溶液稍过量,用量筒取盐酸时若仰视读数,量得盐酸偏多,导致反应放出更多热量,ΔH为负值,放热越多ΔH越小,D错误。
4.D 反应是吸热还是放热与反应条件无关,而是取决于反应物和生成物能量的相对高低,A正确;已知4P(红磷,s) P4(白磷,s) ΔH>0,则白磷能量高于红磷,能量越低越稳定,红磷比白磷稳定,B正确;“冰,水为之,而寒于水”说明水结冰是一个放热过程,故等质量的水和冰相比,冰的能量更低,C正确;氢气的燃烧热为1 mol氢气完全燃烧生成液态水放出的热量,题给方程式中水为气态,则氢气的燃烧热不可能是241.8 kJ·mol-1,D错误。
5.D 中和反应为放热反应,则①NH3·H2O(aq)+H+(aq) N(aq)+H2O(l)为放热反应,ΔH1<0,A错误;由盖斯定律可知,反应②+2×反应④=反应③,则反应②=反应③-2×反应④,ΔH2=ΔH3-2×ΔH4,由于反应④为放热反应,ΔH4<0,所以ΔH2>ΔH3,B错误;根据盖斯定律可知,反应③=反应②+2×反应④,所以ΔH3=ΔH2+2ΔH4,C错误;反应①和反应④均为放热反应,且反应①中NH3·H2O的电离过程吸热,所以反应①放出的热量比反应④少,放热反应的焓变为负值,则ΔH1>ΔH4,D正确。
6.A 碳在氧气中燃烧为放热反应,等质量的碳燃烧生成CO2(g)放出的热量比生成CO(g)放出的热量多,放出的热量越多,焓变越小,即ΔH3<ΔH2,A错误;根据光照条件下,在催化剂(Nb2O5)表面发生反应:H2(g)+CO2(g) CO(g)+H2O(g),可得到能量转化方式主要为太阳能转化为化学能,B正确;根据盖斯定律,将③×2-②×2得2CO(g)+O2(g) 2CO2(g) ΔH=2(ΔH3-ΔH2),C正确;根据盖斯定律,将②-③+①×得H2(g)+CO2(g) CO(g)+H2O(g) ΔH=ΔH2-ΔH3+ΔH1,D正确。
7.B A项,该反应为放热反应,即E反应物>E生成物,错误;B项,该反应为吸热反应,即E反应物
9.C 很多物质溶解过程也是放热的,向题图1的试管A中加入某一固体和液体,若注射器的活塞右移,不能说明A中发生了放热反应,A错误;将题图1虚线框中的装置换为题图2装置,由于锌粒与稀硫酸反应生成H2,生成的H2可使注射器的活塞右移,所以若注射器的活塞右移,不能说明锌粒和稀硫酸的反应为放热反应,B错误;等质量气态硫的能量比固态硫的高,反应①放出的热量比反应②的多,放热反应的焓变为负值,因此ΔH1小于ΔH2,C正确;由题图3可知,ΔH2=ΔH1+ΔH3,D错误。
10.D 不管O2是否过量,S和O2反应都只生成SO2,不能直接生成SO3,A错误;反应生成BaSO4沉淀,会放出热量,故含0.5 mol H2SO4的稀溶液与足量Ba(OH)2溶液反应,放出的热量不是中和反应的反应热,B错误;SO2能使紫色石蕊试液变红但不褪色,C错误;据图可知,ⅰ.SO2(g)+H2O2(aq) H2SO4(aq) ΔH1,ⅱ.SO2(g)+O2(g) SO3(g) ΔH2,ⅲ.SO3(g)+H2O(l) H2SO4(aq) ΔH3,根据盖斯定律,(ⅰ-ⅱ-ⅲ)×2可得2H2O2(aq) 2H2O(l)+O2(g) ΔH=2[ΔH1-(ΔH2+ΔH3)],若ΔH1<ΔH2+ΔH3,则ΔH<0,为放热反应,D正确。
11.A ΔH=反应物的键能总和-生成物的键能总和,由题意Cl2(g)+F2(g) 2ClF(g) ΔH1=a kJ·mol-1;Cl2(g)+3F2(g) 2ClF3(g) ΔH2=b kJ·mol-1可知;ΔH1=(243+157-2×248) kJ·mol-1=-96 kJ·mol-1,ΔH2=(243+3×157-2×3x) kJ·mol-1=(714-6x) kJ·mol-1,即a=-96,b=714-6x,设参与反应Cl2(g)+F2(g) 2ClF(g)的Cl2的物质的量为m,则消耗的F2也为m,剩下的Cl2和F2正好发生反应Cl2(g)+3F2(g) 2ClF3(g),即=,解得m=1.5 mol,则1.5 mol Cl2发生反应Cl2(g)+F2(g) 2ClF(g),放热1.5 mol×96 kJ·mol-1=144 kJ,0.5 mol Cl2发生反应Cl2(g)+3F2(g) 2ClF3(g),放热303 kJ-144 kJ=159 kJ,即(714-6x) kJ·mol-1=- kJ·mol-1,解得x=172,故选A。
12.D 甲图中反应物的总能量比生成物的总能量高,为放热反应,与ΔH>0矛盾,A错误;C(s)完全燃烧生成二氧化碳,且应为放热反应,B错误;物质的量浓度相等的H2SO4、NaOH溶液混合,当V1=20,V2=40时硫酸与氢氧化钠恰好完全反应,放出热量最多,温度最高,与图像不符,C错误。
13.D 从反应1的能量变化图可看出反应物能量低,生成物能量高,Na2CO3·10H2O(s) Na2CO3·H2O(s)+9H2O(g)是吸热反应,ΔH1>0,A错误;失水过程有新物质生成,是化学变化,B错误;由反应1得①Na2CO3·10H2O(s) Na2CO3·H2O(s)+9H2O(g) ΔH1,由反应2得②Na2CO3·10H2O(s) Na2CO3(s)+10H2O(g),②-①得Na2CO3·H2O(s) Na2CO3(s)+H2O(g) ΔH=ΔH2-ΔH1,C错误;向Na2CO3(s)中滴加几滴水,Na2CO3(s)和水反应过程中会放热,温度升高,D正确。
14.D 根据盖斯定律,(①+②)×得:CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g) ΔH=-867 kJ·mol-1,标准状况下4.48 L CH4的物质的量为0.2 mol,放出的热量为0.2 mol×867 kJ·mol-1=173.4 kJ,A正确;由于液态水转化为气态水需要吸收热量,所以生成液态水的反应放出的热量多,放热越多,ΔH越小,即ΔH<-574 kJ·mol-1,B正确;反应①②中CH4均转化为CO2,相同物质的量的CH4发生反应,转移的电子数相同,C正确;因为没有指明气体所处的状况,4.48 L CH4的物质的量无法求算,转移电子数也无法计算,D错误。
15.D 设22 g CO2与375 mL 2 mol·L-1氢氧化钠溶液充分反应生成a mol Na2CO3、b mol NaHCO3,由碳原子守恒可得:a+b=,由钠原子守恒可得:2a+b=2×0.375,解得a=b=0.25,由反应放出x kJ热量可知,反应的热化学方程式为①2CO2(g)+3NaOH(aq) Na2CO3(aq)+NaHCO3(aq)+H2O(l) ΔH1=-=-4x kJ·mol-1,由1 mol CO2与1 L 2 mol·L-1氢氧化钠溶液充分反应放出y kJ热量可知,反应的热化学方程式为②CO2(g)+2NaOH(aq) Na2CO3(aq)+H2O(l) ΔH2=-y kJ·mol-1,由盖斯定律可知,反应①-②可得反应CO2(g)+NaOH(aq) NaHCO3(aq) ΔH=ΔH1-ΔH2=-(4x-y) kJ·mol-1。
16.答案 (每空3分)(1)放出 346
(2)369
解析 (1)N(aq)+O2(g) N(aq)+2H+(aq)+H2O(l) ΔH=-273 kJ·mol-1,N(aq)+O2(g) N(aq) ΔH=-73 kJ·mol-1,两式相加得到N(aq)+2O2(g) N(aq)+2H+(aq)+H2O(l) ΔH=-346 kJ·mol-1,则1 mol N(aq)全部被氧化成N(aq)放出的热量是346 kJ。
(2)H2(g)+Br2(l) 2HBr(g) ΔH1=-72 kJ·mol-1,Br2(l) Br2(g) ΔH2=+30 kJ·mol-1,则H2(g)+Br2(g) 2HBr(g) ΔH=ΔH1-ΔH2=-102 kJ·mol-1,ΔH=反应物的键能之和-生成物的键能之和=(436+200-2a) kJ·mol-1=-102 kJ·mol-1,解得a=369。
17.答案 (除标注外,每空2分)(1)BD
(2)-481.9 kJ·mol-1
(3)Na2O2(s)+2Na(s) 2Na2O(s) ΔH=-313 kJ·mol-1(3分)
(4)25%(3分)
(5)①C ②不变 偏大
解析 (1)灼热的碳与CO2的反应为吸热反应;铝热反应为放热反应;CaCO3受热分解的反应为吸热反应;活泼金属与酸的反应为放热反应;B、D符合题意。
(2)ΔH=反应物的键能之和-生成物键能之和=436 kJ·mol-1×2+497.3 kJ·mol-1-462.8 kJ·mol-1×4=-481.9 kJ·mol-1。
(3)由盖斯定律可知,反应Ⅰ×2-反应Ⅱ可得2Na(s)+Na2O2(s) 2Na2O(s) ΔH=(-412 kJ·mol-1)×2-(-511 kJ·mol-1)=-313 kJ·mol-1。
(4)由反应放出的热量为51.5 kJ可知,反应中一氧化碳的转化率为×100%=25%。
(5)①利用实验装置(b)测定盐酸与氢氧化钠溶液发生中和反应的反应热,若取50 mL 0.50 mol·L-1盐酸,应向盐酸中加入过量的氢氧化钠溶液,以确保盐酸完全反应,减少实验误差,最符合的为C项。②将实验(a)中的铝片更换为等质量的铝粉后,反应消耗铝的物质的量不变,反应释放出的能量不变;将实验(b)中玻璃搅拌器改为具有良好导热性的铁质搅拌器会造成热量散失,导致实验测得的ΔH偏大。
18.答案 (除标注外,每空2分)(1)S(斜方)
(2)C2H2(g)+O2(g) 2CO2(g)+H2O(l) ΔH=-1 299 kJ·mol-1
(3)278 kJ
(4)+(c-2b-a)(3分)
(5)①-80 kJ·mol-1(3分) ②防止高温下Mg、Ti与空气中的O2或N2作用(3分)
解析 (1)S(单斜,s) S(斜方,s) ΔH=-0.398 kJ·mol-1,说明S(单斜)比S(斜方)所具有的能量高,能量越低物质越稳定,所以S(单斜)与S(斜方)中较稳定的是S(斜方)。
(2)0.3 mol C2H2(g)在O2(g)中完全燃烧生成CO2(g)和H2O(l),放出389.7 kJ热量,则其燃烧热的热化学方程式为C2H2(g)+O2(g) 2CO2(g)+H2O(l) ΔH=-1 299 kJ·mol-1。
(3)根据能量变化图可知,热化学方程式为N2O(g)+NO(g) N2(g)+NO2(g) ΔH=209 kJ·mol-1-348 kJ·mol-1=-139 kJ·mol-1,则生成2 mol N2放出的热量为139 kJ·mol-1×2 mol=278 kJ。
(4)①C(石墨,s)+O2(g) CO2(g) ΔH1=-a kJ·mol-1;
②H2(g)+O2(g) H2O(l) ΔH2=-b kJ·mol-1;
③CH4(g)+2O2(g) CO2(g)+2H2O(l) ΔH3=-c kJ·mol-1;根据盖斯定律,①+②×2-③,得C(石墨,s)+2H2(g) CH4(g) ΔH=+(c-2b-a) kJ·mol-1。
(5)①根据盖斯定律,Ⅰ×2-Ⅱ+Ⅲ得TiO2(s)+2Cl2(g)+2C(s) TiCl4(s)+2CO(g) ΔH=-80 kJ·mol-1;②反应TiCl4+2Mg 2MgCl2+Ti在Ar气氛中进行的理由是防止高温下Mg、Ti与空气中的O2或N2作用。
19.答案 (除标注外,每空3分)(1)放出(1分) 135(2分)
(2)3SO2(g)+2H2O(g) 2H2SO4(l)+S(s) ΔH=-254 kJ·mol-1
(3)ΔH1-ΔH2+2ΔH3
(4)SO2+V2O5 V2O4·SO3 2(V2O4·SO3)+O2 2V2O5+2SO3
解析 (1)SO2和CO反应生成S和CO2:SO2(g)+2CO(g) S(s)+2CO2(g),由题图可知,每生成1 mol S(s)放出热量为(679-409) kJ=270 kJ,16 g S(s)的物质的量为0.5 mol,生成16 g S(s)放出热量为135 kJ。
(2)根据题图知,反应Ⅱ为3SO2(g)+2H2O(g) 2H2SO4(l)+S(s),根据盖斯定律可知-Ⅰ-Ⅲ即得3SO2(g)+2H2O(g) 2H2SO4(l)+S(s) ΔH=-(+551 kJ·mol-1)-(-297 kJ·mol-1)=-254 kJ·mol-1。
(3)根据给定的反应①2NO(g)+2CO(g) 2CO2(g)+N2(g) ΔH1;②2NO(g)+O2(g) 2NO2(g) ΔH2,③CO(g)+O2(g) CO2(g) ΔH3,由盖斯定律可知①-②+2×③可得2NO2(g)+4CO(g) 4CO2(g)+N2(g) ΔH=ΔH1-ΔH2+2ΔH3。
(4)反应Ⅱ生成V2O4·SO3,化学方程式为SO2+V2O5 V2O4·SO3,反应Ⅲ是V2O4·SO3与氧气反应生成V2O5和SO3,化学方程式为2(V2O4·SO3)+O2 2V2O5+2SO3。
