本章复习提升-《精讲精练》26版高中同步新教材化学人教A版(2019)选必修2
文档属性
| 名称 | 本章复习提升-《精讲精练》26版高中同步新教材化学人教A版(2019)选必修2 |  | |
| 格式 | docx | ||
| 文件大小 | 251.8KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-11 10:52:21 | ||
图片预览




文档简介
本章复习提升
易混易错练
易错点1 晶体类型判断错误导致比较晶体的熔、沸点时出错
1.下列判断正确的是( )
A.Na、K、Cs的熔点依次升高
B.熔点:I2>Cl2;沸点:PH3>NH3
C.熔点:SiO2>CO2;沸点:CH3CH2CH2CH2CH3>(CH3)2CHCH2CH3>C(CH3)4
D.单晶硅、CsCl、干冰的熔点依次升高
2.(1)下列晶体:①NaCl,②Na,③Si,④CS2,⑤金刚石,它们的熔点从低到高的顺序为 (填序号)。
(2)在H2、(NH4)2SO4、SiC、HF中,四种物质的熔点由低到高的顺序是
。
易错点2 对配位键理解不透彻导致判断错误
3.向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续滴加氨水,难溶物溶解得到深蓝色透明溶液。下列对此现象说法正确的是( )
A.反应前后c(Cu2+)不变
B.[Cu(NH3)4]SO4中配体为NH3,配位数为4
C.NH3与铜离子配合,形成配合物后H—N—H键角会变小
D.[Cu(NH3)4]2+中Cu2+提供孤电子对
4.甲醛能与[Zn(CN)4]2-的水溶液发生反应:[Zn(CN)4]2-+4H++4HCHO+4H2O4HOCH2CN+[Zn(H2O)4]2+。
下列说法错误的是( )
A.[Zn(CN)4]2-中由Zn2+提供空轨道,CN-提供孤电子对
B.H2O分子中的键角大于HCHO分子中的键角
C.CN-和H2O与Zn2+的配位能力:CN->H2O
D.[Zn(CN)4]2-和[Zn(H2O)4]2+中σ键数目之比为2∶3
易错点3 晶胞中计算错误
5.Mg2Si具有反萤石结构,晶胞结构如图所示,其晶胞参数为0.635nm。下列叙述错误的是( )
A.Si的配位数为8
B.紧邻的两个Mg原子的距离为nm
C.紧邻的两个Si原子间的距离为nm
D.该晶体的密度为g·cm-3
6.铪(Hf)的卤化物八面体离子是构建卤化物钙钛矿的基本发光单元,其构建的某晶胞结构如图所示。
(1)该晶胞中K+的配位数为 。
(2)该晶体的密度为ρg·cm-3,设阿伏加德罗常数的值为NA,则Hf—Hf最近距离为 nm。
思想方法练
建模思想在晶胞计算中的应用
方法概述
晶胞的相关计算常利用建模思想。如晶体密度的计算主要取决于晶胞体积的计算,通过建模思想建立起边长与晶胞粒子半径的关系,就可以顺利解决晶胞体积计算的问题。建模思想比较具体地体现了化学学科核心素养中的“证据推理与模型认知”。
1.常见的铜的硫化物有CuS和Cu2S两种。已知:晶胞中S2-的位置如图1所示,Cu2+或Cu+位于硫离子所构成的四面体中心,它们的晶胞具有相同的侧视图如图2所示。Cu2S的晶胞参数为apm,阿伏加德罗常数的值为NA。
图1 图2
下列说法正确的是( )
A.CuS、Cu2S晶胞的体心都有一个S2-
B.Cu2S晶胞中,Cu+填充了晶胞中一半四面体空隙
C.CuS晶胞中,S2-配位数为8
D.Cu2S晶体的密度为g·cm-3
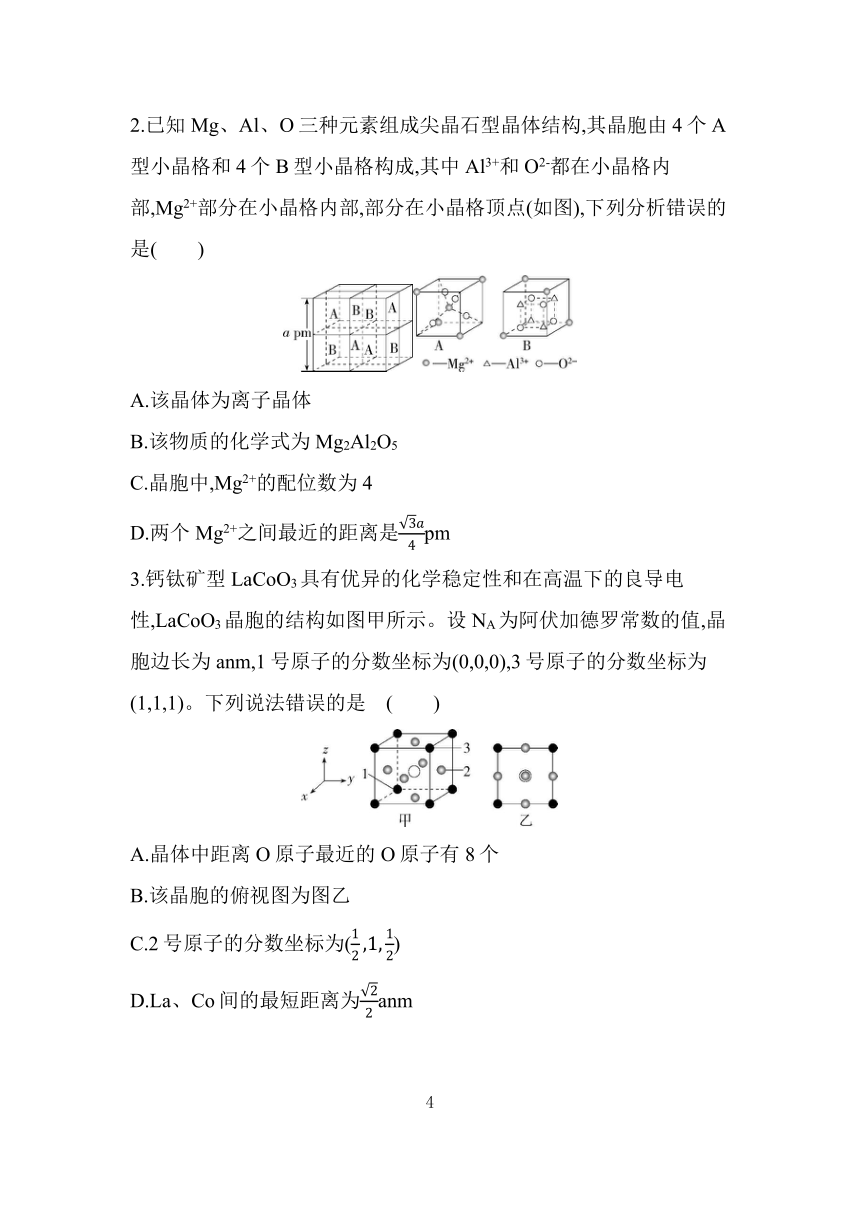
2.已知Mg、Al、O三种元素组成尖晶石型晶体结构,其晶胞由4个A型小晶格和4个B型小晶格构成,其中Al3+和O2-都在小晶格内部,Mg2+部分在小晶格内部,部分在小晶格顶点(如图),下列分析错误的是( )
A.该晶体为离子晶体
B.该物质的化学式为Mg2Al2O5
C.晶胞中,Mg2+的配位数为4
D.两个Mg2+之间最近的距离是pm
3.钙钛矿型LaCoO3具有优异的化学稳定性和在高温下的良导电性,LaCoO3晶胞的结构如图甲所示。设NA为阿伏加德罗常数的值,晶胞边长为anm,1号原子的分数坐标为(0,0,0),3号原子的分数坐标为(1,1,1)。下列说法错误的是 ( )
A.晶体中距离O原子最近的O原子有8个
B.该晶胞的俯视图为图乙
C.2号原子的分数坐标为()
D.La、Co间的最短距离为anm
4.镍酸镧电催化剂立方晶胞如图所示,晶胞参数为a,具有催化活性的是Ni,图①和图②是晶胞的不同切面。下列说法错误的是( )
A.催化活性:①>②
B.镍酸镧晶体的化学式为LaNiO3
C.La周围紧邻的O有4个
D.La和Ni的最短距离为a
镓是重要的战略金属。镓与氮的某种化合物的晶胞结构如图所示,晶胞参数为apm。下列说法错误的是( )
A.该物质的化学式为GaN
B.晶体结构中Ga的配位数为8
C.Ga原子与N原子之间的最短距离为apm
D.该晶体的密度为×1030g·cm-3
6.磷化铟(InP)是微电子和光电子的基础材料,其晶胞结构如图1所示,图2为晶胞沿z轴的1∶1平面投影图,已知图1中A球的原子坐标参数为(0,0,0),B球的原子坐标参数为(1,1,1)。下列说法错误的是( )
图1 图2
A.In的配位数是4
B.晶胞边长为2a
C.晶胞中离B球最远的灰球的坐标参数为()
D.晶胞中与In原子距离最近且相等的In原子有8个
7.硼氢化钠是一种常用的还原剂。其晶胞结构如图所示:
(1)该晶体中与B紧邻且等距的Na+有 个。标注为“1”的Na+的分数坐标为 。
(2)已知硼氢化钠晶体的密度为ρg·cm-3,设NA代表阿伏加德罗常数的值,则a= (用含ρ、NA的代数式表示)。
(3)若硼氢化钠晶胞上下底面的面心处的Na+被Li+取代,得到的晶体的化学式为 。
8.NaF等氟化物可以做光导纤维材料,一定条件下,NaF的晶胞结构如图。
(1)与F-距离最近且相等的Na+有 个,与F-距离最近且相等的F-有 个。
(2)设NA表示阿伏加德罗常数的值。NaF晶胞为正方体,边长为anm,则晶体的摩尔体积Vm= m3·mol-1。(1nm=10-9m)
(3)由Al元素和N元素形成的某种化合物的晶胞如图所示,已知N原子位于晶胞体对角线的处。假设该化合物晶体的密度为ρg·cm-3,NA为阿伏加德罗常数的值,则晶胞中相距最近的两个N原子之间的距离为 。
答案与分层梯度式解析
本章复习提升
易混易错练
1.C Na、K、Cs的熔点依次降低,A错误。结构相似的分子晶体,一般相对分子质量越大,熔、沸点越高,所以熔点:I2>Cl2;由于NH3存在分子间氢键,故沸点:NH3>PH3,B错误。SiO2是共价晶体,CO2是分子晶体,熔点:SiO2>CO2;碳原子数相同的烷烃,支链越多,沸点越低,则沸点:CH3CH2CH2CH2CH3>(CH3)2CHCH2CH3>C(CH3)4,C正确。一般来说晶体的熔点:共价晶体>离子晶体>分子晶体,单晶硅、CsCl、干冰的熔点依次降低,D错误。
易错分析
晶体的熔点一般是共价晶体>离子晶体>分子晶体;同类型晶体比较熔点高低时,共价晶体一般根据原子半径大小判断;分子晶体看范德华力和氢键;离子晶体看离子键强弱;金属晶体看金属键强弱。
2.答案 (1)④<②<①<③<⑤ (2)H2解析 (1)①NaCl属于离子晶体,在常温下是固体;②Na属于熔点较低的金属晶体,在常温下是固体;③Si属于共价晶体,在常温下是固体;④CS2属于分子晶体,在常温下是液体;⑤金刚石属于共价晶体,在常温下是固体,碳原子的半径小于硅原子,故金刚石的熔点高于晶体硅。在通常情况下,共价晶体的熔点高于离子晶体、离子晶体的熔点高于分子晶体。综上所述,它们的熔点从低到高的顺序为④<②<①<③<⑤。(2)H2属于分子晶体,在常温下是气体;(NH4)2SO4属于离子晶体,在常温下是固体;SiC属于共价晶体,在常温下是固体;HF属于分子晶体,其分子间可以形成氢键,在常温下是气体。在分子晶体中,一般相对分子质量越大,其熔点越高,存在分子间氢键的,其熔点较高。在通常情况下,共价晶体的熔点高于离子晶体、离子晶体的熔点高于分子晶体。因此,四种物质的熔点由低到高的顺序是H23.B 反应生成了[Cu(NH3)4]SO4,c(Cu2+)减小,A错误;[Cu(NH3)4]SO4中配体为NH3,配位数为4,B正确;形成配合物后,氮原子没有孤电子对,H—N—H键角会变大,C错误;[Cu(NH3)4]2+中Cu2+提供空轨道,D错误。
易错分析
对配位键理解不透彻导致的常见错误
(1)忽视配位键属于σ键,在计算配合物中σ键的数目时造成错误。
(2)忽视配位化合物中内界的离子不易电离,进行相关离子检验时造成错误。
(3)忽视配体在形成配位键后,孤电子对形成σ键后对微粒中键角的影响造成错误。
4.B [Zn(CN)4]2-中由Zn2+提供空轨道,CN-提供孤电子对形成配位键,A正确;H2O分子中心原子O采用sp3杂化,有两个孤电子对,键角为105°,HCHO分子中心原子C采用sp2杂化,键角约为120°,键角前者小于后者,B错误;CN-中碳原子电负性小,更容易给出孤电子对,则CN-和H2O与Zn2+的配位能力:CN->H2O,C正确;[Zn(CN)4]2-中含有4+4=8个σ键,[Zn(H2O)4]2+中含有4+4×2=12个σ键,σ键数目之比为2∶3,D正确。
5.D 一个Si原子周围距离最近且相等的Mg原子有8个,Si原子的配位数为8,A正确;紧邻的两个镁原子的距离是晶胞参数的一半,该距离为nm,B正确;紧邻的两个硅原子间的距离是面对角线长的一半,该距离为nm,C正确;该晶胞含有4个“Mg2Si”,晶体的密度为g·cm-3,D错误。
易错分析
本题对晶胞结构分析不到位,会造成计算粒子间的距离时出现错误。根据晶胞结构分析,紧邻的两个镁原子的距离是晶胞棱长的一半,紧邻的两个硅原子间的距离是面对角线长的一半。
6.答案 (1)4
(2)×107
解析 (1)根据晶胞结构可知,该晶胞中8个K+位于体内,[HfBr6]2-位于顶点和面心,含有[HfBr6]2-的个数为8×=4个,K+的配位数为4。
(2)一个晶胞的质量为g,设晶胞参数为anm,晶胞的体积为(a×10-7cm)3,则ρ=,解得a=×107,Hf—Hf最近距离等于面对角线长的一半,为×107nm。
思想方法练
1.D 根据题图可知S2-位于立方体的顶点和面心,体心没有,A错误;晶胞中S2-的个数为6×=4,化学式为Cu2S,则Cu+的个数为8,所以占据了8个四面体空隙,即全部的四面体空隙,B错误;CuS晶胞中Cu2+位于四面体空隙中,所以Cu2+的配位数为4,化学式为CuS,所以S2-配位数也为4,C错误;Cu2S晶胞的质量为g,晶胞的体积为a3pm3=a3×10-30cm3,所以密度为g·cm-3,D正确。
方法点津
根据晶胞中含有的粒子数确定晶胞的质量,再根据晶胞的体积求出晶体的密度。
2.B 该晶体由Mg2+、Al3+与通过离子键形成,为离子晶体,A正确;由题图分析可知,1个A型晶格中有4个Mg2+在顶点,1个在体心,1个A中的Mg2+个数为1+4×,1个B型晶格中有4个Mg2+在顶点,1个B中的Mg2+个数为4×,则该晶胞中Mg2+个数为×4=8;1个A型晶格和1个B型晶格中均含有4个O2-,则个数为4×8=32,每个B型晶格中含有4个Al3+,Al3+的个数为4×4=16,该物质的化学式为MgAl2O4,B错误;由A型晶格结构可知每个Mg2+与4个O2-相邻,其配位数为4,C正确;两个Mg2+之间最近的距离是A型晶格结构中体心与顶点的距离,A型晶格的边长为pm,体对角线长为pm,两个Mg2+之间最近的距离是该晶格体对角线长的一半,即pm,D正确。
方法点津
利用建模思想进行分析,先根据A型小晶格和B型小晶格构成分析出尖晶石型晶体结构中两个Mg2+之间最近的距离是A型晶格结构中体心与顶点的距离,据此分析解答D项。
3.D LaCoO3中粒子数目La∶Co∶O=1∶1∶3,则面心位置的是O原子,故晶体中离O原子最近的O原子有8个,A正确;根据图甲,从上方俯视,该晶胞的俯视图与图乙一致,B正确;1号原子的分数坐标为(0,0,0),3号原子的分数坐标为(1,1,1),则可推出2号原子的分数坐标为(),C正确;La、Co之间的最短距离是立方晶胞体对角线长的一半,即anm,D错误。
4.C 具有催化活性的是Ni,图②中没有Ni原子,则催化活性:①>②,A正确;镍酸镧电催化剂立方晶胞中La的数目为1,O的数目为12×=3,Ni的数目为8×=1,镍酸镧晶体的化学式为LaNiO3,B正确;La在晶胞体心,O在晶胞的棱心,则La周围紧邻的O有12个,C错误;由晶胞结构可知,La和Ni的最短距离为体对角线长的一半,为a,D正确。
5.B 该晶胞中,Ga的个数为8×=4,N的个数为4,则该物质的化学式为GaN,A正确;晶体结构中Ga位于顶点和面心,配位数为4,B错误;Ga原子与N原子之间的最短距离为体对角线长的,即apm,C正确;该晶体的密度为×1030g·cm-3,D正确。
6.D 根据题图1可知,与In原子距离相等且最近的P原子有4个,故In的配位数是4,A正确;根据图示可知,晶胞面对角线长的为a,则晶胞的边长为a,B正确;晶胞中离B球最远的灰球为左下角的灰球,坐标参数为(),C正确;晶胞中离In原子距离相等且最近的In原子数目为=12,D错误。
7.答案 (1)8 (1,×107 (3)Na3Li(BH4)4
解析 (1)以体心的B为研究对象,与之紧邻且等距的Na+位于晶胞棱的棱心、晶胞中上面立方体左右面的面心、晶胞中下面立方体前后面的面心,与B紧邻且等距的Na+有8个。标注为“1”的Na+在上面立方体右侧面的面心,分数坐标为(1,)。
(2)晶胞中B的数目为1+8×=4,Na+的数目为6×,解得a=×107。
(3)若硼氢化钠晶胞上下底面的面心处的Na+被Li+取代,得到的晶体的化学式为Na3Li(BH4)4。
方法点津
晶体中原子的分数坐标确定方法
(1)明确坐标原点位置及三维空间坐标方向;(2)分析已知坐标原子和待求坐标原子的相对位置;(3)确定待求坐标的原子与坐标原点的空间位置;(4)按(x、y、z)顺序写出待求原子的分数坐标。
8.答案 (1)6 12 (2)cm
解析 (1)由题图可知,与体心F-距离最近且相等的Na+共有6个,与F-距离最近且相等的F-在同层、上下层各有4个,共12个。
(2)晶胞中Na+个数为8×=4、F-个数为12×+1=4,则晶体的摩尔体积Vm=m3·mol-1。
(3)晶胞中相距最近的两个N原子之间的距离为晶胞面对角线长的一半。1个晶胞中含有4个N原子、4个Al原子,设晶胞边长为acm,则晶体的密度ρg·cm-3=g·cm-3,解得a=,则相距最近的两个N原子之间的距离为cm。
44
易混易错练
易错点1 晶体类型判断错误导致比较晶体的熔、沸点时出错
1.下列判断正确的是( )
A.Na、K、Cs的熔点依次升高
B.熔点:I2>Cl2;沸点:PH3>NH3
C.熔点:SiO2>CO2;沸点:CH3CH2CH2CH2CH3>(CH3)2CHCH2CH3>C(CH3)4
D.单晶硅、CsCl、干冰的熔点依次升高
2.(1)下列晶体:①NaCl,②Na,③Si,④CS2,⑤金刚石,它们的熔点从低到高的顺序为 (填序号)。
(2)在H2、(NH4)2SO4、SiC、HF中,四种物质的熔点由低到高的顺序是
。
易错点2 对配位键理解不透彻导致判断错误
3.向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续滴加氨水,难溶物溶解得到深蓝色透明溶液。下列对此现象说法正确的是( )
A.反应前后c(Cu2+)不变
B.[Cu(NH3)4]SO4中配体为NH3,配位数为4
C.NH3与铜离子配合,形成配合物后H—N—H键角会变小
D.[Cu(NH3)4]2+中Cu2+提供孤电子对
4.甲醛能与[Zn(CN)4]2-的水溶液发生反应:[Zn(CN)4]2-+4H++4HCHO+4H2O4HOCH2CN+[Zn(H2O)4]2+。
下列说法错误的是( )
A.[Zn(CN)4]2-中由Zn2+提供空轨道,CN-提供孤电子对
B.H2O分子中的键角大于HCHO分子中的键角
C.CN-和H2O与Zn2+的配位能力:CN->H2O
D.[Zn(CN)4]2-和[Zn(H2O)4]2+中σ键数目之比为2∶3
易错点3 晶胞中计算错误
5.Mg2Si具有反萤石结构,晶胞结构如图所示,其晶胞参数为0.635nm。下列叙述错误的是( )
A.Si的配位数为8
B.紧邻的两个Mg原子的距离为nm
C.紧邻的两个Si原子间的距离为nm
D.该晶体的密度为g·cm-3
6.铪(Hf)的卤化物八面体离子是构建卤化物钙钛矿的基本发光单元,其构建的某晶胞结构如图所示。
(1)该晶胞中K+的配位数为 。
(2)该晶体的密度为ρg·cm-3,设阿伏加德罗常数的值为NA,则Hf—Hf最近距离为 nm。
思想方法练
建模思想在晶胞计算中的应用
方法概述
晶胞的相关计算常利用建模思想。如晶体密度的计算主要取决于晶胞体积的计算,通过建模思想建立起边长与晶胞粒子半径的关系,就可以顺利解决晶胞体积计算的问题。建模思想比较具体地体现了化学学科核心素养中的“证据推理与模型认知”。
1.常见的铜的硫化物有CuS和Cu2S两种。已知:晶胞中S2-的位置如图1所示,Cu2+或Cu+位于硫离子所构成的四面体中心,它们的晶胞具有相同的侧视图如图2所示。Cu2S的晶胞参数为apm,阿伏加德罗常数的值为NA。
图1 图2
下列说法正确的是( )
A.CuS、Cu2S晶胞的体心都有一个S2-
B.Cu2S晶胞中,Cu+填充了晶胞中一半四面体空隙
C.CuS晶胞中,S2-配位数为8
D.Cu2S晶体的密度为g·cm-3
2.已知Mg、Al、O三种元素组成尖晶石型晶体结构,其晶胞由4个A型小晶格和4个B型小晶格构成,其中Al3+和O2-都在小晶格内部,Mg2+部分在小晶格内部,部分在小晶格顶点(如图),下列分析错误的是( )
A.该晶体为离子晶体
B.该物质的化学式为Mg2Al2O5
C.晶胞中,Mg2+的配位数为4
D.两个Mg2+之间最近的距离是pm
3.钙钛矿型LaCoO3具有优异的化学稳定性和在高温下的良导电性,LaCoO3晶胞的结构如图甲所示。设NA为阿伏加德罗常数的值,晶胞边长为anm,1号原子的分数坐标为(0,0,0),3号原子的分数坐标为(1,1,1)。下列说法错误的是 ( )
A.晶体中距离O原子最近的O原子有8个
B.该晶胞的俯视图为图乙
C.2号原子的分数坐标为()
D.La、Co间的最短距离为anm
4.镍酸镧电催化剂立方晶胞如图所示,晶胞参数为a,具有催化活性的是Ni,图①和图②是晶胞的不同切面。下列说法错误的是( )
A.催化活性:①>②
B.镍酸镧晶体的化学式为LaNiO3
C.La周围紧邻的O有4个
D.La和Ni的最短距离为a
镓是重要的战略金属。镓与氮的某种化合物的晶胞结构如图所示,晶胞参数为apm。下列说法错误的是( )
A.该物质的化学式为GaN
B.晶体结构中Ga的配位数为8
C.Ga原子与N原子之间的最短距离为apm
D.该晶体的密度为×1030g·cm-3
6.磷化铟(InP)是微电子和光电子的基础材料,其晶胞结构如图1所示,图2为晶胞沿z轴的1∶1平面投影图,已知图1中A球的原子坐标参数为(0,0,0),B球的原子坐标参数为(1,1,1)。下列说法错误的是( )
图1 图2
A.In的配位数是4
B.晶胞边长为2a
C.晶胞中离B球最远的灰球的坐标参数为()
D.晶胞中与In原子距离最近且相等的In原子有8个
7.硼氢化钠是一种常用的还原剂。其晶胞结构如图所示:
(1)该晶体中与B紧邻且等距的Na+有 个。标注为“1”的Na+的分数坐标为 。
(2)已知硼氢化钠晶体的密度为ρg·cm-3,设NA代表阿伏加德罗常数的值,则a= (用含ρ、NA的代数式表示)。
(3)若硼氢化钠晶胞上下底面的面心处的Na+被Li+取代,得到的晶体的化学式为 。
8.NaF等氟化物可以做光导纤维材料,一定条件下,NaF的晶胞结构如图。
(1)与F-距离最近且相等的Na+有 个,与F-距离最近且相等的F-有 个。
(2)设NA表示阿伏加德罗常数的值。NaF晶胞为正方体,边长为anm,则晶体的摩尔体积Vm= m3·mol-1。(1nm=10-9m)
(3)由Al元素和N元素形成的某种化合物的晶胞如图所示,已知N原子位于晶胞体对角线的处。假设该化合物晶体的密度为ρg·cm-3,NA为阿伏加德罗常数的值,则晶胞中相距最近的两个N原子之间的距离为 。
答案与分层梯度式解析
本章复习提升
易混易错练
1.C Na、K、Cs的熔点依次降低,A错误。结构相似的分子晶体,一般相对分子质量越大,熔、沸点越高,所以熔点:I2>Cl2;由于NH3存在分子间氢键,故沸点:NH3>PH3,B错误。SiO2是共价晶体,CO2是分子晶体,熔点:SiO2>CO2;碳原子数相同的烷烃,支链越多,沸点越低,则沸点:CH3CH2CH2CH2CH3>(CH3)2CHCH2CH3>C(CH3)4,C正确。一般来说晶体的熔点:共价晶体>离子晶体>分子晶体,单晶硅、CsCl、干冰的熔点依次降低,D错误。
易错分析
晶体的熔点一般是共价晶体>离子晶体>分子晶体;同类型晶体比较熔点高低时,共价晶体一般根据原子半径大小判断;分子晶体看范德华力和氢键;离子晶体看离子键强弱;金属晶体看金属键强弱。
2.答案 (1)④<②<①<③<⑤ (2)H2
易错分析
对配位键理解不透彻导致的常见错误
(1)忽视配位键属于σ键,在计算配合物中σ键的数目时造成错误。
(2)忽视配位化合物中内界的离子不易电离,进行相关离子检验时造成错误。
(3)忽视配体在形成配位键后,孤电子对形成σ键后对微粒中键角的影响造成错误。
4.B [Zn(CN)4]2-中由Zn2+提供空轨道,CN-提供孤电子对形成配位键,A正确;H2O分子中心原子O采用sp3杂化,有两个孤电子对,键角为105°,HCHO分子中心原子C采用sp2杂化,键角约为120°,键角前者小于后者,B错误;CN-中碳原子电负性小,更容易给出孤电子对,则CN-和H2O与Zn2+的配位能力:CN->H2O,C正确;[Zn(CN)4]2-中含有4+4=8个σ键,[Zn(H2O)4]2+中含有4+4×2=12个σ键,σ键数目之比为2∶3,D正确。
5.D 一个Si原子周围距离最近且相等的Mg原子有8个,Si原子的配位数为8,A正确;紧邻的两个镁原子的距离是晶胞参数的一半,该距离为nm,B正确;紧邻的两个硅原子间的距离是面对角线长的一半,该距离为nm,C正确;该晶胞含有4个“Mg2Si”,晶体的密度为g·cm-3,D错误。
易错分析
本题对晶胞结构分析不到位,会造成计算粒子间的距离时出现错误。根据晶胞结构分析,紧邻的两个镁原子的距离是晶胞棱长的一半,紧邻的两个硅原子间的距离是面对角线长的一半。
6.答案 (1)4
(2)×107
解析 (1)根据晶胞结构可知,该晶胞中8个K+位于体内,[HfBr6]2-位于顶点和面心,含有[HfBr6]2-的个数为8×=4个,K+的配位数为4。
(2)一个晶胞的质量为g,设晶胞参数为anm,晶胞的体积为(a×10-7cm)3,则ρ=,解得a=×107,Hf—Hf最近距离等于面对角线长的一半,为×107nm。
思想方法练
1.D 根据题图可知S2-位于立方体的顶点和面心,体心没有,A错误;晶胞中S2-的个数为6×=4,化学式为Cu2S,则Cu+的个数为8,所以占据了8个四面体空隙,即全部的四面体空隙,B错误;CuS晶胞中Cu2+位于四面体空隙中,所以Cu2+的配位数为4,化学式为CuS,所以S2-配位数也为4,C错误;Cu2S晶胞的质量为g,晶胞的体积为a3pm3=a3×10-30cm3,所以密度为g·cm-3,D正确。
方法点津
根据晶胞中含有的粒子数确定晶胞的质量,再根据晶胞的体积求出晶体的密度。
2.B 该晶体由Mg2+、Al3+与通过离子键形成,为离子晶体,A正确;由题图分析可知,1个A型晶格中有4个Mg2+在顶点,1个在体心,1个A中的Mg2+个数为1+4×,1个B型晶格中有4个Mg2+在顶点,1个B中的Mg2+个数为4×,则该晶胞中Mg2+个数为×4=8;1个A型晶格和1个B型晶格中均含有4个O2-,则个数为4×8=32,每个B型晶格中含有4个Al3+,Al3+的个数为4×4=16,该物质的化学式为MgAl2O4,B错误;由A型晶格结构可知每个Mg2+与4个O2-相邻,其配位数为4,C正确;两个Mg2+之间最近的距离是A型晶格结构中体心与顶点的距离,A型晶格的边长为pm,体对角线长为pm,两个Mg2+之间最近的距离是该晶格体对角线长的一半,即pm,D正确。
方法点津
利用建模思想进行分析,先根据A型小晶格和B型小晶格构成分析出尖晶石型晶体结构中两个Mg2+之间最近的距离是A型晶格结构中体心与顶点的距离,据此分析解答D项。
3.D LaCoO3中粒子数目La∶Co∶O=1∶1∶3,则面心位置的是O原子,故晶体中离O原子最近的O原子有8个,A正确;根据图甲,从上方俯视,该晶胞的俯视图与图乙一致,B正确;1号原子的分数坐标为(0,0,0),3号原子的分数坐标为(1,1,1),则可推出2号原子的分数坐标为(),C正确;La、Co之间的最短距离是立方晶胞体对角线长的一半,即anm,D错误。
4.C 具有催化活性的是Ni,图②中没有Ni原子,则催化活性:①>②,A正确;镍酸镧电催化剂立方晶胞中La的数目为1,O的数目为12×=3,Ni的数目为8×=1,镍酸镧晶体的化学式为LaNiO3,B正确;La在晶胞体心,O在晶胞的棱心,则La周围紧邻的O有12个,C错误;由晶胞结构可知,La和Ni的最短距离为体对角线长的一半,为a,D正确。
5.B 该晶胞中,Ga的个数为8×=4,N的个数为4,则该物质的化学式为GaN,A正确;晶体结构中Ga位于顶点和面心,配位数为4,B错误;Ga原子与N原子之间的最短距离为体对角线长的,即apm,C正确;该晶体的密度为×1030g·cm-3,D正确。
6.D 根据题图1可知,与In原子距离相等且最近的P原子有4个,故In的配位数是4,A正确;根据图示可知,晶胞面对角线长的为a,则晶胞的边长为a,B正确;晶胞中离B球最远的灰球为左下角的灰球,坐标参数为(),C正确;晶胞中离In原子距离相等且最近的In原子数目为=12,D错误。
7.答案 (1)8 (1,×107 (3)Na3Li(BH4)4
解析 (1)以体心的B为研究对象,与之紧邻且等距的Na+位于晶胞棱的棱心、晶胞中上面立方体左右面的面心、晶胞中下面立方体前后面的面心,与B紧邻且等距的Na+有8个。标注为“1”的Na+在上面立方体右侧面的面心,分数坐标为(1,)。
(2)晶胞中B的数目为1+8×=4,Na+的数目为6×,解得a=×107。
(3)若硼氢化钠晶胞上下底面的面心处的Na+被Li+取代,得到的晶体的化学式为Na3Li(BH4)4。
方法点津
晶体中原子的分数坐标确定方法
(1)明确坐标原点位置及三维空间坐标方向;(2)分析已知坐标原子和待求坐标原子的相对位置;(3)确定待求坐标的原子与坐标原点的空间位置;(4)按(x、y、z)顺序写出待求原子的分数坐标。
8.答案 (1)6 12 (2)cm
解析 (1)由题图可知,与体心F-距离最近且相等的Na+共有6个,与F-距离最近且相等的F-在同层、上下层各有4个,共12个。
(2)晶胞中Na+个数为8×=4、F-个数为12×+1=4,则晶体的摩尔体积Vm=m3·mol-1。
(3)晶胞中相距最近的两个N原子之间的距离为晶胞面对角线长的一半。1个晶胞中含有4个N原子、4个Al原子,设晶胞边长为acm,则晶体的密度ρg·cm-3=g·cm-3,解得a=,则相距最近的两个N原子之间的距离为cm。
44
