综合拔高练-《精讲精练》26版高中同步新教材化学人教A版(2019)选必修2
文档属性
| 名称 | 综合拔高练-《精讲精练》26版高中同步新教材化学人教A版(2019)选必修2 |  | |
| 格式 | docx | ||
| 文件大小 | 879.7KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-11 10:52:21 | ||
图片预览




文档简介
综合拔高练
高考真题练
考点1 晶胞中粒子数目的计算
1.(高考组合)按要求填空:
(1)(2023北京,15节选)MgS2O3·6H2O的晶胞形状为长方体,边长分别为anm、bnm、cnm,结构如图所示。
晶胞中的[Mg(H2O)6]2+个数为 。
(2)(2023全国乙,35节选)一种硼镁化合物具有超导性能,晶体结构属于六方晶系,其晶体结构、晶胞沿c轴的投影图如图所示,晶胞中含有 个Mg。该物质化学式为 。
2.(2022山东,16节选)研究笼形包合物结构和性质具有重要意义,化学式为Ni(CN)x·Zn(NH3)y·zC6H6的笼形包合物四方晶胞结构如图所示(H原子未画出),每个苯环只有一半属于该晶胞,晶胞参数为a=b≠c,α=β=γ=90°。回答下列问题:
晶胞中N原子均参与形成配位键,Ni2+与Zn2+的配位数之比为 ;x∶y∶z= ;晶胞中有d轨道参与杂化的金属离子是 。
3.(高考组合)(1)(2024浙江1月选考,17节选)氮和氧是构建化合物的常见元素。某化合物的晶胞如图,其化学式是 ,晶体类型是 。
(2)(2021天津,13节选)用X射线衍射测定,得到Fe的两种晶胞A、B,其结构如图所示。晶胞A中每个Fe原子紧邻的原子数为 。每个晶胞B中含Fe原子数为 。
(3)(2021山东,16节选)XeF2晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,该晶胞中有 个XeF2分子。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点原子的分数坐标为()。已知Xe—F键长为rpm,则B点原子的分数坐标为 。
考点2 金属晶体的结构
4.(2024湖北,11)黄金按质量分数分级,纯金为24K。Au-Cu合金的三种晶胞结构如图,Ⅰ、Ⅱ和Ⅲ是立方晶胞。下列说法错误的是( )
A.Ⅰ为18K金
B.Ⅱ中Au的配位数是12
C.Ⅲ中最小核间距Au—CuD.Ⅰ、Ⅱ、Ⅲ中,Au与Cu原子个数比依次为1∶1、1∶3、3∶1
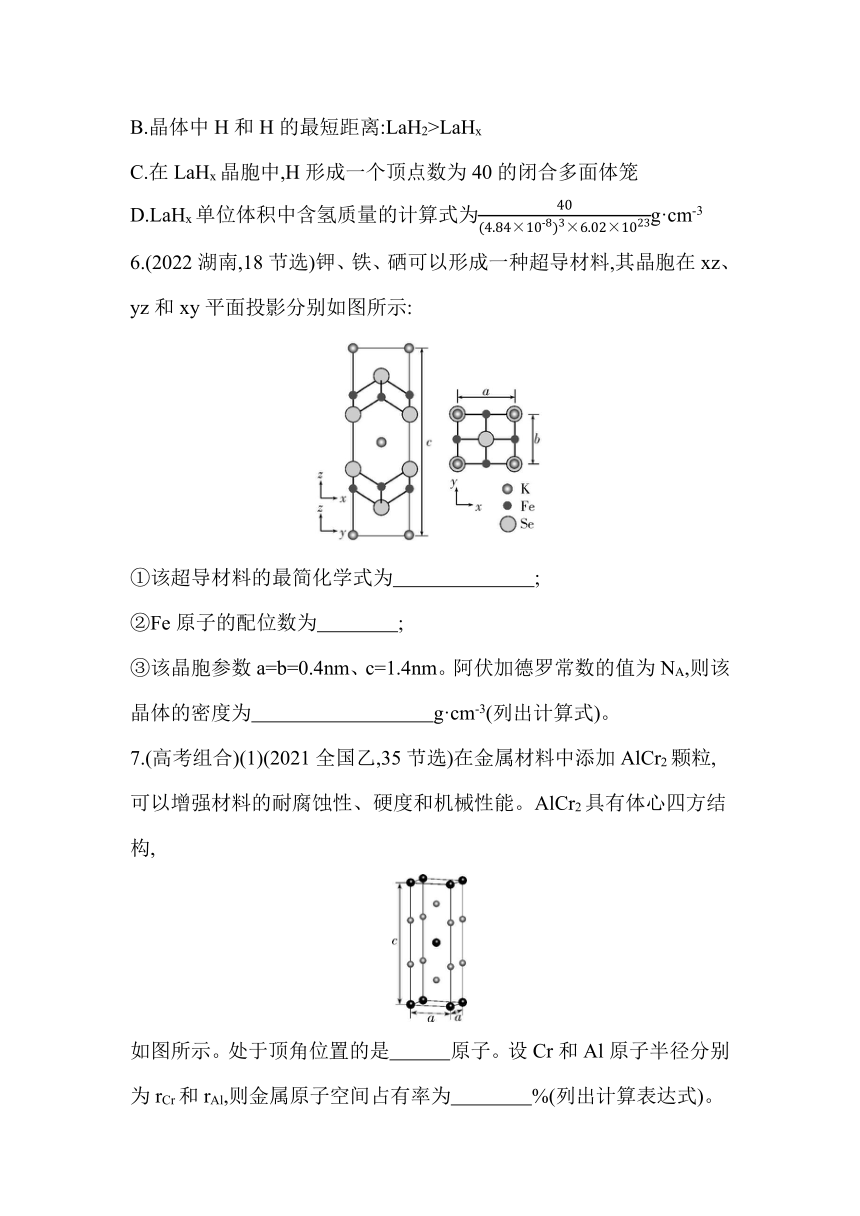
5.(2023湖北,15)镧La和H可以形成一系列晶体材料LaHn,在储氢和超导等领域具有重要应用。LaHn属于立方晶系,晶胞结构和参数如图所示。高压下,LaH2中的每个H结合4个H形成类似CH4的结构,即得到晶体LaHx。下列说法错误的是( )
A.LaH2晶体中La的配位数为8
B.晶体中H和H的最短距离:LaH2>LaHx
C.在LaHx晶胞中,H形成一个顶点数为40的闭合多面体笼
D.LaHx单位体积中含氢质量的计算式为g·cm-3
6.(2022湖南,18节选)钾、铁、硒可以形成一种超导材料,其晶胞在xz、yz和xy平面投影分别如图所示:
①该超导材料的最简化学式为 ;
②Fe原子的配位数为 ;
③该晶胞参数a=b=0.4nm、c=1.4nm。阿伏加德罗常数的值为NA,则该晶体的密度为 g·cm-3(列出计算式)。
7.(高考组合)(1)(2021全国乙,35节选)在金属材料中添加AlCr2颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。AlCr2具有体心四方结构,
如图所示。处于顶角位置的是 原子。设Cr和Al原子半径分别为rCr和rAl,则金属原子空间占有率为 %(列出计算表达式)。
(2)(2021广东,20节选)理论计算预测,由汞(Hg)、锗(Ge)、锑(Sb)形成的一种新物质X为潜在的拓扑绝缘体材料。X的晶体可视为Ge晶体(晶胞如图a所示)中部分Ge原子被Hg和Sb取代后形成。
①图b为Ge晶胞中部分Ge原子被Hg和Sb取代后形成的一种单元结构,它不是晶胞单元,理由是 。
②图c为X的晶胞,X的晶体中与Hg距离最近的Sb的数目为 ;该晶胞中粒子个数比Hg∶Ge∶Sb= 。
③设X的最简式的式量为Mr,则X晶体的密度为 g/cm3(列出算式)。
考点3 离子晶体的结构
8.(2024黑吉辽,14)某锂离子电池电极材料结构如图。结构1是钴硫化物晶胞的一部分,可代表其组成和结构;晶胞2是充电后的晶胞结构;所有晶胞均为立方晶胞。下列说法错误的是( )
A.结构1钴硫化物的化学式为Co9S8
B.晶胞2中S与S的最短距离为a
C.晶胞2中距Li最近的S有4个
D.晶胞2和晶胞3表示同一晶体
9.(2023湖南,11)科学家合成了一种高温超导材料,其晶胞结构如图所示,该立方晶胞参数为apm。阿伏加德罗常数的值为NA。下列说法错误的是 ( )
A.晶体最简化学式为KCaB6C6
B.晶体中与K+最近且距离相等的Ca2+有8个
C.晶胞中B和C原子构成的多面体有12个面
D.晶体的密度为g·cm-3
考点4 晶体的相关计算
10.(2023辽宁,14)晶体结构的缺陷美与对称美同样受关注。某富锂超离子导体的晶胞是立方体(图1),进行镁离子取代及卤素共掺杂后,可获得高性能固体电解质材料(图2)。下列说法错误的是( )
A.图1晶体密度为72.5/(NA×a3×10-30)g·cm-3
B.图1中O原子的配位数为6
C.图2表示的化学式为LiMg2OClxBr1-x
D.Mg2+取代产生的空位有利于Li+传导
11.(高考组合)按要求填空:
(1)(2024全国甲,35节选)结晶型PbS可作为放射性探测器元件材料,其立方晶胞如图所示。其中Pb的配位数为 。设NA为阿伏加德罗常数的值,则该晶体密度为 g·cm-3(列出计算式)。
(2)(2024广东,18节选)一种含Ga、Ni、Co元素的记忆合金的晶体结构可描述为Ga与Ni交替填充在Co构成的立方体体心,形成如图所示的结构单元。该合金的晶胞中,粒子个数最简比Co∶Ga∶Ni= ,其立方晶胞的体积为 nm3。
(3)(2024黑吉辽,18节选)负载在TiO2上的RuO2催化活性高,稳定性强。TiO2和RuO2的晶体结构均可用如图表示,二者晶胞体积近似相等,RuO2与TiO2的密度比为1.66,则Ru的相对原子质量为 (精确至1)。
12.(高考组合)按要求填空:
(1)(2023全国甲,35节选)AlF3结构属立方晶系,晶胞如图所示,F-的配位数为 。若晶胞参数为apm,晶体密度ρ= g·cm-3(列出计算式,阿伏加德罗常数的值为NA)。
(2)(2023山东,16节选)一定条件下,CuCl2、K和F2反应生成KCl和化合物X。已知X属于四方晶系,晶胞结构如图所示(晶胞参数a=b≠c,α=β=γ=90°),其中Cu化合价为+2。上述反应的化学方程式为 。若阿伏加德罗常数的值为NA,化合物X的密度ρ= g·cm-3(用含NA的代数式表示)。
(3)(2023新课标,29节选)合成氨催化剂前驱体(主要成分为Fe3O4)使用前经H2还原,生成α-Fe包裹的Fe3O4。已知α-Fe属于立方晶系,晶胞参数a=287pm,密度为7.8g·cm-3。则α-Fe晶胞中含有Fe的原子数为 (列出计算式,阿伏加德罗常数的值为NA)。
考点5 配合物与超分子
13.(2024黑吉辽,9)环六糊精(D-吡喃葡萄糖缩合物)具有空腔结构,腔内极性较小,腔外极性较大,可包合某些分子形成超分子。图1、图2和图3分别表示环六糊精结构、超分子示意图及相关应用。下列说法错误的是( )
A.环六糊精属于寡糖
B.非极性分子均可被环六糊精包合形成超分子
C.图2中甲氧基对位暴露在反应环境中
D.可用萃取法分离环六糊精和氯代苯甲醚
14.(高考组合)按要求填空:
(1)(2024湖北,16节选)Be(OH)2与醋酸反应得到某含4个Be的配合物,4个Be位于以1个O原子为中心的四面体的4个顶点,且每个Be的配位环境相同,Be与Be间通过CH3COO-相连,其化学式为 。
(2)(2024安徽,17节选)通过Cu+修饰的Y分子筛的吸附—脱附,可实现C2H4和C2H6混合气的分离。Cu+的 与C2H4分子的π键电子形成配位键,这种配位键强弱介于范德华力和共价键之间。用该分子筛分离C2H4和C2H6的优点是 。
15.(2023海南,19节选)我国科学家发现一种钒配合物Ⅰ可以充当固氮反应的催化剂,反应过程中经历的中间体包括Ⅱ和Ⅲ。
(代表单键、双键或三键)
回答问题:
(1)配合物Ⅰ中钒的配位原子有4种,它们是 。
(2)配合物Ⅰ中,R'代表芳基,V—O—R'空间结构呈角形,原因是 。
(3)配合物Ⅱ中,第一电离能最大的配位原子是 。
(4)配合物Ⅱ和Ⅲ中,钒的化合价分别为+4和+3,配合物Ⅱ、Ⅲ和N2三者中,两个氮原子间键长最长的是 。
16.(高考组合)(1)(2021全国乙,35节选)三价铬离子能形成多种配位化合物。[Cr(NH3)3(H2O)2Cl]2+中提供电子对形成配位键的原子是 ,中心离子的配位数为 。
(2)(2021湖南,18节选)SiCl4与N-甲基咪唑()反应可以得到M2+,其结构如图所示:
N-甲基咪唑分子中碳原子的杂化轨道类型为 。
高考模拟练
应用实践
1.氮化铬有优异的化学稳定性和耐磨性,被广泛用作材料的涂层,某氮化铬的晶胞结构与氯化钠的相同,已知N原子在晶胞中的位置如图所示,下列说法不正确的是( )
A.Cr原子位于体心和12条棱上
B.距离Cr原子最近的N原子有12个
C.Cr原子位于N原子构成的八面体空隙中
D.晶胞中Cr原子沿x轴方向的投影为
2.新型储氢材料是开发利用氢能的重要研究方向。某种新型储氢材料的晶胞如图,八面体中心为Fe2+,顶点均为NH3配体;四面体中心为硼原子,顶点均为氢原子。下列说法错误的是( )
A.材料中硼原子采用sp3杂化
B.化学式为[Fe(NH3)6]4(BH4)8
C.Fe2+的价电子排布式为3d6
D.该化合物中存在离子键、极性键和配位键
3.设想从CsCl晶格中除去一半Cs+,使Cl-周围成为四面体配位,这样得到的物质的结构与下列物质相同的是( )
A.NaCl B.CaF2 C.ZnS D.石墨
4.作为储氢材料的镧镍合金被广泛应用于电动车辆,某种镧镍合金储氢后所得晶体的化学式为LaNi5H6,晶胞结构如图,晶胞参数为a,下列有关表述不正确的是( )
A.Z表示的微粒为H2
B.每个X原子周围最近且等距离的X原子有6个
C.若A的原子分数坐标为(0,0.5,0.5),B的原子分数坐标为(0.75,0.25,0),则C的原子分数坐标为(1,0.5,1)
D.若四条竖直棱的棱心位置均插入Z,则晶体的化学式为LaNi5H7
5.某水性钠离子电池电极材料由Na+、Fe2+、Fe3+、CN-组成,其立方晶胞嵌入和嵌出Na+过程中,Fe2+与Fe3+含量发生变化,物质颜色依次为格林绿、普鲁士蓝、普鲁士白,其过程如图所示。下列说法错误的是( )
A.普鲁士蓝中Fe2+与Fe3+个数比为1∶2
B.格林绿晶体中Fe3+周围等距且最近的Fe3+数为6
C.基态Fe原子的价电子排布式为3d64s2,失去4s电子转化为Fe2+
D.若普鲁士白的晶胞棱长为apm,则其晶体的密度为×1030g·cm-3
6.某立方晶系的锑钾(Sb-K)合金可作为钾离子电池的电极材料,图a为该合金的晶胞结构,图b表示晶胞的一部分,晶胞中1号、3号原子的分数坐标分别为(0,0,0)、(1,1,1)。下列说法错误的是( )
A.晶胞中含有的Sb原子数为4
B.2号原子的分数坐标为()
C.K和Sb之间的最短距离为apm
D.该晶体的密度为g·cm-3
7.乙二胺四乙酸又名EDTA,是一种能与Ca2+、Mg2+等金属离子结合的螯合剂,它与Ca2+形成配离子的结构如图所示。下列说法错误的是( )
A.EDTA中C原子的杂化类型为sp2、sp3
B.EDTA与Ca2+形成的配离子中,Ca2+的配位数是6
C.EDTA与Ca2+形成的配离子中,Ca2+的配体数为2
D.EDTA中部分元素的第一电离能大小顺序为N>O>C
8.磷至少有10种同素异形体,其中主要是白磷、红磷和黑磷三种。回答下列问题:
(1)基态磷原子最外层单电子数与成对电子数之比为 。
(2)白磷晶体是由P4分子()组成的分子晶体,P4分子中键角为 。
(3)白磷隔绝空气加热到533K转化为红磷,红磷是一种暗红色粉末。红磷的结构为,磷原子的杂化方式为 , (填“难”或“易”)溶于水。
(4)黑磷是磷的一种同素异形体,其具有类似于石墨的层状结构(如图),层状结构间通过 相结合。
(5)磷有多种含氧酸,磷酸是其中一种,磷酸通过分子间脱水缩合形成多磷酸,如:
++
若4个磷酸分子间脱水形成环状的多磷酸,则该多磷酸的分子式可写成 。
(6)磷的卤化物有PX3和PX5两种类型,其中PCl5是白色固体,在气态和液态时PCl5以分子形态存在,固态时PCl5不再保持该结构,而形成离子晶体。晶胞中含有正四面体形的[PCl4]+和正八面体形的 ,其晶胞结构最合理的是 (填字母)。
9.Li2S因其良好的锂离子传输性能可作锂电池的固体电解质,其晶胞结构示意图如下,晶胞的边长为apm(1pm=10-10cm)。
(1)晶胞中的白球代表 (填“Li+”或“S2-”)。
(2)距离Li+最近的S2-有 个。
(3)已知Li2S的摩尔质量是Mg/mol,阿伏加德罗常数的值为NA。该晶体的密度为 g/cm3。
10.硼、镓及其化合物在科研和工业中有广泛的应用。回答下列问题:
(1)六方氮化硼别称白石墨,是优良的绝缘体,平行层形成的网状结构如图所示,层内硼原子的杂化方式为 ,形成π键的电子由 (填“硼”或“氮”)原子提供。
(2)一种含镓的药物合成方法如图所示:
1mol化合物Ⅰ中含有的σ键的物质的量为 mol,x= 。
(3)Ga、Li和O三种原子形成的一种晶体基片在二极管中有重要用途。其四方晶胞结构如图所示:
其化学式为 ,上述晶胞沿着x轴的投影图为 (填字母)。
A B C
迁移创新
11.氢能作为一种新型的能量密度高的绿色能源,正引起世界各国的重视。储氢技术是氢能利用的关键,储氢材料是当今研究的重点课题之一,金属镍与镧(La)形成的合金是一种良好的储氢材料。
(1)Ni原子的核外电子排布式为 。
(2)NiO、FeO、MgO的晶体结构类型均与氯化钠相似,Ni2+和Fe2+的半径分别为69pm和78pm,则熔点:NiO (填“<”或“>”)FeO;某同学画出的MgO晶胞结构示意图如图所示,请指出图中的错误: 。
(3)NiO晶胞中Ni和O的配位数分别为 、 。
(4)金属镍与镧(La)形成的晶体的晶胞结构示意图如图所示(部分原子间连线未画出)。该合金的化学式为 。
答案与分层梯度式解析
综合拔高练
高考真题练
1.答案 (1)4 (2)1 MgB2
解析 (1)[Mg(H2O)6]2+在晶胞的8个顶点、4个棱心、2个面心和体心,则1个晶胞中[Mg(H2O)6]2+的个数为8×+1=4。(2)由题图知,Mg位于正六棱柱的顶点和面心,由均摊法求出正六棱柱中含12×=3个Mg,B在正六棱柱体内,共6个,正六棱柱晶体结构中含有3个晶胞,则1个晶胞中含有1个Mg,2个B,该物质的化学式为MgB2。
2.答案 2∶3 2∶1∶1 Zn2+、Ni2+
解析 结合晶胞图可知,1个晶胞中Ni2+的数目为2×=1,Zn2+的数目为8×=1,CN-的数目为8×=4,NH3的数目为8×=2,C6H6的数目为4×=2,则该晶胞的化学式为Ni(CN)4·Zn(NH3)2·2C6H6,x∶y∶z=2∶1∶1;晶胞中N原子均参与形成配位键,故Ni2+与Zn2+的配位数之比为2∶3;晶胞中Ni2+的配位数为4,则Ni2+采取dsp2杂化,Zn2+的配位数为6,Zn2+采取sp3d2杂化,两者的d轨道均参与杂化。
3.答案 (1)Cr(H2O)4Cl2(或CrCl2·4H2O) 分子晶体 (2)8 4 (3)2 (0,0,)
解析 (1)由晶胞图知,每个Cr周围有4个H2O和2个Cl,故该化合物的化学式为Cr(H2O)4Cl2或CrCl2·4H2O;该物质由分子构成,为分子晶体。(2)由题图可知,晶胞A中每个Fe原子紧邻的原子数为8。根据均摊法,每个晶胞B中含Fe原子数为8×=4。(3)图中大球的个数为8×+1=2,小球的个数为8×+2=4,根据XeF2的原子个数比知大球是Xe原子,小球是F原子,该晶胞中有2个XeF2分子;由题给图示可知B点原子位于z轴上,高度为rpm,则B点原子的分数坐标为(0,0,)。
4.C 24K金的质量分数为100%,则18K金的质量分数为×100%=75%;Ⅰ中,Au位于体心,个数为1,Cu位于顶点,个数为8×=1,Ⅰ中Au与Cu的个数比为1∶1,其中Au的质量分数为×100%≈75%,故Ⅰ为18K金,A正确。Ⅱ中,与Au距离最近且相等的Cu位于相邻面心上,个数为3×8×=12,故Au的配位数为12,B正确。Ⅲ中Au—Cu的最小核间距为面对角线长度的,Au—Au的最小核间距也为面对角线长度的,故最小核间距Au—Cu=Au—Au,C错误。由A项分析可知,Ⅰ中Au与Cu的个数比为1∶1;Ⅱ中Au位于顶点,个数为8×=1,Cu位于面心,个数为6×=3,Au与Cu的个数比为1∶3;Ⅲ中Cu位于顶点,个数为8×=1,Au位于面心,个数为6×=3,Au与Cu的个数比为3∶1,D正确。
5.C 根据LaH2的晶胞和沿c轴的投影图可知,每个La周围等距且最近的H个数为8,则La的配位数为8,A项正确;由题图可知,LaH2的晶胞参数大于LaHx的晶胞参数,且LaHx中H数目增多,故在LaHx中H和H的最短距离小于LaH2中H和H的最短距离,B项正确;LaHx晶体中,H的数目为4×8+8=40,每个H结合4个H形成类似甲烷的结构,所以H形成的多面体笼的顶点数不可能为40,C项错误;1个LaHx晶胞中含有40个H,晶胞的体积为(4.84×10-8)3cm3,所以单位体积中含氢质量为g·cm-3,D项正确。
6.答案 ①KFe2Se2 ②4 ③
解析 ①由题图可知,K在晶胞的顶点和体心,1个晶胞中含1+8×=2个K,Se在侧棱上和内部,1个晶胞中含2+8×=4个Se,Fe在晶胞的侧面上,1个晶胞中含8×=4个Fe,所以化学式为KFe2Se2。②由题图可知与Fe等距的Se有4个,故Fe的配位数为4。③ρ=g·cm-3,注意1nm=10-7cm。
7.答案 (1)Al ×100
(2)①不能无隙并置成晶体,不是最小重复单元
②4 1∶1∶2 ③
解析 (1)根据均摊法,该晶胞中黑球的个数为8×+1=2,灰球的个数为8×+2=4,个数之比为1∶2,根据化学式AlCr2可知,黑球代表Al,灰球代表Cr,故处于顶角位置的为Al原子。晶胞的体积为a2×c,晶胞所含原子的体积为),则金属原子的空间占有率为×100%。
(2)①组成晶体的最小重复单元称为晶胞,整块晶体可以看成是无数晶胞无隙并置而成的,而题图b不符合此条件,故不是晶胞。②题图c晶胞中底面面心的原子是Hg原子,与其距离最近的Sb有两个,其下方的晶胞中还有两个距离最近的Sb,故X的晶体中与Hg距离最近的Sb的数目为4;每个晶胞中Hg原子数目为4×=4,Ge原子数目为8×+1=4,Sb原子数目为8,故该晶胞中粒子个数比为Hg∶Ge∶Sb=1∶1∶2。③每个晶胞含有的“HgGeSb2”数目为4,则1mol“HgGeSb2”的体积为×NA,1mol“HgGeSb2”的质量为Mrg,故X晶体的密度为 g/cm3。
8.B 根据均摊法,结构1中S的个数为12×+1=4,Co的个数为4×+4=4.5,则结构1钴硫化物的化学式为Co9S8,A正确;晶胞2中S与S的最短距离为面对角线长度的一半,为a,B错误;晶胞2中Li的个数为8,S的个数为12×+1=4,化学式为Li2S,距S最近的Li的个数为8,则距Li最近的S的个数为4,C正确;将晶胞2的体心放置在面心可以得到晶胞3,故晶胞2和晶胞3表示同一晶体,D正确。
9.C 由晶胞结构图可知,在1个晶胞中,K原子位于顶点,其个数为8×=1;Ca原子位于体心,其个数为1;B原子和C原子均位于面上,其个数均为12×=6,则该晶体最简化学式为KCaB6C6,A正确。以顶点的K+为观察对象,与K+最近且距离相等的Ca2+位于体心,每个K+被8个晶胞所共用,则晶体中与K+最近且距离相等的Ca2+有8个,B正确。B和C构成的多面体中,四边形共有6个,六边形共有8个,共有14个面,C错误。该晶胞的质量为g,晶胞的体积为a3×10-30cm-3,则晶体的密度为g·cm-3=g·cm-3,D正确。
10.C 根据均摊法计算,图1晶胞中含有1个Cl,1个O,3个Li,密度ρ=g·cm-3=g·cm-3,A正确;图1中与氧原子距离最近(pm)的Li有6个,则O原子的配位数为6,B正确;根据均摊法计算,图2晶胞中含有1个Li,Mg或空位共2个,1个O,Cl或Br共1个,根据化合物中各元素正负化合价代数和为0,得Mg有1个,所以化学式为LiMgOClxBr1-x,C错误;Mg2+取代Li+后,产生的空位可供Li+移动传导电荷,增强导电性,D正确。
11.答案 (1)6 (2)2∶1∶1 8a3 (3)101
解析 (1)由题给晶胞图可知,晶胞中含有Pb、S的个数均为4,晶体的密度为g·cm-3。
(2)一种含Ga、Ni、Co元素的记忆合金的晶体结构可描述为Ga与Ni交替填充在Co构成的立方体体心,形成如题图所示的结构单元,则该记忆合金晶体的晶胞如图:
Co的个数为8×+1=8,Ga的个数为4,Ni的个数为4。该晶胞中,粒子个数最简比Co∶Ga∶Ni=2∶1∶1,其立方晶胞的体积=(2anm)3=8a3nm3。
(3)TiO2和RuO2的晶体结构相同,晶胞体积近似相等,根据密度之比等于相对分子质量之比,TiO2的相对分子质量为80,则RuO2的相对分子质量=80×1.66≈133,Ru的相对原子质量为133-32=101。
12.答案 (1)2 ×1030
(2)CuCl2+4K+2F22KCl+K2CuF4
(3)
解析 (1)由题图可知,1个该晶胞中位于顶点的粒子的数目为8×=1,位于棱心的粒子的数目为12×=3,故顶点处粒子为Al3+,棱心处粒子为F-,与F-最邻近的Al3+的数目为2,故F-的配位数为2。晶胞质量m=g,晶胞体积V=(a×10-10)3cm3,晶体密度ρ=g·cm-3=×1030g·cm-3。
(2)CuCl2+K+F2KCl+X,由原子守恒可知化合物X中一定含有Cu和F,根据晶胞结构,利用均摊法可知,1个晶胞中白球(A)的个数为16×+2=8,灰球(B)的个数为8×+1=2,黑球(C)的个数为8×+2=4,其最简式为C2BA4,又因为Cu为+2价,K为+1价,F为-1价,故X为K2CuF4,则反应的化学方程式为CuCl2+4K+2F22KCl+K2CuF4。1个晶胞中含有4个K、2个Cu和8个F,则晶胞质量m=g,晶胞体积V=(a×10-10cm)2×c×10-10cm=a2c×10-30cm3,故化合物X的密度ρ=g·cm-3。
(3)设晶胞中含Fe原子数为N,则晶胞密度ρ=g·cm-3=7.8g·cm-3,得出N=。
13.B 1mol糖水解后能产生2~10mol单糖的称为寡糖,由环六糊精结构可知,环六糊精属于寡糖,A正确;非极性分子与环六糊精形成超分子时,分子直径大小应与环六糊精空腔大小接近,B错误;根据题图3可知,在环六糊精中,与HOCl反应主要生成,说明题图2中甲氧基的对位暴露在反应环境中,C正确;环六糊精含多个羟基,可与水形成分子间氢键,故环六糊精能溶于水中,而氯代苯甲醚不溶于水,可用水作萃取剂分离环六糊精和氯代苯甲醚,D正确。
14.答案 (1)Be4O(CH3COO)6 (2)4s空轨道 具有选择性吸附,可实现对C2H4和C2H6混合气的有效分离
解析 (1)由题意可知,四面体的4个顶点是Be,四面体中心为O,Be与Be间通过CH3COO-相连,且每个Be的配位环境相同,则CH3COO-的个数为6,该配合物的化学式为Be4O(CH3COO)6。
(2)Cu的价层电子排布式为3d104s1,Cu失去1个电子得到Cu+,则Cu+的4s空轨道与C2H4分子的π键电子形成配位键;C2H4可以和Cu+形成配合物吸附在Y分子筛上,C2H6不含π键电子,不能与Cu+形成配合物,该分子筛具有选择性吸附,可以实现对C2H4和C2H6混合气的有效分离。
15.答案 (1)C、O、P、Cl
(2)根据VSEPR模型,氧原子的价层电子对数为4,其中孤电子对数为2,成键电子对之间呈角形
(3)N (4)配合物Ⅱ
解析 (1)根据配合物Ⅰ的结构图可知,中心原子钒的配位原子有C、O、P、Cl。(2)根据VSEPR模型,中心原子氧原子的价层电子对数为4,其中孤电子对数为2,空间结构呈角形。(3)配合物Ⅱ中,第一电离能最大的配位原子是N。(4)根据题中所给配合物Ⅱ和Ⅲ的结构,结合钒的化合价分别为+4和+3可知,配合物Ⅱ中氮原子间是氮氮单键,配合物Ⅲ中氮原子间是氮氮双键,N2中氮原子间是氮氮三键,故配合物Ⅱ中两个氮原子间键长最长。
16.答案 (1)N、O、Cl 6 (2)sp3、sp2
解析 (1)H2O中的氧原子、NH3中的氮原子和Cl-中都有孤电子对,可作配位原子,故配位原子为O、N、Cl,中心离子的配位数为3+2+1=6。
(2)由结构可知,N-甲基咪唑分子中碳原子的杂化轨道类型为sp2、sp3。
高考模拟练
1.B 氮化铬的晶胞结构与氯化钠的相同,N原子在8个顶点和6个面心,则Cr原子位于体心和12条棱上,Cr原子周围紧邻的N原子有6个,A正确、B错误;Cr原子位于N原子构成的八面体空隙中,C正确;Cr原子沿x轴方向的投影位于正方形的顶点、边的中心、正方形中心,D正确。
2.B 四面体中心为B原子,顶点均为H原子,一个四面体表示一个B,硼原子的价层电子对数是4+0=4,杂化方式为sp3,A正确;八面体中心为Fe2+,顶点为NH3配体,一个八面体表示一个[Fe(NH3)6]2+,黑球个数为8×=4,白球个数为8,该物质的化学式为[Fe(NH3)6](BH4)2,B错误;Fe的电子排布式为[Ar]3d64s2,Fe2+的价电子排布式为3d6,C正确;化合物中[Fe(NH3)6]2+与B之间形成离子键,NH3内存在极性键,Fe2+和NH3形成配位键,D正确。
3.B 从CsCl晶格中除去一半Cs+,则阳离子与阴离子的数目之比为1∶2;NaCl、ZnS中阳离子与阴离子数目之比为1∶1,A、C不符合题意;CaF2中阳离子与阴离子数目之比为1∶2,B符合题意;石墨是层状结构,D不符合题意。
4.D 由晶胞结构可知,含X的个数为8×=1,含Y的个数为8×+1=5,含Z的个数为8×=3,对照晶胞的化学式LaNi5H6,可得出Z表示的微粒为H2,A正确;每个X原子周围最近且等距离的X原子数目为6,B正确;若A的原子分数坐标为(0,0.5,0.5),B的原子分数坐标为(0.75,0.25,0),则坐标原点为底面左后角的X原子,所以C的原子分数坐标为(1,0.5,1),C正确;若四条竖直棱的棱心位置均插入Z,则与原晶胞比,增加Z的个数为4×=1,而Z为H2,所以晶体的化学式为LaNi5H8,D不正确。
5.A 根据均摊法,普鲁士蓝晶胞中含Fe的个数为8×+1=8,CN-的个数为24×+6=24,Na+的个数为4,根据化合物中各元素化合价代数和等于0,可知Fe2+与Fe3+个数比为1∶1,A错误;根据晶胞图,格林绿晶体中Fe3+周围等距且最近的Fe3+个数为6,B正确;Fe是26号元素,基态Fe原子的价电子排布式为3d64s2,失去4s电子转化为Fe2+,C正确;根据均摊法,普鲁士白晶胞中含Fe的个数为8×+1=8,含CN-的个数为24×+6=24,含Na+的个数为8,若普鲁士白的晶胞棱长为apm,则其晶体的密度为g·cm-3=×1030g·cm-3,D正确。
6.C 晶胞中含有的Sb原子个数为8×=4,A正确;由晶胞中1号、3号原子的分数坐标可知2号原子的分数坐标为(),B正确;据题图可知,K与Sb原子之间的最短距离为晶胞体对角线长的,即apm,C错误;该晶胞中Sb原子个数为4,K原子个数为12×+9=12,该晶体的密度为g·cm-3=g·cm-3,D正确。
7.C —CH2—中C原子采取sp3杂化,—COO—中碳原子采取sp2杂化,A正确;Ca2+为中心离子,周围有4个O和2个N与Ca2+形成配位键,故Ca2+的配位数为6,B正确;EDTA与Ca2+是以数目比1∶1配位,Ca2+的配体数为1,C错误;基态N原子的2p轨道为半充满稳定状态,第一电离能大于同周期相邻元素,第一电离能大小顺序为N>O>C,D正确。
8.答案 (1)3∶2 (2)60° (3)sp3 难 (4)范德华力 (5)H4P4O12 (6)[PCl6]- B
解析 (1)基态磷原子最外层电子排布式为3s23p3,3s能级的2个电子已成对,3p能级的3个电子分占3个不同的p轨道,故单电子数与成对电子数之比为3∶2。(2)P4分子的空间结构是正四面体形,每个面都是正三角形,键角为60°。(3)从红磷的结构可知,每个P原子形成3个σ键,每个P原子有1个孤电子对,故磷原子的价层电子对数是4,其杂化方式为sp3;红磷具有高聚合结构,有较高的稳定性,难溶于水。(4)黑磷是磷的一种同素异形体,其具有类似于石墨的层状结构,层状结构间通过范德华力相结合。(5)依据题意,磷酸分子可通过脱水缩合形成多磷酸,若4个磷酸分子间脱水形成环状的多磷酸,则脱去4个水分子,根据原子守恒,则该多磷酸的分子式可写成H4P4O12。(6)根据题意,固态时PCl5形成离子晶体,且晶胞中含有正四面体形的[PCl4]+,则阴离子是正八面体形的[PCl6]-;A晶胞中,带不同电荷的离子的数目之比为1∶2;B晶胞中,阴、阳离子数之比为1∶1;C晶胞中,带不同电荷的离子的数目之比为1∶2。
9.答案 (1)Li+ (2)4 (3)×1030
解析 (1)晶胞中黑球个数为8×=4,白球个数为8,白球与黑球的个数比为2∶1,则晶胞中白球代表Li+。(2)根据晶胞图可知距离Li+最近的S2-有4个。(3)密度ρ=×1030g/cm3。
10.答案 (1)sp2 氮 (2)17 1 (3)LiGaO2 C
解析 (1)由题图可知1个B原子与三个N原子形成σ键,无孤电子对,则其采用sp2杂化,B最外层3个电子均形成σ键,每个N原子与周围3个B原子形成σ键,还有一个孤电子对,因此形成π键的电子由N原子提供。(2)单键为σ键,1个双键中含1个σ键和1个π键,则由化合物Ⅰ的结构可知1mol该物质中含17molσ键;Ga3+带3个正电荷,—COO-带一个负电荷,则Ⅱ所带负电荷数为1。(3)由晶胞结构可知,O位于顶点和体心,个数为8×+1=2,Li位于面心,个数为2×=1,Ga位于棱心,个数为4×=1,则Ga、Li、O的个数比为1∶1∶2,化学式为LiGaO2;晶胞沿着x轴的投影:O原子投影为四边形顶点和面心,Ga原子投影为左右两个棱的中点,Li原子投影为上下棱的中点,则C符合。
11.答案 (1)1s22s22p63s23p63d84s2或[Ar]3d84s2 (2)> 8处应为灰色球(或8处应为Mg2+) (3)6 6 (4)LaNi5
解析 (1)Ni是28号元素,核外电子排布式为1s22s22p63s23p63d84s2或[Ar]3d84s2。(2)其他因素相同时,离子半径越大,离子晶体熔点越低。(3)由信息可知NiO与氯化钠的晶胞结构相似,所以Ni和O的配位数均为6。(4)La原子在8个顶点上,所以晶胞占有的La原子数为8×=1;Ni原子有4个位于前、后、左、右四个面的面心,有1个位于体心,有4个在上、下两个面上,所以晶胞占有的Ni原子数为(4+4)×+1=5,La与Ni的原子数之比为1∶5,则化学式为LaNi5。
高考真题练
考点1 晶胞中粒子数目的计算
1.(高考组合)按要求填空:
(1)(2023北京,15节选)MgS2O3·6H2O的晶胞形状为长方体,边长分别为anm、bnm、cnm,结构如图所示。
晶胞中的[Mg(H2O)6]2+个数为 。
(2)(2023全国乙,35节选)一种硼镁化合物具有超导性能,晶体结构属于六方晶系,其晶体结构、晶胞沿c轴的投影图如图所示,晶胞中含有 个Mg。该物质化学式为 。
2.(2022山东,16节选)研究笼形包合物结构和性质具有重要意义,化学式为Ni(CN)x·Zn(NH3)y·zC6H6的笼形包合物四方晶胞结构如图所示(H原子未画出),每个苯环只有一半属于该晶胞,晶胞参数为a=b≠c,α=β=γ=90°。回答下列问题:
晶胞中N原子均参与形成配位键,Ni2+与Zn2+的配位数之比为 ;x∶y∶z= ;晶胞中有d轨道参与杂化的金属离子是 。
3.(高考组合)(1)(2024浙江1月选考,17节选)氮和氧是构建化合物的常见元素。某化合物的晶胞如图,其化学式是 ,晶体类型是 。
(2)(2021天津,13节选)用X射线衍射测定,得到Fe的两种晶胞A、B,其结构如图所示。晶胞A中每个Fe原子紧邻的原子数为 。每个晶胞B中含Fe原子数为 。
(3)(2021山东,16节选)XeF2晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,该晶胞中有 个XeF2分子。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点原子的分数坐标为()。已知Xe—F键长为rpm,则B点原子的分数坐标为 。
考点2 金属晶体的结构
4.(2024湖北,11)黄金按质量分数分级,纯金为24K。Au-Cu合金的三种晶胞结构如图,Ⅰ、Ⅱ和Ⅲ是立方晶胞。下列说法错误的是( )
A.Ⅰ为18K金
B.Ⅱ中Au的配位数是12
C.Ⅲ中最小核间距Au—Cu
5.(2023湖北,15)镧La和H可以形成一系列晶体材料LaHn,在储氢和超导等领域具有重要应用。LaHn属于立方晶系,晶胞结构和参数如图所示。高压下,LaH2中的每个H结合4个H形成类似CH4的结构,即得到晶体LaHx。下列说法错误的是( )
A.LaH2晶体中La的配位数为8
B.晶体中H和H的最短距离:LaH2>LaHx
C.在LaHx晶胞中,H形成一个顶点数为40的闭合多面体笼
D.LaHx单位体积中含氢质量的计算式为g·cm-3
6.(2022湖南,18节选)钾、铁、硒可以形成一种超导材料,其晶胞在xz、yz和xy平面投影分别如图所示:
①该超导材料的最简化学式为 ;
②Fe原子的配位数为 ;
③该晶胞参数a=b=0.4nm、c=1.4nm。阿伏加德罗常数的值为NA,则该晶体的密度为 g·cm-3(列出计算式)。
7.(高考组合)(1)(2021全国乙,35节选)在金属材料中添加AlCr2颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。AlCr2具有体心四方结构,
如图所示。处于顶角位置的是 原子。设Cr和Al原子半径分别为rCr和rAl,则金属原子空间占有率为 %(列出计算表达式)。
(2)(2021广东,20节选)理论计算预测,由汞(Hg)、锗(Ge)、锑(Sb)形成的一种新物质X为潜在的拓扑绝缘体材料。X的晶体可视为Ge晶体(晶胞如图a所示)中部分Ge原子被Hg和Sb取代后形成。
①图b为Ge晶胞中部分Ge原子被Hg和Sb取代后形成的一种单元结构,它不是晶胞单元,理由是 。
②图c为X的晶胞,X的晶体中与Hg距离最近的Sb的数目为 ;该晶胞中粒子个数比Hg∶Ge∶Sb= 。
③设X的最简式的式量为Mr,则X晶体的密度为 g/cm3(列出算式)。
考点3 离子晶体的结构
8.(2024黑吉辽,14)某锂离子电池电极材料结构如图。结构1是钴硫化物晶胞的一部分,可代表其组成和结构;晶胞2是充电后的晶胞结构;所有晶胞均为立方晶胞。下列说法错误的是( )
A.结构1钴硫化物的化学式为Co9S8
B.晶胞2中S与S的最短距离为a
C.晶胞2中距Li最近的S有4个
D.晶胞2和晶胞3表示同一晶体
9.(2023湖南,11)科学家合成了一种高温超导材料,其晶胞结构如图所示,该立方晶胞参数为apm。阿伏加德罗常数的值为NA。下列说法错误的是 ( )
A.晶体最简化学式为KCaB6C6
B.晶体中与K+最近且距离相等的Ca2+有8个
C.晶胞中B和C原子构成的多面体有12个面
D.晶体的密度为g·cm-3
考点4 晶体的相关计算
10.(2023辽宁,14)晶体结构的缺陷美与对称美同样受关注。某富锂超离子导体的晶胞是立方体(图1),进行镁离子取代及卤素共掺杂后,可获得高性能固体电解质材料(图2)。下列说法错误的是( )
A.图1晶体密度为72.5/(NA×a3×10-30)g·cm-3
B.图1中O原子的配位数为6
C.图2表示的化学式为LiMg2OClxBr1-x
D.Mg2+取代产生的空位有利于Li+传导
11.(高考组合)按要求填空:
(1)(2024全国甲,35节选)结晶型PbS可作为放射性探测器元件材料,其立方晶胞如图所示。其中Pb的配位数为 。设NA为阿伏加德罗常数的值,则该晶体密度为 g·cm-3(列出计算式)。
(2)(2024广东,18节选)一种含Ga、Ni、Co元素的记忆合金的晶体结构可描述为Ga与Ni交替填充在Co构成的立方体体心,形成如图所示的结构单元。该合金的晶胞中,粒子个数最简比Co∶Ga∶Ni= ,其立方晶胞的体积为 nm3。
(3)(2024黑吉辽,18节选)负载在TiO2上的RuO2催化活性高,稳定性强。TiO2和RuO2的晶体结构均可用如图表示,二者晶胞体积近似相等,RuO2与TiO2的密度比为1.66,则Ru的相对原子质量为 (精确至1)。
12.(高考组合)按要求填空:
(1)(2023全国甲,35节选)AlF3结构属立方晶系,晶胞如图所示,F-的配位数为 。若晶胞参数为apm,晶体密度ρ= g·cm-3(列出计算式,阿伏加德罗常数的值为NA)。
(2)(2023山东,16节选)一定条件下,CuCl2、K和F2反应生成KCl和化合物X。已知X属于四方晶系,晶胞结构如图所示(晶胞参数a=b≠c,α=β=γ=90°),其中Cu化合价为+2。上述反应的化学方程式为 。若阿伏加德罗常数的值为NA,化合物X的密度ρ= g·cm-3(用含NA的代数式表示)。
(3)(2023新课标,29节选)合成氨催化剂前驱体(主要成分为Fe3O4)使用前经H2还原,生成α-Fe包裹的Fe3O4。已知α-Fe属于立方晶系,晶胞参数a=287pm,密度为7.8g·cm-3。则α-Fe晶胞中含有Fe的原子数为 (列出计算式,阿伏加德罗常数的值为NA)。
考点5 配合物与超分子
13.(2024黑吉辽,9)环六糊精(D-吡喃葡萄糖缩合物)具有空腔结构,腔内极性较小,腔外极性较大,可包合某些分子形成超分子。图1、图2和图3分别表示环六糊精结构、超分子示意图及相关应用。下列说法错误的是( )
A.环六糊精属于寡糖
B.非极性分子均可被环六糊精包合形成超分子
C.图2中甲氧基对位暴露在反应环境中
D.可用萃取法分离环六糊精和氯代苯甲醚
14.(高考组合)按要求填空:
(1)(2024湖北,16节选)Be(OH)2与醋酸反应得到某含4个Be的配合物,4个Be位于以1个O原子为中心的四面体的4个顶点,且每个Be的配位环境相同,Be与Be间通过CH3COO-相连,其化学式为 。
(2)(2024安徽,17节选)通过Cu+修饰的Y分子筛的吸附—脱附,可实现C2H4和C2H6混合气的分离。Cu+的 与C2H4分子的π键电子形成配位键,这种配位键强弱介于范德华力和共价键之间。用该分子筛分离C2H4和C2H6的优点是 。
15.(2023海南,19节选)我国科学家发现一种钒配合物Ⅰ可以充当固氮反应的催化剂,反应过程中经历的中间体包括Ⅱ和Ⅲ。
(代表单键、双键或三键)
回答问题:
(1)配合物Ⅰ中钒的配位原子有4种,它们是 。
(2)配合物Ⅰ中,R'代表芳基,V—O—R'空间结构呈角形,原因是 。
(3)配合物Ⅱ中,第一电离能最大的配位原子是 。
(4)配合物Ⅱ和Ⅲ中,钒的化合价分别为+4和+3,配合物Ⅱ、Ⅲ和N2三者中,两个氮原子间键长最长的是 。
16.(高考组合)(1)(2021全国乙,35节选)三价铬离子能形成多种配位化合物。[Cr(NH3)3(H2O)2Cl]2+中提供电子对形成配位键的原子是 ,中心离子的配位数为 。
(2)(2021湖南,18节选)SiCl4与N-甲基咪唑()反应可以得到M2+,其结构如图所示:
N-甲基咪唑分子中碳原子的杂化轨道类型为 。
高考模拟练
应用实践
1.氮化铬有优异的化学稳定性和耐磨性,被广泛用作材料的涂层,某氮化铬的晶胞结构与氯化钠的相同,已知N原子在晶胞中的位置如图所示,下列说法不正确的是( )
A.Cr原子位于体心和12条棱上
B.距离Cr原子最近的N原子有12个
C.Cr原子位于N原子构成的八面体空隙中
D.晶胞中Cr原子沿x轴方向的投影为
2.新型储氢材料是开发利用氢能的重要研究方向。某种新型储氢材料的晶胞如图,八面体中心为Fe2+,顶点均为NH3配体;四面体中心为硼原子,顶点均为氢原子。下列说法错误的是( )
A.材料中硼原子采用sp3杂化
B.化学式为[Fe(NH3)6]4(BH4)8
C.Fe2+的价电子排布式为3d6
D.该化合物中存在离子键、极性键和配位键
3.设想从CsCl晶格中除去一半Cs+,使Cl-周围成为四面体配位,这样得到的物质的结构与下列物质相同的是( )
A.NaCl B.CaF2 C.ZnS D.石墨
4.作为储氢材料的镧镍合金被广泛应用于电动车辆,某种镧镍合金储氢后所得晶体的化学式为LaNi5H6,晶胞结构如图,晶胞参数为a,下列有关表述不正确的是( )
A.Z表示的微粒为H2
B.每个X原子周围最近且等距离的X原子有6个
C.若A的原子分数坐标为(0,0.5,0.5),B的原子分数坐标为(0.75,0.25,0),则C的原子分数坐标为(1,0.5,1)
D.若四条竖直棱的棱心位置均插入Z,则晶体的化学式为LaNi5H7
5.某水性钠离子电池电极材料由Na+、Fe2+、Fe3+、CN-组成,其立方晶胞嵌入和嵌出Na+过程中,Fe2+与Fe3+含量发生变化,物质颜色依次为格林绿、普鲁士蓝、普鲁士白,其过程如图所示。下列说法错误的是( )
A.普鲁士蓝中Fe2+与Fe3+个数比为1∶2
B.格林绿晶体中Fe3+周围等距且最近的Fe3+数为6
C.基态Fe原子的价电子排布式为3d64s2,失去4s电子转化为Fe2+
D.若普鲁士白的晶胞棱长为apm,则其晶体的密度为×1030g·cm-3
6.某立方晶系的锑钾(Sb-K)合金可作为钾离子电池的电极材料,图a为该合金的晶胞结构,图b表示晶胞的一部分,晶胞中1号、3号原子的分数坐标分别为(0,0,0)、(1,1,1)。下列说法错误的是( )
A.晶胞中含有的Sb原子数为4
B.2号原子的分数坐标为()
C.K和Sb之间的最短距离为apm
D.该晶体的密度为g·cm-3
7.乙二胺四乙酸又名EDTA,是一种能与Ca2+、Mg2+等金属离子结合的螯合剂,它与Ca2+形成配离子的结构如图所示。下列说法错误的是( )
A.EDTA中C原子的杂化类型为sp2、sp3
B.EDTA与Ca2+形成的配离子中,Ca2+的配位数是6
C.EDTA与Ca2+形成的配离子中,Ca2+的配体数为2
D.EDTA中部分元素的第一电离能大小顺序为N>O>C
8.磷至少有10种同素异形体,其中主要是白磷、红磷和黑磷三种。回答下列问题:
(1)基态磷原子最外层单电子数与成对电子数之比为 。
(2)白磷晶体是由P4分子()组成的分子晶体,P4分子中键角为 。
(3)白磷隔绝空气加热到533K转化为红磷,红磷是一种暗红色粉末。红磷的结构为,磷原子的杂化方式为 , (填“难”或“易”)溶于水。
(4)黑磷是磷的一种同素异形体,其具有类似于石墨的层状结构(如图),层状结构间通过 相结合。
(5)磷有多种含氧酸,磷酸是其中一种,磷酸通过分子间脱水缩合形成多磷酸,如:
++
若4个磷酸分子间脱水形成环状的多磷酸,则该多磷酸的分子式可写成 。
(6)磷的卤化物有PX3和PX5两种类型,其中PCl5是白色固体,在气态和液态时PCl5以分子形态存在,固态时PCl5不再保持该结构,而形成离子晶体。晶胞中含有正四面体形的[PCl4]+和正八面体形的 ,其晶胞结构最合理的是 (填字母)。
9.Li2S因其良好的锂离子传输性能可作锂电池的固体电解质,其晶胞结构示意图如下,晶胞的边长为apm(1pm=10-10cm)。
(1)晶胞中的白球代表 (填“Li+”或“S2-”)。
(2)距离Li+最近的S2-有 个。
(3)已知Li2S的摩尔质量是Mg/mol,阿伏加德罗常数的值为NA。该晶体的密度为 g/cm3。
10.硼、镓及其化合物在科研和工业中有广泛的应用。回答下列问题:
(1)六方氮化硼别称白石墨,是优良的绝缘体,平行层形成的网状结构如图所示,层内硼原子的杂化方式为 ,形成π键的电子由 (填“硼”或“氮”)原子提供。
(2)一种含镓的药物合成方法如图所示:
1mol化合物Ⅰ中含有的σ键的物质的量为 mol,x= 。
(3)Ga、Li和O三种原子形成的一种晶体基片在二极管中有重要用途。其四方晶胞结构如图所示:
其化学式为 ,上述晶胞沿着x轴的投影图为 (填字母)。
A B C
迁移创新
11.氢能作为一种新型的能量密度高的绿色能源,正引起世界各国的重视。储氢技术是氢能利用的关键,储氢材料是当今研究的重点课题之一,金属镍与镧(La)形成的合金是一种良好的储氢材料。
(1)Ni原子的核外电子排布式为 。
(2)NiO、FeO、MgO的晶体结构类型均与氯化钠相似,Ni2+和Fe2+的半径分别为69pm和78pm,则熔点:NiO (填“<”或“>”)FeO;某同学画出的MgO晶胞结构示意图如图所示,请指出图中的错误: 。
(3)NiO晶胞中Ni和O的配位数分别为 、 。
(4)金属镍与镧(La)形成的晶体的晶胞结构示意图如图所示(部分原子间连线未画出)。该合金的化学式为 。
答案与分层梯度式解析
综合拔高练
高考真题练
1.答案 (1)4 (2)1 MgB2
解析 (1)[Mg(H2O)6]2+在晶胞的8个顶点、4个棱心、2个面心和体心,则1个晶胞中[Mg(H2O)6]2+的个数为8×+1=4。(2)由题图知,Mg位于正六棱柱的顶点和面心,由均摊法求出正六棱柱中含12×=3个Mg,B在正六棱柱体内,共6个,正六棱柱晶体结构中含有3个晶胞,则1个晶胞中含有1个Mg,2个B,该物质的化学式为MgB2。
2.答案 2∶3 2∶1∶1 Zn2+、Ni2+
解析 结合晶胞图可知,1个晶胞中Ni2+的数目为2×=1,Zn2+的数目为8×=1,CN-的数目为8×=4,NH3的数目为8×=2,C6H6的数目为4×=2,则该晶胞的化学式为Ni(CN)4·Zn(NH3)2·2C6H6,x∶y∶z=2∶1∶1;晶胞中N原子均参与形成配位键,故Ni2+与Zn2+的配位数之比为2∶3;晶胞中Ni2+的配位数为4,则Ni2+采取dsp2杂化,Zn2+的配位数为6,Zn2+采取sp3d2杂化,两者的d轨道均参与杂化。
3.答案 (1)Cr(H2O)4Cl2(或CrCl2·4H2O) 分子晶体 (2)8 4 (3)2 (0,0,)
解析 (1)由晶胞图知,每个Cr周围有4个H2O和2个Cl,故该化合物的化学式为Cr(H2O)4Cl2或CrCl2·4H2O;该物质由分子构成,为分子晶体。(2)由题图可知,晶胞A中每个Fe原子紧邻的原子数为8。根据均摊法,每个晶胞B中含Fe原子数为8×=4。(3)图中大球的个数为8×+1=2,小球的个数为8×+2=4,根据XeF2的原子个数比知大球是Xe原子,小球是F原子,该晶胞中有2个XeF2分子;由题给图示可知B点原子位于z轴上,高度为rpm,则B点原子的分数坐标为(0,0,)。
4.C 24K金的质量分数为100%,则18K金的质量分数为×100%=75%;Ⅰ中,Au位于体心,个数为1,Cu位于顶点,个数为8×=1,Ⅰ中Au与Cu的个数比为1∶1,其中Au的质量分数为×100%≈75%,故Ⅰ为18K金,A正确。Ⅱ中,与Au距离最近且相等的Cu位于相邻面心上,个数为3×8×=12,故Au的配位数为12,B正确。Ⅲ中Au—Cu的最小核间距为面对角线长度的,Au—Au的最小核间距也为面对角线长度的,故最小核间距Au—Cu=Au—Au,C错误。由A项分析可知,Ⅰ中Au与Cu的个数比为1∶1;Ⅱ中Au位于顶点,个数为8×=1,Cu位于面心,个数为6×=3,Au与Cu的个数比为1∶3;Ⅲ中Cu位于顶点,个数为8×=1,Au位于面心,个数为6×=3,Au与Cu的个数比为3∶1,D正确。
5.C 根据LaH2的晶胞和沿c轴的投影图可知,每个La周围等距且最近的H个数为8,则La的配位数为8,A项正确;由题图可知,LaH2的晶胞参数大于LaHx的晶胞参数,且LaHx中H数目增多,故在LaHx中H和H的最短距离小于LaH2中H和H的最短距离,B项正确;LaHx晶体中,H的数目为4×8+8=40,每个H结合4个H形成类似甲烷的结构,所以H形成的多面体笼的顶点数不可能为40,C项错误;1个LaHx晶胞中含有40个H,晶胞的体积为(4.84×10-8)3cm3,所以单位体积中含氢质量为g·cm-3,D项正确。
6.答案 ①KFe2Se2 ②4 ③
解析 ①由题图可知,K在晶胞的顶点和体心,1个晶胞中含1+8×=2个K,Se在侧棱上和内部,1个晶胞中含2+8×=4个Se,Fe在晶胞的侧面上,1个晶胞中含8×=4个Fe,所以化学式为KFe2Se2。②由题图可知与Fe等距的Se有4个,故Fe的配位数为4。③ρ=g·cm-3,注意1nm=10-7cm。
7.答案 (1)Al ×100
(2)①不能无隙并置成晶体,不是最小重复单元
②4 1∶1∶2 ③
解析 (1)根据均摊法,该晶胞中黑球的个数为8×+1=2,灰球的个数为8×+2=4,个数之比为1∶2,根据化学式AlCr2可知,黑球代表Al,灰球代表Cr,故处于顶角位置的为Al原子。晶胞的体积为a2×c,晶胞所含原子的体积为),则金属原子的空间占有率为×100%。
(2)①组成晶体的最小重复单元称为晶胞,整块晶体可以看成是无数晶胞无隙并置而成的,而题图b不符合此条件,故不是晶胞。②题图c晶胞中底面面心的原子是Hg原子,与其距离最近的Sb有两个,其下方的晶胞中还有两个距离最近的Sb,故X的晶体中与Hg距离最近的Sb的数目为4;每个晶胞中Hg原子数目为4×=4,Ge原子数目为8×+1=4,Sb原子数目为8,故该晶胞中粒子个数比为Hg∶Ge∶Sb=1∶1∶2。③每个晶胞含有的“HgGeSb2”数目为4,则1mol“HgGeSb2”的体积为×NA,1mol“HgGeSb2”的质量为Mrg,故X晶体的密度为 g/cm3。
8.B 根据均摊法,结构1中S的个数为12×+1=4,Co的个数为4×+4=4.5,则结构1钴硫化物的化学式为Co9S8,A正确;晶胞2中S与S的最短距离为面对角线长度的一半,为a,B错误;晶胞2中Li的个数为8,S的个数为12×+1=4,化学式为Li2S,距S最近的Li的个数为8,则距Li最近的S的个数为4,C正确;将晶胞2的体心放置在面心可以得到晶胞3,故晶胞2和晶胞3表示同一晶体,D正确。
9.C 由晶胞结构图可知,在1个晶胞中,K原子位于顶点,其个数为8×=1;Ca原子位于体心,其个数为1;B原子和C原子均位于面上,其个数均为12×=6,则该晶体最简化学式为KCaB6C6,A正确。以顶点的K+为观察对象,与K+最近且距离相等的Ca2+位于体心,每个K+被8个晶胞所共用,则晶体中与K+最近且距离相等的Ca2+有8个,B正确。B和C构成的多面体中,四边形共有6个,六边形共有8个,共有14个面,C错误。该晶胞的质量为g,晶胞的体积为a3×10-30cm-3,则晶体的密度为g·cm-3=g·cm-3,D正确。
10.C 根据均摊法计算,图1晶胞中含有1个Cl,1个O,3个Li,密度ρ=g·cm-3=g·cm-3,A正确;图1中与氧原子距离最近(pm)的Li有6个,则O原子的配位数为6,B正确;根据均摊法计算,图2晶胞中含有1个Li,Mg或空位共2个,1个O,Cl或Br共1个,根据化合物中各元素正负化合价代数和为0,得Mg有1个,所以化学式为LiMgOClxBr1-x,C错误;Mg2+取代Li+后,产生的空位可供Li+移动传导电荷,增强导电性,D正确。
11.答案 (1)6 (2)2∶1∶1 8a3 (3)101
解析 (1)由题给晶胞图可知,晶胞中含有Pb、S的个数均为4,晶体的密度为g·cm-3。
(2)一种含Ga、Ni、Co元素的记忆合金的晶体结构可描述为Ga与Ni交替填充在Co构成的立方体体心,形成如题图所示的结构单元,则该记忆合金晶体的晶胞如图:
Co的个数为8×+1=8,Ga的个数为4,Ni的个数为4。该晶胞中,粒子个数最简比Co∶Ga∶Ni=2∶1∶1,其立方晶胞的体积=(2anm)3=8a3nm3。
(3)TiO2和RuO2的晶体结构相同,晶胞体积近似相等,根据密度之比等于相对分子质量之比,TiO2的相对分子质量为80,则RuO2的相对分子质量=80×1.66≈133,Ru的相对原子质量为133-32=101。
12.答案 (1)2 ×1030
(2)CuCl2+4K+2F22KCl+K2CuF4
(3)
解析 (1)由题图可知,1个该晶胞中位于顶点的粒子的数目为8×=1,位于棱心的粒子的数目为12×=3,故顶点处粒子为Al3+,棱心处粒子为F-,与F-最邻近的Al3+的数目为2,故F-的配位数为2。晶胞质量m=g,晶胞体积V=(a×10-10)3cm3,晶体密度ρ=g·cm-3=×1030g·cm-3。
(2)CuCl2+K+F2KCl+X,由原子守恒可知化合物X中一定含有Cu和F,根据晶胞结构,利用均摊法可知,1个晶胞中白球(A)的个数为16×+2=8,灰球(B)的个数为8×+1=2,黑球(C)的个数为8×+2=4,其最简式为C2BA4,又因为Cu为+2价,K为+1价,F为-1价,故X为K2CuF4,则反应的化学方程式为CuCl2+4K+2F22KCl+K2CuF4。1个晶胞中含有4个K、2个Cu和8个F,则晶胞质量m=g,晶胞体积V=(a×10-10cm)2×c×10-10cm=a2c×10-30cm3,故化合物X的密度ρ=g·cm-3。
(3)设晶胞中含Fe原子数为N,则晶胞密度ρ=g·cm-3=7.8g·cm-3,得出N=。
13.B 1mol糖水解后能产生2~10mol单糖的称为寡糖,由环六糊精结构可知,环六糊精属于寡糖,A正确;非极性分子与环六糊精形成超分子时,分子直径大小应与环六糊精空腔大小接近,B错误;根据题图3可知,在环六糊精中,与HOCl反应主要生成,说明题图2中甲氧基的对位暴露在反应环境中,C正确;环六糊精含多个羟基,可与水形成分子间氢键,故环六糊精能溶于水中,而氯代苯甲醚不溶于水,可用水作萃取剂分离环六糊精和氯代苯甲醚,D正确。
14.答案 (1)Be4O(CH3COO)6 (2)4s空轨道 具有选择性吸附,可实现对C2H4和C2H6混合气的有效分离
解析 (1)由题意可知,四面体的4个顶点是Be,四面体中心为O,Be与Be间通过CH3COO-相连,且每个Be的配位环境相同,则CH3COO-的个数为6,该配合物的化学式为Be4O(CH3COO)6。
(2)Cu的价层电子排布式为3d104s1,Cu失去1个电子得到Cu+,则Cu+的4s空轨道与C2H4分子的π键电子形成配位键;C2H4可以和Cu+形成配合物吸附在Y分子筛上,C2H6不含π键电子,不能与Cu+形成配合物,该分子筛具有选择性吸附,可以实现对C2H4和C2H6混合气的有效分离。
15.答案 (1)C、O、P、Cl
(2)根据VSEPR模型,氧原子的价层电子对数为4,其中孤电子对数为2,成键电子对之间呈角形
(3)N (4)配合物Ⅱ
解析 (1)根据配合物Ⅰ的结构图可知,中心原子钒的配位原子有C、O、P、Cl。(2)根据VSEPR模型,中心原子氧原子的价层电子对数为4,其中孤电子对数为2,空间结构呈角形。(3)配合物Ⅱ中,第一电离能最大的配位原子是N。(4)根据题中所给配合物Ⅱ和Ⅲ的结构,结合钒的化合价分别为+4和+3可知,配合物Ⅱ中氮原子间是氮氮单键,配合物Ⅲ中氮原子间是氮氮双键,N2中氮原子间是氮氮三键,故配合物Ⅱ中两个氮原子间键长最长。
16.答案 (1)N、O、Cl 6 (2)sp3、sp2
解析 (1)H2O中的氧原子、NH3中的氮原子和Cl-中都有孤电子对,可作配位原子,故配位原子为O、N、Cl,中心离子的配位数为3+2+1=6。
(2)由结构可知,N-甲基咪唑分子中碳原子的杂化轨道类型为sp2、sp3。
高考模拟练
1.B 氮化铬的晶胞结构与氯化钠的相同,N原子在8个顶点和6个面心,则Cr原子位于体心和12条棱上,Cr原子周围紧邻的N原子有6个,A正确、B错误;Cr原子位于N原子构成的八面体空隙中,C正确;Cr原子沿x轴方向的投影位于正方形的顶点、边的中心、正方形中心,D正确。
2.B 四面体中心为B原子,顶点均为H原子,一个四面体表示一个B,硼原子的价层电子对数是4+0=4,杂化方式为sp3,A正确;八面体中心为Fe2+,顶点为NH3配体,一个八面体表示一个[Fe(NH3)6]2+,黑球个数为8×=4,白球个数为8,该物质的化学式为[Fe(NH3)6](BH4)2,B错误;Fe的电子排布式为[Ar]3d64s2,Fe2+的价电子排布式为3d6,C正确;化合物中[Fe(NH3)6]2+与B之间形成离子键,NH3内存在极性键,Fe2+和NH3形成配位键,D正确。
3.B 从CsCl晶格中除去一半Cs+,则阳离子与阴离子的数目之比为1∶2;NaCl、ZnS中阳离子与阴离子数目之比为1∶1,A、C不符合题意;CaF2中阳离子与阴离子数目之比为1∶2,B符合题意;石墨是层状结构,D不符合题意。
4.D 由晶胞结构可知,含X的个数为8×=1,含Y的个数为8×+1=5,含Z的个数为8×=3,对照晶胞的化学式LaNi5H6,可得出Z表示的微粒为H2,A正确;每个X原子周围最近且等距离的X原子数目为6,B正确;若A的原子分数坐标为(0,0.5,0.5),B的原子分数坐标为(0.75,0.25,0),则坐标原点为底面左后角的X原子,所以C的原子分数坐标为(1,0.5,1),C正确;若四条竖直棱的棱心位置均插入Z,则与原晶胞比,增加Z的个数为4×=1,而Z为H2,所以晶体的化学式为LaNi5H8,D不正确。
5.A 根据均摊法,普鲁士蓝晶胞中含Fe的个数为8×+1=8,CN-的个数为24×+6=24,Na+的个数为4,根据化合物中各元素化合价代数和等于0,可知Fe2+与Fe3+个数比为1∶1,A错误;根据晶胞图,格林绿晶体中Fe3+周围等距且最近的Fe3+个数为6,B正确;Fe是26号元素,基态Fe原子的价电子排布式为3d64s2,失去4s电子转化为Fe2+,C正确;根据均摊法,普鲁士白晶胞中含Fe的个数为8×+1=8,含CN-的个数为24×+6=24,含Na+的个数为8,若普鲁士白的晶胞棱长为apm,则其晶体的密度为g·cm-3=×1030g·cm-3,D正确。
6.C 晶胞中含有的Sb原子个数为8×=4,A正确;由晶胞中1号、3号原子的分数坐标可知2号原子的分数坐标为(),B正确;据题图可知,K与Sb原子之间的最短距离为晶胞体对角线长的,即apm,C错误;该晶胞中Sb原子个数为4,K原子个数为12×+9=12,该晶体的密度为g·cm-3=g·cm-3,D正确。
7.C —CH2—中C原子采取sp3杂化,—COO—中碳原子采取sp2杂化,A正确;Ca2+为中心离子,周围有4个O和2个N与Ca2+形成配位键,故Ca2+的配位数为6,B正确;EDTA与Ca2+是以数目比1∶1配位,Ca2+的配体数为1,C错误;基态N原子的2p轨道为半充满稳定状态,第一电离能大于同周期相邻元素,第一电离能大小顺序为N>O>C,D正确。
8.答案 (1)3∶2 (2)60° (3)sp3 难 (4)范德华力 (5)H4P4O12 (6)[PCl6]- B
解析 (1)基态磷原子最外层电子排布式为3s23p3,3s能级的2个电子已成对,3p能级的3个电子分占3个不同的p轨道,故单电子数与成对电子数之比为3∶2。(2)P4分子的空间结构是正四面体形,每个面都是正三角形,键角为60°。(3)从红磷的结构可知,每个P原子形成3个σ键,每个P原子有1个孤电子对,故磷原子的价层电子对数是4,其杂化方式为sp3;红磷具有高聚合结构,有较高的稳定性,难溶于水。(4)黑磷是磷的一种同素异形体,其具有类似于石墨的层状结构,层状结构间通过范德华力相结合。(5)依据题意,磷酸分子可通过脱水缩合形成多磷酸,若4个磷酸分子间脱水形成环状的多磷酸,则脱去4个水分子,根据原子守恒,则该多磷酸的分子式可写成H4P4O12。(6)根据题意,固态时PCl5形成离子晶体,且晶胞中含有正四面体形的[PCl4]+,则阴离子是正八面体形的[PCl6]-;A晶胞中,带不同电荷的离子的数目之比为1∶2;B晶胞中,阴、阳离子数之比为1∶1;C晶胞中,带不同电荷的离子的数目之比为1∶2。
9.答案 (1)Li+ (2)4 (3)×1030
解析 (1)晶胞中黑球个数为8×=4,白球个数为8,白球与黑球的个数比为2∶1,则晶胞中白球代表Li+。(2)根据晶胞图可知距离Li+最近的S2-有4个。(3)密度ρ=×1030g/cm3。
10.答案 (1)sp2 氮 (2)17 1 (3)LiGaO2 C
解析 (1)由题图可知1个B原子与三个N原子形成σ键,无孤电子对,则其采用sp2杂化,B最外层3个电子均形成σ键,每个N原子与周围3个B原子形成σ键,还有一个孤电子对,因此形成π键的电子由N原子提供。(2)单键为σ键,1个双键中含1个σ键和1个π键,则由化合物Ⅰ的结构可知1mol该物质中含17molσ键;Ga3+带3个正电荷,—COO-带一个负电荷,则Ⅱ所带负电荷数为1。(3)由晶胞结构可知,O位于顶点和体心,个数为8×+1=2,Li位于面心,个数为2×=1,Ga位于棱心,个数为4×=1,则Ga、Li、O的个数比为1∶1∶2,化学式为LiGaO2;晶胞沿着x轴的投影:O原子投影为四边形顶点和面心,Ga原子投影为左右两个棱的中点,Li原子投影为上下棱的中点,则C符合。
11.答案 (1)1s22s22p63s23p63d84s2或[Ar]3d84s2 (2)> 8处应为灰色球(或8处应为Mg2+) (3)6 6 (4)LaNi5
解析 (1)Ni是28号元素,核外电子排布式为1s22s22p63s23p63d84s2或[Ar]3d84s2。(2)其他因素相同时,离子半径越大,离子晶体熔点越低。(3)由信息可知NiO与氯化钠的晶胞结构相似,所以Ni和O的配位数均为6。(4)La原子在8个顶点上,所以晶胞占有的La原子数为8×=1;Ni原子有4个位于前、后、左、右四个面的面心,有1个位于体心,有4个在上、下两个面上,所以晶胞占有的Ni原子数为(4+4)×+1=5,La与Ni的原子数之比为1∶5,则化学式为LaNi5。
