题型整合练 原电池和电解池组合装置分析-《精讲精练》26版高中同步新教材化学苏教版(2019)选必修1
文档属性
| 名称 | 题型整合练 原电池和电解池组合装置分析-《精讲精练》26版高中同步新教材化学苏教版(2019)选必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 232.3KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-10-28 18:10:14 | ||
图片预览


文档简介
题型整合练 原电池和电解池组合装置分析
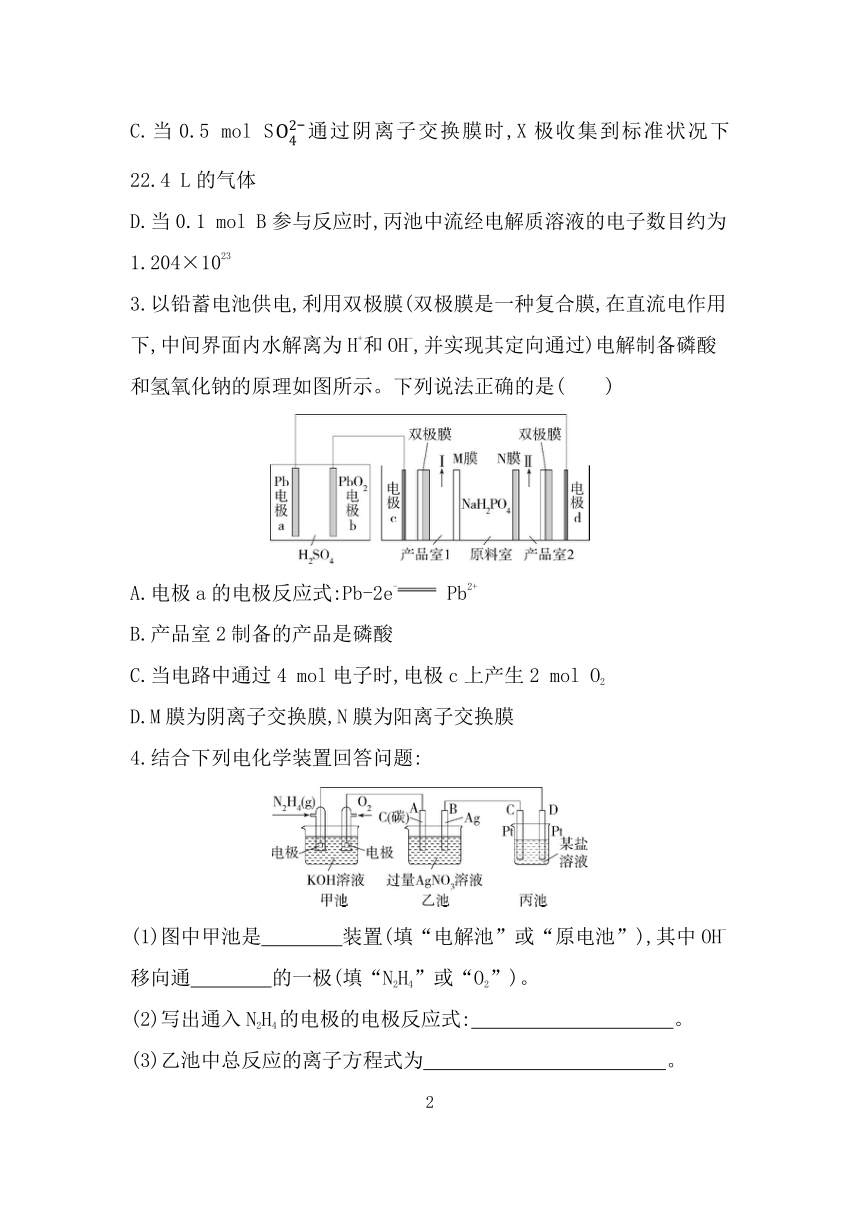
1.MFC电芬顿技术不需要外加能量即可发生,通过产生羟基自由基(·OH)处理有机污染物,可获得高效的废水净化效果。其耦合系统原理示意图如下,下列说法不正确的是( )
A.电子移动方向为a→Y,X→b
B.Y电极上得到H2O2的反应为O2+2e-+2H+ H2O2
C.b电极上发生还原反应
D.理论上当乙中产生1 mol羟基自由基时,甲中有4 mol H+从M室移动到N室
2.某同学按如图所示的装置进行实验。电极A、B为两种常见金属,当K闭合时,X极上产生的气体能使湿润的淀粉碘化钾试纸变蓝。下列说法正确的是( )
A.A极和Y极上均发生还原反应,且Y极的电极反应式为Cu2++2e- Cu
B.电池工作一段时间后,丙池中两极的总质量不变
C.当0.5 mol S通过阴离子交换膜时,X极收集到标准状况下 22.4 L的气体
D.当0.1 mol B参与反应时,丙池中流经电解质溶液的电子数目约为1.204×1023
3.以铅蓄电池供电,利用双极膜(双极膜是一种复合膜,在直流电作用下,中间界面内水解离为H+和OH-,并实现其定向通过)电解制备磷酸和氢氧化钠的原理如图所示。下列说法正确的是( )
A.电极a的电极反应式:Pb-2e- Pb2+
B.产品室2制备的产品是磷酸
C.当电路中通过4 mol电子时,电极c上产生2 mol O2
D.M膜为阴离子交换膜,N膜为阳离子交换膜
4.结合下列电化学装置回答问题:
(1)图中甲池是 装置(填“电解池”或“原电池”),其中OH-移向通 的一极(填“N2H4”或“O2”)。
(2)写出通入N2H4的电极的电极反应式: 。
(3)乙池中总反应的离子方程式为 。
(4)当乙池中B(Ag)极的质量增加5.40 g时,丙池也有金属析出,则丙中的某盐溶液可能是 (填字母),此时丙池某电极析出 g金属。
A.MgSO4 B.CuSO4 C.NaCl D.Al(NO3)3
答案与分层梯度式解析
题型整合练 原电池和电解池组合装置分析
1.D 甲装置为燃料电池,乙装置为电解池;燃料电池中燃料在a电极发生失电子的氧化反应,a为负极,Y为阴极;氧气在b电极发生得电子的还原反应,b为正极,X为阳极。电子由负极(a电极)经导线流向Y电极,由阳极(X电极)经导线流向b电极,A正确;Y电极上氧气得电子生成H2O2,电极反应为O2+2e-+2H+ H2O2,B正确;氧气在b电极发生得电子的还原反应,C正确;乙中生成羟基自由基的反应为Fe2++H2O2+H+ Fe3++H2O+·OH,产生1 mol羟基自由基需消耗1 mol H2O2,结合选项B可知,需转移2 mol电子,则有2 mol H+转移,D错误。
2.A X极上产生的气体能使湿润的淀粉碘化钾试纸变蓝,说明X极生成氯气,为电解池阳极,发生失电子的氧化反应,电极反应式为 2Cl--2e- Cl2↑,则Y为阴极,发生得电子的还原反应,电极反应式为Cu2++2e- Cu;左端为原电池装置,A为正极,发生得电子的还原反应,B为负极,发生失电子的氧化反应。由分析可知,A项正确;电池工作一段时间后,丙池中Y极上析出Cu,X极的质量不变,两极的总质量增加,B项错误;当0.5 mol S通过阴离子交换膜时,根据电荷守恒可知,X极Cl-失去1 mol电子,收集到标准状况下11.2 L的氯气,C项错误;电子只能在导线中移动,不能流经电解质溶液,D项错误。
3.D 铅蓄电池中Pb为负极,PbO2为正极,电极a是铅蓄电池的负极,电极反应为Pb+S-2e- PbSO4,A项错误;电极c为电解池的阳极,电极d为阴极,电解池工作时阴离子向阳极迁移,阳离子向阴极迁移,则原料室中Na+通过N膜向电极d(阴极)移动,H2P通过M膜向电极c(阳极)移动,所以M膜为阴离子交换膜,N膜为阳离子交换膜,D项正确;原料室中H2P通过M膜进入产品室1,与双极膜产生的H+反应生成H3PO4,Na+通过N膜进入产品室2,产品室2制备的产品是NaOH,B项错误;电极c的电极反应式为4OH--4e- O2↑+2H2O,可知电路中通过4 mol电子时,产生O2的物质的量为1 mol,C项错误。
4.答案 (1)原电池 N2H4
(2)N2H4(g)-4e-+4OH- 4H2O+N2
(3)4Ag++2H2O 4Ag+O2↑+4H+
(4)B 1.6
解析 甲池为燃料电池,乙池、丙池都为电解池。在甲池中,通入N2H4的电极为负极,通入O2的电极为正极。在乙池中,A电极为阳极,B电极为阴极;在丙池中,C电极为阳极,D电极为阴极。(1)甲池是原电池,OH-向负极移动。(2)N2H4失去电子生成N2,电极反应式为N2H4(g)-4e-+4OH- 4H2O+N2。(3)乙池为电解池,电解AgNO3溶液时,A电极上水得电子生成O2和H+,电极反应式为2H2O-4e- O2↑+4H+,阴极上Ag+得电子生成银,则该电解装置中总反应的离子方程式为4Ag++ 2H2O 4Ag+O2↑+4H+。(4)电解MgSO4溶液时,Mg2+不放电,无金属生成,A错误;电解CuSO4溶液时,Cu2+得电子生成Cu,B正确;电解NaCl溶液时,Na+不放电,无金属生成,C错误;电解Al(NO3)3溶液时,Al3+不放电,无金属生成,D错误。当乙池中B(Ag)极的质量增加5.40 g时,n(Ag+)==0.05 mol,转移0.05 mol电子,依据得失电子守恒,生成0.025 mol Cu,质量为0.025 mol×64 g/mol=1.6 g。
2
1.MFC电芬顿技术不需要外加能量即可发生,通过产生羟基自由基(·OH)处理有机污染物,可获得高效的废水净化效果。其耦合系统原理示意图如下,下列说法不正确的是( )
A.电子移动方向为a→Y,X→b
B.Y电极上得到H2O2的反应为O2+2e-+2H+ H2O2
C.b电极上发生还原反应
D.理论上当乙中产生1 mol羟基自由基时,甲中有4 mol H+从M室移动到N室
2.某同学按如图所示的装置进行实验。电极A、B为两种常见金属,当K闭合时,X极上产生的气体能使湿润的淀粉碘化钾试纸变蓝。下列说法正确的是( )
A.A极和Y极上均发生还原反应,且Y极的电极反应式为Cu2++2e- Cu
B.电池工作一段时间后,丙池中两极的总质量不变
C.当0.5 mol S通过阴离子交换膜时,X极收集到标准状况下 22.4 L的气体
D.当0.1 mol B参与反应时,丙池中流经电解质溶液的电子数目约为1.204×1023
3.以铅蓄电池供电,利用双极膜(双极膜是一种复合膜,在直流电作用下,中间界面内水解离为H+和OH-,并实现其定向通过)电解制备磷酸和氢氧化钠的原理如图所示。下列说法正确的是( )
A.电极a的电极反应式:Pb-2e- Pb2+
B.产品室2制备的产品是磷酸
C.当电路中通过4 mol电子时,电极c上产生2 mol O2
D.M膜为阴离子交换膜,N膜为阳离子交换膜
4.结合下列电化学装置回答问题:
(1)图中甲池是 装置(填“电解池”或“原电池”),其中OH-移向通 的一极(填“N2H4”或“O2”)。
(2)写出通入N2H4的电极的电极反应式: 。
(3)乙池中总反应的离子方程式为 。
(4)当乙池中B(Ag)极的质量增加5.40 g时,丙池也有金属析出,则丙中的某盐溶液可能是 (填字母),此时丙池某电极析出 g金属。
A.MgSO4 B.CuSO4 C.NaCl D.Al(NO3)3
答案与分层梯度式解析
题型整合练 原电池和电解池组合装置分析
1.D 甲装置为燃料电池,乙装置为电解池;燃料电池中燃料在a电极发生失电子的氧化反应,a为负极,Y为阴极;氧气在b电极发生得电子的还原反应,b为正极,X为阳极。电子由负极(a电极)经导线流向Y电极,由阳极(X电极)经导线流向b电极,A正确;Y电极上氧气得电子生成H2O2,电极反应为O2+2e-+2H+ H2O2,B正确;氧气在b电极发生得电子的还原反应,C正确;乙中生成羟基自由基的反应为Fe2++H2O2+H+ Fe3++H2O+·OH,产生1 mol羟基自由基需消耗1 mol H2O2,结合选项B可知,需转移2 mol电子,则有2 mol H+转移,D错误。
2.A X极上产生的气体能使湿润的淀粉碘化钾试纸变蓝,说明X极生成氯气,为电解池阳极,发生失电子的氧化反应,电极反应式为 2Cl--2e- Cl2↑,则Y为阴极,发生得电子的还原反应,电极反应式为Cu2++2e- Cu;左端为原电池装置,A为正极,发生得电子的还原反应,B为负极,发生失电子的氧化反应。由分析可知,A项正确;电池工作一段时间后,丙池中Y极上析出Cu,X极的质量不变,两极的总质量增加,B项错误;当0.5 mol S通过阴离子交换膜时,根据电荷守恒可知,X极Cl-失去1 mol电子,收集到标准状况下11.2 L的氯气,C项错误;电子只能在导线中移动,不能流经电解质溶液,D项错误。
3.D 铅蓄电池中Pb为负极,PbO2为正极,电极a是铅蓄电池的负极,电极反应为Pb+S-2e- PbSO4,A项错误;电极c为电解池的阳极,电极d为阴极,电解池工作时阴离子向阳极迁移,阳离子向阴极迁移,则原料室中Na+通过N膜向电极d(阴极)移动,H2P通过M膜向电极c(阳极)移动,所以M膜为阴离子交换膜,N膜为阳离子交换膜,D项正确;原料室中H2P通过M膜进入产品室1,与双极膜产生的H+反应生成H3PO4,Na+通过N膜进入产品室2,产品室2制备的产品是NaOH,B项错误;电极c的电极反应式为4OH--4e- O2↑+2H2O,可知电路中通过4 mol电子时,产生O2的物质的量为1 mol,C项错误。
4.答案 (1)原电池 N2H4
(2)N2H4(g)-4e-+4OH- 4H2O+N2
(3)4Ag++2H2O 4Ag+O2↑+4H+
(4)B 1.6
解析 甲池为燃料电池,乙池、丙池都为电解池。在甲池中,通入N2H4的电极为负极,通入O2的电极为正极。在乙池中,A电极为阳极,B电极为阴极;在丙池中,C电极为阳极,D电极为阴极。(1)甲池是原电池,OH-向负极移动。(2)N2H4失去电子生成N2,电极反应式为N2H4(g)-4e-+4OH- 4H2O+N2。(3)乙池为电解池,电解AgNO3溶液时,A电极上水得电子生成O2和H+,电极反应式为2H2O-4e- O2↑+4H+,阴极上Ag+得电子生成银,则该电解装置中总反应的离子方程式为4Ag++ 2H2O 4Ag+O2↑+4H+。(4)电解MgSO4溶液时,Mg2+不放电,无金属生成,A错误;电解CuSO4溶液时,Cu2+得电子生成Cu,B正确;电解NaCl溶液时,Na+不放电,无金属生成,C错误;电解Al(NO3)3溶液时,Al3+不放电,无金属生成,D错误。当乙池中B(Ag)极的质量增加5.40 g时,n(Ag+)==0.05 mol,转移0.05 mol电子,依据得失电子守恒,生成0.025 mol Cu,质量为0.025 mol×64 g/mol=1.6 g。
2
