专题复习提升-《精讲精练》26版高中同步新教材化学苏教版(2019)选必修1
文档属性
| 名称 | 专题复习提升-《精讲精练》26版高中同步新教材化学苏教版(2019)选必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 773.1KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-10-28 18:10:14 | ||
图片预览




文档简介
本专题复习提升
易混易错练
易错点1 对标准燃烧热定义认识不清
1.下列热化学方程式书写正确的是( )
A.甲烷的标准燃烧热为ΔH=-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g) CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B.在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g) 2H2O(l) ΔH= -571.6 kJ·mol-1
C.HCl和NaOH发生中和反应生成1 mol H2O时放热57.3 kJ,则该反应的热化学方程式为HCl(aq)+NaOH(s) NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1
D.将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g)放热19.3 kJ,其热化学方程式为N2(g)+3H2(g) 2NH3(g) ΔH=-38.6 kJ·mol-1
2.已知E1=134 kJ·mol-1、E2=368 kJ·mol-1,根据要求回答问题。
图Ⅰ
图Ⅱ
(1)图Ⅰ是1 mol NO2(g)和1 mol CO(g)反应生成1 mol CO2和1 mol NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1将 (填“增大”“减小”或“不变”,下同),ΔH将 。请写出NO2和CO反应的热化学方程式: 。
(2)如表所示是部分化学键的键能。
化学键 P—P P—O OO PO
键能/(kJ·mol-1) a b c x
已知白磷的标准燃烧热为-d kJ·mol-1,白磷及其完全燃烧的产物的结构如图Ⅱ所示。1个P4O10分子中P—O键的个数为 ,表中x= (用含a、b、c、d的代数式表示)。
易错点2 盖斯定律应用错误
3.以N2O5为新型硝化剂的硝化反应具有反应条件温和、选择性高、无副反应发生、过程无污染等优点。N2O5可通过N2O4臭氧化法制备。
已知:①N2O4(g) 2NO2(g) ΔH1
②2O3(g) 3O2(g) ΔH2
③2N2O5(s) 4NO2(g)+O2(g) ΔH3
则N2O4(g)+O3(g) N2O5(s)+O2(g)的ΔH为( )
A.ΔH1+ΔH2-ΔH3 B.2ΔH1-ΔH2+ΔH3
C.ΔH1+ΔH2-ΔH3 D.2ΔH1+ΔH2+ΔH3
4.将甲醇蒸气转化为氢气的两种反应的热化学方程式如下:
①CH3OH(g)+H2O(g) CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+O2(g) CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
又知③H2O(g) H2O(l) ΔH=-44 kJ·mol-1,写出表示甲醇蒸气燃烧生成液态水的热化学方程式: 。
易错点3 忽略电池中介质的作用
5.利用膜技术原理和电化学原理制备少量硫酸和绿色硝化剂N2O5,装置如下,下列说法正确的是( )
A.电极b反应式是O2+4e-+2H2O 4OH-
B.甲中每消耗64 g SO2,乙中有2 mol H+通过隔膜
C.电极c反应式为N2O4-2e-+H2O N2O5+2H+
D.每转移2 mol电子,生成2 mol N2O5和7 mol H2SO4
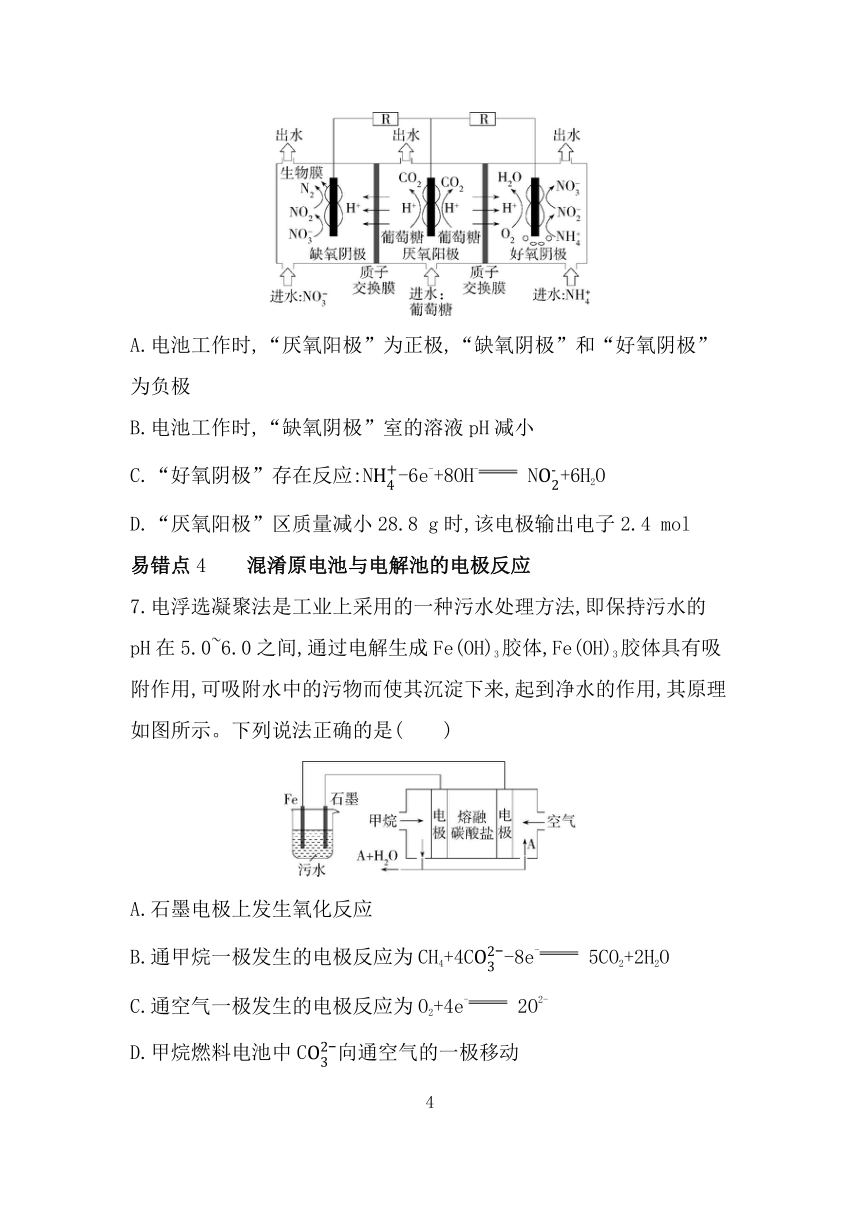
6.一种双阴极微生物燃料电池装置如图所示。该装置可以同时进行硝化和反硝化脱氮,其中硝化过程中N被O2氧化。下列叙述正确的是( )
A.电池工作时,“厌氧阳极”为正极,“缺氧阴极”和“好氧阴极”为负极
B.电池工作时,“缺氧阴极”室的溶液pH减小
C.“好氧阴极”存在反应:N-6e-+8OH- N+6H2O
D.“厌氧阳极”区质量减小28.8 g时,该电极输出电子2.4 mol
易错点4 混淆原电池与电解池的电极反应
7.电浮选凝聚法是工业上采用的一种污水处理方法,即保持污水的 pH在5.0~6.0之间,通过电解生成Fe(OH)3胶体,Fe(OH)3胶体具有吸附作用,可吸附水中的污物而使其沉淀下来,起到净水的作用,其原理如图所示。下列说法正确的是( )
A.石墨电极上发生氧化反应
B.通甲烷一极发生的电极反应为CH4+4C-8e- 5CO2+2H2O
C.通空气一极发生的电极反应为O2+4e- 2O2-
D.甲烷燃料电池中C向通空气的一极移动
8.液流电池是一种新的蓄电池,是利用正、负极电解液分开,各自循环的一种高性能蓄电池,具有容量高、使用领域(环境)广、循环使用寿命长的特点。如图是一种锌溴液流电池,电解液为溴化锌的水溶液。下列说法正确的是( )
A.充电时阳极的电极反应式:Zn-2e- Zn2+
B.充电时电极a为外接电源的负极
C.放电时Br-向右侧电极移动
D.放电时左侧电解质储罐中的离子总浓度增大
思想方法练
建模思想在电化学中的应用
方法概述
针对电化学中电池工作原理、电解的工作原理的分析和电极反应式的书写等问题,构建“定物、定极、定流向”的思维模型,有利于快速解答相关问题。
(1)“定物”——在方程式中先选择好相应的物质,根据其中元素化合价的变化判断各物质发生反应的类型。(2)“定极”——根据物质发生反应的类型确定电极的名称。(3)“定流向”——根据电极反应或反应现象,分析电子流向和电解质溶液中阴、阳离子的移动方向。
1.某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。下列说法正确的是( )
A.该装置将化学能转化为光能和电能
B.该装置工作时,H+从b极区向a极区迁移
C.每生成1 mol O2,有44 g CO2被还原
D.a电极的反应为3CO2+18H+-18e- C3H8O+5H2O
2.原油中的硫化氢可采用电化学法处理,并制取氢气,其原理如图所示。
下列说法错误的是( )
A.电解池中电极a为阳极
B.从反应池进入电解池的溶液溶质为FeCl2
C.H+通过离子交换膜到电解池右极室
D.生成5.6 L(标准状况)H2,理论上在反应池中生成0.25 mol S沉淀
3.控制合适的条件,将反应2Fe3++2I- 2Fe2++I2设计成如图所示原电池(盐桥中成分为饱和KCl溶液和琼脂),下列判断不正确的是( )
A.反应开始时,电流方向是从甲中石墨经导线流向乙中石墨
B.反应开始时,甲中石墨电极上Fe3+被还原
C.灵敏电流计示数为零时,反应达到化学平衡状态
D.灵敏电流计示数为零后,在甲中加入FeCl2固体,灵敏电流计指针不会发生偏转
4.利用微生物电化学处理有机废水,同时可淡化海水并获得酸碱。现以NaCl溶液模拟海水、采用惰性电极,用如下图所示的装置处理有机废水(以含有机酸CH3COOH为例),在直流电场作用下,双极膜间的水解离成H+和OH-。下列说法正确的是 ( )
A.膜a为阴离子交换膜,膜b为阳离子交换膜
B.产品室生成的物质为盐酸
C.当阴极产生22.4 L气体时,理论上可除去模拟海水中11.7 g NaCl
D.阳极反应式为CH3COOH+2H2O+8e- 2CO2↑+8H+
5.工业中常采用歧化法制备KMnO4:3K2MnO4+ 2CO2 2KMnO4+MnO2↓+2K2CO3;利用电解法也可以实现由K2MnO4向 KMnO4的转化,其装置如图。下列说法不正确的是( )
A.与歧化法相比电解法明显优点是Mn元素的利用率高
B.电源m为正极,n为负极
C.阴极每产生4.48 L(标准状况下)H2,则有0.2 mol的K+迁移至阴极
D.总反应为2K2MnO4+2H2O 2KMnO4+2KOH+H2↑
6.下图是实现对天然气中CO2和H2S高效去除的协同转化装置,电极材料是ZnO@石墨烯(石墨烯包裹的ZnO)和石墨烯。下列有关该电池的说法正确的是( )
A.电池工作时将化学能转化为电能
B.石墨烯电极反应式为H2S-2e- S+2H+
C.电池总反应方程式为CO2+H2S CO+H2O+S↓
D.电池工作过程中每转移2 mol电子,理论上可处理标准状况下CO2和H2S气体总体积为22.4 L
7.某兴趣小组的同学用如图所示装置研究有关电化学的问题。当闭合该装置的电键时,观察到电流表的指针发生了偏转。(电解质溶液均足量)
请回答下列问题:
(1)甲池为 (填“原电池”“电解池”或“电镀池”),通入O2电极的电极反应式为 。
(2)乙池中A(石墨)电极的名称为 (填“正极”“负极”“阴极”或“阳极”),总反应的离子方程式为 。
(3)当乙池中B极质量增加2.16 g时,甲池中理论上消耗O2的体积为 mL(标准状况下),此时若要将乙池复原需向乙池加一定量的 (填化学式)。
(4)丙池中电极C的电极反应为 ,若丙池中电极不变,将其溶液换成NaCl溶液,电键闭合一段时间后,丙池中溶液的pH将 (填“增大”“减小”或“不变”)。
答案与分层梯度式解析
本专题复习提升
易混易错练
1.B 标准燃烧热是指101 kPa下,1 mol物质完全燃烧的反应热,生成的水应为液态(25 ℃),热化学方程式应为CH4(g)+2O2(g) CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1,A项错误;2 g即1 mol H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式为2H2(g)+O2(g) 2H2O(l) ΔH=-571.6 kJ·mol-1,B项正确;NaOH(s)溶于水会放出热量,若表示HCl和NaOH中和反应的反应热,则NaOH应为溶液,热化学方程式为HCl(aq)+NaOH(aq) NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1,C项错误;该反应为可逆反应,则生成2 mol NH3时放出的热量大于38.6 kJ,D项错误。
易错提示 解答有关标准燃烧热的题目时应注意几个要点:1 mol可燃物,101 kPa,25 ℃时,完全燃烧生成指定产物[N→N2(g),H→H2O(l),C→CO2(g)]。
2.答案 (1)减小 不变 NO2(g)+CO(g) CO2(g)+NO(g) ΔH= -234 kJ·mol-1
(2)12
解析 (1)催化剂能降低反应的活化能,则E1和E2都减小,催化剂不能改变反应焓变;由图Ⅰ可知,1 mol NO2(g)和1 mol CO(g)反应生成1 mol CO2(g)和1 mol NO(g)放出热量368 kJ-134 kJ=234 kJ,该反应的热化学方程式为NO2(g)+CO(g) NO(g)+CO2(g) ΔH=-234 kJ· mol-1。(2)白磷燃烧的化学方程式为P4+5O2 P4O10,根据图Ⅱ,1 mol白磷完全燃烧断裂6 mol P—P键、5 mol 键,形成12 mol P—O键、4 mol 键,所以-d kJ·mol-1=6a kJ·mol-1+5c kJ· mol-1-12b kJ·mol-1-4x kJ·mol-1,x=。
3.C 根据盖斯定律,由①+×②-×③得反应N2O4(g)+O3(g) N2O5(s)+O2(g),故该反应的ΔH=ΔH1+ΔH2-ΔH3,故选C。
易错提示 观察不仔细,在根据盖斯定律进行方程式相加或相减时计算错误。
4.答案 CH3OH(g)+O2(g) CO2(g)+2H2O(l) ΔH=-764.7 kJ· mol-1
解析 根据盖斯定律,② 3-① 2+③ 2可得CH3OH(g)+O2(g) CO2(g)+2H2O(l) ΔH=(-192.9 kJ·mol-1) 3-(+49.0 kJ·mol-1) 2+(-44 kJ·mol-1) 2=-764.7 kJ·mol-1。
5.B SO2在a极发生失电子的氧化反应,生成H2SO4,则a为负极,b为正极;与a相连的d为电解池阴极,c为电解池阳极。电极b为正极,酸性条件下,氧气在正极得到电子发生还原反应生成水,电极反应式为O2+4H++4e- 2H2O,A项错误;电极a发生反应:SO2+2H2O-2e- S+4H+,1 mol(64 g)SO2失去2 mol电子,电极d的电极反应式为 2H++2e- H2↑,由得失电子守恒可知,有2 mol H+通过隔膜由左侧移向右侧,B项正确;电极c为阳极,N2O4在阳极失去电子发生氧化反应生成N2O5,阳极室中不含水,电极反应式为N2O4+2HNO3-2e- 2N2O5+2H+,C项错误;分析电极a和电极c的电极反应式,每转移2 mol电子,电极c生成2 mol N2O5,电极a生成1 mol H2SO4,D项错误。
易错提示 忽视“无水”的含义,一是无水硝酸中硝酸以分子形式存在,二是电极c上发生的反应不能有水参与。
6.D “厌氧阳极”上,C6H12O6失去电子,发生氧化反应,为负极,电极反应式为C6H12O6+6H2O-24e- 6CO2↑+24H+;“缺氧阴极”上,N得到电子生成NO2,发生还原反应,为正极,NO2再转化为N2,电极反应式分别为:N+e-+2H+ NO2↑+H2O、2NO2+8e-+8H+ N2+4H2O;“好氧阴极”上,O2得到电子,发生还原反应,为正极,电极反应式为O2+4H++ 4e- 2H2O,同时O2还能将N氧化生成N,N还可以被O2氧化为N,化学方程式分别为2N+3O2 2N+2H2O+4H+、2N+O2 2N。由分析可知,A、C错误;电池工作时,“缺氧阴极”上消耗的H+比进入缺氧阴极室的H+多,其溶液pH增大,B错误;“厌氧阳极”的电极反应式为C6H12O6+6H2O-24e- 6CO2↑+24H+,每消耗 1 mol C6H12O6和6 mol H2O,转移24 mol电子,“厌氧阳极”区质量减小288 g,故“厌氧阳极”区质量减小28.8 g时,该电极输出电子 2.4 mol,D正确。
易错提示 电极反应式的书写与电解质溶液有密切关系,酸性溶液中电极反应式不能出现OH-,碱性溶液中电极反应式不能出现H+;一般出现质子交换膜时,其所在环境为酸性。
7.B 由题图可知通入CH4的一极为原电池的负极, 与之相连的石墨电极为电解池的阴极,通入空气的一极为原电池的正极,与之相连的Fe电极为电解池的阳极。阴极上发生还原反应,A错误;以熔融的碳酸盐为电解质,通甲烷的一极作为负极,电极反应为CH4+4C-8e- 5CO2+2H2O,B正确;通空气的一极为正极,电极反应为O2+2CO2+4e- 2C,C错误;在原电池内部,阴离子向负极移动,所以甲烷燃料电池中C向通甲烷的一极移动,D错误。
8.D 该电池的负极为锌,放电时负极的电极反应式为Zn-2e- Zn2+,A错误;在充电时,原电池的正极连接外接电源的正极,是电解池的阳极,所以充电时电极a为外接电源的正极,B错误;放电时为原电池,在原电池中间隔着一个阳离子交换膜,所以Br-不能向右侧电极移动,C错误;放电时左侧生成溴离子,右侧生成的锌离子通过阳离子交换膜移向左侧,左侧电解质储罐中的离子总浓度增大,D正确。
思想方法练
1.B 该装置将电能和光能转化为化学能,A项错误;该装置工作时,H+从阳极区向阴极区迁移,B项正确;6CO2~9O2,每生成1 mol O2,有 mol CO2被还原,其质量是 g,C项错误;根据图示可知与电源负极连接的a电极为阴极,发生还原反应,电极反应式为3CO2+18H++18e- C3H8O+5H2O,D项错误。
方法点拨 含离子交换膜电化学装置题的解题步骤:
2.B 由图可知反应池中发生的反应为:2Fe3++H2S S↓+2Fe2++2H+,生成的Fe2+进入电解池在a极室放电生成Fe3+,电极反应式为Fe2+-e- Fe3+,故a为阳极,故A正确;FeCl3与H2S反应生成S、FeCl2和 HCl,则从反应池进入电解池的溶液溶质为FeCl2和HCl,B错误;在b极上生成H2,电极反应式为2H++2e- H2↑,H+通过离子交换膜由a极室进入b极室,C正确;由得失电子守恒得,1 mol H2~1 mol S,5.6 L(标准状况)H2,即0.25 mol H2,理论上在反应池中生成0.25 mol S沉淀,D正确。
方法点拨 通过图示分析出正、负极或阴、阳极。由题图可知在a电极上Fe2+转化为Fe3+,由此得出a为阳极,这是解题的突破口。
3.D 第1步:确定正、负极。由2Fe3++2I- 2Fe2++I2可知,开始时乙中碘离子失电子生成碘单质,乙中石墨电极为负极,而甲中铁离子发生得电子的还原反应生成亚铁离子,甲中石墨电极为正极。
第2步:分析移动方向。
(1)电子移动方向:从负极流出沿导线流入正极;
(2)电流移动方向:从正极沿导线流向负极;
(3)离子移动方向:电解质溶液中,阴离子向负极迁移,阳离子向正极迁移。
第3步:分析选项。电流方向是从甲中石墨经导线流向乙中石墨,A正确;由电池总反应知,Fe3+得电子被还原成Fe2+,B正确;当灵敏电流计示数为零时,各物质的浓度不变,则反应达到平衡状态,C正确;灵敏电流计示数为零后,甲中加入FeCl2,原有化学平衡被打破,灵敏电流计指针会发生偏转,D错误。
方法点拨 在确定原电池正、负极时需把握一个原则,就是负极发生氧化反应,正极发生还原反应,找出题中化合价发生变化的元素,进而确定正、负极的电极反应。
4.B 由题图可知,阳极上CH3COOH失去电子生成CO2,阴极上H+得电子生成H2,该电解池是利用微生物电化学处理有机废水,同时可淡化海水并获得酸碱,则H+通过双极膜向阴极移动,进入产品室,NaCl中 Na+和Cl-向两侧移动,以达到淡化海水的目的,Cl-通过膜b向阳极移动,进入产品室,则膜b为阴离子交换膜,产品室生成的物质为盐酸; Na+通过膜a向阴极移动,则膜a为阳离子交换膜,Na+进入阴极室,得到产品氢氧化钠。由分析可知,膜a为阳离子交换膜,膜b为阴离子交换膜,A项错误;H+通过双极膜进入产品室,氯离子通过膜b进入产品室,产品室生成的物质为盐酸,B项正确;未说明气体所处状况,无法通过气体摩尔体积计算,C项错误;阳极上CH3COOH失去电子生成 CO2,阳极反应式为CH3COOH+8OH--8e- 2CO2↑+6H2O,D项错误。
5.C 电解法K2MnO4~KMnO4,Mn元素的利用率达到100%,而歧化法 3K2MnO4~2KMnO4,Mn元素的利用率未达到100%,A正确;左侧K2MnO4中锰元素由+6价升高到KMnO4中的+7价,发生氧化反应,该电极是阳极,连接的直流电源m极是正极,则n极是负极,B正确;标准状况下 4.48 L H2的物质的量是0.2 mol,阴极为水电离产生的H+放电,反应式为2H2O+2e- H2↑+2OH-,产生0.2 mol H2,则电路中转移0.4 mol e-,电解质溶液中有0.4 mol的K+迁移至阴极,C错误;阳极反应式为Mn-e- Mn,结合阴极反应式,可得总反应为2K2MnO4+2H2O 2KMnO4+2KOH+H2↑,D正确。
6.C 整个过程的主要能量变化形式为:光能→电能→化学能,A错误;ZnO@石墨烯电极上发生的电极反应为CO2+2H++2e- CO+H2O,ZnO@石墨烯电极为阴极,石墨烯电极为阳极,阳极电极反应式为EDTA-Fe2+-e- EDTA-Fe3+,B错误;在阳极区发生反应EDTA-Fe2+-e- EDTA- Fe3+,2EDTA-Fe3++H2S 2EDTA-Fe2++2H++S↓,在阴极区发生反应CO2+2H++2e- CO+H2O,整个过程中EDTA-Fe2+相当于催化剂,所以协同转化总反应是将CO2和H2S转化为CO和S,故总反应为CO2+H2S CO+H2O+S↓,C正确;总反应为CO2+H2S CO+H2O+S↓,1 mol CO2参与反应,转移2 mol电子,电池工作过程中每转移2 mol电子,理论上可处理1 mol CO2和1 mol H2S,在标准状况下的总体积为44.8 L,D错误。
思维建模 分析电解过程的思维流程
7.答案 (1)原电池 O2+4e-+2H2O 4OH-
(2)阳极 4Ag++2H2O 4Ag+O2↑+4H+
(3)112 Ag2O
(4)2Cl--2e- Cl2↑ 增大
解析 由题图可知,甲池为甲醇燃料电池,通O2的一极为正极,电极反应式为O2+4e-+2H2O 4OH-,通甲醇的一极为负极,电极反应式为 CH3OH-6e-+8OH- C+6H2O;乙池为电解池,石墨电极A为阳极,电极反应式为2H2O-4e- 4H++O2↑,Ag电极B为阴极,电极反应式为 Ag++e- Ag;丙池为电解池,电极C为阳极,电极反应式为2Cl--2e- Cl2↑,电极D为阴极,电极反应式为Cu2++2e- Cu。(1)甲池为原电池,通入O2电极的电极反应式为O2+4e-+2H2O 4OH-。(2)乙池为电解池,石墨电极A为阳极,总反应式为4Ag++2H2O 4Ag+ O2↑+4H+。(3)当乙池中B极质量增加2.16 g,即析出2.16 g的Ag时,n(Ag)==0.02 mol,电子转移的物质的量也是0.02 mol,根据O2+4e-+2H2O 4OH-得出消耗O2的物质的量为0.005 mol,标准状况下体积为0.005 mol×22.4 L/mol×1000 mL/L=112 mL;乙池总反应为4Ag++2H2O 4Ag+O2↑+4H+,若要让溶液复原需要加入Ag2O。 (4)丙池中电极C的电极反应式为2Cl--2e- Cl2↑;若丙池中电极不变,将其溶液换成NaCl溶液,即用惰性电极电解NaCl溶液,总反应为2NaCl+2H2O Cl2↑+H2↑+2NaOH,由于生成了NaOH,则溶液的pH增大。
25
易混易错练
易错点1 对标准燃烧热定义认识不清
1.下列热化学方程式书写正确的是( )
A.甲烷的标准燃烧热为ΔH=-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g) CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B.在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g) 2H2O(l) ΔH= -571.6 kJ·mol-1
C.HCl和NaOH发生中和反应生成1 mol H2O时放热57.3 kJ,则该反应的热化学方程式为HCl(aq)+NaOH(s) NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1
D.将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g)放热19.3 kJ,其热化学方程式为N2(g)+3H2(g) 2NH3(g) ΔH=-38.6 kJ·mol-1
2.已知E1=134 kJ·mol-1、E2=368 kJ·mol-1,根据要求回答问题。
图Ⅰ
图Ⅱ
(1)图Ⅰ是1 mol NO2(g)和1 mol CO(g)反应生成1 mol CO2和1 mol NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1将 (填“增大”“减小”或“不变”,下同),ΔH将 。请写出NO2和CO反应的热化学方程式: 。
(2)如表所示是部分化学键的键能。
化学键 P—P P—O OO PO
键能/(kJ·mol-1) a b c x
已知白磷的标准燃烧热为-d kJ·mol-1,白磷及其完全燃烧的产物的结构如图Ⅱ所示。1个P4O10分子中P—O键的个数为 ,表中x= (用含a、b、c、d的代数式表示)。
易错点2 盖斯定律应用错误
3.以N2O5为新型硝化剂的硝化反应具有反应条件温和、选择性高、无副反应发生、过程无污染等优点。N2O5可通过N2O4臭氧化法制备。
已知:①N2O4(g) 2NO2(g) ΔH1
②2O3(g) 3O2(g) ΔH2
③2N2O5(s) 4NO2(g)+O2(g) ΔH3
则N2O4(g)+O3(g) N2O5(s)+O2(g)的ΔH为( )
A.ΔH1+ΔH2-ΔH3 B.2ΔH1-ΔH2+ΔH3
C.ΔH1+ΔH2-ΔH3 D.2ΔH1+ΔH2+ΔH3
4.将甲醇蒸气转化为氢气的两种反应的热化学方程式如下:
①CH3OH(g)+H2O(g) CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+O2(g) CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
又知③H2O(g) H2O(l) ΔH=-44 kJ·mol-1,写出表示甲醇蒸气燃烧生成液态水的热化学方程式: 。
易错点3 忽略电池中介质的作用
5.利用膜技术原理和电化学原理制备少量硫酸和绿色硝化剂N2O5,装置如下,下列说法正确的是( )
A.电极b反应式是O2+4e-+2H2O 4OH-
B.甲中每消耗64 g SO2,乙中有2 mol H+通过隔膜
C.电极c反应式为N2O4-2e-+H2O N2O5+2H+
D.每转移2 mol电子,生成2 mol N2O5和7 mol H2SO4
6.一种双阴极微生物燃料电池装置如图所示。该装置可以同时进行硝化和反硝化脱氮,其中硝化过程中N被O2氧化。下列叙述正确的是( )
A.电池工作时,“厌氧阳极”为正极,“缺氧阴极”和“好氧阴极”为负极
B.电池工作时,“缺氧阴极”室的溶液pH减小
C.“好氧阴极”存在反应:N-6e-+8OH- N+6H2O
D.“厌氧阳极”区质量减小28.8 g时,该电极输出电子2.4 mol
易错点4 混淆原电池与电解池的电极反应
7.电浮选凝聚法是工业上采用的一种污水处理方法,即保持污水的 pH在5.0~6.0之间,通过电解生成Fe(OH)3胶体,Fe(OH)3胶体具有吸附作用,可吸附水中的污物而使其沉淀下来,起到净水的作用,其原理如图所示。下列说法正确的是( )
A.石墨电极上发生氧化反应
B.通甲烷一极发生的电极反应为CH4+4C-8e- 5CO2+2H2O
C.通空气一极发生的电极反应为O2+4e- 2O2-
D.甲烷燃料电池中C向通空气的一极移动
8.液流电池是一种新的蓄电池,是利用正、负极电解液分开,各自循环的一种高性能蓄电池,具有容量高、使用领域(环境)广、循环使用寿命长的特点。如图是一种锌溴液流电池,电解液为溴化锌的水溶液。下列说法正确的是( )
A.充电时阳极的电极反应式:Zn-2e- Zn2+
B.充电时电极a为外接电源的负极
C.放电时Br-向右侧电极移动
D.放电时左侧电解质储罐中的离子总浓度增大
思想方法练
建模思想在电化学中的应用
方法概述
针对电化学中电池工作原理、电解的工作原理的分析和电极反应式的书写等问题,构建“定物、定极、定流向”的思维模型,有利于快速解答相关问题。
(1)“定物”——在方程式中先选择好相应的物质,根据其中元素化合价的变化判断各物质发生反应的类型。(2)“定极”——根据物质发生反应的类型确定电极的名称。(3)“定流向”——根据电极反应或反应现象,分析电子流向和电解质溶液中阴、阳离子的移动方向。
1.某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。下列说法正确的是( )
A.该装置将化学能转化为光能和电能
B.该装置工作时,H+从b极区向a极区迁移
C.每生成1 mol O2,有44 g CO2被还原
D.a电极的反应为3CO2+18H+-18e- C3H8O+5H2O
2.原油中的硫化氢可采用电化学法处理,并制取氢气,其原理如图所示。
下列说法错误的是( )
A.电解池中电极a为阳极
B.从反应池进入电解池的溶液溶质为FeCl2
C.H+通过离子交换膜到电解池右极室
D.生成5.6 L(标准状况)H2,理论上在反应池中生成0.25 mol S沉淀
3.控制合适的条件,将反应2Fe3++2I- 2Fe2++I2设计成如图所示原电池(盐桥中成分为饱和KCl溶液和琼脂),下列判断不正确的是( )
A.反应开始时,电流方向是从甲中石墨经导线流向乙中石墨
B.反应开始时,甲中石墨电极上Fe3+被还原
C.灵敏电流计示数为零时,反应达到化学平衡状态
D.灵敏电流计示数为零后,在甲中加入FeCl2固体,灵敏电流计指针不会发生偏转
4.利用微生物电化学处理有机废水,同时可淡化海水并获得酸碱。现以NaCl溶液模拟海水、采用惰性电极,用如下图所示的装置处理有机废水(以含有机酸CH3COOH为例),在直流电场作用下,双极膜间的水解离成H+和OH-。下列说法正确的是 ( )
A.膜a为阴离子交换膜,膜b为阳离子交换膜
B.产品室生成的物质为盐酸
C.当阴极产生22.4 L气体时,理论上可除去模拟海水中11.7 g NaCl
D.阳极反应式为CH3COOH+2H2O+8e- 2CO2↑+8H+
5.工业中常采用歧化法制备KMnO4:3K2MnO4+ 2CO2 2KMnO4+MnO2↓+2K2CO3;利用电解法也可以实现由K2MnO4向 KMnO4的转化,其装置如图。下列说法不正确的是( )
A.与歧化法相比电解法明显优点是Mn元素的利用率高
B.电源m为正极,n为负极
C.阴极每产生4.48 L(标准状况下)H2,则有0.2 mol的K+迁移至阴极
D.总反应为2K2MnO4+2H2O 2KMnO4+2KOH+H2↑
6.下图是实现对天然气中CO2和H2S高效去除的协同转化装置,电极材料是ZnO@石墨烯(石墨烯包裹的ZnO)和石墨烯。下列有关该电池的说法正确的是( )
A.电池工作时将化学能转化为电能
B.石墨烯电极反应式为H2S-2e- S+2H+
C.电池总反应方程式为CO2+H2S CO+H2O+S↓
D.电池工作过程中每转移2 mol电子,理论上可处理标准状况下CO2和H2S气体总体积为22.4 L
7.某兴趣小组的同学用如图所示装置研究有关电化学的问题。当闭合该装置的电键时,观察到电流表的指针发生了偏转。(电解质溶液均足量)
请回答下列问题:
(1)甲池为 (填“原电池”“电解池”或“电镀池”),通入O2电极的电极反应式为 。
(2)乙池中A(石墨)电极的名称为 (填“正极”“负极”“阴极”或“阳极”),总反应的离子方程式为 。
(3)当乙池中B极质量增加2.16 g时,甲池中理论上消耗O2的体积为 mL(标准状况下),此时若要将乙池复原需向乙池加一定量的 (填化学式)。
(4)丙池中电极C的电极反应为 ,若丙池中电极不变,将其溶液换成NaCl溶液,电键闭合一段时间后,丙池中溶液的pH将 (填“增大”“减小”或“不变”)。
答案与分层梯度式解析
本专题复习提升
易混易错练
1.B 标准燃烧热是指101 kPa下,1 mol物质完全燃烧的反应热,生成的水应为液态(25 ℃),热化学方程式应为CH4(g)+2O2(g) CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1,A项错误;2 g即1 mol H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式为2H2(g)+O2(g) 2H2O(l) ΔH=-571.6 kJ·mol-1,B项正确;NaOH(s)溶于水会放出热量,若表示HCl和NaOH中和反应的反应热,则NaOH应为溶液,热化学方程式为HCl(aq)+NaOH(aq) NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1,C项错误;该反应为可逆反应,则生成2 mol NH3时放出的热量大于38.6 kJ,D项错误。
易错提示 解答有关标准燃烧热的题目时应注意几个要点:1 mol可燃物,101 kPa,25 ℃时,完全燃烧生成指定产物[N→N2(g),H→H2O(l),C→CO2(g)]。
2.答案 (1)减小 不变 NO2(g)+CO(g) CO2(g)+NO(g) ΔH= -234 kJ·mol-1
(2)12
解析 (1)催化剂能降低反应的活化能,则E1和E2都减小,催化剂不能改变反应焓变;由图Ⅰ可知,1 mol NO2(g)和1 mol CO(g)反应生成1 mol CO2(g)和1 mol NO(g)放出热量368 kJ-134 kJ=234 kJ,该反应的热化学方程式为NO2(g)+CO(g) NO(g)+CO2(g) ΔH=-234 kJ· mol-1。(2)白磷燃烧的化学方程式为P4+5O2 P4O10,根据图Ⅱ,1 mol白磷完全燃烧断裂6 mol P—P键、5 mol 键,形成12 mol P—O键、4 mol 键,所以-d kJ·mol-1=6a kJ·mol-1+5c kJ· mol-1-12b kJ·mol-1-4x kJ·mol-1,x=。
3.C 根据盖斯定律,由①+×②-×③得反应N2O4(g)+O3(g) N2O5(s)+O2(g),故该反应的ΔH=ΔH1+ΔH2-ΔH3,故选C。
易错提示 观察不仔细,在根据盖斯定律进行方程式相加或相减时计算错误。
4.答案 CH3OH(g)+O2(g) CO2(g)+2H2O(l) ΔH=-764.7 kJ· mol-1
解析 根据盖斯定律,② 3-① 2+③ 2可得CH3OH(g)+O2(g) CO2(g)+2H2O(l) ΔH=(-192.9 kJ·mol-1) 3-(+49.0 kJ·mol-1) 2+(-44 kJ·mol-1) 2=-764.7 kJ·mol-1。
5.B SO2在a极发生失电子的氧化反应,生成H2SO4,则a为负极,b为正极;与a相连的d为电解池阴极,c为电解池阳极。电极b为正极,酸性条件下,氧气在正极得到电子发生还原反应生成水,电极反应式为O2+4H++4e- 2H2O,A项错误;电极a发生反应:SO2+2H2O-2e- S+4H+,1 mol(64 g)SO2失去2 mol电子,电极d的电极反应式为 2H++2e- H2↑,由得失电子守恒可知,有2 mol H+通过隔膜由左侧移向右侧,B项正确;电极c为阳极,N2O4在阳极失去电子发生氧化反应生成N2O5,阳极室中不含水,电极反应式为N2O4+2HNO3-2e- 2N2O5+2H+,C项错误;分析电极a和电极c的电极反应式,每转移2 mol电子,电极c生成2 mol N2O5,电极a生成1 mol H2SO4,D项错误。
易错提示 忽视“无水”的含义,一是无水硝酸中硝酸以分子形式存在,二是电极c上发生的反应不能有水参与。
6.D “厌氧阳极”上,C6H12O6失去电子,发生氧化反应,为负极,电极反应式为C6H12O6+6H2O-24e- 6CO2↑+24H+;“缺氧阴极”上,N得到电子生成NO2,发生还原反应,为正极,NO2再转化为N2,电极反应式分别为:N+e-+2H+ NO2↑+H2O、2NO2+8e-+8H+ N2+4H2O;“好氧阴极”上,O2得到电子,发生还原反应,为正极,电极反应式为O2+4H++ 4e- 2H2O,同时O2还能将N氧化生成N,N还可以被O2氧化为N,化学方程式分别为2N+3O2 2N+2H2O+4H+、2N+O2 2N。由分析可知,A、C错误;电池工作时,“缺氧阴极”上消耗的H+比进入缺氧阴极室的H+多,其溶液pH增大,B错误;“厌氧阳极”的电极反应式为C6H12O6+6H2O-24e- 6CO2↑+24H+,每消耗 1 mol C6H12O6和6 mol H2O,转移24 mol电子,“厌氧阳极”区质量减小288 g,故“厌氧阳极”区质量减小28.8 g时,该电极输出电子 2.4 mol,D正确。
易错提示 电极反应式的书写与电解质溶液有密切关系,酸性溶液中电极反应式不能出现OH-,碱性溶液中电极反应式不能出现H+;一般出现质子交换膜时,其所在环境为酸性。
7.B 由题图可知通入CH4的一极为原电池的负极, 与之相连的石墨电极为电解池的阴极,通入空气的一极为原电池的正极,与之相连的Fe电极为电解池的阳极。阴极上发生还原反应,A错误;以熔融的碳酸盐为电解质,通甲烷的一极作为负极,电极反应为CH4+4C-8e- 5CO2+2H2O,B正确;通空气的一极为正极,电极反应为O2+2CO2+4e- 2C,C错误;在原电池内部,阴离子向负极移动,所以甲烷燃料电池中C向通甲烷的一极移动,D错误。
8.D 该电池的负极为锌,放电时负极的电极反应式为Zn-2e- Zn2+,A错误;在充电时,原电池的正极连接外接电源的正极,是电解池的阳极,所以充电时电极a为外接电源的正极,B错误;放电时为原电池,在原电池中间隔着一个阳离子交换膜,所以Br-不能向右侧电极移动,C错误;放电时左侧生成溴离子,右侧生成的锌离子通过阳离子交换膜移向左侧,左侧电解质储罐中的离子总浓度增大,D正确。
思想方法练
1.B 该装置将电能和光能转化为化学能,A项错误;该装置工作时,H+从阳极区向阴极区迁移,B项正确;6CO2~9O2,每生成1 mol O2,有 mol CO2被还原,其质量是 g,C项错误;根据图示可知与电源负极连接的a电极为阴极,发生还原反应,电极反应式为3CO2+18H++18e- C3H8O+5H2O,D项错误。
方法点拨 含离子交换膜电化学装置题的解题步骤:
2.B 由图可知反应池中发生的反应为:2Fe3++H2S S↓+2Fe2++2H+,生成的Fe2+进入电解池在a极室放电生成Fe3+,电极反应式为Fe2+-e- Fe3+,故a为阳极,故A正确;FeCl3与H2S反应生成S、FeCl2和 HCl,则从反应池进入电解池的溶液溶质为FeCl2和HCl,B错误;在b极上生成H2,电极反应式为2H++2e- H2↑,H+通过离子交换膜由a极室进入b极室,C正确;由得失电子守恒得,1 mol H2~1 mol S,5.6 L(标准状况)H2,即0.25 mol H2,理论上在反应池中生成0.25 mol S沉淀,D正确。
方法点拨 通过图示分析出正、负极或阴、阳极。由题图可知在a电极上Fe2+转化为Fe3+,由此得出a为阳极,这是解题的突破口。
3.D 第1步:确定正、负极。由2Fe3++2I- 2Fe2++I2可知,开始时乙中碘离子失电子生成碘单质,乙中石墨电极为负极,而甲中铁离子发生得电子的还原反应生成亚铁离子,甲中石墨电极为正极。
第2步:分析移动方向。
(1)电子移动方向:从负极流出沿导线流入正极;
(2)电流移动方向:从正极沿导线流向负极;
(3)离子移动方向:电解质溶液中,阴离子向负极迁移,阳离子向正极迁移。
第3步:分析选项。电流方向是从甲中石墨经导线流向乙中石墨,A正确;由电池总反应知,Fe3+得电子被还原成Fe2+,B正确;当灵敏电流计示数为零时,各物质的浓度不变,则反应达到平衡状态,C正确;灵敏电流计示数为零后,甲中加入FeCl2,原有化学平衡被打破,灵敏电流计指针会发生偏转,D错误。
方法点拨 在确定原电池正、负极时需把握一个原则,就是负极发生氧化反应,正极发生还原反应,找出题中化合价发生变化的元素,进而确定正、负极的电极反应。
4.B 由题图可知,阳极上CH3COOH失去电子生成CO2,阴极上H+得电子生成H2,该电解池是利用微生物电化学处理有机废水,同时可淡化海水并获得酸碱,则H+通过双极膜向阴极移动,进入产品室,NaCl中 Na+和Cl-向两侧移动,以达到淡化海水的目的,Cl-通过膜b向阳极移动,进入产品室,则膜b为阴离子交换膜,产品室生成的物质为盐酸; Na+通过膜a向阴极移动,则膜a为阳离子交换膜,Na+进入阴极室,得到产品氢氧化钠。由分析可知,膜a为阳离子交换膜,膜b为阴离子交换膜,A项错误;H+通过双极膜进入产品室,氯离子通过膜b进入产品室,产品室生成的物质为盐酸,B项正确;未说明气体所处状况,无法通过气体摩尔体积计算,C项错误;阳极上CH3COOH失去电子生成 CO2,阳极反应式为CH3COOH+8OH--8e- 2CO2↑+6H2O,D项错误。
5.C 电解法K2MnO4~KMnO4,Mn元素的利用率达到100%,而歧化法 3K2MnO4~2KMnO4,Mn元素的利用率未达到100%,A正确;左侧K2MnO4中锰元素由+6价升高到KMnO4中的+7价,发生氧化反应,该电极是阳极,连接的直流电源m极是正极,则n极是负极,B正确;标准状况下 4.48 L H2的物质的量是0.2 mol,阴极为水电离产生的H+放电,反应式为2H2O+2e- H2↑+2OH-,产生0.2 mol H2,则电路中转移0.4 mol e-,电解质溶液中有0.4 mol的K+迁移至阴极,C错误;阳极反应式为Mn-e- Mn,结合阴极反应式,可得总反应为2K2MnO4+2H2O 2KMnO4+2KOH+H2↑,D正确。
6.C 整个过程的主要能量变化形式为:光能→电能→化学能,A错误;ZnO@石墨烯电极上发生的电极反应为CO2+2H++2e- CO+H2O,ZnO@石墨烯电极为阴极,石墨烯电极为阳极,阳极电极反应式为EDTA-Fe2+-e- EDTA-Fe3+,B错误;在阳极区发生反应EDTA-Fe2+-e- EDTA- Fe3+,2EDTA-Fe3++H2S 2EDTA-Fe2++2H++S↓,在阴极区发生反应CO2+2H++2e- CO+H2O,整个过程中EDTA-Fe2+相当于催化剂,所以协同转化总反应是将CO2和H2S转化为CO和S,故总反应为CO2+H2S CO+H2O+S↓,C正确;总反应为CO2+H2S CO+H2O+S↓,1 mol CO2参与反应,转移2 mol电子,电池工作过程中每转移2 mol电子,理论上可处理1 mol CO2和1 mol H2S,在标准状况下的总体积为44.8 L,D错误。
思维建模 分析电解过程的思维流程
7.答案 (1)原电池 O2+4e-+2H2O 4OH-
(2)阳极 4Ag++2H2O 4Ag+O2↑+4H+
(3)112 Ag2O
(4)2Cl--2e- Cl2↑ 增大
解析 由题图可知,甲池为甲醇燃料电池,通O2的一极为正极,电极反应式为O2+4e-+2H2O 4OH-,通甲醇的一极为负极,电极反应式为 CH3OH-6e-+8OH- C+6H2O;乙池为电解池,石墨电极A为阳极,电极反应式为2H2O-4e- 4H++O2↑,Ag电极B为阴极,电极反应式为 Ag++e- Ag;丙池为电解池,电极C为阳极,电极反应式为2Cl--2e- Cl2↑,电极D为阴极,电极反应式为Cu2++2e- Cu。(1)甲池为原电池,通入O2电极的电极反应式为O2+4e-+2H2O 4OH-。(2)乙池为电解池,石墨电极A为阳极,总反应式为4Ag++2H2O 4Ag+ O2↑+4H+。(3)当乙池中B极质量增加2.16 g,即析出2.16 g的Ag时,n(Ag)==0.02 mol,电子转移的物质的量也是0.02 mol,根据O2+4e-+2H2O 4OH-得出消耗O2的物质的量为0.005 mol,标准状况下体积为0.005 mol×22.4 L/mol×1000 mL/L=112 mL;乙池总反应为4Ag++2H2O 4Ag+O2↑+4H+,若要让溶液复原需要加入Ag2O。 (4)丙池中电极C的电极反应式为2Cl--2e- Cl2↑;若丙池中电极不变,将其溶液换成NaCl溶液,即用惰性电极电解NaCl溶液,总反应为2NaCl+2H2O Cl2↑+H2↑+2NaOH,由于生成了NaOH,则溶液的pH增大。
25
