专题复习提升-《精讲精练》26版高中同步新教材化学苏教版(2019)选必修1
文档属性
| 名称 | 专题复习提升-《精讲精练》26版高中同步新教材化学苏教版(2019)选必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 350.6KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-10-28 18:10:14 | ||
图片预览




文档简介
本专题复习提升
易混易错练
易错点1 对溶液酸碱性或pH分析错误
1.常温下用0.1 mol/L NaOH溶液滴定20 mL 0.1 mol/L盐酸,恰好中和后不慎多加了1滴NaOH溶液(1滴溶液的体积以0.05 mL计),再往锥形瓶中加蒸馏水至反应液的总体积为50 mL,此时混合溶液的pH约为( )
A.4 B.7.2 C.10 D.11.3
2.下列说法不正确的是(已知:lg2=0.3)( )
A.c(H+)=的溶液一定呈中性
B.Ka大的酸溶液中c(H+)一定比Ka小的酸溶液中c(H+)大
C.将pH=2的盐酸和pH=4的硫酸等体积混合(混合后体积变化不计),所得溶液pH=2.3
D.常温下,某溶液中由水电离出的c(H+)=10-11 mol/L,此溶液pH=11或pH=3
3.在不同温度下的水溶液中,c(H+)和c(OH-)的关系如图所示(温度:T1(1)A点水的离子积为 ,C点水的离子积为 ,将纯水由T1升高温度至T2时水的离子积 (填“增大”“减小”或“不变”),各离子浓度由 点(填“A”“B”“C”或“D”,下同)变为 点。
(2)T2时,若向B点溶液中滴少量稀硫酸,离子浓度将由B点移向 点(填“C”或“D”)。
(3)25 ℃时,0.001 mol·L-1的盐酸pH= ;25 ℃时, 0.001 mol·L-1的氢氧化钠溶液pH= ;若将二者温度都升高至100 ℃, (填“盐酸”“氢氧化钠溶液”或“盐酸和氢氧化钠溶液”)的pH会改变。
易错点2 对图像信息分析不到位
4.常温下,向1 L pH=10的NaOH溶液中持续通入CO2。通入的CO2的体积(V)与溶液中水电离出的OH-浓度(c)的关系如图所示。下列叙述正确的是( )
A.a点溶液:水电离出的c(OH-)=1×10-4 mol/L
B.b点溶液:c(OH-)=c(H+)
C.c点溶液:c(Na+)=2c(C)+2c(HC)+2c(H2CO3)
D.d点溶液:c(Na+)>2c(C)+c(HC)
5.25 ℃时,在20 mL 0.1 mol·L-1 CH3COOH溶液中逐滴加入0.1 mol·L-1 NaOH溶液,pH变化曲线如下图所示:
下列说法不正确的是( )
A.若用10 mL H2O代替10 mL NaOH溶液,所得溶液pH小于a点
B.b点溶液中微粒浓度:c(Na+)>c(CH3COO-)>c(CH3COOH)
C.a点→c点的过程中n(CH3COO-)持续增大
D.若向a点对应的溶液中滴加1滴0.1 mol·L-1 NaOH溶液或1滴0.1 mol·L-1醋酸溶液,pH变化均不大
6.常温下,用0.1 mol·L-1的NaOH标准溶液滴定20.0 mL 0.1 mol·L-1的H2A溶液,溶液的pH与所加NaOH溶液的体积关系如图所示。
下列有关叙述正确的是( )
A.N点由水电离出来的c(H+)=1×10-9.6 mol·L-1
B.该滴定过程中可以选择石蕊或酚酞作为指示剂
C.H2A的Ka2大约等于×10-6.2
D.对于H2A有Ka1·Ka2易错点3 对Ka、KW、Kh、Ksp等常数应用不灵活
7.常温下,Kb(NH3·H2O)=1.77×10-5,Ka(CH3COOH)=1.76×10-5,Ka(HCN)= 4.93×10-10,Ka(HF)=3.53×10-4。对常温下的下列溶液的说法正确的是 ( )
A.用相同浓度的NaOH溶液分别滴定等体积pH均为3的HF溶液和CH3COOH溶液至终点,消耗NaOH溶液的体积相等
B.0.2 mol·L-1 CH3COONa溶液与0.1 mol·L-1盐酸等体积混合后的溶液中:c(Na+)>c(Cl-)>c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-)
C.0.2 mol·L-1HCN溶液与0.1 mol·L-1 NaOH溶液等体积混合后的溶液中:c(CN-)+c(OH-)D.浓度均为0.1 mol·L-1的NaCN和NH4Cl溶液中阴离子的浓度之和:前者大于后者
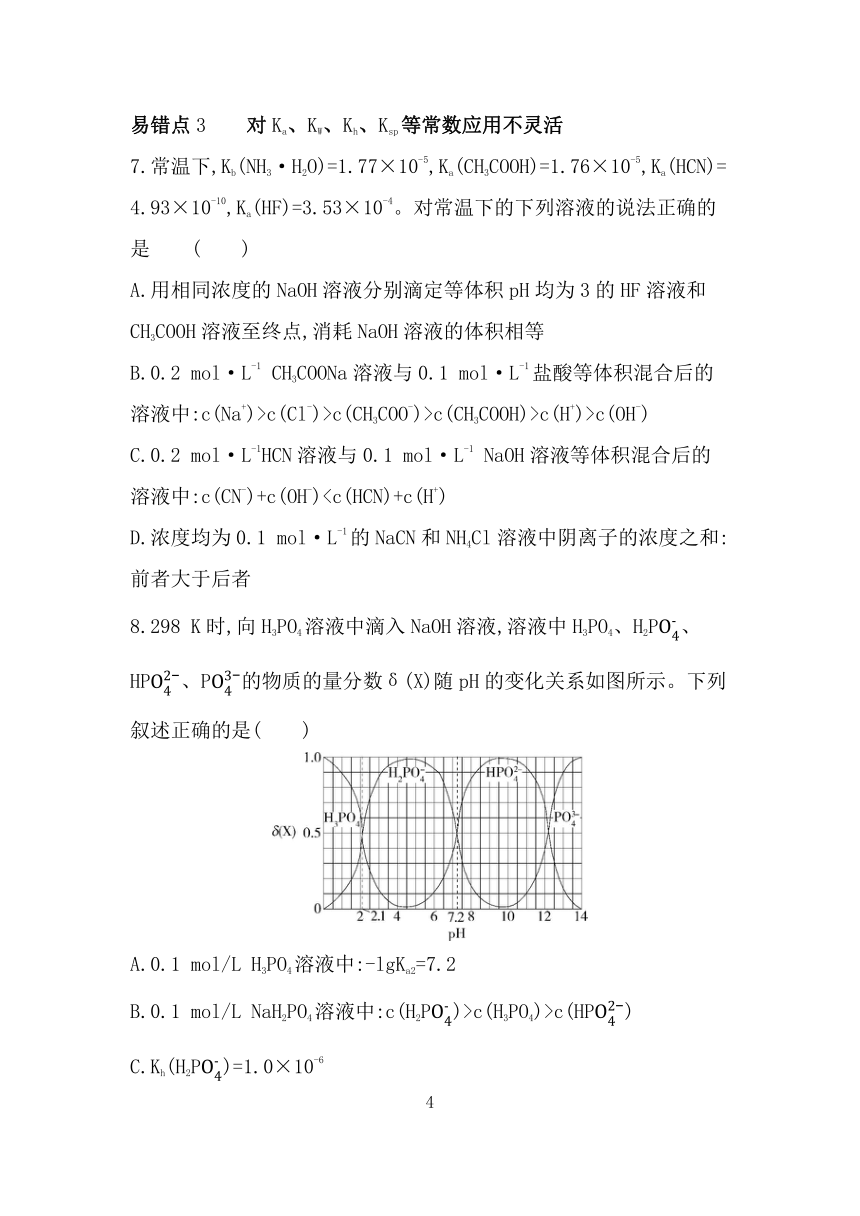
8.298 K时,向H3PO4溶液中滴入NaOH溶液,溶液中H3PO4、H2P、HP、P的物质的量分数δ(X)随pH的变化关系如图所示。下列叙述正确的是( )
A.0.1 mol/L H3PO4溶液中:-lgKa2=7.2
B.0.1 mol/L NaH2PO4溶液中:c(H2P)>c(H3PO4)>c(HP)
C.Kh(H2P)=1.0×10-6
D.0.1 mol/L Na2HPO4溶液中存在3个电离平衡
9.常温下,通过下列实验探究NaHCO3、Na2CO3溶液的性质。
实验1:用pH试纸测量0.1 mol·L-1 NaHCO3溶液的pH,测得pH约为8
实验2:将0.1 mol·L-1 NaHCO3溶液与0.1 mol·L-1 CaCl2溶液等体积混合,产生白色沉淀
实验3:饱和Na2CO3溶液中通入CO2产生白色沉淀,溶液pH从12下降到约为9
实验4:0.1 mol·L-1 NaHCO3溶液中滴加新制饱和氯水,氯水颜色褪去并有气泡
下列说法正确的是( )
A.由实验1可得出:Ka1(H2CO3)·Ka2(H2CO3)<10-16
B.实验2中两溶液混合时有:Ksp(CaCO3)>2.5×10-3
C.实验3中发生反应的离子方程式为C+H2O+CO2 2HC
D.实验4所得溶液中c(Na+)=c(HC)+c(C)+c(H2CO3)
思想方法练
应用守恒思想分析溶液中粒子浓度的大小关系
方法概述
熟练运用“三大守恒”解决溶液中粒子浓度的大小关系:
(1)物料守恒:电解质溶液中,由于某些离子的水解或电离,离子种类增多,但原子总数是守恒的。
(2)电荷守恒:在电解质溶液中,阳离子的电荷总数与阴离子的电荷总数相等,即溶液呈电中性。
(3)质子守恒:电解质溶液中,分子或离子得、失质子(H+)的物质的量应相等。
1.水体中的重金属离子如Cu2+、Sn2+等可以通过转化为CuS、SnS沉淀除去。已知:常温下Ka1(H2S)=9×10-8,Ka2(H2S)=1×10-12。下列说法正确的是 ( )
A.0.1 mol·L-1 Na2S溶液中:c(OH-)=c(H2S)+c(HS-)+c(H+)
B.0.1 mol·L-1 NaHS溶液中:c(Na+)C.向10 mL 0.001 mol·L-1 CuSO4溶液中加入10 mL 0.001 mol·L-1 Na2S溶液,有沉淀析出。忽略混合时溶液体积的变化,说明Ksp(CuS)> 2.5×10-7
D.常温时,向0.001 mol SnS粉末中加入10 mL 0.1 mol·L-1 CuSO4溶液,充分浸出后所得溶液中c(Cu2+)2.燃煤烟气中的CO2捕集可通过如图所示的物质转化实现。已知:Ka1(H2CO3)=4.3×10-7、Ka2(H2CO3)=5.6× 10-11。下列说法正确的是( )
A.KOH(aq)吸收CO2所得到的溶液中:c(H2CO3)>c(HC)
B.KOH完全转化为KHCO3时,溶液中存在:Ka1(H2CO3)·Ka2(H2CO3)C.“吸收”后所得溶液中:c(K+)D.“转化”后得到的上层清液中:c(Ca2+)·c(C)3.常温下,用200 mL 0.1 mol·L-1 NaOH溶液吸收SO2与N2的混合气体,所得溶液pH与吸收气体体积的关系如图所示,已知Ka1(H2SO3)=1.2×10-2,Ka2(H2SO3)=5.6×10-8。下列说法正确的是( )
A.吸收3 L气体时溶液中主要溶质为NaHSO3
B.溶液pH=7时2c(S)>c(HS)
C.X点呈酸性的原因是HS的水解程度大于其电离程度
D.曲线上任意点均存在:c(H+)+c(Na+)=c(OH-)+c(HS)+c(S)
4.常温下,通过下列实验探究Na2C2O4溶液的性质。下列说法不正确的是( )
已知:25 ℃时Ka1(H2C2O4)=5.9×10-2,Ka2(H2C2O4)=6.4×10-5。
实验 实验操作和现象
1 用pH计测得0.01 mol·L-1 Na2C2O4溶液pH为8.60
2 向0.01 mol·L-1 Na2C2O4溶液中滴加稀盐酸至溶液pH=7
3 向0.01 mol·L-1 Na2C2O4溶液中滴加等浓度、等体积稀盐酸
4 向0.01 mol·L-1 Na2C2O4溶液中加入足量稀硫酸酸化后,再滴加KMnO4溶液,溶液紫红色褪去
A.实验1,溶液中:c(OH-)=c(H+)+2c(H2C2O4)+c(HC2)
B.实验2,溶液中:c(Na+)=c(HC2)+2c(C2)
C.实验3,溶液中:c(HC2)>c(C2)>c(H2C2O4)
D.实验4中滴加KMnO4溶液,发生反应的离子方程式为5H2C2O4+ 2Mn+6H+ 10CO2↑+2Mn2++8H2O
5.苹果酸(简写为H2A)是二元弱酸, Ka1=10-3.4、Ka2=10-5.1。20 ℃时,向0.100 mol/L的Na2A溶液中缓慢通入HCl气体(忽略溶液体积的变化)。下列指定溶液中微粒关系正确的是( )
A.测得0.100 mol/L Na2A溶液的pH为8.6,此时溶液中存在:c(Na+)>c(A2-)>c(HA-)
B.通入HCl后的溶液中:c(HA-)+2c(A2-)+c(OH-)=c(Na+)+c(H+)
C.在c(Cl-)=0.100 mol/L的溶液中:c(Na+)=c(A2-)+c(HA-)+c(H2A)
D.溶液pH从3.4变为2时,发生的主要反应为A2-+H+ HA-
6.室温下,向5 mL 0.1 mol·L-1 Na2CO3溶液中滴加1 mL 0.1 mol·L-1 BaCl2溶液,有白色沉淀生成,过滤,向滤渣中加入1 mL Na2SO4溶液,浸泡一段时间后过滤,向滤渣中加入足量的1 mol·L-1盐酸,无明显现象。已知:Ksp(BaCO3)=5×10-9,Ksp(BaSO4)=1×10-10。下列说法正确的是( )
A.0.1 mol·L-1 Na2CO3溶液中存在:2c(Na+)=c(C)+c(HC)+c(H2CO3)
B.第二次过滤后所得滤渣中加盐酸发生反应的离子方程式为BaCO3+H+ HC+Ba2+
C.Na2SO4溶液的浓度至少为0.1 mol·L-1(浸泡后溶液仍为1 mL)
D.Na2SO4溶液浸泡后的溶液中一定存在c(C)≤50c(S)
7.研究发现,H2S是继NO、CO之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管的功能。常温时,H2S在水中的电离常数为Ka1=1.3×10-7,Ka2=7.0×10-15。按要求回答下列问题。
(1)H2S在水中的二级电离常数表达式Ka2= ;0.1 mol/L Na2S溶液中离子浓度由大到小的顺序为 。
(2)常温下,向0.1 mol/L H2S溶液中通入HCl或加入NaOH固体,测得c(S2-)与溶液pH的关系如图(忽略溶液体积的变化及H2S的挥发)。
①当溶液中c(S2-)=1.4×10-19 mol/L时,溶液中c(OH-)= ,水电离产生的c(H+)= 。
②当pH=13时,溶液中的c(H2S)+c(HS-)= 。
(3)在工业废水处理中常用H2S将Mn2+转化为MnS除去。常温下,向含有0.01 mol/L Mn2+的废水中通入H2S以调节废水的pH,当c(HS-)= 2.0×10-4 mol/L时,Mn2+开始沉淀,此时废水的pH= 。[已知Ksp(MnS)=1.4×10-15]
答案与分层梯度式解析
本专题复习提升
易混易错练
1.C 恰好中和后不慎多加了1滴NaOH溶液,则碱过量,溶液显碱性,加水稀释后溶液中c(OH-)==10-4 mol/L,则溶液中c(H+)=10-10 mol/L,pH=10,故选C。
2.B c(H+)=的溶液中,c(OH-)==,即c(H+)=c(OH-),溶液一定呈中性,A正确;c(H+)还受酸的浓度影响,B错误;将pH=2的盐酸和pH=4的硫酸等体积混合,所得溶液中c(H+)=×10-2 mol/L,pH= -lgc(H+)=2.3,C正确;常温下,某溶液中由水电离出的c(H+)= 10-11 mol/L,表明水的电离受到抑制,若溶质为酸,此溶液的pH=3,若溶质为碱,此溶液的pH=11,D正确。
3.答案 (1)1×10-14 1×10-12 增大 A B
(2)D
(3)3 11 氢氧化钠溶液
解析 (1)水的离子积KW=c(H+)·c(OH-),则A点水的离子积为KW= 10-7×10-7=1×10-14,B点水的离子积为KW=10-6×10-6=1×10-12,B点与C点所处温度相同,水的离子积也相同;将纯水由T1升高温度至T2,水的离子积增大,纯水中c(H+)始终等于c(OH-),则氢离子、氢氧根离子浓度由A点变为B点。(2)向溶液中滴加稀硫酸,氢离子浓度增大,氢氧根离子浓度减小,但是温度不变,水的离子积不变,会在该温度曲线的基础上向着下方移动,则各离子浓度将由B点移向D点。(3)25 ℃时,KW=1×10-14,0.001 mol·L-1的盐酸pH=-lgc(H+)=-lg0.001=3; 0.001 mol·L-1的氢氧化钠溶液中c(OH-)=0.001 mol·L-1, c(H+)= = mol·L-1=10-11 mol·L-1,则pH=-lgc(H+)=-lg10-11=11;若将二者温度都升高至100 ℃,KW增大,盐酸中氢离子浓度不变,pH不变,氢氧化钠溶液中c(OH-)不变,c(H+)=增大, pH变小。
4.C a点溶液为pH=10的NaOH溶液,水电离出的c(H+)=1×10-10 mol/L,氢离子浓度和水电离出的氢氧根离子浓度相等,所以水电离出的c(OH-)=1×10-10 mol/L,A项错误;c点二氧化碳和NaOH完全反应生成Na2CO3,则b点溶液中的溶质为Na2CO3和NaOH,溶液显碱性,所以 c(OH-)>c(H+),B项错误;c点溶液中的溶质为Na2CO3,存在物料守恒c(Na+)=2c(C)+2c(HC)+2c(H2CO3),C项正确;d点溶液中水电离出的氢氧根离子浓度为10-7 mol/L,水的电离既不受到促进也不受到抑制,则此时溶液中的溶质应为NaHCO3和H2CO3,溶液呈中性,c(H+)= c(OH-),结合电荷守恒可得c(Na+)=2c(C)+c(HC),D项错误。
易错提示 解答本题的关键一是要明确二氧化碳持续通入氢氧化钠溶液,不同阶段溶液中的溶质成分,二是要明确水电离出的c(OH-)两次为10-7 mol/L,哪一次溶液呈中性。
5.B 若用10 mL H2O代替10 mL NaOH溶液,则CH3COOH溶液中氢离子浓度下降幅度减小,所得溶液pH小于a点,A正确;b点时溶液中存在电荷守恒:c(CH3COO-)+c(OH-)=c(Na+)+c(H+),b点溶液呈中性, c(H+)=c(OH-),则c(CH3COO-)=c(Na+),B错误;c点醋酸和NaOH完全反应,a点→c点的过程中,随着NaOH的增多,n(CH3COO-)持续增大,C正确;a点对应溶液中,溶质为等物质的量的CH3COOH和CH3COONa,此时向a点对应的溶液中滴加1滴0.1 mol·L-1 NaOH溶液或1滴 0.1 mol·L-1醋酸溶液,pH变化均不大,D正确。
易错提示 b点pH为7,这个关键信息若忽视,则此题无法作出正确选择。
6.C N点溶质为Na2A,Na2A促进水的电离,由水电离出来的c水(H+)= c溶液(OH-)= mol·L-1=10-4.4 mol·L-1,A项错误;第一次突变时,pH= 4.3,溶液显酸性,第二次突变时pH=9.6,溶液显碱性,则该滴定过程中可以选择甲基橙或酚酞作为指示剂,不能选择石蕊作为指示剂,B项错误;N点为Na2A溶液,A2-水解使溶液显碱性,Kh(A2-)=≈ =3×10-7.8,则H2A的Ka2==×10-6.2,C项正确;20.0 mL 0.1 mol·L-1 H2A溶液pH=1,则Ka1≈0.1,Ka2=×10-6.2,对于H2A有Ka1·Ka2>KW,D项错误。
易错提示 注意N点溶液的体积为60 mL,计算c(A2-)时容易忽视体积的变化。
7.C 由电离平衡常数知,HF的酸性比CH3COOH强,pH均为3的HF溶液和CH3COOH溶液,CH3COOH的物质的量浓度大,故相同浓度的NaOH溶液分别滴定等体积pH均为3的HF溶液和CH3COOH溶液至终点,醋酸消耗NaOH溶液的体积大,A项错误;0.2 mol·L-1 CH3COONa溶液与0.1 mol·L-1盐酸等体积混合后,所得溶液为物质的量浓度相等的醋酸、醋酸钠和NaCl溶液,Ka(CH3COOH)=1.76×10-5,则醋酸钠的水解平衡常数Kh==c(CH3COO-)>c(Cl-)> c(CH3COOH)>c(H+)>c(OH-),B项错误;0.2 mol·L-1HCN溶液与0.1 mol·L-1 NaOH溶液等体积混合后溶液中溶质为等浓度的NaCN和HCN,由电荷守恒得c(Na+)+c(H+)=c(CN-)+c(OH-),由物料守恒可知2c(Na+)= c(CN-)+c(HCN),联立两式得到:c(CN-)+2c(OH-)=c(HCN)+2c(H+), Ka(HCN)=4.93×10-10,则Kh(CN-)==>Ka(HCN),则该溶液显碱性,c(OH-)>c(H+),则c(CN-)+c(OH-)易错提示 对KW、Ka、Kh之间的关系不熟悉,对相关公式不会进行相互推导。
8.A H3PO4在溶液中分步电离H3PO4 H++H2P,H2P H++ HP,HP H++P,Ka2(H3PO4)=,根据题图可知当c(H2P)=c(HP)时,pH=7.2,则Ka2=c(H+)=10-7.2,-lgKa2=7.2,A正确; 0.1 mol/L NaH2PO4溶液中c(H2P)>c(HP)>c(H3PO4),B错误;H2P的水解方程式:H2P+H2O H3PO4+OH-,Kh(H2P)=,由题图知,c(H3PO4)=c(H2P)时pH=2.1,则此时c(OH-)=10-11.9,则Kh(H2P)=10-11.9,C错误;Na2HPO4溶液中存在2个电离平衡,HP H++P、H2O H++OH-,D错误。
9.A 实验1中,Ka1(H2CO3)·Ka2(H2CO3)=·=,NaHCO3溶液的pH约为8,表明溶液中HC的水解是主要的,电离是次要的,则c(C)Ksp(CaCO3),则有:Ksp(CaCO3)< c(Ca2+)·c(HC)<2.5×10-3,B项错误;NaHCO3以晶体形式产生,不能拆成离子,则反应的离子方程式为2Na++C+H2O+CO2 2NaHCO3↓,C项错误;滴加氯水,HC与H+反应生成H2CO3,有气泡产生,说明有一部分H2CO3分解生成CO2,根据物料守恒,溶液中c(Na+)=c(HC)+ c(C)+c(H2CO3)+c(CO2),则c(Na+)>c(HC)+c(C)+c(H2CO3),D项错误。
思想方法练
1.D Na2S溶液中存在质子守恒:c(OH-)=2c(H2S)+c(HS-)+c(H+),A项错误;NaHS溶液中,Kh(HS-)==>Ka2(H2S),即HS-的水解程度大于其电离程度,溶液显碱性,NaHS溶液中的电荷守恒为c(Na+)+c(H+)= c(HS-)+2c(S2-)+c(OH-),c(H+)c(HS-)+2c(S2-),B项错误;n(CuSO4)=0.001 mol·L-1×10×10-3 L=10-5 mol,混合后溶液的总体积为20 mL,混合后溶液中c(CuSO4)==5×10-4 mol·L-1,同理,c(Na2S)=5×10-4 mol·L-1,出现沉淀,说明Qc(CuS)>Ksp(CuS), Qc(CuS)=5×10-4×5×10-4=2.5×10-7,即Ksp(CuS)<2.5×10-7,C项错误; n(SnS)=0.001 mol,n(CuSO4)=0.1 mol·L-1×10×10-3 L=0.001 mol, n(Sn2+)=n(Cu2+),充分反应后,c(Cu2+)方法指导 如何判断“三大守恒”:
2.B KOH(aq)吸收CO2所得到的溶液,若为K2CO3溶液,则主要发生第一步水解,溶液中:c(H2CO3) c(HC)+2c(C),C项错误;转化后的上层清液为碳酸钙的饱和溶液,c(Ca2+)·c(C)=Ksp(CaCO3),D项错误。
3.B 0.1 mol·L-1 NaOH溶液吸收SO2,先后发生两个反应,即2NaOH+ SO2 Na2SO3+H2O和Na2SO3+H2O+SO2 2NaHSO3。由题图中信息可知,当吸收3 L气体时,得到Na2SO3溶液;当吸收6 L气体时,得到NaHSO3溶液。当吸收3 L气体时得到Na2SO3溶液,溶液中主要溶质为Na2SO3,A错误;pH=7时,溶液呈中性,则c(H+)=1 10-7 mol·L-1,Ka2(H2SO3)= =5.6×10-8,则=0.56,因此,=1.12>1,则2c(S)>c(HS),B正确;X点对应溶液为NaHSO3溶液,溶液呈酸性说明HS的电离程度大于其水解程度,C错误;曲线上除起点外,其他任意点均存在c(H+)+c(Na+)=c(OH-)+c(HS)+2c(S),D错误。
4.B 实验1,根据质子守恒可知,该溶液中存在:c(OH-)=c(H+)+c(HC2)+ 2c(H2C2O4),A正确;实验2,c(OH-)=c(H+),根据电荷守恒可得c(H+)+ c(Na+)=c(OH-)+c(HC2)+2c(C2)+c(Cl-),故c(Na+)=c(HC2)+ 2c(C2)+c(Cl-),B错误;实验3,反应Na2C2O4+HCl NaHC2O4+NaCl恰好完全,由题干信息Ka1(H2C2O4)=5.9×10-2,Ka2(H2C2O4)=6.4×10-5可知,Kh(C2)==c(C2)>c(H2C2O4),C正确;实验4,溶液紫红色褪去,发生反应的离子方程式为5H2C2O4+2Mn+6H+ 10CO2↑+2Mn2++8H2O,D正确。
5.A Na2A是强碱弱酸盐,A2-水解生成少量HA-,此时溶液中存在: c(Na+)>c(A2-)>c(HA-),A正确;通入HCl后的溶液中,根据电荷守恒可得c(HA-)+2c(A2-)+c(OH-)+c(Cl-)=c(Na+)+c(H+),B错误;溶液中始终存在物料守恒,c(Na+)=c(A2-)+c(HA-)+c(H2A),C错误;溶液pH从3.4变为2,发生的主要反应为HA-+H+ H2A,D错误。
6.D Na2CO3溶液中存在物料守恒:c(Na+)=2[c(C)+c(HC)+ c(H2CO3)],A错误;Na2CO3和BaCl2反应生成的白色沉淀为BaCO3,加入Na2SO4溶液,发生沉淀转化,过滤得到BaSO4沉淀,向滤渣中加入足量的盐酸,无明显现象,说明第二次过滤后所得滤渣中不存在BaCO3,B错误;根据B项分析,可知BaCO3完全转化为BaSO4,n(BaCO3)= 0.1 mol·L-1×1×10-3 L=10-4 mol,则消耗n(Na2SO4)=10-4 mol,同时生成c(C)=10-4 mol,浸泡后溶液中c(C)==0.1 mol·L-1, c(Ba2+)== mol·L-1=5×10-8 mol·L-1,c(S)≥ = mol·L-1=2×10-3 mol·L-1,故所加Na2SO4溶液的浓度至少为+2×10-3 mol·L-1=0.102 mol·L-1,C错误;增大c(S),使BaCO3转化为BaSO4的平衡正向移动,BaCO3沉淀完全转化,则Qc=≤50,即c(C)≤50c(S),D正确。
7.答案 (1) c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+)
(2)①1.0×10-13 mol/L 1.0×10-13 mol/L
②0.043 mol/L
(3)5
解析 (1)H2S在水中的电离方程式为H2S HS-+H+、HS- S2-+H+,所以二级电离常数表达式Ka2=;0.1 mol/L Na2S溶液中硫离子水解,溶液显碱性,离子浓度的大小顺序为c(Na+)>c(S2-)>c(OH-)> c(HS-)>c(H+)。(2)①根据图像可知当溶液中c(S2-)=1.4×10-19 mol/L时溶液pH=1,则溶液中c(OH-)=1×10-13 mol/L,水电离产生的c(H+)等于溶液中c(OH-),为1.0×10-13 mol/L;②当pH=13时溶液中c(S2-)= 5.7×10-2 mol/L,溶液中的c(H2S)+c(HS-)=0.1 mol/L-0.057 mol/L= 0.043 mol/L。(3)Mn2+开始沉淀时溶液中c(S2-)= mol/L= 1.4×10-13 mol/L,根据H2S的二级电离常数可知溶液中c(H+)= = mol/L=1×10-5 mol/L,所以pH=5。
2
易混易错练
易错点1 对溶液酸碱性或pH分析错误
1.常温下用0.1 mol/L NaOH溶液滴定20 mL 0.1 mol/L盐酸,恰好中和后不慎多加了1滴NaOH溶液(1滴溶液的体积以0.05 mL计),再往锥形瓶中加蒸馏水至反应液的总体积为50 mL,此时混合溶液的pH约为( )
A.4 B.7.2 C.10 D.11.3
2.下列说法不正确的是(已知:lg2=0.3)( )
A.c(H+)=的溶液一定呈中性
B.Ka大的酸溶液中c(H+)一定比Ka小的酸溶液中c(H+)大
C.将pH=2的盐酸和pH=4的硫酸等体积混合(混合后体积变化不计),所得溶液pH=2.3
D.常温下,某溶液中由水电离出的c(H+)=10-11 mol/L,此溶液pH=11或pH=3
3.在不同温度下的水溶液中,c(H+)和c(OH-)的关系如图所示(温度:T1
(2)T2时,若向B点溶液中滴少量稀硫酸,离子浓度将由B点移向 点(填“C”或“D”)。
(3)25 ℃时,0.001 mol·L-1的盐酸pH= ;25 ℃时, 0.001 mol·L-1的氢氧化钠溶液pH= ;若将二者温度都升高至100 ℃, (填“盐酸”“氢氧化钠溶液”或“盐酸和氢氧化钠溶液”)的pH会改变。
易错点2 对图像信息分析不到位
4.常温下,向1 L pH=10的NaOH溶液中持续通入CO2。通入的CO2的体积(V)与溶液中水电离出的OH-浓度(c)的关系如图所示。下列叙述正确的是( )
A.a点溶液:水电离出的c(OH-)=1×10-4 mol/L
B.b点溶液:c(OH-)=c(H+)
C.c点溶液:c(Na+)=2c(C)+2c(HC)+2c(H2CO3)
D.d点溶液:c(Na+)>2c(C)+c(HC)
5.25 ℃时,在20 mL 0.1 mol·L-1 CH3COOH溶液中逐滴加入0.1 mol·L-1 NaOH溶液,pH变化曲线如下图所示:
下列说法不正确的是( )
A.若用10 mL H2O代替10 mL NaOH溶液,所得溶液pH小于a点
B.b点溶液中微粒浓度:c(Na+)>c(CH3COO-)>c(CH3COOH)
C.a点→c点的过程中n(CH3COO-)持续增大
D.若向a点对应的溶液中滴加1滴0.1 mol·L-1 NaOH溶液或1滴0.1 mol·L-1醋酸溶液,pH变化均不大
6.常温下,用0.1 mol·L-1的NaOH标准溶液滴定20.0 mL 0.1 mol·L-1的H2A溶液,溶液的pH与所加NaOH溶液的体积关系如图所示。
下列有关叙述正确的是( )
A.N点由水电离出来的c(H+)=1×10-9.6 mol·L-1
B.该滴定过程中可以选择石蕊或酚酞作为指示剂
C.H2A的Ka2大约等于×10-6.2
D.对于H2A有Ka1·Ka2
7.常温下,Kb(NH3·H2O)=1.77×10-5,Ka(CH3COOH)=1.76×10-5,Ka(HCN)= 4.93×10-10,Ka(HF)=3.53×10-4。对常温下的下列溶液的说法正确的是 ( )
A.用相同浓度的NaOH溶液分别滴定等体积pH均为3的HF溶液和CH3COOH溶液至终点,消耗NaOH溶液的体积相等
B.0.2 mol·L-1 CH3COONa溶液与0.1 mol·L-1盐酸等体积混合后的溶液中:c(Na+)>c(Cl-)>c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-)
C.0.2 mol·L-1HCN溶液与0.1 mol·L-1 NaOH溶液等体积混合后的溶液中:c(CN-)+c(OH-)
8.298 K时,向H3PO4溶液中滴入NaOH溶液,溶液中H3PO4、H2P、HP、P的物质的量分数δ(X)随pH的变化关系如图所示。下列叙述正确的是( )
A.0.1 mol/L H3PO4溶液中:-lgKa2=7.2
B.0.1 mol/L NaH2PO4溶液中:c(H2P)>c(H3PO4)>c(HP)
C.Kh(H2P)=1.0×10-6
D.0.1 mol/L Na2HPO4溶液中存在3个电离平衡
9.常温下,通过下列实验探究NaHCO3、Na2CO3溶液的性质。
实验1:用pH试纸测量0.1 mol·L-1 NaHCO3溶液的pH,测得pH约为8
实验2:将0.1 mol·L-1 NaHCO3溶液与0.1 mol·L-1 CaCl2溶液等体积混合,产生白色沉淀
实验3:饱和Na2CO3溶液中通入CO2产生白色沉淀,溶液pH从12下降到约为9
实验4:0.1 mol·L-1 NaHCO3溶液中滴加新制饱和氯水,氯水颜色褪去并有气泡
下列说法正确的是( )
A.由实验1可得出:Ka1(H2CO3)·Ka2(H2CO3)<10-16
B.实验2中两溶液混合时有:Ksp(CaCO3)>2.5×10-3
C.实验3中发生反应的离子方程式为C+H2O+CO2 2HC
D.实验4所得溶液中c(Na+)=c(HC)+c(C)+c(H2CO3)
思想方法练
应用守恒思想分析溶液中粒子浓度的大小关系
方法概述
熟练运用“三大守恒”解决溶液中粒子浓度的大小关系:
(1)物料守恒:电解质溶液中,由于某些离子的水解或电离,离子种类增多,但原子总数是守恒的。
(2)电荷守恒:在电解质溶液中,阳离子的电荷总数与阴离子的电荷总数相等,即溶液呈电中性。
(3)质子守恒:电解质溶液中,分子或离子得、失质子(H+)的物质的量应相等。
1.水体中的重金属离子如Cu2+、Sn2+等可以通过转化为CuS、SnS沉淀除去。已知:常温下Ka1(H2S)=9×10-8,Ka2(H2S)=1×10-12。下列说法正确的是 ( )
A.0.1 mol·L-1 Na2S溶液中:c(OH-)=c(H2S)+c(HS-)+c(H+)
B.0.1 mol·L-1 NaHS溶液中:c(Na+)
D.常温时,向0.001 mol SnS粉末中加入10 mL 0.1 mol·L-1 CuSO4溶液,充分浸出后所得溶液中c(Cu2+)
A.KOH(aq)吸收CO2所得到的溶液中:c(H2CO3)>c(HC)
B.KOH完全转化为KHCO3时,溶液中存在:Ka1(H2CO3)·Ka2(H2CO3)
A.吸收3 L气体时溶液中主要溶质为NaHSO3
B.溶液pH=7时2c(S)>c(HS)
C.X点呈酸性的原因是HS的水解程度大于其电离程度
D.曲线上任意点均存在:c(H+)+c(Na+)=c(OH-)+c(HS)+c(S)
4.常温下,通过下列实验探究Na2C2O4溶液的性质。下列说法不正确的是( )
已知:25 ℃时Ka1(H2C2O4)=5.9×10-2,Ka2(H2C2O4)=6.4×10-5。
实验 实验操作和现象
1 用pH计测得0.01 mol·L-1 Na2C2O4溶液pH为8.60
2 向0.01 mol·L-1 Na2C2O4溶液中滴加稀盐酸至溶液pH=7
3 向0.01 mol·L-1 Na2C2O4溶液中滴加等浓度、等体积稀盐酸
4 向0.01 mol·L-1 Na2C2O4溶液中加入足量稀硫酸酸化后,再滴加KMnO4溶液,溶液紫红色褪去
A.实验1,溶液中:c(OH-)=c(H+)+2c(H2C2O4)+c(HC2)
B.实验2,溶液中:c(Na+)=c(HC2)+2c(C2)
C.实验3,溶液中:c(HC2)>c(C2)>c(H2C2O4)
D.实验4中滴加KMnO4溶液,发生反应的离子方程式为5H2C2O4+ 2Mn+6H+ 10CO2↑+2Mn2++8H2O
5.苹果酸(简写为H2A)是二元弱酸, Ka1=10-3.4、Ka2=10-5.1。20 ℃时,向0.100 mol/L的Na2A溶液中缓慢通入HCl气体(忽略溶液体积的变化)。下列指定溶液中微粒关系正确的是( )
A.测得0.100 mol/L Na2A溶液的pH为8.6,此时溶液中存在:c(Na+)>c(A2-)>c(HA-)
B.通入HCl后的溶液中:c(HA-)+2c(A2-)+c(OH-)=c(Na+)+c(H+)
C.在c(Cl-)=0.100 mol/L的溶液中:c(Na+)=c(A2-)+c(HA-)+c(H2A)
D.溶液pH从3.4变为2时,发生的主要反应为A2-+H+ HA-
6.室温下,向5 mL 0.1 mol·L-1 Na2CO3溶液中滴加1 mL 0.1 mol·L-1 BaCl2溶液,有白色沉淀生成,过滤,向滤渣中加入1 mL Na2SO4溶液,浸泡一段时间后过滤,向滤渣中加入足量的1 mol·L-1盐酸,无明显现象。已知:Ksp(BaCO3)=5×10-9,Ksp(BaSO4)=1×10-10。下列说法正确的是( )
A.0.1 mol·L-1 Na2CO3溶液中存在:2c(Na+)=c(C)+c(HC)+c(H2CO3)
B.第二次过滤后所得滤渣中加盐酸发生反应的离子方程式为BaCO3+H+ HC+Ba2+
C.Na2SO4溶液的浓度至少为0.1 mol·L-1(浸泡后溶液仍为1 mL)
D.Na2SO4溶液浸泡后的溶液中一定存在c(C)≤50c(S)
7.研究发现,H2S是继NO、CO之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管的功能。常温时,H2S在水中的电离常数为Ka1=1.3×10-7,Ka2=7.0×10-15。按要求回答下列问题。
(1)H2S在水中的二级电离常数表达式Ka2= ;0.1 mol/L Na2S溶液中离子浓度由大到小的顺序为 。
(2)常温下,向0.1 mol/L H2S溶液中通入HCl或加入NaOH固体,测得c(S2-)与溶液pH的关系如图(忽略溶液体积的变化及H2S的挥发)。
①当溶液中c(S2-)=1.4×10-19 mol/L时,溶液中c(OH-)= ,水电离产生的c(H+)= 。
②当pH=13时,溶液中的c(H2S)+c(HS-)= 。
(3)在工业废水处理中常用H2S将Mn2+转化为MnS除去。常温下,向含有0.01 mol/L Mn2+的废水中通入H2S以调节废水的pH,当c(HS-)= 2.0×10-4 mol/L时,Mn2+开始沉淀,此时废水的pH= 。[已知Ksp(MnS)=1.4×10-15]
答案与分层梯度式解析
本专题复习提升
易混易错练
1.C 恰好中和后不慎多加了1滴NaOH溶液,则碱过量,溶液显碱性,加水稀释后溶液中c(OH-)==10-4 mol/L,则溶液中c(H+)=10-10 mol/L,pH=10,故选C。
2.B c(H+)=的溶液中,c(OH-)==,即c(H+)=c(OH-),溶液一定呈中性,A正确;c(H+)还受酸的浓度影响,B错误;将pH=2的盐酸和pH=4的硫酸等体积混合,所得溶液中c(H+)=×10-2 mol/L,pH= -lgc(H+)=2.3,C正确;常温下,某溶液中由水电离出的c(H+)= 10-11 mol/L,表明水的电离受到抑制,若溶质为酸,此溶液的pH=3,若溶质为碱,此溶液的pH=11,D正确。
3.答案 (1)1×10-14 1×10-12 增大 A B
(2)D
(3)3 11 氢氧化钠溶液
解析 (1)水的离子积KW=c(H+)·c(OH-),则A点水的离子积为KW= 10-7×10-7=1×10-14,B点水的离子积为KW=10-6×10-6=1×10-12,B点与C点所处温度相同,水的离子积也相同;将纯水由T1升高温度至T2,水的离子积增大,纯水中c(H+)始终等于c(OH-),则氢离子、氢氧根离子浓度由A点变为B点。(2)向溶液中滴加稀硫酸,氢离子浓度增大,氢氧根离子浓度减小,但是温度不变,水的离子积不变,会在该温度曲线的基础上向着下方移动,则各离子浓度将由B点移向D点。(3)25 ℃时,KW=1×10-14,0.001 mol·L-1的盐酸pH=-lgc(H+)=-lg0.001=3; 0.001 mol·L-1的氢氧化钠溶液中c(OH-)=0.001 mol·L-1, c(H+)= = mol·L-1=10-11 mol·L-1,则pH=-lgc(H+)=-lg10-11=11;若将二者温度都升高至100 ℃,KW增大,盐酸中氢离子浓度不变,pH不变,氢氧化钠溶液中c(OH-)不变,c(H+)=增大, pH变小。
4.C a点溶液为pH=10的NaOH溶液,水电离出的c(H+)=1×10-10 mol/L,氢离子浓度和水电离出的氢氧根离子浓度相等,所以水电离出的c(OH-)=1×10-10 mol/L,A项错误;c点二氧化碳和NaOH完全反应生成Na2CO3,则b点溶液中的溶质为Na2CO3和NaOH,溶液显碱性,所以 c(OH-)>c(H+),B项错误;c点溶液中的溶质为Na2CO3,存在物料守恒c(Na+)=2c(C)+2c(HC)+2c(H2CO3),C项正确;d点溶液中水电离出的氢氧根离子浓度为10-7 mol/L,水的电离既不受到促进也不受到抑制,则此时溶液中的溶质应为NaHCO3和H2CO3,溶液呈中性,c(H+)= c(OH-),结合电荷守恒可得c(Na+)=2c(C)+c(HC),D项错误。
易错提示 解答本题的关键一是要明确二氧化碳持续通入氢氧化钠溶液,不同阶段溶液中的溶质成分,二是要明确水电离出的c(OH-)两次为10-7 mol/L,哪一次溶液呈中性。
5.B 若用10 mL H2O代替10 mL NaOH溶液,则CH3COOH溶液中氢离子浓度下降幅度减小,所得溶液pH小于a点,A正确;b点时溶液中存在电荷守恒:c(CH3COO-)+c(OH-)=c(Na+)+c(H+),b点溶液呈中性, c(H+)=c(OH-),则c(CH3COO-)=c(Na+),B错误;c点醋酸和NaOH完全反应,a点→c点的过程中,随着NaOH的增多,n(CH3COO-)持续增大,C正确;a点对应溶液中,溶质为等物质的量的CH3COOH和CH3COONa,此时向a点对应的溶液中滴加1滴0.1 mol·L-1 NaOH溶液或1滴 0.1 mol·L-1醋酸溶液,pH变化均不大,D正确。
易错提示 b点pH为7,这个关键信息若忽视,则此题无法作出正确选择。
6.C N点溶质为Na2A,Na2A促进水的电离,由水电离出来的c水(H+)= c溶液(OH-)= mol·L-1=10-4.4 mol·L-1,A项错误;第一次突变时,pH= 4.3,溶液显酸性,第二次突变时pH=9.6,溶液显碱性,则该滴定过程中可以选择甲基橙或酚酞作为指示剂,不能选择石蕊作为指示剂,B项错误;N点为Na2A溶液,A2-水解使溶液显碱性,Kh(A2-)=≈ =3×10-7.8,则H2A的Ka2==×10-6.2,C项正确;20.0 mL 0.1 mol·L-1 H2A溶液pH=1,则Ka1≈0.1,Ka2=×10-6.2,对于H2A有Ka1·Ka2>KW,D项错误。
易错提示 注意N点溶液的体积为60 mL,计算c(A2-)时容易忽视体积的变化。
7.C 由电离平衡常数知,HF的酸性比CH3COOH强,pH均为3的HF溶液和CH3COOH溶液,CH3COOH的物质的量浓度大,故相同浓度的NaOH溶液分别滴定等体积pH均为3的HF溶液和CH3COOH溶液至终点,醋酸消耗NaOH溶液的体积大,A项错误;0.2 mol·L-1 CH3COONa溶液与0.1 mol·L-1盐酸等体积混合后,所得溶液为物质的量浓度相等的醋酸、醋酸钠和NaCl溶液,Ka(CH3COOH)=1.76×10-5,则醋酸钠的水解平衡常数Kh==
8.A H3PO4在溶液中分步电离H3PO4 H++H2P,H2P H++ HP,HP H++P,Ka2(H3PO4)=,根据题图可知当c(H2P)=c(HP)时,pH=7.2,则Ka2=c(H+)=10-7.2,-lgKa2=7.2,A正确; 0.1 mol/L NaH2PO4溶液中c(H2P)>c(HP)>c(H3PO4),B错误;H2P的水解方程式:H2P+H2O H3PO4+OH-,Kh(H2P)=,由题图知,c(H3PO4)=c(H2P)时pH=2.1,则此时c(OH-)=10-11.9,则Kh(H2P)=10-11.9,C错误;Na2HPO4溶液中存在2个电离平衡,HP H++P、H2O H++OH-,D错误。
9.A 实验1中,Ka1(H2CO3)·Ka2(H2CO3)=·=,NaHCO3溶液的pH约为8,表明溶液中HC的水解是主要的,电离是次要的,则c(C)
思想方法练
1.D Na2S溶液中存在质子守恒:c(OH-)=2c(H2S)+c(HS-)+c(H+),A项错误;NaHS溶液中,Kh(HS-)==>Ka2(H2S),即HS-的水解程度大于其电离程度,溶液显碱性,NaHS溶液中的电荷守恒为c(Na+)+c(H+)= c(HS-)+2c(S2-)+c(OH-),c(H+)
2.B KOH(aq)吸收CO2所得到的溶液,若为K2CO3溶液,则主要发生第一步水解,溶液中:c(H2CO3)
3.B 0.1 mol·L-1 NaOH溶液吸收SO2,先后发生两个反应,即2NaOH+ SO2 Na2SO3+H2O和Na2SO3+H2O+SO2 2NaHSO3。由题图中信息可知,当吸收3 L气体时,得到Na2SO3溶液;当吸收6 L气体时,得到NaHSO3溶液。当吸收3 L气体时得到Na2SO3溶液,溶液中主要溶质为Na2SO3,A错误;pH=7时,溶液呈中性,则c(H+)=1 10-7 mol·L-1,Ka2(H2SO3)= =5.6×10-8,则=0.56,因此,=1.12>1,则2c(S)>c(HS),B正确;X点对应溶液为NaHSO3溶液,溶液呈酸性说明HS的电离程度大于其水解程度,C错误;曲线上除起点外,其他任意点均存在c(H+)+c(Na+)=c(OH-)+c(HS)+2c(S),D错误。
4.B 实验1,根据质子守恒可知,该溶液中存在:c(OH-)=c(H+)+c(HC2)+ 2c(H2C2O4),A正确;实验2,c(OH-)=c(H+),根据电荷守恒可得c(H+)+ c(Na+)=c(OH-)+c(HC2)+2c(C2)+c(Cl-),故c(Na+)=c(HC2)+ 2c(C2)+c(Cl-),B错误;实验3,反应Na2C2O4+HCl NaHC2O4+NaCl恰好完全,由题干信息Ka1(H2C2O4)=5.9×10-2,Ka2(H2C2O4)=6.4×10-5可知,Kh(C2)==
5.A Na2A是强碱弱酸盐,A2-水解生成少量HA-,此时溶液中存在: c(Na+)>c(A2-)>c(HA-),A正确;通入HCl后的溶液中,根据电荷守恒可得c(HA-)+2c(A2-)+c(OH-)+c(Cl-)=c(Na+)+c(H+),B错误;溶液中始终存在物料守恒,c(Na+)=c(A2-)+c(HA-)+c(H2A),C错误;溶液pH从3.4变为2,发生的主要反应为HA-+H+ H2A,D错误。
6.D Na2CO3溶液中存在物料守恒:c(Na+)=2[c(C)+c(HC)+ c(H2CO3)],A错误;Na2CO3和BaCl2反应生成的白色沉淀为BaCO3,加入Na2SO4溶液,发生沉淀转化,过滤得到BaSO4沉淀,向滤渣中加入足量的盐酸,无明显现象,说明第二次过滤后所得滤渣中不存在BaCO3,B错误;根据B项分析,可知BaCO3完全转化为BaSO4,n(BaCO3)= 0.1 mol·L-1×1×10-3 L=10-4 mol,则消耗n(Na2SO4)=10-4 mol,同时生成c(C)=10-4 mol,浸泡后溶液中c(C)==0.1 mol·L-1, c(Ba2+)== mol·L-1=5×10-8 mol·L-1,c(S)≥ = mol·L-1=2×10-3 mol·L-1,故所加Na2SO4溶液的浓度至少为+2×10-3 mol·L-1=0.102 mol·L-1,C错误;增大c(S),使BaCO3转化为BaSO4的平衡正向移动,BaCO3沉淀完全转化,则Qc=≤50,即c(C)≤50c(S),D正确。
7.答案 (1) c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+)
(2)①1.0×10-13 mol/L 1.0×10-13 mol/L
②0.043 mol/L
(3)5
解析 (1)H2S在水中的电离方程式为H2S HS-+H+、HS- S2-+H+,所以二级电离常数表达式Ka2=;0.1 mol/L Na2S溶液中硫离子水解,溶液显碱性,离子浓度的大小顺序为c(Na+)>c(S2-)>c(OH-)> c(HS-)>c(H+)。(2)①根据图像可知当溶液中c(S2-)=1.4×10-19 mol/L时溶液pH=1,则溶液中c(OH-)=1×10-13 mol/L,水电离产生的c(H+)等于溶液中c(OH-),为1.0×10-13 mol/L;②当pH=13时溶液中c(S2-)= 5.7×10-2 mol/L,溶液中的c(H2S)+c(HS-)=0.1 mol/L-0.057 mol/L= 0.043 mol/L。(3)Mn2+开始沉淀时溶液中c(S2-)= mol/L= 1.4×10-13 mol/L,根据H2S的二级电离常数可知溶液中c(H+)= = mol/L=1×10-5 mol/L,所以pH=5。
2
