贵州省贵阳市贵州师范大学附属中学2024-2025学年九年级下学期诊断考试化学试题(含解析)
文档属性
| 名称 | 贵州省贵阳市贵州师范大学附属中学2024-2025学年九年级下学期诊断考试化学试题(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 710.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-11 16:30:22 | ||
图片预览


文档简介
贵州省贵阳市贵州师范大学附属中学2024-2025学年九年级下学期诊断考试化学试题
学校:___________姓名:___________班级:___________考号:___________
一、选择题
1.春节,《哪吒之魔童闹海》的爆火,让越界影城成为贵阳新的名片。下列做法能体现贵阳这座文明城市的行为是
A.商铺污水任意排放 B.市区尽量开车出行
C.菜市场大量使用塑料袋 D.生活垃圾分类回收
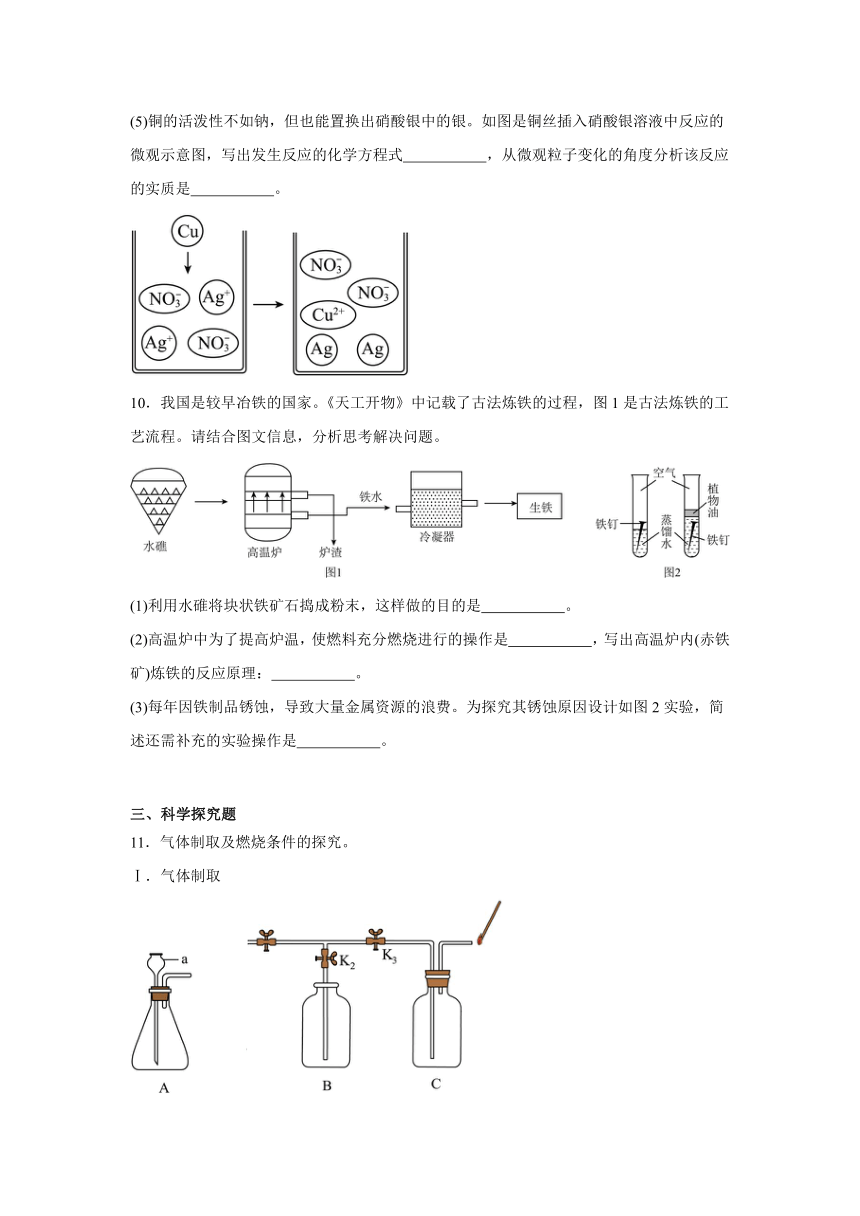
2.某同学学习了粗盐提纯的实验操作过程,用到了以下基本实验操作。其中正确的是
A.称取固体 B.溶解固体
C.过滤 D.蒸发
3.下列劳动实践,不是直接利用所给物质性质的是
选项 劳动实践 化学知识
A 用氮气防止食品腐烂 氮气的化学性质不活泼
B 用竹炭去除汽车内的异味 竹炭具有吸附性
C 用二氧化碳生产碳酸饮料 二氧化碳是无色、无臭的气体
D 用石墨制造受电弓滑板 石墨的熔点高,具有优良的导电性能
A.A B.B C.C D.D
4.2024年7月30日,中国运动员孙颖莎和王楚钦获得了巴黎奥运会乒乓球混双冠军,乒乓球的主要成分是聚酯纤维,是由对苯二甲酸和乙二醇为原料制成的,对其原料对苯二甲酸的说法不正确的是
A.对苯二甲酸属于化合物
B.对苯二甲酸的相对分子质量为166g
C.对苯二甲酸中碳、氢、氧元素的质量比为
D.每个对苯二甲酸分子由8个碳原子、6个氢原子和4个氧原子构成
5.下列实验现象中,能够验证质量守恒定律的是
A.铜在空气中加热固体质量增加 B.硫酸铜溶液与铁反应,总质量不变
C.碳酸钠粉末与稀盐酸反应后质量减轻 D.镁条在空气中燃烧后,生成物质质量增加
6.设计实验方案,分析实验原理,解决实验问题,是化学独特的学科思想。下列实验设计能达到相应实验目的的是
A.证明蜡烛中含碳元素
B.验证质量守恒定律
C.探究不同溶剂中物质溶解性大小
D.除去CO2中的CO气体
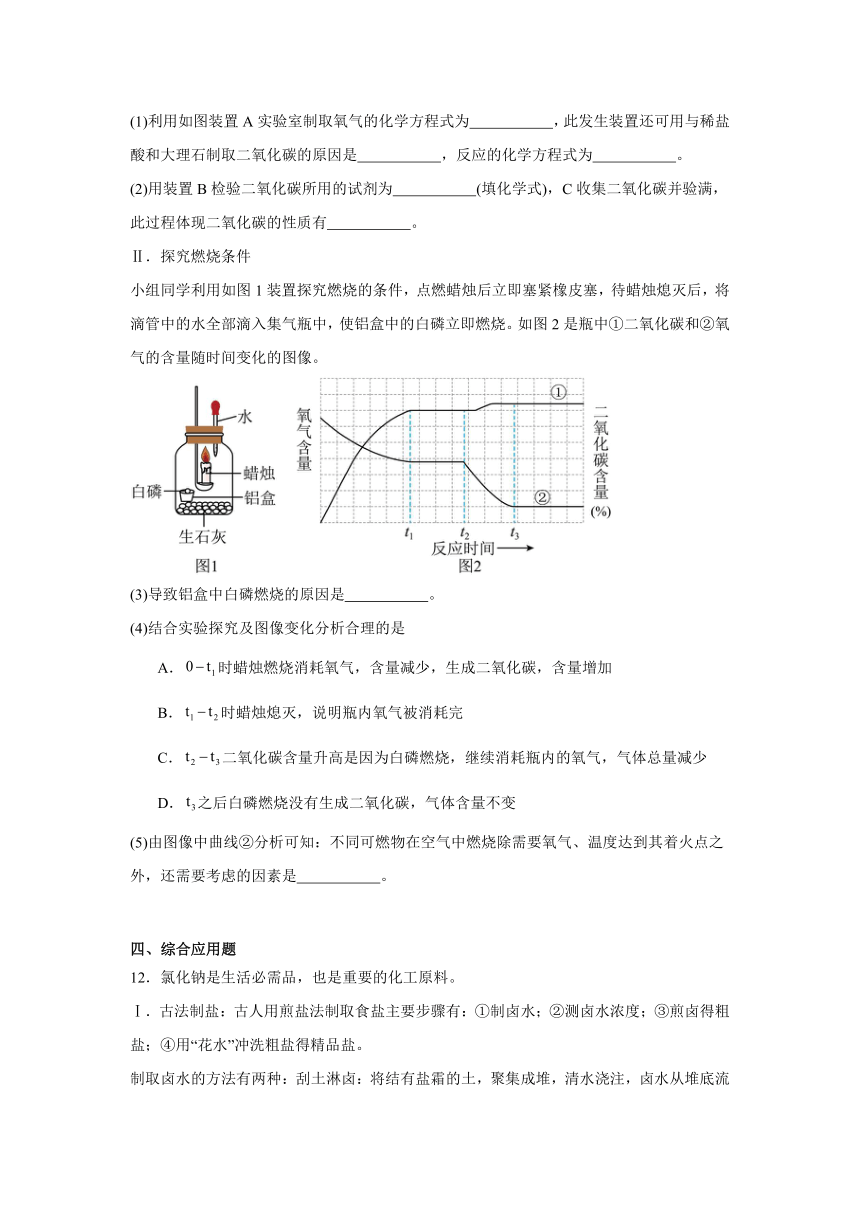
7.向盛有10g49%稀硫酸的烧杯中加入5.6g的铁粉,充分反应后有固体残留,t1时迅速倒入一定量的硫酸铜溶液。整个过程烧杯中溶液的质量随时间的变化如图所示。分析错误的是
A.m=12.7g B.c点时,溶液中有两种溶质
C.d点固体,加入盐酸一定没有气泡产生 D.a→b点,溶液中溶质的总质量逐渐增大
二、填空与简答
8.生活中处处有化学。
(1)空气是人类生活生产的重要资源,在晨跑时供给呼吸的气体是 ,能闻到树木花草的清香是因为 。
(2)在食盐中加入适量的碘酸钾补充碘元素。碘酸钾中碘元素的化合价 ,从化学式中可以获得的信息是 (写一条即可)。
(3)我国海域埋藏着大量的可燃冰(主要含有甲烷水合物),其燃烧过程中伴随的能量转化是将化学能转化为 ,你还知道的新能源有 (写一种即可)。
(4)制造太阳能电池板需要铝合金片,铝合金能加工成箔片是利用了金属的 性。铝制品在空气中不易被腐蚀的原因是 。
9.阅读科普短文,回答下列问题:
钠是一种银白色金属,质软,密度为,化学性质很活泼。钠遇水立即发生剧烈反应,生成氢氧化钠和氢气。实验室,通常将钠保存在煤油中。金属钠在工业上具有非常重要的用途。利用钠的强还原性,在一定条件下可将钛、锆等稀有金属从其氯化物中置换出来。工业上通常采用电解熔融氯化钠的方式制取单质钠。阅读分析,解决问题:
(1)在实验室,将钠保存在煤油中的原因是 。
(2)写出钠和水发生反应的化学方程式 。
(3)工业上制取金属钠的原理属于 (填基本反应类型)。
(4)金属镁与钠位于元素周期表中同一周期,其化学性质却没有钠活泼,请从原子结构分析其原因是 。
(5)铜的活泼性不如钠,但也能置换出硝酸银中的银。如图是铜丝插入硝酸银溶液中反应的微观示意图,写出发生反应的化学方程式 ,从微观粒子变化的角度分析该反应的实质是 。
10.我国是较早冶铁的国家。《天工开物》中记载了古法炼铁的过程,图1是古法炼铁的工艺流程。请结合图文信息,分析思考解决问题。
(1)利用水碓将块状铁矿石捣成粉末,这样做的目的是 。
(2)高温炉中为了提高炉温,使燃料充分燃烧进行的操作是 ,写出高温炉内(赤铁矿)炼铁的反应原理: 。
(3)每年因铁制品锈蚀,导致大量金属资源的浪费。为探究其锈蚀原因设计如图2实验,简述还需补充的实验操作是 。
三、科学探究题
11.气体制取及燃烧条件的探究。
Ⅰ.气体制取
(1)利用如图装置A实验室制取氧气的化学方程式为 ,此发生装置还可用与稀盐酸和大理石制取二氧化碳的原因是 ,反应的化学方程式为 。
(2)用装置B检验二氧化碳所用的试剂为 (填化学式),C收集二氧化碳并验满,此过程体现二氧化碳的性质有 。
Ⅱ.探究燃烧条件
小组同学利用如图1装置探究燃烧的条件,点燃蜡烛后立即塞紧橡皮塞,待蜡烛熄灭后,将滴管中的水全部滴入集气瓶中,使铝盒中的白磷立即燃烧。如图2是瓶中①二氧化碳和②氧气的含量随时间变化的图像。
(3)导致铝盒中白磷燃烧的原因是 。
(4)结合实验探究及图像变化分析合理的是
A.时蜡烛燃烧消耗氧气,含量减少,生成二氧化碳,含量增加
B.时蜡烛熄灭,说明瓶内氧气被消耗完
C.二氧化碳含量升高是因为白磷燃烧,继续消耗瓶内的氧气,气体总量减少
D.之后白磷燃烧没有生成二氧化碳,气体含量不变
(5)由图像中曲线②分析可知:不同可燃物在空气中燃烧除需要氧气、温度达到其着火点之外,还需要考虑的因素是 。
四、综合应用题
12.氯化钠是生活必需品,也是重要的化工原料。
Ⅰ.古法制盐:古人用煎盐法制取食盐主要步骤有:①制卤水;②测卤水浓度;③煎卤得粗盐;④用“花水”冲洗粗盐得精品盐。
制取卤水的方法有两种:刮土淋卤:将结有盐霜的土,聚集成堆,清水浇注,卤水从堆底流出;
草木灰淋卤:将草木灰浸入海水然后晾晒至现出白光,再用海水淋之,得卤水。
(1)上述两种制取卤水的方法属于 变化。
(2)卤水入锅前,以石莲子或鸡蛋投入卤中,检验卤水浓度,石莲子或者鸡蛋沉入水下的为淡卤,半飘浮的为半淡卤,浮立于水面的为成卤,其中溶质质量分数最大的是 (填“淡卤”“半淡卤”或“成卤”)。
(3)以成卤入锅煎盐,有白色晶体析出。此过程制盐的原理是 。
(4)经调查发现,“花水”是NaCl的饱和溶液,用“花水”冲洗粗盐而不用淡水冲洗的原因是 。
Ⅱ.工业制盐:目前工业上常用真空法制备食盐,通过减压使热的海水快速蒸发而获得食盐。某同学在实验室中用溶液a(3%NaCl溶液1000g)模拟真空法制备食盐的流程(忽略物质的损耗)及氯化钠溶解度曲线如图所示:
(5)溶液a中溶质的质量为 g。溶液a经减压蒸发后得到溶液b和NaCl固体xg,x的数值为 。溶液b的质量 溶液c的质量(填“<”“=”或“>”)。
(6)海水晒盐是借助日光和风力使水分蒸发。对比分析真空制盐,海水晒盐的优点是 。
五、填空与简答
13.金属材料的广泛应用,极大地促进了“中国梦”的实现。逐梦小组以“探究金属性质”为主题开展项目式学习。
【任务一】:初识金属
(1)观看“打铁花”表演,了解到用生铁而不用纯铁的原因是生铁的熔点比纯铁的 (填“高”或“低”)。请写出铁在氧气中燃烧的化学方程式: 。
【任务二】:探究金属
(2)将稀盐酸滴入装有铁片的试管中观察到现象是 ,此反应的化学方程式 。
【任务三】:再探金属
小组同学将铁粉投入一定量硝酸铜和硝酸银的混合溶液中,过滤,各自得到一份滤渣和滤液。滤液中阳离子变化如图所示。请你分析回答:
(3)图9中曲线b发生的化学反应方程式为: 。
(4)时,曲线a表示离子数目不变的原因是 。
(5)请分析此实验过程中的溶液质量变化关系及解释原因 。
【总结归纳】:
(6)上述实验中体现了金属的化学性质有 。
六、计算题
14.实验室取100g某浓度的稀硫酸恰好与6.5g锌完全反应。试计算该反应能产生氢气的质量是多少?(写出计算过程)
《贵州省贵阳市贵州师范大学附属中学2024-2025学年九年级下学期诊断考试化学试题》参考答案
题号 1 2 3 4 5 6 7
答案 D C C B B C C
1.D
【详解】A. 商铺污水任意排放,会造成水污染, 此选项不符合题意;
B. 市区尽量开车出行,会加重城市交通拥堵,此选项不符合题意;
C. 菜市场大量使用塑料袋,会造成白色污染,此选项不符合题意;
D. 生活垃圾分类回收,有利用环境保护,此选项符合题意。
故选D。
2.C
【详解】A、使用天平时要遵循“左物右码”的原则,药品应放在称量纸上称量,防止药品污染托盘,选项错误;
B、量筒只用于量取液体体积,不能作溶解固体的容器,选项错误;
C、过滤用玻璃棒引流,液面低于滤纸边缘,漏斗底部靠在烧杯内壁上,选项正确;
D、不能用手拿正在加热的蒸发皿,以免烫伤,选项错误。
故选C。
3.C
【详解】A、用氮气防止食品腐烂,是利用了氮气的化学性质不活泼,不易发生反应,可作保护气,不符合题意;
B、用竹炭去除汽车内的异味,是因为竹炭具有吸附性,能吸附异味,不符合题意;
C、用二氧化碳生产碳酸饮料,是利用了二氧化碳能与水反应生成碳酸这一化学性质,而不是二氧化碳是无色、无臭的气体这一物理性质,符合题意;
D、用石墨制造受电弓滑板,是利用了石墨的熔点高且具有优良的导电性能,不符合题意;
故选:C。
4.B
【详解】A、化合物是由不同元素组成的纯净物,对苯二甲酸是由碳、氢、氧三种元素组成的纯净物,属于化合物。A正确;
B、对苯二甲酸的相对分子质量=12×8+1×6+16×4=166。B不正确;
C、对苯二甲酸中碳、氢、氧元素的质量比=(12×8):(1×6):(16×4)=48:3:32。C正确;
D、据对苯二甲酸的化学式可知,每个对苯二甲酸分子由8个碳原子、6个氢原子和4个氧原子构成。D正确。
综上所述:选择B。
5.B
【详解】A. 铜在空气中加热固体质量增加,是因为铜与氧气反应生成氧化铜,因为氧气参加反应,所以反应后氧化铜的质量大于铜的质量,符合质量守恒定律,但不能验证质量守恒定律,此选项不符合题意;
B. 硫酸铜溶液与铁反应,总质量不变,是因为铁与硫酸铜溶液反应生成硫酸亚铁、铜,属于化学变化,因为反应前后质量相等,能验证质量守恒定,此选项符合题意;
C. 碳酸钠粉末与稀盐酸反应后质量减轻,是因为该两种物质发生反应生成的二氧化碳逸出,属于化学变化,符合质量守恒定律,但不能验证质量守恒定律,此选项不符合题意;
D. 镁条在空气中燃烧后,生成物质质量增加,是因为镁与氧气反应生成氧化镁,属于化学变化,符合质量守恒定律,但不能验证质量守恒定律,此选项不符合题意。
故选B。
6.C
【详解】A、在火焰上方罩一个干冷的烧杯,烧杯内壁出现水雾,说明生成了水,水是由氢元素和氧元素组成的,反应物氧气中只含有氧元素,说明蜡烛中一定含有氢元素,无法确定是否含有碳元素,故选项不能达到相应实验目的;
B、蜡烛在空气中燃烧生成二氧化碳和水蒸气,逸散到空气中,天平不平衡,不能验证质量守恒定律,故选项不能达到相应实验目的;
C、图中实验,除了溶剂的种类不同外,其它条件均相同,可探究不同溶剂中物质溶解性强弱,故选项能达到相应实验目的;
D、在加热条件下,碳和二氧化碳反应生成一氧化碳,没有除去一氧化碳,反而把原物质二氧化碳除去了,不符合除杂原则,故选项不能达到相应实验目的。
故选C。
7.C
【分析】,铁和硫酸的质量比是56:98,实际铁5.6g,硫酸:10g×49%=4.9g,则硫酸完全反应,铁粉有剩余,铁与稀硫酸反应时,56份的铁置换出2份的氢气,溶液质量增加,在t1时迅速倒入一定量的硫酸铜溶液,铁与硫酸铜反应:56份的铁置换出 64份的铜,固体质量增加,溶液的质量减小。
【详解】A、,溶液增加的质量为7.6g-4.9g=2.7g,所以m=10g+2.7g=12.7g,该选项不符合题意;
B、由图象可知,c点时溶液的质量还在减小,硫酸铜没有完全反应,溶液中溶质有硫酸亚铁和硫酸铜两种,该选项不符合题意;
C、由于硫酸铜的量不能确定,可能有剩余的铁,d点时,烧杯中固体一定是有铜,可能有铁,加入盐酸不一定有气泡产生,该选项符合题意;
D、由图可知,a→b点,溶液质量逐渐增加,溶剂质量不变,故溶质的总质量逐渐增大,该选项不符合题意;
故选C。
8.(1) 氧气/O2 分子在不断运动
(2) +5 碘酸钾由钾、碘、氧三种元素组成(合理即可)
(3) 热能/内能 太阳能(合理即可)
(4) 延展 铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,从而阻止铝进一步氧化
【详解】(1)供给呼吸的气体是氧气,人呼吸过程需要氧气参与体内的氧化反应释放能量;能闻到树木花草的清香是因为分子在不断运动,树木花草中的有气味分子运动到人的鼻腔,使人闻到香味;
(2)在KIO3中,钾元素显+1价,氧元素显 2价,设碘元素的化合价为x,根据化合物中各元素正负化合价代数和为零,则(+1)+x+( 2)×3=0,解得x=+5,所以碘酸钾中碘元素的化合价为+5价;
从化学式KIO3中可以获得的信息有:碘酸钾由钾、碘、氧三种元素组成(或碘酸钾是由不同元素组成的纯净物,属于化合物等合理即可)。
(3)可燃冰(主要成分是甲烷水合物)燃烧过程中伴随的能量转化是将化学能转化为热能(或内能),燃烧时释放热量。 常见的新能源有太阳能、风能、地热能、潮汐能、氢能等(任写一种即可)。
(4)铝合金能加工成箔片是利用了金属的延展性,金属可以被压成薄片;铝制品在空气中不易被腐蚀的原因是铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,从而阻止铝进一步氧化。
9.(1)钠化学性质活泼,钠的密度比煤油大且不与煤油反应,可隔绝空气和水
(2)2Na+2H2O=2NaOH+H2↑
(3)分解反应
(4)镁与钠电子层数相同,镁原子的质子数比钠原子多一个,对最外层电子的吸引力更强,最外层电子更难失去
(5) Cu+2AgNO3=Cu(NO3)2+2Ag 铜原子失去电子变成铜离子,银离子得到电子变成银原子,即铜原子和银离子之间发生了电子转移
【详解】(1)钠的化学性质很活泼,钠遇水立即发生剧烈反应,而钠的密度比煤油大,且钠不与煤油反应,将钠保存在煤油中可隔绝空气和水,防止钠与空气中的氧气、水等物质发生反应。在实验室,将钠保存在煤油中的原因是钠化学性质活泼,钠的密度比煤油大且不与煤油反应,可隔绝空气和水;
(2)钠和水反应生成氢氧化钠和氢气,化学方程式为2Na+2H2O=2NaOH+H2↑;
(3)工业上采用电解熔融氯化钠制取单质钠, 同时生成氯气,该反应是由一种化合物生成两种单质,符合 “一变多” 的特点,属于分解反应;
(4)镁与钠位于同一周期,电子层数相同,镁原子的质子数比钠原子多一个,对最外层电子的吸引力更强,最外层电子更难失去,所以镁的化学性质不如钠活泼;
(5)铜丝插入硝酸银溶液中,铜与硝酸银反应生成硝酸铜和银,化学方程式为Cu+2AgNO3=Cu(NO3)2+2Ag;从微观粒子变化的角度分析,该反应的实质是铜原子失去电子变成铜离子,银离子得到电子变成银原子,即铜原子和银离子之间发生了电子转移。
10.(1)增大反应物之间的接触面积,加快化学反应的速率
(2) 鼓入大量的空气
(3)将洁净的铁钉放入充满干燥空气的密闭试管中
【详解】(1)将块状铁矿石捣成粉末,这样做的目的是增大反应物之间的接触面积,加快化学反应的速率;
(2)高温炉中为了提高炉温,可进行的操作是鼓入大量的空气;在高温的条件下,氧化铁与碳反应生成铁和二氧化碳,高温炉内发生反应的化学方程式为:;
(3)铁生锈的条件是铁与氧气和水接触,为了完整探究铁钉锈蚀条件,还需补充的实验为:将洁净的铁钉放入充满干燥空气的密闭试管中。
11.(1) 2H2O22H2O+O2↑ 装置A是固液常温型发生装置 CaCO3+2HCl=CaCl2+H2O+CO2↑
(2) Ca(OH)2 密度比空气大,不燃烧、不支持燃烧
(3)氧化钙与水反应放出大量的热,温度达到了白磷的着火点
(4)AC
(5)氧气达到各自可燃物燃烧的最低浓度
【详解】(1)装置A是固液常温型发生装置,利用如图装置A实验室制取氧气,则是用过氧化氢溶液制取氧气,反应的化学方程式为:2H2O22H2O+O2↑,此发生装置还可用与稀盐酸和大理石制取二氧化碳的原因是装置A是:固液常温型发生装置,反应的化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑。
(2)二氧化碳能澄清石灰水变浑浊,实验室常用澄清石灰水检验二氧化碳,澄清石灰水是氢氧化钙溶液。所以用装置B检验二氧化碳所用的试剂为Ca(OH)2,C收集二氧化碳并验满,二氧化碳由短导气管排出,用燃烧的木条检验,体现二氧化碳的性质有:密度比空气大,二氧化碳不燃烧、不支持燃烧。
(3)导致铝盒中白磷燃烧的原因是:氧化钙与水反应放出大量的热,温度达到了白磷的着火点。
(4)A. 开始点燃蜡烛,蜡烛燃烧消耗氧气,生成二氧化碳,氧气含量下降,二氧化碳含量升高,所以时蜡烛燃烧消耗氧气,氧气含量减少,生成二氧化碳,二氧化碳含量增加,此选项正确;
B. 时二氧化碳含量不再增加,说明蜡烛熄灭,由图像可知,此时氧气的含量不为0,说明瓶内氧气未被消耗完,此选项错误;
C. 二氧化碳含量升高,是因为白磷燃烧,继续消耗瓶内的氧气,导致装置内气体总质量减少,使得二氧化碳的含量增多,此选项正确;
D. 之后氧气含量、二氧化碳的含量不变,说明白磷燃烧停止,此选项错误。
故选AC。
(5)由图像中曲线②分析可知:氧气并没有完全耗尽,说明不同可燃物在空气中燃烧除需要氧气、温度达到其着火点之外,还需要考虑的因素是氧气达到各自可燃物燃烧的最低浓度。
12.(1)物理
(2)成卤
(3)蒸发结晶
(4)“花水” 是NaCl的饱和溶液,不会溶解NaCl,但能溶解其他杂质,可减少NaCl的损失
(5) 30 10.5 >
(6)节约能源,成本低
【详解】(1)刮土淋卤是将结有盐霜的土用清水浇注,使盐溶解在水中形成卤水,没有新物质生成;草木灰淋卤是将草木灰浸入海水然后晾晒等操作得到卤水,整个过程也没有新物质生成。所以上述两种制取卤水的方法属于物理变化;
(2)当一个物体放在液体中时,如果它的密度大于液体的密度,它就会沉下去;如果它的密度小于液体的密度,它就会浮起来;如果它的密度等于液体的密度,它就会悬浮在液体中。石莲子或者鸡蛋沉入水下的为淡卤,半飘浮的为半淡卤,浮立于水面的为成卤,即温度相同时成卤的密度最大,成卤的浓度最大,溶质质量分数最大的是成卤;
(3)以成卤入锅煎盐,有白色晶体析出,此过程是通过加热使水分不断蒸发,溶液由不饱和变为饱和,继续蒸发水分,溶质氯化钠就会结晶析出,制盐的原理是蒸发结晶;
(4)“花水” 是NaCl的饱和溶液,用 “花水” 冲洗粗盐,“花水” 不能再溶解NaCl,但可以溶解粗盐中的其他杂质,从而得到更纯净的食盐,同时又不会损失NaCl。而用淡水冲洗会溶解部分NaCl,导致食盐损失。所以用 “花水” 冲洗粗盐而不用淡水冲洗的原因是 “花水” 是NaCl的饱和溶液,不会溶解NaCl,但能溶解其他杂质,可减少NaCl的损失。
(5)溶质的质量=溶液的质量溶质质量分数,溶液a中溶质的质量为1000g3%=30g;溶液a中溶剂的质量为1000g-30g=970g,溶液a经减压蒸发后得到溶液b和NaCl固体xg,且蒸发920g水蒸气,则溶液b属于饱和溶液,溶液b中溶剂的质量为970g-920g=50g。由已知信息可知90℃时,氯化钠的溶解度为39g,即100g的水中最多溶解39g氯化钠固体,故溶液b中溶质的质量为19.5g,则x=30-19.5=10.5;饱和溶液b降温后得到溶液c,该过程有固体析出,溶液质量减小,溶液b的质量>溶液c的质量;
(6)海水晒盐是借助日光和风力使水分蒸发,不需要消耗额外的能源来加热,成本较低。所以海水晒盐的优点是节约能源,成本低。
13.(1) 低 3Fe+2O2Fe3O4
(2) 有气泡产生,溶液由无色变为浅绿色 Fe+2HCl=FeCl2+H2↑
(3)Fe+Cu(NO3)2=Fe(NO3)2+Cu
(4)铁先与硝酸银反应,还未与硝酸铜反应
(5)整个过程溶液质量一直减小,因为铁与硝酸银反应时,每56份质量的铁能置换出216份质量的银,溶液质量减小,铁与硝酸铜反应时,每56份质量的铁能置换出64份质量的铜,溶液质量也减小
(6)金属能与氧气反应、金属能与酸反应、金属能与盐溶液反应
【详解】(1)合金的熔点一般比组成它的纯金属低,所以生铁的熔点比纯铁的低;铁在氧气中燃烧生成四氧化三铁,化学方程式为3Fe+2O2Fe3O4;
(2)将稀盐酸滴入装有铁片的试管中,铁与稀盐酸反应生成氯化亚铁和氢气,观察到的现象是有气泡产生,溶液由无色变为浅绿色。 化学方程式为Fe+2HCl=FeCl2+H2↑;
(3)铁粉投入硝酸铜和硝酸银的混合溶液中,铁先与硝酸银反应,当硝酸银完全反应后,铁再与硝酸铜反应。曲线b表示铁与硝酸铜反应,化学方程式为Fe+Cu(NO3)2=Fe(NO3)2+Cu;
(4)曲线a表示Cu2+,0 t1时,铁先与硝酸银反应,还未与硝酸铜反应,所以Cu2+数目不变;
(5)铁与硝酸银反应时,Fe+2AgNO3=Fe(NO3)2+2Ag,根据化学方程式可知,每56份质量的铁能置换出216份质量的银,固体质量增加,溶液质量减小。 铁与硝酸铜反应时,Fe+Cu(NO3)2=Fe(NO3)2+Cu,每56份质量的铁能置换出64份质量的铜,固体质量增加,溶液质量减小。 整个过程溶液质量一直减小;
(6)上述实验体现了金属能与氧气反应(铁在氧气中燃烧),金属能与酸反应(铁与稀盐酸反应),金属能与盐溶液反应(铁与硝酸银、硝酸铜溶液反应)。
14.解:该反应能产生氢气的质量为x
答:该反应能产生氢气的质量为0.2g。
【详解】计算氢气质量时,不能用稀硫酸质量100g,因为100g稀硫酸中含有硫酸和水,水没有参加反应。具体过程见答案。
学校:___________姓名:___________班级:___________考号:___________
一、选择题
1.春节,《哪吒之魔童闹海》的爆火,让越界影城成为贵阳新的名片。下列做法能体现贵阳这座文明城市的行为是
A.商铺污水任意排放 B.市区尽量开车出行
C.菜市场大量使用塑料袋 D.生活垃圾分类回收
2.某同学学习了粗盐提纯的实验操作过程,用到了以下基本实验操作。其中正确的是
A.称取固体 B.溶解固体
C.过滤 D.蒸发
3.下列劳动实践,不是直接利用所给物质性质的是
选项 劳动实践 化学知识
A 用氮气防止食品腐烂 氮气的化学性质不活泼
B 用竹炭去除汽车内的异味 竹炭具有吸附性
C 用二氧化碳生产碳酸饮料 二氧化碳是无色、无臭的气体
D 用石墨制造受电弓滑板 石墨的熔点高,具有优良的导电性能
A.A B.B C.C D.D
4.2024年7月30日,中国运动员孙颖莎和王楚钦获得了巴黎奥运会乒乓球混双冠军,乒乓球的主要成分是聚酯纤维,是由对苯二甲酸和乙二醇为原料制成的,对其原料对苯二甲酸的说法不正确的是
A.对苯二甲酸属于化合物
B.对苯二甲酸的相对分子质量为166g
C.对苯二甲酸中碳、氢、氧元素的质量比为
D.每个对苯二甲酸分子由8个碳原子、6个氢原子和4个氧原子构成
5.下列实验现象中,能够验证质量守恒定律的是
A.铜在空气中加热固体质量增加 B.硫酸铜溶液与铁反应,总质量不变
C.碳酸钠粉末与稀盐酸反应后质量减轻 D.镁条在空气中燃烧后,生成物质质量增加
6.设计实验方案,分析实验原理,解决实验问题,是化学独特的学科思想。下列实验设计能达到相应实验目的的是
A.证明蜡烛中含碳元素
B.验证质量守恒定律
C.探究不同溶剂中物质溶解性大小
D.除去CO2中的CO气体
7.向盛有10g49%稀硫酸的烧杯中加入5.6g的铁粉,充分反应后有固体残留,t1时迅速倒入一定量的硫酸铜溶液。整个过程烧杯中溶液的质量随时间的变化如图所示。分析错误的是
A.m=12.7g B.c点时,溶液中有两种溶质
C.d点固体,加入盐酸一定没有气泡产生 D.a→b点,溶液中溶质的总质量逐渐增大
二、填空与简答
8.生活中处处有化学。
(1)空气是人类生活生产的重要资源,在晨跑时供给呼吸的气体是 ,能闻到树木花草的清香是因为 。
(2)在食盐中加入适量的碘酸钾补充碘元素。碘酸钾中碘元素的化合价 ,从化学式中可以获得的信息是 (写一条即可)。
(3)我国海域埋藏着大量的可燃冰(主要含有甲烷水合物),其燃烧过程中伴随的能量转化是将化学能转化为 ,你还知道的新能源有 (写一种即可)。
(4)制造太阳能电池板需要铝合金片,铝合金能加工成箔片是利用了金属的 性。铝制品在空气中不易被腐蚀的原因是 。
9.阅读科普短文,回答下列问题:
钠是一种银白色金属,质软,密度为,化学性质很活泼。钠遇水立即发生剧烈反应,生成氢氧化钠和氢气。实验室,通常将钠保存在煤油中。金属钠在工业上具有非常重要的用途。利用钠的强还原性,在一定条件下可将钛、锆等稀有金属从其氯化物中置换出来。工业上通常采用电解熔融氯化钠的方式制取单质钠。阅读分析,解决问题:
(1)在实验室,将钠保存在煤油中的原因是 。
(2)写出钠和水发生反应的化学方程式 。
(3)工业上制取金属钠的原理属于 (填基本反应类型)。
(4)金属镁与钠位于元素周期表中同一周期,其化学性质却没有钠活泼,请从原子结构分析其原因是 。
(5)铜的活泼性不如钠,但也能置换出硝酸银中的银。如图是铜丝插入硝酸银溶液中反应的微观示意图,写出发生反应的化学方程式 ,从微观粒子变化的角度分析该反应的实质是 。
10.我国是较早冶铁的国家。《天工开物》中记载了古法炼铁的过程,图1是古法炼铁的工艺流程。请结合图文信息,分析思考解决问题。
(1)利用水碓将块状铁矿石捣成粉末,这样做的目的是 。
(2)高温炉中为了提高炉温,使燃料充分燃烧进行的操作是 ,写出高温炉内(赤铁矿)炼铁的反应原理: 。
(3)每年因铁制品锈蚀,导致大量金属资源的浪费。为探究其锈蚀原因设计如图2实验,简述还需补充的实验操作是 。
三、科学探究题
11.气体制取及燃烧条件的探究。
Ⅰ.气体制取
(1)利用如图装置A实验室制取氧气的化学方程式为 ,此发生装置还可用与稀盐酸和大理石制取二氧化碳的原因是 ,反应的化学方程式为 。
(2)用装置B检验二氧化碳所用的试剂为 (填化学式),C收集二氧化碳并验满,此过程体现二氧化碳的性质有 。
Ⅱ.探究燃烧条件
小组同学利用如图1装置探究燃烧的条件,点燃蜡烛后立即塞紧橡皮塞,待蜡烛熄灭后,将滴管中的水全部滴入集气瓶中,使铝盒中的白磷立即燃烧。如图2是瓶中①二氧化碳和②氧气的含量随时间变化的图像。
(3)导致铝盒中白磷燃烧的原因是 。
(4)结合实验探究及图像变化分析合理的是
A.时蜡烛燃烧消耗氧气,含量减少,生成二氧化碳,含量增加
B.时蜡烛熄灭,说明瓶内氧气被消耗完
C.二氧化碳含量升高是因为白磷燃烧,继续消耗瓶内的氧气,气体总量减少
D.之后白磷燃烧没有生成二氧化碳,气体含量不变
(5)由图像中曲线②分析可知:不同可燃物在空气中燃烧除需要氧气、温度达到其着火点之外,还需要考虑的因素是 。
四、综合应用题
12.氯化钠是生活必需品,也是重要的化工原料。
Ⅰ.古法制盐:古人用煎盐法制取食盐主要步骤有:①制卤水;②测卤水浓度;③煎卤得粗盐;④用“花水”冲洗粗盐得精品盐。
制取卤水的方法有两种:刮土淋卤:将结有盐霜的土,聚集成堆,清水浇注,卤水从堆底流出;
草木灰淋卤:将草木灰浸入海水然后晾晒至现出白光,再用海水淋之,得卤水。
(1)上述两种制取卤水的方法属于 变化。
(2)卤水入锅前,以石莲子或鸡蛋投入卤中,检验卤水浓度,石莲子或者鸡蛋沉入水下的为淡卤,半飘浮的为半淡卤,浮立于水面的为成卤,其中溶质质量分数最大的是 (填“淡卤”“半淡卤”或“成卤”)。
(3)以成卤入锅煎盐,有白色晶体析出。此过程制盐的原理是 。
(4)经调查发现,“花水”是NaCl的饱和溶液,用“花水”冲洗粗盐而不用淡水冲洗的原因是 。
Ⅱ.工业制盐:目前工业上常用真空法制备食盐,通过减压使热的海水快速蒸发而获得食盐。某同学在实验室中用溶液a(3%NaCl溶液1000g)模拟真空法制备食盐的流程(忽略物质的损耗)及氯化钠溶解度曲线如图所示:
(5)溶液a中溶质的质量为 g。溶液a经减压蒸发后得到溶液b和NaCl固体xg,x的数值为 。溶液b的质量 溶液c的质量(填“<”“=”或“>”)。
(6)海水晒盐是借助日光和风力使水分蒸发。对比分析真空制盐,海水晒盐的优点是 。
五、填空与简答
13.金属材料的广泛应用,极大地促进了“中国梦”的实现。逐梦小组以“探究金属性质”为主题开展项目式学习。
【任务一】:初识金属
(1)观看“打铁花”表演,了解到用生铁而不用纯铁的原因是生铁的熔点比纯铁的 (填“高”或“低”)。请写出铁在氧气中燃烧的化学方程式: 。
【任务二】:探究金属
(2)将稀盐酸滴入装有铁片的试管中观察到现象是 ,此反应的化学方程式 。
【任务三】:再探金属
小组同学将铁粉投入一定量硝酸铜和硝酸银的混合溶液中,过滤,各自得到一份滤渣和滤液。滤液中阳离子变化如图所示。请你分析回答:
(3)图9中曲线b发生的化学反应方程式为: 。
(4)时,曲线a表示离子数目不变的原因是 。
(5)请分析此实验过程中的溶液质量变化关系及解释原因 。
【总结归纳】:
(6)上述实验中体现了金属的化学性质有 。
六、计算题
14.实验室取100g某浓度的稀硫酸恰好与6.5g锌完全反应。试计算该反应能产生氢气的质量是多少?(写出计算过程)
《贵州省贵阳市贵州师范大学附属中学2024-2025学年九年级下学期诊断考试化学试题》参考答案
题号 1 2 3 4 5 6 7
答案 D C C B B C C
1.D
【详解】A. 商铺污水任意排放,会造成水污染, 此选项不符合题意;
B. 市区尽量开车出行,会加重城市交通拥堵,此选项不符合题意;
C. 菜市场大量使用塑料袋,会造成白色污染,此选项不符合题意;
D. 生活垃圾分类回收,有利用环境保护,此选项符合题意。
故选D。
2.C
【详解】A、使用天平时要遵循“左物右码”的原则,药品应放在称量纸上称量,防止药品污染托盘,选项错误;
B、量筒只用于量取液体体积,不能作溶解固体的容器,选项错误;
C、过滤用玻璃棒引流,液面低于滤纸边缘,漏斗底部靠在烧杯内壁上,选项正确;
D、不能用手拿正在加热的蒸发皿,以免烫伤,选项错误。
故选C。
3.C
【详解】A、用氮气防止食品腐烂,是利用了氮气的化学性质不活泼,不易发生反应,可作保护气,不符合题意;
B、用竹炭去除汽车内的异味,是因为竹炭具有吸附性,能吸附异味,不符合题意;
C、用二氧化碳生产碳酸饮料,是利用了二氧化碳能与水反应生成碳酸这一化学性质,而不是二氧化碳是无色、无臭的气体这一物理性质,符合题意;
D、用石墨制造受电弓滑板,是利用了石墨的熔点高且具有优良的导电性能,不符合题意;
故选:C。
4.B
【详解】A、化合物是由不同元素组成的纯净物,对苯二甲酸是由碳、氢、氧三种元素组成的纯净物,属于化合物。A正确;
B、对苯二甲酸的相对分子质量=12×8+1×6+16×4=166。B不正确;
C、对苯二甲酸中碳、氢、氧元素的质量比=(12×8):(1×6):(16×4)=48:3:32。C正确;
D、据对苯二甲酸的化学式可知,每个对苯二甲酸分子由8个碳原子、6个氢原子和4个氧原子构成。D正确。
综上所述:选择B。
5.B
【详解】A. 铜在空气中加热固体质量增加,是因为铜与氧气反应生成氧化铜,因为氧气参加反应,所以反应后氧化铜的质量大于铜的质量,符合质量守恒定律,但不能验证质量守恒定律,此选项不符合题意;
B. 硫酸铜溶液与铁反应,总质量不变,是因为铁与硫酸铜溶液反应生成硫酸亚铁、铜,属于化学变化,因为反应前后质量相等,能验证质量守恒定,此选项符合题意;
C. 碳酸钠粉末与稀盐酸反应后质量减轻,是因为该两种物质发生反应生成的二氧化碳逸出,属于化学变化,符合质量守恒定律,但不能验证质量守恒定律,此选项不符合题意;
D. 镁条在空气中燃烧后,生成物质质量增加,是因为镁与氧气反应生成氧化镁,属于化学变化,符合质量守恒定律,但不能验证质量守恒定律,此选项不符合题意。
故选B。
6.C
【详解】A、在火焰上方罩一个干冷的烧杯,烧杯内壁出现水雾,说明生成了水,水是由氢元素和氧元素组成的,反应物氧气中只含有氧元素,说明蜡烛中一定含有氢元素,无法确定是否含有碳元素,故选项不能达到相应实验目的;
B、蜡烛在空气中燃烧生成二氧化碳和水蒸气,逸散到空气中,天平不平衡,不能验证质量守恒定律,故选项不能达到相应实验目的;
C、图中实验,除了溶剂的种类不同外,其它条件均相同,可探究不同溶剂中物质溶解性强弱,故选项能达到相应实验目的;
D、在加热条件下,碳和二氧化碳反应生成一氧化碳,没有除去一氧化碳,反而把原物质二氧化碳除去了,不符合除杂原则,故选项不能达到相应实验目的。
故选C。
7.C
【分析】,铁和硫酸的质量比是56:98,实际铁5.6g,硫酸:10g×49%=4.9g,则硫酸完全反应,铁粉有剩余,铁与稀硫酸反应时,56份的铁置换出2份的氢气,溶液质量增加,在t1时迅速倒入一定量的硫酸铜溶液,铁与硫酸铜反应:56份的铁置换出 64份的铜,固体质量增加,溶液的质量减小。
【详解】A、,溶液增加的质量为7.6g-4.9g=2.7g,所以m=10g+2.7g=12.7g,该选项不符合题意;
B、由图象可知,c点时溶液的质量还在减小,硫酸铜没有完全反应,溶液中溶质有硫酸亚铁和硫酸铜两种,该选项不符合题意;
C、由于硫酸铜的量不能确定,可能有剩余的铁,d点时,烧杯中固体一定是有铜,可能有铁,加入盐酸不一定有气泡产生,该选项符合题意;
D、由图可知,a→b点,溶液质量逐渐增加,溶剂质量不变,故溶质的总质量逐渐增大,该选项不符合题意;
故选C。
8.(1) 氧气/O2 分子在不断运动
(2) +5 碘酸钾由钾、碘、氧三种元素组成(合理即可)
(3) 热能/内能 太阳能(合理即可)
(4) 延展 铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,从而阻止铝进一步氧化
【详解】(1)供给呼吸的气体是氧气,人呼吸过程需要氧气参与体内的氧化反应释放能量;能闻到树木花草的清香是因为分子在不断运动,树木花草中的有气味分子运动到人的鼻腔,使人闻到香味;
(2)在KIO3中,钾元素显+1价,氧元素显 2价,设碘元素的化合价为x,根据化合物中各元素正负化合价代数和为零,则(+1)+x+( 2)×3=0,解得x=+5,所以碘酸钾中碘元素的化合价为+5价;
从化学式KIO3中可以获得的信息有:碘酸钾由钾、碘、氧三种元素组成(或碘酸钾是由不同元素组成的纯净物,属于化合物等合理即可)。
(3)可燃冰(主要成分是甲烷水合物)燃烧过程中伴随的能量转化是将化学能转化为热能(或内能),燃烧时释放热量。 常见的新能源有太阳能、风能、地热能、潮汐能、氢能等(任写一种即可)。
(4)铝合金能加工成箔片是利用了金属的延展性,金属可以被压成薄片;铝制品在空气中不易被腐蚀的原因是铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,从而阻止铝进一步氧化。
9.(1)钠化学性质活泼,钠的密度比煤油大且不与煤油反应,可隔绝空气和水
(2)2Na+2H2O=2NaOH+H2↑
(3)分解反应
(4)镁与钠电子层数相同,镁原子的质子数比钠原子多一个,对最外层电子的吸引力更强,最外层电子更难失去
(5) Cu+2AgNO3=Cu(NO3)2+2Ag 铜原子失去电子变成铜离子,银离子得到电子变成银原子,即铜原子和银离子之间发生了电子转移
【详解】(1)钠的化学性质很活泼,钠遇水立即发生剧烈反应,而钠的密度比煤油大,且钠不与煤油反应,将钠保存在煤油中可隔绝空气和水,防止钠与空气中的氧气、水等物质发生反应。在实验室,将钠保存在煤油中的原因是钠化学性质活泼,钠的密度比煤油大且不与煤油反应,可隔绝空气和水;
(2)钠和水反应生成氢氧化钠和氢气,化学方程式为2Na+2H2O=2NaOH+H2↑;
(3)工业上采用电解熔融氯化钠制取单质钠, 同时生成氯气,该反应是由一种化合物生成两种单质,符合 “一变多” 的特点,属于分解反应;
(4)镁与钠位于同一周期,电子层数相同,镁原子的质子数比钠原子多一个,对最外层电子的吸引力更强,最外层电子更难失去,所以镁的化学性质不如钠活泼;
(5)铜丝插入硝酸银溶液中,铜与硝酸银反应生成硝酸铜和银,化学方程式为Cu+2AgNO3=Cu(NO3)2+2Ag;从微观粒子变化的角度分析,该反应的实质是铜原子失去电子变成铜离子,银离子得到电子变成银原子,即铜原子和银离子之间发生了电子转移。
10.(1)增大反应物之间的接触面积,加快化学反应的速率
(2) 鼓入大量的空气
(3)将洁净的铁钉放入充满干燥空气的密闭试管中
【详解】(1)将块状铁矿石捣成粉末,这样做的目的是增大反应物之间的接触面积,加快化学反应的速率;
(2)高温炉中为了提高炉温,可进行的操作是鼓入大量的空气;在高温的条件下,氧化铁与碳反应生成铁和二氧化碳,高温炉内发生反应的化学方程式为:;
(3)铁生锈的条件是铁与氧气和水接触,为了完整探究铁钉锈蚀条件,还需补充的实验为:将洁净的铁钉放入充满干燥空气的密闭试管中。
11.(1) 2H2O22H2O+O2↑ 装置A是固液常温型发生装置 CaCO3+2HCl=CaCl2+H2O+CO2↑
(2) Ca(OH)2 密度比空气大,不燃烧、不支持燃烧
(3)氧化钙与水反应放出大量的热,温度达到了白磷的着火点
(4)AC
(5)氧气达到各自可燃物燃烧的最低浓度
【详解】(1)装置A是固液常温型发生装置,利用如图装置A实验室制取氧气,则是用过氧化氢溶液制取氧气,反应的化学方程式为:2H2O22H2O+O2↑,此发生装置还可用与稀盐酸和大理石制取二氧化碳的原因是装置A是:固液常温型发生装置,反应的化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑。
(2)二氧化碳能澄清石灰水变浑浊,实验室常用澄清石灰水检验二氧化碳,澄清石灰水是氢氧化钙溶液。所以用装置B检验二氧化碳所用的试剂为Ca(OH)2,C收集二氧化碳并验满,二氧化碳由短导气管排出,用燃烧的木条检验,体现二氧化碳的性质有:密度比空气大,二氧化碳不燃烧、不支持燃烧。
(3)导致铝盒中白磷燃烧的原因是:氧化钙与水反应放出大量的热,温度达到了白磷的着火点。
(4)A. 开始点燃蜡烛,蜡烛燃烧消耗氧气,生成二氧化碳,氧气含量下降,二氧化碳含量升高,所以时蜡烛燃烧消耗氧气,氧气含量减少,生成二氧化碳,二氧化碳含量增加,此选项正确;
B. 时二氧化碳含量不再增加,说明蜡烛熄灭,由图像可知,此时氧气的含量不为0,说明瓶内氧气未被消耗完,此选项错误;
C. 二氧化碳含量升高,是因为白磷燃烧,继续消耗瓶内的氧气,导致装置内气体总质量减少,使得二氧化碳的含量增多,此选项正确;
D. 之后氧气含量、二氧化碳的含量不变,说明白磷燃烧停止,此选项错误。
故选AC。
(5)由图像中曲线②分析可知:氧气并没有完全耗尽,说明不同可燃物在空气中燃烧除需要氧气、温度达到其着火点之外,还需要考虑的因素是氧气达到各自可燃物燃烧的最低浓度。
12.(1)物理
(2)成卤
(3)蒸发结晶
(4)“花水” 是NaCl的饱和溶液,不会溶解NaCl,但能溶解其他杂质,可减少NaCl的损失
(5) 30 10.5 >
(6)节约能源,成本低
【详解】(1)刮土淋卤是将结有盐霜的土用清水浇注,使盐溶解在水中形成卤水,没有新物质生成;草木灰淋卤是将草木灰浸入海水然后晾晒等操作得到卤水,整个过程也没有新物质生成。所以上述两种制取卤水的方法属于物理变化;
(2)当一个物体放在液体中时,如果它的密度大于液体的密度,它就会沉下去;如果它的密度小于液体的密度,它就会浮起来;如果它的密度等于液体的密度,它就会悬浮在液体中。石莲子或者鸡蛋沉入水下的为淡卤,半飘浮的为半淡卤,浮立于水面的为成卤,即温度相同时成卤的密度最大,成卤的浓度最大,溶质质量分数最大的是成卤;
(3)以成卤入锅煎盐,有白色晶体析出,此过程是通过加热使水分不断蒸发,溶液由不饱和变为饱和,继续蒸发水分,溶质氯化钠就会结晶析出,制盐的原理是蒸发结晶;
(4)“花水” 是NaCl的饱和溶液,用 “花水” 冲洗粗盐,“花水” 不能再溶解NaCl,但可以溶解粗盐中的其他杂质,从而得到更纯净的食盐,同时又不会损失NaCl。而用淡水冲洗会溶解部分NaCl,导致食盐损失。所以用 “花水” 冲洗粗盐而不用淡水冲洗的原因是 “花水” 是NaCl的饱和溶液,不会溶解NaCl,但能溶解其他杂质,可减少NaCl的损失。
(5)溶质的质量=溶液的质量溶质质量分数,溶液a中溶质的质量为1000g3%=30g;溶液a中溶剂的质量为1000g-30g=970g,溶液a经减压蒸发后得到溶液b和NaCl固体xg,且蒸发920g水蒸气,则溶液b属于饱和溶液,溶液b中溶剂的质量为970g-920g=50g。由已知信息可知90℃时,氯化钠的溶解度为39g,即100g的水中最多溶解39g氯化钠固体,故溶液b中溶质的质量为19.5g,则x=30-19.5=10.5;饱和溶液b降温后得到溶液c,该过程有固体析出,溶液质量减小,溶液b的质量>溶液c的质量;
(6)海水晒盐是借助日光和风力使水分蒸发,不需要消耗额外的能源来加热,成本较低。所以海水晒盐的优点是节约能源,成本低。
13.(1) 低 3Fe+2O2Fe3O4
(2) 有气泡产生,溶液由无色变为浅绿色 Fe+2HCl=FeCl2+H2↑
(3)Fe+Cu(NO3)2=Fe(NO3)2+Cu
(4)铁先与硝酸银反应,还未与硝酸铜反应
(5)整个过程溶液质量一直减小,因为铁与硝酸银反应时,每56份质量的铁能置换出216份质量的银,溶液质量减小,铁与硝酸铜反应时,每56份质量的铁能置换出64份质量的铜,溶液质量也减小
(6)金属能与氧气反应、金属能与酸反应、金属能与盐溶液反应
【详解】(1)合金的熔点一般比组成它的纯金属低,所以生铁的熔点比纯铁的低;铁在氧气中燃烧生成四氧化三铁,化学方程式为3Fe+2O2Fe3O4;
(2)将稀盐酸滴入装有铁片的试管中,铁与稀盐酸反应生成氯化亚铁和氢气,观察到的现象是有气泡产生,溶液由无色变为浅绿色。 化学方程式为Fe+2HCl=FeCl2+H2↑;
(3)铁粉投入硝酸铜和硝酸银的混合溶液中,铁先与硝酸银反应,当硝酸银完全反应后,铁再与硝酸铜反应。曲线b表示铁与硝酸铜反应,化学方程式为Fe+Cu(NO3)2=Fe(NO3)2+Cu;
(4)曲线a表示Cu2+,0 t1时,铁先与硝酸银反应,还未与硝酸铜反应,所以Cu2+数目不变;
(5)铁与硝酸银反应时,Fe+2AgNO3=Fe(NO3)2+2Ag,根据化学方程式可知,每56份质量的铁能置换出216份质量的银,固体质量增加,溶液质量减小。 铁与硝酸铜反应时,Fe+Cu(NO3)2=Fe(NO3)2+Cu,每56份质量的铁能置换出64份质量的铜,固体质量增加,溶液质量减小。 整个过程溶液质量一直减小;
(6)上述实验体现了金属能与氧气反应(铁在氧气中燃烧),金属能与酸反应(铁与稀盐酸反应),金属能与盐溶液反应(铁与硝酸银、硝酸铜溶液反应)。
14.解:该反应能产生氢气的质量为x
答:该反应能产生氢气的质量为0.2g。
【详解】计算氢气质量时,不能用稀硫酸质量100g,因为100g稀硫酸中含有硫酸和水,水没有参加反应。具体过程见答案。
同课章节目录
