4.3氮及其化合物——2026届高考化学一轮复习 课件 (共49张PPT)
文档属性
| 名称 | 4.3氮及其化合物——2026届高考化学一轮复习 课件 (共49张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 11.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-13 16:07:27 | ||
图片预览






文档简介
(共49张PPT)
2026届高考一轮复习
第四单元 非金属及其化合物
第3节 氮及其化合物
高考考情分析
本讲知识内容丰富,涉及面广,是高考命题的热点内容之一。试题常以氮元素及其化合物知识为载体,与基本概念、基本理论、实验、计算等密切结合。
以NH3的制备为基础的含氮化合物的制备及性质探究是高考实验命题的热点之一,主要涉及NH3、氮氧化物、硝酸盐、亚硝酸盐等,解答此类问题的实验基础是掌握教材中有关NH3的制备及性质实验。“实践探索”包括认知操作和行动操作两个方面,是完成认知学习和实践的关键环节。含氮化合物的制备及性质探究涉及《中国高考评价体现》中“实践探索”涉及的研究探索、操作运用、语言表达等学科素养,体现“分析与推测”、“探究与创新”等化学学科关键能力。
高频考点与题型分布
选择题:从宏观辨识与微观探析角度考查氮的固定、氮氧化物的回收利用
非选择题:结合工艺流程、实验、化学反应原理考查氨气、铵盐、硝酸、亚硝酸等物质的性质,具有一定的综合性,要关注守恒法在化学计算中的应用。
基础知识梳理
01
基础知识梳理
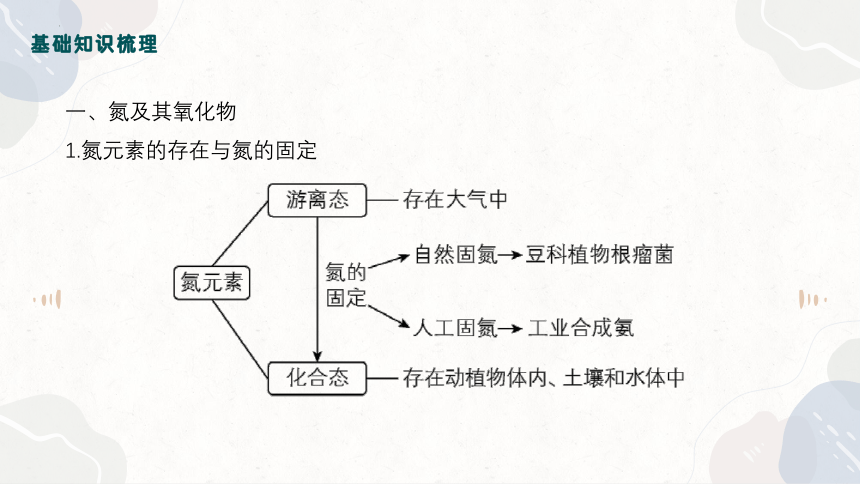
一、氮及其氧化物
1.氮元素的存在与氮的固定
基础知识梳理
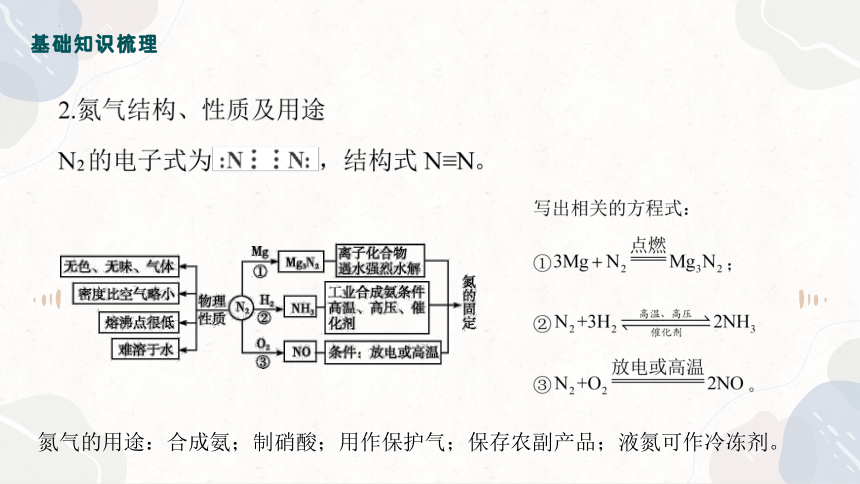
氮气的用途:合成氨;制硝酸;用作保护气;保存农副产品;液氮可作冷冻剂。
基础知识梳理
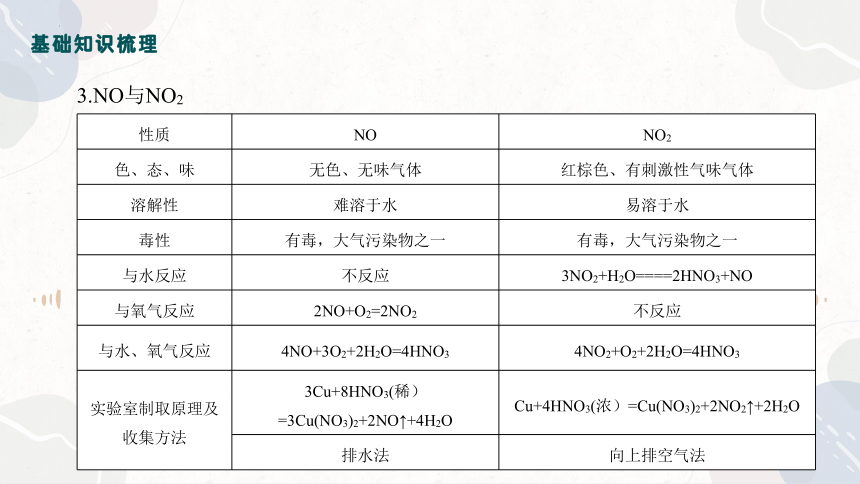
3.NO与NO2
性质 NO NO2
色、态、味 无色、无味气体 红棕色、有刺激性气味气体
溶解性 难溶于水 易溶于水
毒性 有毒,大气污染物之一 有毒,大气污染物之一
与水反应 不反应 3NO2+H2O====2HNO3+NO
与氧气反应 2NO+O2=2NO2 不反应
与水、氧气反应 4NO+3O2+2H2O=4HNO3 4NO2+O2+2H2O=4HNO3
实验室制取原理及收集方法 3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
排水法 向上排空气法
基础知识梳理
二、氨和铵盐
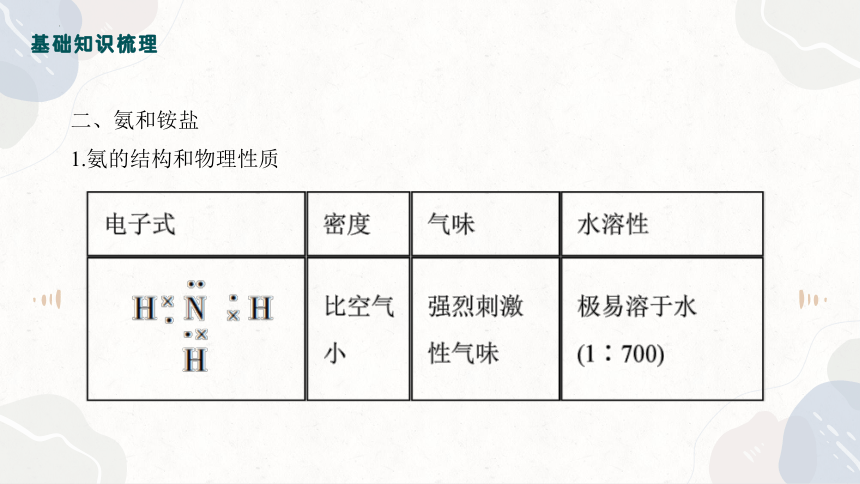
1.氨的结构和物理性质
基础知识梳理
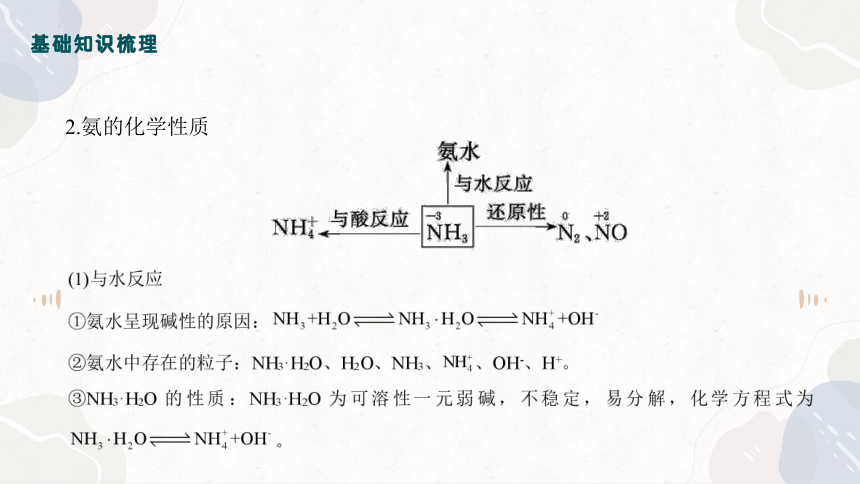
2.氨的化学性质
基础知识梳理
基础知识梳理
基础知识梳理
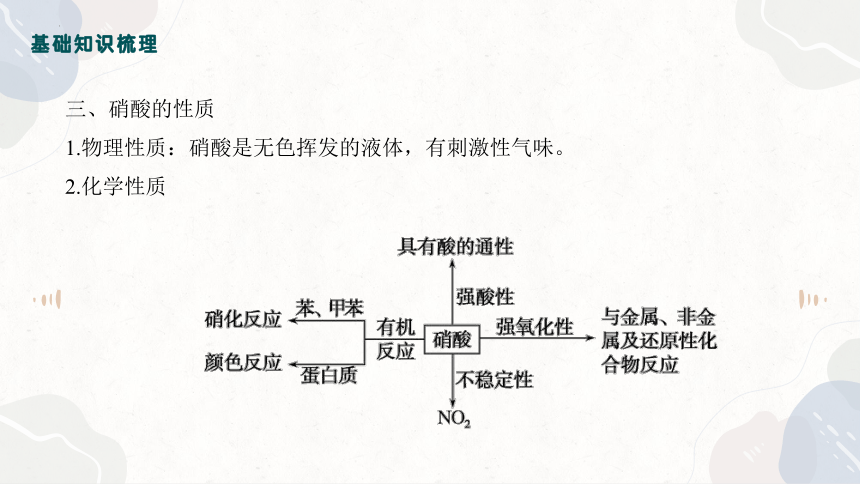
三、硝酸的性质
1.物理性质:硝酸是无色挥发的液体,有刺激性气味。
2.化学性质
基础知识梳理
基础知识梳理
基础知识梳理
四、含氮化合物的转化
1.典型含氮元素物质之间的相互转化
基础知识梳理
基础知识梳理
2.氮元素的价类二维图及转化关系
基础知识梳理
五、环境保护与绿色化学
1.常见的环境问题及对应的污染物
环境问题 污染物
酸雨 SO2及NOx
光化学烟雾 NOx及碳氢化合物
臭氧层空洞 氟氯烃及NOx
水体富营养化 含氮、磷的化合物
废旧电池污染 废旧电池中的汞、镉、铅等重金属离子
温室效应 主要是CO2,但CO2不是大气污染物
白色污染 塑料等有机物
基础知识梳理
2.绿色化学的核心和特征
(1)绿色化学的核心。
绿色化学的核心就是利用化学原理从源头上减少或消除对环境的污染。又称为“环境友好化学”“清洁化学”。
(2)绿色化学的四个特征:
①采用无毒、无害、可再生的物质作原料;
②在无毒、无害的条件(包括催化剂、溶剂)下进行;
③产品应该是环境友好的;
④具有理想的“原子经济性”,即反应具有高选择性、极少副产物,甚至实现“零排放”。
(3)原子经济性:原子经济性可用原子利用率来衡量,其定义可表示为原子利用率=期望产物的总质量/生成物的总质量×100%
基础知识梳理
3.环境污染的类型及防治
类型 防治措施
大气污染 ①开发新能源,减少化石燃料的燃烧
②对工业尾气进行处理
③立法管理
水污染 ①对废水进行无害化处理后排布
②立法管理
土壤污染 ①对垃圾进行回收和分类处理,综合利用
②控制各种污水排放
重难点解析
02
重难点解析
重难点解析
氮氧化物的污染
污染 类型 光化学烟雾:NOx在紫外线作用下,与碳氢化合物发生一系列光化学反应所产生的一种有毒的烟雾
酸雨:NOx排入大气后,与水反应生成HNO3和HNO2,随雨、雪降到地面
破坏臭氧层:NO、NO2可使平流层中的臭氧减少,导致地面紫外线辐射量增加
处理 方法 ①碱液吸收法:NO2、NO的混合气体能被足量的烧碱溶液完全吸收的条件是n(NO2)≥n(NO),一般适用于工业尾气中NOx的处理。2NO2+2NaOH= NaNO3+NaNO2+H2O,NO2+NO+2NaOH=2NaNO2+H2O。
②催化转化:在催化剂条件下,NOx可与氨反应转化为无毒气体(N2)和H2O或与CO反应转化为无毒气体(N2和CO2)。一般适用于汽车尾气的处理
重难点解析
氨的实验室制法
重难点解析
实验室制取氨的其他三种简易方法
重难点解析
氨气实验室制法的注意事项
(1) 实验室用固体铵盐与碱共热制NH3 时,不能使用NH4HCO3、NH4NO3 及NaOH固体,因为NH4HCO3受热分解产生CO2,使制得的NH3不纯;NH4NO3受热时易发生爆炸;NaOH容易吸水结块,不利于NH3的产生和逸出,且加热条件下NaOH容易腐蚀玻璃。
(2)干燥氨气时不能选用酸性干燥剂,如浓硫酸、P2O5 等,也不能选用无水CaCl2,因为它们均能与NH3 发生反应,通常选用碱石灰。
(3)吸收氨气(或 HCl)时要注意防止倒吸。
可用于吸收氨气(或 HCl)并能防倒吸的常用装置为:
重难点解析
重难点解析
喷泉实验的拓展应用
1.形成喷泉的原理
形成喷泉最根本的原因是容器内外存在较大的压强差。在这种压强差的作用下,液体迅速流动,通过带有尖嘴的导管喷出来,形成喷泉。
2.常见喷泉的类型
①容器内气体极易溶于水(或容器内气体易与溶液反应),使容器内压强迅速降低引发的喷泉(容器内压强小于外界大气压)。图1中打开止水夹,挤出胶头滴管中的水,氨气极易溶于水,烧瓶内压强迅速减小,即产生喷泉。图2中打开止水夹,用手(或热毛巾等)将烧瓶捂热,氨气受热膨胀,赶出玻璃导管内的空气,与水接触,即产生喷泉。
重难点解析
②容器内的液体由于受热或发生化学反应产生了大量的气体,使容器内的压强增大引发的喷泉(容器内压强大于外界大气压)。
图3的锥形瓶中盛放“碳酸氢铵与稀盐酸”或“过氧化钠与水”等均能形成喷泉。城市喷泉装置的原理与图3所示装置相同,属于正压喷泉。
重难点解析
3.常见的能形成喷泉的气体和吸收剂
气体 HCl NH3 CO2、Cl2、 SO2、H2S NO2 NO、O2 (体积比为4∶3) NO2、O2
(体积比为4∶1)
吸收剂 水、碱 溶液 水、酸 溶液 碱溶液 水、碱 溶液 水、碱 溶液 水、碱
溶液
重难点解析
4.常见的装置
装置Ⅰ:打开止水夹,挤压胶头滴管的胶头,使少量水进入烧瓶,导致大量的NH3溶解。烧瓶内形成负压而产生喷泉。
装置Ⅱ:挤压气球,即可使少量的酚酞溶液沿导管进入烧瓶,导致大量的NH3溶解,烧瓶内形成负压而产生红色喷泉。
重难点解析
装置Ⅲ:打开止水夹,用手(或热毛巾等)捂热烧瓶,氨气受热膨胀,使氨气通过导管与水接触,即产生喷泉(或用浸冰水的毛巾“冷敷”烧瓶,使水进入烧瓶,烧瓶内氨气溶于水)。
装置Ⅳ:在锥形瓶中加入能产生气体的物质,使锥形瓶内气体的压强明显增大,将液体压入烧瓶而产生喷泉。
装置Ⅴ:在水槽中加入使水温度升高的物质,使锥形瓶内酒精因升温而挥发,锥形瓶内气体压强增大而产生喷泉。
装置Ⅵ:向烧瓶中通入H2S(或SO2),然后通入SO2(或H2S),有淡黄色粉末状物质生成,烧瓶内壁附有水珠,NaOH溶液喷到烧瓶内。
装置Ⅶ:向烧瓶中通入HCl,使HCl进入烧瓶中与NH3反应,导致烧瓶中压强减小,NaOH溶液喷到烧瓶内。
重难点解析
技巧归纳
03
技巧归纳
金属与HNO3反应计算的思维流程
技巧归纳
硝酸与金属反应的计算技巧
重点题型突破
04
重难题型突破
重难题型突破
重难题型突破
重难题型突破
重难题型突破
重难题型突破
重难题型突破
重难题型突破
重难题型突破
重难题型突破
重难题型突破
重难题型突破
Thanks
好好学习天天向上
2026届高考一轮复习
第四单元 非金属及其化合物
第3节 氮及其化合物
高考考情分析
本讲知识内容丰富,涉及面广,是高考命题的热点内容之一。试题常以氮元素及其化合物知识为载体,与基本概念、基本理论、实验、计算等密切结合。
以NH3的制备为基础的含氮化合物的制备及性质探究是高考实验命题的热点之一,主要涉及NH3、氮氧化物、硝酸盐、亚硝酸盐等,解答此类问题的实验基础是掌握教材中有关NH3的制备及性质实验。“实践探索”包括认知操作和行动操作两个方面,是完成认知学习和实践的关键环节。含氮化合物的制备及性质探究涉及《中国高考评价体现》中“实践探索”涉及的研究探索、操作运用、语言表达等学科素养,体现“分析与推测”、“探究与创新”等化学学科关键能力。
高频考点与题型分布
选择题:从宏观辨识与微观探析角度考查氮的固定、氮氧化物的回收利用
非选择题:结合工艺流程、实验、化学反应原理考查氨气、铵盐、硝酸、亚硝酸等物质的性质,具有一定的综合性,要关注守恒法在化学计算中的应用。
基础知识梳理
01
基础知识梳理
一、氮及其氧化物
1.氮元素的存在与氮的固定
基础知识梳理
氮气的用途:合成氨;制硝酸;用作保护气;保存农副产品;液氮可作冷冻剂。
基础知识梳理
3.NO与NO2
性质 NO NO2
色、态、味 无色、无味气体 红棕色、有刺激性气味气体
溶解性 难溶于水 易溶于水
毒性 有毒,大气污染物之一 有毒,大气污染物之一
与水反应 不反应 3NO2+H2O====2HNO3+NO
与氧气反应 2NO+O2=2NO2 不反应
与水、氧气反应 4NO+3O2+2H2O=4HNO3 4NO2+O2+2H2O=4HNO3
实验室制取原理及收集方法 3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
排水法 向上排空气法
基础知识梳理
二、氨和铵盐
1.氨的结构和物理性质
基础知识梳理
2.氨的化学性质
基础知识梳理
基础知识梳理
基础知识梳理
三、硝酸的性质
1.物理性质:硝酸是无色挥发的液体,有刺激性气味。
2.化学性质
基础知识梳理
基础知识梳理
基础知识梳理
四、含氮化合物的转化
1.典型含氮元素物质之间的相互转化
基础知识梳理
基础知识梳理
2.氮元素的价类二维图及转化关系
基础知识梳理
五、环境保护与绿色化学
1.常见的环境问题及对应的污染物
环境问题 污染物
酸雨 SO2及NOx
光化学烟雾 NOx及碳氢化合物
臭氧层空洞 氟氯烃及NOx
水体富营养化 含氮、磷的化合物
废旧电池污染 废旧电池中的汞、镉、铅等重金属离子
温室效应 主要是CO2,但CO2不是大气污染物
白色污染 塑料等有机物
基础知识梳理
2.绿色化学的核心和特征
(1)绿色化学的核心。
绿色化学的核心就是利用化学原理从源头上减少或消除对环境的污染。又称为“环境友好化学”“清洁化学”。
(2)绿色化学的四个特征:
①采用无毒、无害、可再生的物质作原料;
②在无毒、无害的条件(包括催化剂、溶剂)下进行;
③产品应该是环境友好的;
④具有理想的“原子经济性”,即反应具有高选择性、极少副产物,甚至实现“零排放”。
(3)原子经济性:原子经济性可用原子利用率来衡量,其定义可表示为原子利用率=期望产物的总质量/生成物的总质量×100%
基础知识梳理
3.环境污染的类型及防治
类型 防治措施
大气污染 ①开发新能源,减少化石燃料的燃烧
②对工业尾气进行处理
③立法管理
水污染 ①对废水进行无害化处理后排布
②立法管理
土壤污染 ①对垃圾进行回收和分类处理,综合利用
②控制各种污水排放
重难点解析
02
重难点解析
重难点解析
氮氧化物的污染
污染 类型 光化学烟雾:NOx在紫外线作用下,与碳氢化合物发生一系列光化学反应所产生的一种有毒的烟雾
酸雨:NOx排入大气后,与水反应生成HNO3和HNO2,随雨、雪降到地面
破坏臭氧层:NO、NO2可使平流层中的臭氧减少,导致地面紫外线辐射量增加
处理 方法 ①碱液吸收法:NO2、NO的混合气体能被足量的烧碱溶液完全吸收的条件是n(NO2)≥n(NO),一般适用于工业尾气中NOx的处理。2NO2+2NaOH= NaNO3+NaNO2+H2O,NO2+NO+2NaOH=2NaNO2+H2O。
②催化转化:在催化剂条件下,NOx可与氨反应转化为无毒气体(N2)和H2O或与CO反应转化为无毒气体(N2和CO2)。一般适用于汽车尾气的处理
重难点解析
氨的实验室制法
重难点解析
实验室制取氨的其他三种简易方法
重难点解析
氨气实验室制法的注意事项
(1) 实验室用固体铵盐与碱共热制NH3 时,不能使用NH4HCO3、NH4NO3 及NaOH固体,因为NH4HCO3受热分解产生CO2,使制得的NH3不纯;NH4NO3受热时易发生爆炸;NaOH容易吸水结块,不利于NH3的产生和逸出,且加热条件下NaOH容易腐蚀玻璃。
(2)干燥氨气时不能选用酸性干燥剂,如浓硫酸、P2O5 等,也不能选用无水CaCl2,因为它们均能与NH3 发生反应,通常选用碱石灰。
(3)吸收氨气(或 HCl)时要注意防止倒吸。
可用于吸收氨气(或 HCl)并能防倒吸的常用装置为:
重难点解析
重难点解析
喷泉实验的拓展应用
1.形成喷泉的原理
形成喷泉最根本的原因是容器内外存在较大的压强差。在这种压强差的作用下,液体迅速流动,通过带有尖嘴的导管喷出来,形成喷泉。
2.常见喷泉的类型
①容器内气体极易溶于水(或容器内气体易与溶液反应),使容器内压强迅速降低引发的喷泉(容器内压强小于外界大气压)。图1中打开止水夹,挤出胶头滴管中的水,氨气极易溶于水,烧瓶内压强迅速减小,即产生喷泉。图2中打开止水夹,用手(或热毛巾等)将烧瓶捂热,氨气受热膨胀,赶出玻璃导管内的空气,与水接触,即产生喷泉。
重难点解析
②容器内的液体由于受热或发生化学反应产生了大量的气体,使容器内的压强增大引发的喷泉(容器内压强大于外界大气压)。
图3的锥形瓶中盛放“碳酸氢铵与稀盐酸”或“过氧化钠与水”等均能形成喷泉。城市喷泉装置的原理与图3所示装置相同,属于正压喷泉。
重难点解析
3.常见的能形成喷泉的气体和吸收剂
气体 HCl NH3 CO2、Cl2、 SO2、H2S NO2 NO、O2 (体积比为4∶3) NO2、O2
(体积比为4∶1)
吸收剂 水、碱 溶液 水、酸 溶液 碱溶液 水、碱 溶液 水、碱 溶液 水、碱
溶液
重难点解析
4.常见的装置
装置Ⅰ:打开止水夹,挤压胶头滴管的胶头,使少量水进入烧瓶,导致大量的NH3溶解。烧瓶内形成负压而产生喷泉。
装置Ⅱ:挤压气球,即可使少量的酚酞溶液沿导管进入烧瓶,导致大量的NH3溶解,烧瓶内形成负压而产生红色喷泉。
重难点解析
装置Ⅲ:打开止水夹,用手(或热毛巾等)捂热烧瓶,氨气受热膨胀,使氨气通过导管与水接触,即产生喷泉(或用浸冰水的毛巾“冷敷”烧瓶,使水进入烧瓶,烧瓶内氨气溶于水)。
装置Ⅳ:在锥形瓶中加入能产生气体的物质,使锥形瓶内气体的压强明显增大,将液体压入烧瓶而产生喷泉。
装置Ⅴ:在水槽中加入使水温度升高的物质,使锥形瓶内酒精因升温而挥发,锥形瓶内气体压强增大而产生喷泉。
装置Ⅵ:向烧瓶中通入H2S(或SO2),然后通入SO2(或H2S),有淡黄色粉末状物质生成,烧瓶内壁附有水珠,NaOH溶液喷到烧瓶内。
装置Ⅶ:向烧瓶中通入HCl,使HCl进入烧瓶中与NH3反应,导致烧瓶中压强减小,NaOH溶液喷到烧瓶内。
重难点解析
技巧归纳
03
技巧归纳
金属与HNO3反应计算的思维流程
技巧归纳
硝酸与金属反应的计算技巧
重点题型突破
04
重难题型突破
重难题型突破
重难题型突破
重难题型突破
重难题型突破
重难题型突破
重难题型突破
重难题型突破
重难题型突破
重难题型突破
重难题型突破
重难题型突破
Thanks
好好学习天天向上
同课章节目录
