模块质量检测(一)(含解析)高中化学人教版(2019)必修 第一册
文档属性
| 名称 | 模块质量检测(一)(含解析)高中化学人教版(2019)必修 第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 241.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-13 10:18:56 | ||
图片预览



文档简介
模块质量检测(一)
(本试卷满分100分)
一、选择题:本题共15小题,每小题3分,共45分。
1.化学无处不在,下列与化学有关的说法错误的是( )
A.用漂白粉对游泳池进行杀菌消毒,利用了其强氧化性
B.氧化铁用作红色油漆,利用了其颜色为红棕色
C.SO2用作葡萄酒的添加剂,利用了其还原性和漂白性
D.用小苏打发酵面团制作馒头,利用了其碱性
2.下列反应既属于氧化还原反应,又属于离子反应的是( )
A.氢氧化钠与稀硫酸反应
B.灼热的木炭与CO2反应
C.钠与水反应
D.CO2与氢氧化钠溶液反应
3.下列各组物质的分类正确的是( )
A.碱:氨水
B.碱性氧化物:Al2O3
C.混合物:Fe(OH)3胶体
D.电解质:液氯
4.下列物质其水溶液能导电,但物质本身属于非电解质的是( )
A.HCl B.SO2
C.BaCO3 D.C2H5OH(乙醇)
5.下列离子可以在溶液中大量共存的是( )
A.Ba2+、Cl-、SO、NO
B.Fe2+、H+、CO、MnO
C.H+、Cl-、SO、NO
D.Ag+、NO、Cl-、Fe3+
6.下列离子方程式正确的是( )
A.FeCl2溶液中滴加氯水:Fe2++Cl2===Fe3++2Cl-
B.钠与水反应:Na+H2O===Na++OH-+H2↑
C.过量二氧化碳通入氢氧化钠溶液:CO2+2OH-===CO+H2O
D.硫酸铜溶液中加入氢氧化钡溶液:
Ba2++2OH-+Cu2++SO===BaSO4↓+Cu(OH)2↓
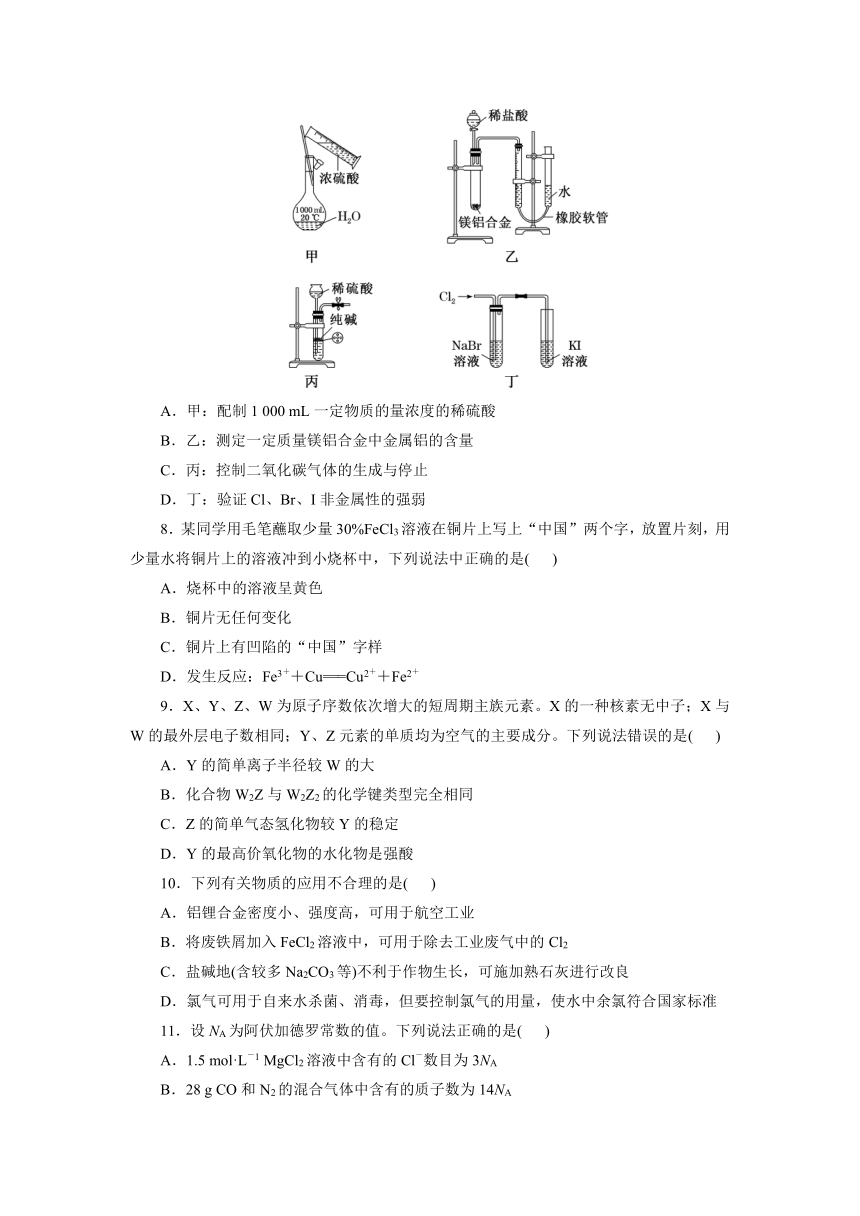
7.下列装置或操作能达到实验目的的是( )
A.甲:配制1 000 mL一定物质的量浓度的稀硫酸
B.乙:测定一定质量镁铝合金中金属铝的含量
C.丙:控制二氧化碳气体的生成与停止
D.丁:验证Cl、Br、I非金属性的强弱
8.某同学用毛笔蘸取少量30%FeCl3溶液在铜片上写上“中国”两个字,放置片刻,用少量水将铜片上的溶液冲到小烧杯中,下列说法中正确的是( )
A.烧杯中的溶液呈黄色
B.铜片无任何变化
C.铜片上有凹陷的“中国”字样
D.发生反应:Fe3++Cu===Cu2++Fe2+
9.X、Y、Z、W为原子序数依次增大的短周期主族元素。X的一种核素无中子;X与W的最外层电子数相同;Y、Z元素的单质均为空气的主要成分。下列说法错误的是( )
A.Y的简单离子半径较W的大
B.化合物W2Z与W2Z2的化学键类型完全相同
C.Z的简单气态氢化物较Y的稳定
D.Y的最高价氧化物的水化物是强酸
10.下列有关物质的应用不合理的是( )
A.铝锂合金密度小、强度高,可用于航空工业
B.将废铁屑加入FeCl2溶液中,可用于除去工业废气中的Cl2
C.盐碱地(含较多Na2CO3等)不利于作物生长,可施加熟石灰进行改良
D.氯气可用于自来水杀菌、消毒,但要控制氯气的用量,使水中余氯符合国家标准
11.设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.1.5 mol·L-1 MgCl2溶液中含有的Cl-数目为3NA
B.28 g CO和N2的混合气体中含有的质子数为14NA
C.11.2 L CO2与足量Na2O2反应转移的电子数为0.5NA
D.含2 mol HCl的浓盐酸与足量MnO2充分反应转移的电子数为NA
12.O2F2可以发生反应:H2S+4O2F2===SF6+2HF+4O2,下列说法正确的是( )
A.氧气是还原产物
B.O2F2既是氧化剂又是还原剂
C.若生成4.48 L HF,则转移0.8 mol电子
D.还原剂与氧化剂的物质的量之比为4∶1
13.四种短周期元素X、Y、Z和M在周期表中的位置如图所示,Y的原子序数是X的2倍。下列说法不正确的是( )
A.Z、M、X的简单离子半径依次减小
B.Y和M可形成化合物YM5
C.X的简单气态氢化物的稳定性强于Y的
D.M的最高价氧化物对应的水化物的酸性比Z的强
14.二氧化氯(ClO2)是一种黄绿色气体,熔点为-59.5 ℃,沸点为11.0 ℃,易溶于水且不与冷水反应,浓度过高时易发生分解引起爆炸,制备二氧化氯溶液的装置如图所示:
下列说法错误的是( )
A.实验中,通入空气的作用之一是稀释ClO2
B.装置②作安全瓶,起防止倒吸的作用
C.装置①反应中氧化剂与还原剂的物质的量之比为1∶2
D.当看到装置③中导管内液面上升时,应增大空气的通入速率
15.以菱镁矿(主要成分为MgCO3,含少量FeCO3、SiO2)为原料制备高纯氧化镁的流程如图。下列说法错误的是( )
A.MgCO3与稀硫酸反应的离子方程式为
MgCO3+2H+===Mg2++CO2↑+H2O
B.滤渣1的成分是Fe(OH)3,滤渣2的成分是SiO2
C.加入H2O2氧化时,发生反应的离子方程式为2Fe2++H2O2+2H+===2Fe3++2H2O
D.实验室灼烧时使用的主要仪器有酒精灯、三脚架、泥三角、坩埚、坩埚钳等
二、非选择题:本题共4小题,共55分。
16.(13分)现有以下物质:①NaOH溶液
②液氨 ③BaCO3固体 ④熔融KHSO4
⑤Fe(OH)3胶体 ⑥铜 ⑦CO2 ⑧稀醋酸
⑨饱和NaHCO3溶液 ⑩乙醇
请回答下列问题。
(1)物质中属于电解质的是________,非电解质的是________,强电解质的是________。(均填序号)
(2)写出⑨和KHSO4溶液反应的离子方程式:
________________________________________________________________________
________________________________________________________________________。
写出①和⑨反应的离子方程式:________________________________________________
________________________________________________________________________。
(3)写出④的电离方程式:_______________________________________________
________________________________________________________________________。
(4)⑤的实验室制备方案:向沸水中滴加几滴______溶液,加热至液体呈红褐色,停止加热;其化学方程式为____________________________________________________
________________________________________________________________________。
(5)在足量①的水溶液中通入少量⑦,发生反应的离子方程式为________________________________________________________________________
________________________________________________________________________。
现有11 g ⑦发生上述反应,需要消耗①的溶质的物质的量为____________mol。
(6)用NaOH固体配制500 mL 0.2 mol·L-1NaOH溶液,需用托盘天平称量的质量为______g,配制所用的玻璃仪器除了烧杯、玻璃棒外还有________________________________________________________________________。
17.(14分)氯化钠是一种化工原料,可以制备多种物质,如图所示,甲为一元强碱,常温下,X2、Y2为气体。
回答下列问题:
(1)甲的化学式是________;Y2的化学式是______;反应④的实验现象是________________________________________________________________________
________________________________________________________________________。
(2)X2和石灰乳的反应与温度有关,某温度下,X2与石灰乳恰好完全反应,X的产物是X-、XO-、XO,若产物中n(X-)=6n(XO-),则XO-与XO的物质的量之比为____________。
(3)工业纯碱中常含有少量NaCl,测定工业纯碱中Na2CO3含量的装置和数据如下:
质量/g
工业纯碱 a
反应前装置C m1
反应后装置C m2
反应前、后均需通入氮气,反应前通入氮气的操作是______________________;样品中Na2CO3的质量分数为____________(用含a、m1、m2的代数式表示);若缺少装置D,会使测定结果__________(填“偏高”“偏低”或“无影响”)。
18.(14分)以高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2、少量FeS2和金属硫酸盐)为原料生产氧化铝并获得Fe3O4的部分工艺流程如图:
(1)配平“焙烧”过程中发生反应的化学方程式。
FeS2+____O2____Fe2O3+____SO2。焙烧时加入的少量CaO可将SiO2转化为______________(填化学式)。
(2)“碱浸”时Al2O3发生反应的离子方程式为_____________________________
________________________________________________________________________。
(3)向“过滤”得到的滤液中通入过量CO2,反应的离子方程式为________________________________________________________________________
________________________________________________________________________。
(4)“过滤”得到的滤渣中含大量的Fe2O3,Fe2O3与FeS2混合后在隔绝空气条件下焙烧生成Fe3O4和SO2,“焙烧”过程理论上完全反应消耗的n(FeS2)∶n(Fe2O3)=________________________________________________________________________。
(5)“烧渣分离”过程中可选用的方法是_______________________________(填字母)。
A.磁选法 B.酸浸法 C.碱浸法
19.(14分)X、Y、Z、W、R、Q为原子序数依次增大的六种短周期主族元素。X是原子半径最小的元素;Y原子最外层电子数是核外电子层数的3倍;Z是短周期中金属性最强的元素;W是地壳中含量最多的金属元素;R的最高正价与最低负价代数和为4。请回答下列问题:
(1)Y的元素名称是____________。
(2)W在周期表中的位置是____________________________________________________。
(3)写出化合物Z2R的电子式:________________________________________________。
(4)写出化合物X2Y2的结构式:____________________________________________。
(5)Y、Z、W三种元素对应的简单离子半径由大到小的顺序是____________________(用元素的离子符号表示)。
(6)下列说法能证明非金属性Q强于R的是______(填字母)。
a.简单阴离子的还原性:Q>R
b.简单氢化物的稳定性:Q>R
c.氧化物对应的水化物的酸性:Q>R
(7)W的单质与Z的最高价氧化物对应的水化物反应的化学方程式是________________________________________________________________________
________________________________________________________________________。
模块质量检测(一)
1.选C SO2有还原性,抗氧化,还能杀菌,可用作葡萄酒的添加剂,不是利用漂白性,C项错误。
2.选C A项,该反应不是氧化还原反应,错误;B项,该反应不是离子反应,错误;D项,该反应不是氧化还原反应,错误。
3.选C 氨水属于碱溶液,A项错误;Al2O3为两性氧化物,B项错误;液氯是单质不是电解质,D项错误。
4.B
5.选C A.Ba2+、SO会反应生成BaSO4沉淀而不能大量共存;B.Fe2+、H+、MnO会发生氧化还原反应而不能大量共存且H+、CO会发生反应生成CO2、H2O,也不能大量共存;C.离子之间不能发生任何反应,可以大量共存;D.Ag+、Cl-会反应生成AgCl沉淀而不能大量共存。
6.选D FeCl2与Cl2反应生成氯化铁,反应的离子方程式为2Fe2++Cl2===2Fe3++2Cl-,故A错误;金属钠加入水生成氢氧化钠和氢气,反应的离子方程式为2Na+2H2O===2Na++2OH-+H2↑,故B错误;过量的二氧化碳通入氢氧化钠溶液中,离子方程式:CO2+OH-===HCO,故C错误;硫酸铜溶液与氢氧化钡溶液反应生成硫酸钡和氢氧化铜沉淀,故D正确。
7.选B 容量瓶不能用于稀释溶液,A错误;镁铝合金与稀盐酸反应生成H2,可以用排水法知道H2的体积,可以计算出一定质量镁铝合金中金属铝的含量,B正确;碳酸钠为粉末状固体且装置中的长颈漏斗不能控制气体的生成与停止,C错误;氯气可以和溴化钠反应生成溴单质,非金属性:氯大于溴;过量的氯气可以和碘化钾反应生成碘单质,则非金属性:氯大于碘,但是不能证明溴和碘的非金属性强弱,D错误。
8.选C FeCl3溶液与铜片发生反应:2FeCl3+Cu===2FeCl2+CuCl2,FeCl2溶液是浅绿色的,CuCl2是蓝色的,A项错误;FeCl3溶液与铜片发生了反应,B项错误;离子方程式中电荷不守恒,D项错误。
9.选B 由题干信息可知,X的一种核素无中子,故X为H,X与W的最外层电子数相同;Y、Z元素的单质均为空气的主要成分,故Y、Z为N、O,结合X、Y、Z、W为原子序数依次增大的短周期主族元素,可知W为Na。化合物W2Z为Na2O只含离子键,W2Z2为Na2O2含有离子键和非极性共价键,二者化学键类型不完全相同,B错误。
10.选C 加入熟石灰,生成CaCO3难溶物,造成土壤板结,C项符合题意。
11.选B 溶液的体积未知,无法计算其物质的量,故A错误;CO和N2的质子数都为14,28 g CO和N2的物质的量为1 mol,故28 g CO和N2的混合气体中含有的质子数为14NA,故B正确;无气体的状况,无法计算其物质的量,故C错误;浓盐酸和二氧化锰的反应随着反应的进行,浓盐酸逐渐变为稀盐酸,不能继续反应,故D错误。
12.选A 分析所给反应可知,反应中硫元素的化合价升高,氧元素的化合价降低,所以氧气是还原产物,O2F2是氧化剂,故A正确,B错误。未指明温度和压强,无法判断转移电子的物质的量,C错误。H2S是还原剂,O2F2是氧化剂,其物质的量之比为1∶4,D错误。
13.选B 由X、Y、Z和M在周期表中的位置和Y原子序数是X的2倍可知,X为氮元素,Y为硅元素,Z为硫元素,M为氯元素。Z、M简单离子的电子层结构相同,X的简单离子少一个电子层,半径依次减小,A正确;Y的最高正价为+4价,和M可形成化合物SiCl4,B错误;非金属性N>Si,则X的简单气态氢化物NH3的稳定性强于SiH4,C正确;非金属性Cl>S,Cl的最高价氧化物对应的水化物的酸性比S的强,故D正确。
14.选C 装置①中在酸性条件下,NaClO3与H2O2反应生成ClO2,H2O2被氧化生成O2;ClO2浓度过高时易发生分解引起爆炸,通入空气可以稀释二氧化氯,防止因ClO2的浓度过高而发生爆炸,同时可以起到搅拌作用,有利于反应进行;装置②作安全瓶,ClO2易溶于水,③装置可以溶解ClO2,④装置的NaOH可以吸收尾气,防止大气污染。实验中通入空气主要是稀释ClO2,防止因ClO2浓度过高时易发生分解引起爆炸,A正确;二氧化氯易溶于水,③装置可以溶解二氧化氯,利用②装置为安全瓶,可防倒吸现象的发生,B正确;装置①中发生反应的化学方程式为H2SO4+2NaClO3+H2O2===2ClO2↑+O2↑+2H2O+Na2SO4,其中NaClO3是氧化剂,H2O2是还原剂,则反应中氧化剂与还原剂的物质的量之比为2∶1,C错误;当看到装置③中导管内液面上升时,说明发生倒吸现象,应增大空气的通入速率,利用增大气体压强,将导管内液体压回到装置③中,D正确。
15.选B 菱镁矿的主要成分为MgCO3,含少量FeCO3及SiO2,加硫酸时MgCO3和FeCO3溶解得到MgSO4和FeSO4的混合溶液,过滤,滤去不溶于酸的SiO2,向滤液中加双氧水,氧化Fe2+生成Fe3+,再加氨水调pH至4,使Fe3+完全沉淀,过滤掉Fe(OH)3沉淀,将滤液(MgSO4溶液)经一系列转化得到Mg(OH)2,再灼烧得到MgO。
16.(1)③④ ②⑦⑩ ③④
(2)HCO+H+===H2O+CO2↑
HCO+OH-===CO+H2O
(3)KHSO4(熔融)===K++HSO
(4)饱和FeCl3 FeCl3+3H2OFe(OH)3(胶体)+3HCl
(5)CO2+2OH-===CO+H2O 0.5
(6)4.0 500 mL容量瓶、胶头滴管
17.解析:电解氯化钠溶液的反应方程式为2NaCl+2H2O2NaOH+H2↑+Cl2↑,X2、Y2为气体,则甲为NaOH,氢气与氯气在点燃条件下反应生成HCl,则乙为HCl,电解熔融NaCl的反应方程式为2NaCl(熔融)2Na+Cl2↑,则X2为Cl2,Y2为H2,据此分析。(1)根据分析,甲为NaOH,Y2为H2,反应④的方程式为H2+Cl22HCl,其现象为氢气在氯气中安静地燃烧,发出苍白色火焰,瓶口有白雾出现;(2)氯气与石灰乳发生氧化还原反应,根据得失电子数目守恒,有n(Cl-)=n(ClO-)+5n(ClO),根据题意:n(Cl-)=6n(ClO-),因此有n(ClO-)∶n(ClO)=1∶1;(3)空气中含有二氧化碳和水蒸气,对碳酸钠含量测定产生影响,需要排尽,因此实验前通入氮气的目的是排除装置中的空气,防止对测定结果产生影响,即操作是关闭K3,打开K1、K2;装置A中发生Na2CO3+H2SO4===Na2SO4+CO2↑+H2O,装置B为干燥装置,装置C吸收二氧化碳,C装置前后质量差为二氧化碳的质量,即二氧化碳的质量为(m2-m1)g,根据碳原子守恒,计算碳酸钠的质量分数为×100%=×100%;装置D的作用是防止空气中CO2和水蒸气进入C装置,若缺少装置D,测得二氧化碳的质量增大,即测定结果偏高。
答案:(1)NaOH H2 氢气在氯气中安静地燃烧,发出苍白色火焰,瓶口有白雾出现 (2)1∶1
(3)关闭K3,打开K1、K2 ×100% 偏高
18.解析:高硫铝土矿粉碎后通入空气、加入氧化钙焙烧,其中氧化钙和二氧化硫反应生成亚硫酸钙,和二氧化硅反应生成硅酸钙,得到产物加入氢氧化钠溶液“碱浸”,其中氧化铝溶解生成四羟基合铝酸钠溶液,经过滤得到的固体中含大量的Fe2O3,Fe2O3与FeS2混合后在隔绝空气条件下焙烧生成Fe3O4和SO2。(4)Fe2O3与FeS2混合后在隔绝空气条件下焙烧生成Fe3O4和SO2,设有x mol Fe2O3和y mol FeS2完全参加反应,根据电子得失守恒:2x×=2y×[4-(-1)]+y×,解得=16,所以“焙烧”过程理论上完全反应消耗的n(FeS2)∶n(Fe2O3)=1∶16。
答案:(1)4 11 2 8 CaSiO3
(2)Al2O3+2OH-+3H2O===2[Al(OH)4]-
(3)[Al(OH)4]-+CO2===Al(OH)3↓+HCO
(4)1∶16 (5)A
19.解析:X是原子半径最小的元素,则X是H元素;Y原子最外层电子数是核外电子层数的3倍,则Y是O元素;Z是短周期中金属性最强的元素,则Z是Na元素;W是地壳中含量最多的金属元素,则W为Al元素;由R最高正价与最低负价的代数和为4,可确定R是S元素,则Q是Cl元素。(2)Al元素位于元素周期表中第三周期第ⅢA族。(3)离子化合物Na2S的电子式为Na+[??]2-Na+。(4)H2O2中同时存在H—O和O—O,其结构式为H—O—O—H。(5)O2-、Na+、Al3+的电子层结构相同,根据“核大径小”可确定离子半径:O2->Na+>Al3+。(6)根据还原性:S2->Cl-,可证明非金属性:Cl>S,a错误;根据简单氢化物的稳定性:HCl>H2S,可证明非金属性:Cl>S,b正确;未指明是否为最高价氧化物对应的水化物,无法判断非金属性强弱,c错误。(7)Al和NaOH溶液反应生成Na[Al(OH)4]和H2,反应的化学方程式为2Al+2NaOH+6H2O===2Na[Al(OH)4]+3H2↑。
答案:(1)氧 (2)第三周期第ⅢA族
(3)Na+[??]2-Na+ (4)H—O—O—H
(5)O2->Na+>Al3+ (6)b
(7)2Al+2NaOH+6H2O===2Na[Al(OH)4]+3H2↑
(本试卷满分100分)
一、选择题:本题共15小题,每小题3分,共45分。
1.化学无处不在,下列与化学有关的说法错误的是( )
A.用漂白粉对游泳池进行杀菌消毒,利用了其强氧化性
B.氧化铁用作红色油漆,利用了其颜色为红棕色
C.SO2用作葡萄酒的添加剂,利用了其还原性和漂白性
D.用小苏打发酵面团制作馒头,利用了其碱性
2.下列反应既属于氧化还原反应,又属于离子反应的是( )
A.氢氧化钠与稀硫酸反应
B.灼热的木炭与CO2反应
C.钠与水反应
D.CO2与氢氧化钠溶液反应
3.下列各组物质的分类正确的是( )
A.碱:氨水
B.碱性氧化物:Al2O3
C.混合物:Fe(OH)3胶体
D.电解质:液氯
4.下列物质其水溶液能导电,但物质本身属于非电解质的是( )
A.HCl B.SO2
C.BaCO3 D.C2H5OH(乙醇)
5.下列离子可以在溶液中大量共存的是( )
A.Ba2+、Cl-、SO、NO
B.Fe2+、H+、CO、MnO
C.H+、Cl-、SO、NO
D.Ag+、NO、Cl-、Fe3+
6.下列离子方程式正确的是( )
A.FeCl2溶液中滴加氯水:Fe2++Cl2===Fe3++2Cl-
B.钠与水反应:Na+H2O===Na++OH-+H2↑
C.过量二氧化碳通入氢氧化钠溶液:CO2+2OH-===CO+H2O
D.硫酸铜溶液中加入氢氧化钡溶液:
Ba2++2OH-+Cu2++SO===BaSO4↓+Cu(OH)2↓
7.下列装置或操作能达到实验目的的是( )
A.甲:配制1 000 mL一定物质的量浓度的稀硫酸
B.乙:测定一定质量镁铝合金中金属铝的含量
C.丙:控制二氧化碳气体的生成与停止
D.丁:验证Cl、Br、I非金属性的强弱
8.某同学用毛笔蘸取少量30%FeCl3溶液在铜片上写上“中国”两个字,放置片刻,用少量水将铜片上的溶液冲到小烧杯中,下列说法中正确的是( )
A.烧杯中的溶液呈黄色
B.铜片无任何变化
C.铜片上有凹陷的“中国”字样
D.发生反应:Fe3++Cu===Cu2++Fe2+
9.X、Y、Z、W为原子序数依次增大的短周期主族元素。X的一种核素无中子;X与W的最外层电子数相同;Y、Z元素的单质均为空气的主要成分。下列说法错误的是( )
A.Y的简单离子半径较W的大
B.化合物W2Z与W2Z2的化学键类型完全相同
C.Z的简单气态氢化物较Y的稳定
D.Y的最高价氧化物的水化物是强酸
10.下列有关物质的应用不合理的是( )
A.铝锂合金密度小、强度高,可用于航空工业
B.将废铁屑加入FeCl2溶液中,可用于除去工业废气中的Cl2
C.盐碱地(含较多Na2CO3等)不利于作物生长,可施加熟石灰进行改良
D.氯气可用于自来水杀菌、消毒,但要控制氯气的用量,使水中余氯符合国家标准
11.设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.1.5 mol·L-1 MgCl2溶液中含有的Cl-数目为3NA
B.28 g CO和N2的混合气体中含有的质子数为14NA
C.11.2 L CO2与足量Na2O2反应转移的电子数为0.5NA
D.含2 mol HCl的浓盐酸与足量MnO2充分反应转移的电子数为NA
12.O2F2可以发生反应:H2S+4O2F2===SF6+2HF+4O2,下列说法正确的是( )
A.氧气是还原产物
B.O2F2既是氧化剂又是还原剂
C.若生成4.48 L HF,则转移0.8 mol电子
D.还原剂与氧化剂的物质的量之比为4∶1
13.四种短周期元素X、Y、Z和M在周期表中的位置如图所示,Y的原子序数是X的2倍。下列说法不正确的是( )
A.Z、M、X的简单离子半径依次减小
B.Y和M可形成化合物YM5
C.X的简单气态氢化物的稳定性强于Y的
D.M的最高价氧化物对应的水化物的酸性比Z的强
14.二氧化氯(ClO2)是一种黄绿色气体,熔点为-59.5 ℃,沸点为11.0 ℃,易溶于水且不与冷水反应,浓度过高时易发生分解引起爆炸,制备二氧化氯溶液的装置如图所示:
下列说法错误的是( )
A.实验中,通入空气的作用之一是稀释ClO2
B.装置②作安全瓶,起防止倒吸的作用
C.装置①反应中氧化剂与还原剂的物质的量之比为1∶2
D.当看到装置③中导管内液面上升时,应增大空气的通入速率
15.以菱镁矿(主要成分为MgCO3,含少量FeCO3、SiO2)为原料制备高纯氧化镁的流程如图。下列说法错误的是( )
A.MgCO3与稀硫酸反应的离子方程式为
MgCO3+2H+===Mg2++CO2↑+H2O
B.滤渣1的成分是Fe(OH)3,滤渣2的成分是SiO2
C.加入H2O2氧化时,发生反应的离子方程式为2Fe2++H2O2+2H+===2Fe3++2H2O
D.实验室灼烧时使用的主要仪器有酒精灯、三脚架、泥三角、坩埚、坩埚钳等
二、非选择题:本题共4小题,共55分。
16.(13分)现有以下物质:①NaOH溶液
②液氨 ③BaCO3固体 ④熔融KHSO4
⑤Fe(OH)3胶体 ⑥铜 ⑦CO2 ⑧稀醋酸
⑨饱和NaHCO3溶液 ⑩乙醇
请回答下列问题。
(1)物质中属于电解质的是________,非电解质的是________,强电解质的是________。(均填序号)
(2)写出⑨和KHSO4溶液反应的离子方程式:
________________________________________________________________________
________________________________________________________________________。
写出①和⑨反应的离子方程式:________________________________________________
________________________________________________________________________。
(3)写出④的电离方程式:_______________________________________________
________________________________________________________________________。
(4)⑤的实验室制备方案:向沸水中滴加几滴______溶液,加热至液体呈红褐色,停止加热;其化学方程式为____________________________________________________
________________________________________________________________________。
(5)在足量①的水溶液中通入少量⑦,发生反应的离子方程式为________________________________________________________________________
________________________________________________________________________。
现有11 g ⑦发生上述反应,需要消耗①的溶质的物质的量为____________mol。
(6)用NaOH固体配制500 mL 0.2 mol·L-1NaOH溶液,需用托盘天平称量的质量为______g,配制所用的玻璃仪器除了烧杯、玻璃棒外还有________________________________________________________________________。
17.(14分)氯化钠是一种化工原料,可以制备多种物质,如图所示,甲为一元强碱,常温下,X2、Y2为气体。
回答下列问题:
(1)甲的化学式是________;Y2的化学式是______;反应④的实验现象是________________________________________________________________________
________________________________________________________________________。
(2)X2和石灰乳的反应与温度有关,某温度下,X2与石灰乳恰好完全反应,X的产物是X-、XO-、XO,若产物中n(X-)=6n(XO-),则XO-与XO的物质的量之比为____________。
(3)工业纯碱中常含有少量NaCl,测定工业纯碱中Na2CO3含量的装置和数据如下:
质量/g
工业纯碱 a
反应前装置C m1
反应后装置C m2
反应前、后均需通入氮气,反应前通入氮气的操作是______________________;样品中Na2CO3的质量分数为____________(用含a、m1、m2的代数式表示);若缺少装置D,会使测定结果__________(填“偏高”“偏低”或“无影响”)。
18.(14分)以高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2、少量FeS2和金属硫酸盐)为原料生产氧化铝并获得Fe3O4的部分工艺流程如图:
(1)配平“焙烧”过程中发生反应的化学方程式。
FeS2+____O2____Fe2O3+____SO2。焙烧时加入的少量CaO可将SiO2转化为______________(填化学式)。
(2)“碱浸”时Al2O3发生反应的离子方程式为_____________________________
________________________________________________________________________。
(3)向“过滤”得到的滤液中通入过量CO2,反应的离子方程式为________________________________________________________________________
________________________________________________________________________。
(4)“过滤”得到的滤渣中含大量的Fe2O3,Fe2O3与FeS2混合后在隔绝空气条件下焙烧生成Fe3O4和SO2,“焙烧”过程理论上完全反应消耗的n(FeS2)∶n(Fe2O3)=________________________________________________________________________。
(5)“烧渣分离”过程中可选用的方法是_______________________________(填字母)。
A.磁选法 B.酸浸法 C.碱浸法
19.(14分)X、Y、Z、W、R、Q为原子序数依次增大的六种短周期主族元素。X是原子半径最小的元素;Y原子最外层电子数是核外电子层数的3倍;Z是短周期中金属性最强的元素;W是地壳中含量最多的金属元素;R的最高正价与最低负价代数和为4。请回答下列问题:
(1)Y的元素名称是____________。
(2)W在周期表中的位置是____________________________________________________。
(3)写出化合物Z2R的电子式:________________________________________________。
(4)写出化合物X2Y2的结构式:____________________________________________。
(5)Y、Z、W三种元素对应的简单离子半径由大到小的顺序是____________________(用元素的离子符号表示)。
(6)下列说法能证明非金属性Q强于R的是______(填字母)。
a.简单阴离子的还原性:Q>R
b.简单氢化物的稳定性:Q>R
c.氧化物对应的水化物的酸性:Q>R
(7)W的单质与Z的最高价氧化物对应的水化物反应的化学方程式是________________________________________________________________________
________________________________________________________________________。
模块质量检测(一)
1.选C SO2有还原性,抗氧化,还能杀菌,可用作葡萄酒的添加剂,不是利用漂白性,C项错误。
2.选C A项,该反应不是氧化还原反应,错误;B项,该反应不是离子反应,错误;D项,该反应不是氧化还原反应,错误。
3.选C 氨水属于碱溶液,A项错误;Al2O3为两性氧化物,B项错误;液氯是单质不是电解质,D项错误。
4.B
5.选C A.Ba2+、SO会反应生成BaSO4沉淀而不能大量共存;B.Fe2+、H+、MnO会发生氧化还原反应而不能大量共存且H+、CO会发生反应生成CO2、H2O,也不能大量共存;C.离子之间不能发生任何反应,可以大量共存;D.Ag+、Cl-会反应生成AgCl沉淀而不能大量共存。
6.选D FeCl2与Cl2反应生成氯化铁,反应的离子方程式为2Fe2++Cl2===2Fe3++2Cl-,故A错误;金属钠加入水生成氢氧化钠和氢气,反应的离子方程式为2Na+2H2O===2Na++2OH-+H2↑,故B错误;过量的二氧化碳通入氢氧化钠溶液中,离子方程式:CO2+OH-===HCO,故C错误;硫酸铜溶液与氢氧化钡溶液反应生成硫酸钡和氢氧化铜沉淀,故D正确。
7.选B 容量瓶不能用于稀释溶液,A错误;镁铝合金与稀盐酸反应生成H2,可以用排水法知道H2的体积,可以计算出一定质量镁铝合金中金属铝的含量,B正确;碳酸钠为粉末状固体且装置中的长颈漏斗不能控制气体的生成与停止,C错误;氯气可以和溴化钠反应生成溴单质,非金属性:氯大于溴;过量的氯气可以和碘化钾反应生成碘单质,则非金属性:氯大于碘,但是不能证明溴和碘的非金属性强弱,D错误。
8.选C FeCl3溶液与铜片发生反应:2FeCl3+Cu===2FeCl2+CuCl2,FeCl2溶液是浅绿色的,CuCl2是蓝色的,A项错误;FeCl3溶液与铜片发生了反应,B项错误;离子方程式中电荷不守恒,D项错误。
9.选B 由题干信息可知,X的一种核素无中子,故X为H,X与W的最外层电子数相同;Y、Z元素的单质均为空气的主要成分,故Y、Z为N、O,结合X、Y、Z、W为原子序数依次增大的短周期主族元素,可知W为Na。化合物W2Z为Na2O只含离子键,W2Z2为Na2O2含有离子键和非极性共价键,二者化学键类型不完全相同,B错误。
10.选C 加入熟石灰,生成CaCO3难溶物,造成土壤板结,C项符合题意。
11.选B 溶液的体积未知,无法计算其物质的量,故A错误;CO和N2的质子数都为14,28 g CO和N2的物质的量为1 mol,故28 g CO和N2的混合气体中含有的质子数为14NA,故B正确;无气体的状况,无法计算其物质的量,故C错误;浓盐酸和二氧化锰的反应随着反应的进行,浓盐酸逐渐变为稀盐酸,不能继续反应,故D错误。
12.选A 分析所给反应可知,反应中硫元素的化合价升高,氧元素的化合价降低,所以氧气是还原产物,O2F2是氧化剂,故A正确,B错误。未指明温度和压强,无法判断转移电子的物质的量,C错误。H2S是还原剂,O2F2是氧化剂,其物质的量之比为1∶4,D错误。
13.选B 由X、Y、Z和M在周期表中的位置和Y原子序数是X的2倍可知,X为氮元素,Y为硅元素,Z为硫元素,M为氯元素。Z、M简单离子的电子层结构相同,X的简单离子少一个电子层,半径依次减小,A正确;Y的最高正价为+4价,和M可形成化合物SiCl4,B错误;非金属性N>Si,则X的简单气态氢化物NH3的稳定性强于SiH4,C正确;非金属性Cl>S,Cl的最高价氧化物对应的水化物的酸性比S的强,故D正确。
14.选C 装置①中在酸性条件下,NaClO3与H2O2反应生成ClO2,H2O2被氧化生成O2;ClO2浓度过高时易发生分解引起爆炸,通入空气可以稀释二氧化氯,防止因ClO2的浓度过高而发生爆炸,同时可以起到搅拌作用,有利于反应进行;装置②作安全瓶,ClO2易溶于水,③装置可以溶解ClO2,④装置的NaOH可以吸收尾气,防止大气污染。实验中通入空气主要是稀释ClO2,防止因ClO2浓度过高时易发生分解引起爆炸,A正确;二氧化氯易溶于水,③装置可以溶解二氧化氯,利用②装置为安全瓶,可防倒吸现象的发生,B正确;装置①中发生反应的化学方程式为H2SO4+2NaClO3+H2O2===2ClO2↑+O2↑+2H2O+Na2SO4,其中NaClO3是氧化剂,H2O2是还原剂,则反应中氧化剂与还原剂的物质的量之比为2∶1,C错误;当看到装置③中导管内液面上升时,说明发生倒吸现象,应增大空气的通入速率,利用增大气体压强,将导管内液体压回到装置③中,D正确。
15.选B 菱镁矿的主要成分为MgCO3,含少量FeCO3及SiO2,加硫酸时MgCO3和FeCO3溶解得到MgSO4和FeSO4的混合溶液,过滤,滤去不溶于酸的SiO2,向滤液中加双氧水,氧化Fe2+生成Fe3+,再加氨水调pH至4,使Fe3+完全沉淀,过滤掉Fe(OH)3沉淀,将滤液(MgSO4溶液)经一系列转化得到Mg(OH)2,再灼烧得到MgO。
16.(1)③④ ②⑦⑩ ③④
(2)HCO+H+===H2O+CO2↑
HCO+OH-===CO+H2O
(3)KHSO4(熔融)===K++HSO
(4)饱和FeCl3 FeCl3+3H2OFe(OH)3(胶体)+3HCl
(5)CO2+2OH-===CO+H2O 0.5
(6)4.0 500 mL容量瓶、胶头滴管
17.解析:电解氯化钠溶液的反应方程式为2NaCl+2H2O2NaOH+H2↑+Cl2↑,X2、Y2为气体,则甲为NaOH,氢气与氯气在点燃条件下反应生成HCl,则乙为HCl,电解熔融NaCl的反应方程式为2NaCl(熔融)2Na+Cl2↑,则X2为Cl2,Y2为H2,据此分析。(1)根据分析,甲为NaOH,Y2为H2,反应④的方程式为H2+Cl22HCl,其现象为氢气在氯气中安静地燃烧,发出苍白色火焰,瓶口有白雾出现;(2)氯气与石灰乳发生氧化还原反应,根据得失电子数目守恒,有n(Cl-)=n(ClO-)+5n(ClO),根据题意:n(Cl-)=6n(ClO-),因此有n(ClO-)∶n(ClO)=1∶1;(3)空气中含有二氧化碳和水蒸气,对碳酸钠含量测定产生影响,需要排尽,因此实验前通入氮气的目的是排除装置中的空气,防止对测定结果产生影响,即操作是关闭K3,打开K1、K2;装置A中发生Na2CO3+H2SO4===Na2SO4+CO2↑+H2O,装置B为干燥装置,装置C吸收二氧化碳,C装置前后质量差为二氧化碳的质量,即二氧化碳的质量为(m2-m1)g,根据碳原子守恒,计算碳酸钠的质量分数为×100%=×100%;装置D的作用是防止空气中CO2和水蒸气进入C装置,若缺少装置D,测得二氧化碳的质量增大,即测定结果偏高。
答案:(1)NaOH H2 氢气在氯气中安静地燃烧,发出苍白色火焰,瓶口有白雾出现 (2)1∶1
(3)关闭K3,打开K1、K2 ×100% 偏高
18.解析:高硫铝土矿粉碎后通入空气、加入氧化钙焙烧,其中氧化钙和二氧化硫反应生成亚硫酸钙,和二氧化硅反应生成硅酸钙,得到产物加入氢氧化钠溶液“碱浸”,其中氧化铝溶解生成四羟基合铝酸钠溶液,经过滤得到的固体中含大量的Fe2O3,Fe2O3与FeS2混合后在隔绝空气条件下焙烧生成Fe3O4和SO2。(4)Fe2O3与FeS2混合后在隔绝空气条件下焙烧生成Fe3O4和SO2,设有x mol Fe2O3和y mol FeS2完全参加反应,根据电子得失守恒:2x×=2y×[4-(-1)]+y×,解得=16,所以“焙烧”过程理论上完全反应消耗的n(FeS2)∶n(Fe2O3)=1∶16。
答案:(1)4 11 2 8 CaSiO3
(2)Al2O3+2OH-+3H2O===2[Al(OH)4]-
(3)[Al(OH)4]-+CO2===Al(OH)3↓+HCO
(4)1∶16 (5)A
19.解析:X是原子半径最小的元素,则X是H元素;Y原子最外层电子数是核外电子层数的3倍,则Y是O元素;Z是短周期中金属性最强的元素,则Z是Na元素;W是地壳中含量最多的金属元素,则W为Al元素;由R最高正价与最低负价的代数和为4,可确定R是S元素,则Q是Cl元素。(2)Al元素位于元素周期表中第三周期第ⅢA族。(3)离子化合物Na2S的电子式为Na+[??]2-Na+。(4)H2O2中同时存在H—O和O—O,其结构式为H—O—O—H。(5)O2-、Na+、Al3+的电子层结构相同,根据“核大径小”可确定离子半径:O2->Na+>Al3+。(6)根据还原性:S2->Cl-,可证明非金属性:Cl>S,a错误;根据简单氢化物的稳定性:HCl>H2S,可证明非金属性:Cl>S,b正确;未指明是否为最高价氧化物对应的水化物,无法判断非金属性强弱,c错误。(7)Al和NaOH溶液反应生成Na[Al(OH)4]和H2,反应的化学方程式为2Al+2NaOH+6H2O===2Na[Al(OH)4]+3H2↑。
答案:(1)氧 (2)第三周期第ⅢA族
(3)Na+[??]2-Na+ (4)H—O—O—H
(5)O2->Na+>Al3+ (6)b
(7)2Al+2NaOH+6H2O===2Na[Al(OH)4]+3H2↑
