模块质量检测(二)(含解析)高中化学人教版(2019)必修 第一册
文档属性
| 名称 | 模块质量检测(二)(含解析)高中化学人教版(2019)必修 第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 258.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-13 10:20:20 | ||
图片预览




文档简介
模块质量检测(二)
(本试卷满分100分)
一、选择题:本题共15小题,每小题3分,共45分。
1.下列说法正确的是( )
A.中科院天津化学研究所在世界上首次利用人工方法将CO2合成淀粉,可以实现利用空气“生产粮食”
B.以煤为原料的火力发电厂发生的化学反应不包含还原反应
C.天然气不充分燃烧的产物都是酸性氧化物
D.推进煤炭消费替代和转型升级,大力发展新能源不是实现碳达峰的途径之一
2.“天问一号”着陆火星,“嫦娥五号”采回月壤。腾飞中国离不开化学,长征系列运载火箭使用的燃料有液氢和煤油等化学品。下列有关说法正确的是( )
A.石油产品煤油是可再生能源
B.煤油属于纯净物
C.火星陨石中的20Ne质量数为20
D.月壤中的3He与地球上的3H互为同位素
3.下列化学用语表示正确的是( )
A.HClO的电子式:?
B.硫的原子结构示意图:
C.H2O2的电子式:
D.NH3的结构式:
4.下列物质中既含有共价键又含有离子键的是( )
A.NaCl B.CaCl2
C.Na2O D.Na2O2
5.设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.用1 mol FeCl3制备Fe(OH)3胶体,所得胶粒的数目为NA
B.1 mol·L-1 MgCl2中所含Cl-数为2NA
C.32 g O2和O3混合物中,含有的氧原子数目一定为2NA
D.标准状况下,22.4 L H2O含有的分子数为NA
6.下列实验现象与氧化还原反应无关的是( )
A.新切开钠的光亮表面很快变暗
B.将一块绿豆大的钠放入水中,钠块在水面四处游动
C.向包有Na2O2粉末的棉花上滴几滴水,棉花立刻燃烧
D.将Na2CO3固体投入滴有酚酞的水溶液中,溶液变红
7.除去下列各组物质中的杂质(括号内为杂质),采用的方法不正确的是( )
A.FeCl3溶液(FeCl2):通入适量Cl2
B.Al(Fe):加入足量的NaOH溶液,过滤
C.CO气体(CO2):通过NaOH溶液洗气后干燥
D.Cl2气体(HCl):通过饱和NaCl溶液洗气后干燥
8.某同学探究金属Na与CO2的反应,实验如下:
实验Ⅰ 实验Ⅱ
操作 将点燃的金属钠伸到盛有CO2的集气瓶中 将实验Ⅰ的集气瓶用水冲洗,过滤。取黑色滤渣灼烧;取滤液分别滴加酚酞和氯化钡溶液
现象 ①火焰呈黄色 ②底部有黑色固体,瓶壁上附有白色固体 ①黑色滤渣可燃 ②滤液能使酚酞溶液变红,滴加氯化钡溶液有白色沉淀生成
下列说法不正确的是( )
A.生成的黑色固体中含有C
B.白色固体是Na2O
C.实验说明CO2具有氧化性
D.金属Na着火不能用二氧化碳灭火器灭火
9.X、Y两种短周期元素可形成化合物X2Y3,X3+比Y2-少一个电子层,且X3+具有与Ne相同的核外电子层结构。下列说法正确的是( )
A.X2Y3是Al2O3
B.X是第二周期第ⅢA族的元素
C.Y是第二周期第ⅣA族的元素
D.Y2-与Y的核外电子层数相等
10.KIO3常用作食盐中的补碘剂,可用“氯酸钾氧化法”制备,该方法的第一步反应为6I2+11KClO3+3H2O6KH(IO3)2+5KCl+3Cl2↑。下列说法错误的是( )
A.产生22.4 L(标准状况)Cl2时,反应中转移10 mol e-
B.反应中氧化剂和还原剂的物质的量之比为11∶6
C.可用石灰乳吸收反应产生的Cl2制备漂白粉
D.可用酸化的淀粉碘化钾溶液检验食盐中IO的存在
11.根据下列实验内容得出的结论正确的是( )
选项 实验内容 结论
A 用洁净的玻璃棒蘸取待测液在酒精灯外焰上灼烧,火焰呈黄色 原溶液中一定存在Na+
B 向某溶液中滴入适量稀硝酸,然后滴入AgNO3溶液,生成白色沉淀 原溶液中一定存在Cl-
C 向某溶液中加入盐酸,产生无色无味气体,该气体能使澄清石灰水变浑浊 原溶液中一定存在CO
D 向某溶液中滴加少量氯水,再滴加几滴KSCN溶液,溶液变红色 原溶液中一定存在Fe2+
12.下列实验操作、现象及结论正确的是( )
选项 实验 操作、现象及结论
A 鉴别NaHCO3与Na2CO3 取少许两种物质,加入几滴水,插入温度计,温度升高的是Na2CO3
B 探究Na2O2与水反应 将2 mL水滴入盛有1 g过氧化钠试管中,立即把带火星的木条伸入试管,木条复燃,证明有氢气产生
C 检验Fe3+中是否含Fe2+ 向溶液中加入KSCN溶液,变红则含Fe2+
D 检验溶液中是否含SO 向某溶液中加入盐酸酸化的BaCl2溶液,有白色沉淀生成,说明含有SO
13.X、Y、Z、P、Q为五种短周期元素,其原子半径和最外层电子数之间的关系如下图所示。下列说法正确的是( )
A.Q的氧化物一定含有离子键和共价键
B.最高价含氧酸的酸性:ZC.P的最低价氢化物常温常压下为液体
D.Y形成的化合物种类最多
14.实验室用MnO2和浓盐酸反应生成Cl2后,按照净化、收集、性质检验及尾气处理的顺序进行实验。下列装置(“→”表示气流方向)不能达到实验目的的是( )
15.下列离子方程式正确的是( )
A.Cl2通入冷的NaOH溶液:Cl2+2OH-===Cl-+ClO-+H2O
B.用醋酸和淀粉 KI溶液检验加碘盐中的IO:IO+5I-+6H+===3I2+3H2O
C.FeSO4溶液中加入H2O2产生沉淀:2Fe2++H2O2+4H2O===Fe(OH)3↓+4H+
D.NaHCO3溶液与少量的Ba(OH)2溶液混合:HCO+Ba2++OH-===BaCO3↓+H2O
二、非选择题:本题共4小题,共55分。
16.(13分)根据如图短周期主族元素的原子序数和化合价的关系推断元素种类,回答下列问题:
(1)写出元素③在周期表中的位置_____________________________________
________________________________________________________________________。
(2)元素⑤⑥的最高价氧化物对应的水化物中,碱性较强的是______________(填化学式)。
(3)⑥⑦⑧三种元素原子半径最大的是______________。
(4)元素⑥和⑧的最高价氧化物对应的水化物反应的离子方程式为________________________________________________________________________
________________________________________________________________________。
(5)元素⑦⑧形成的简单氢化物中,稳定性较强的是__________,原因是________________________________________________________________________
________________________________________________________________________。
(6)写出由①④元素组成的含有极性键和非极性键的一种常见化合物的结构式:________________________________________________________________________。
(7)用电子式表示⑤和⑦按2∶1的原子个数比形成化合物的过程:________________________________________________________________________
________________________________________________________________________。
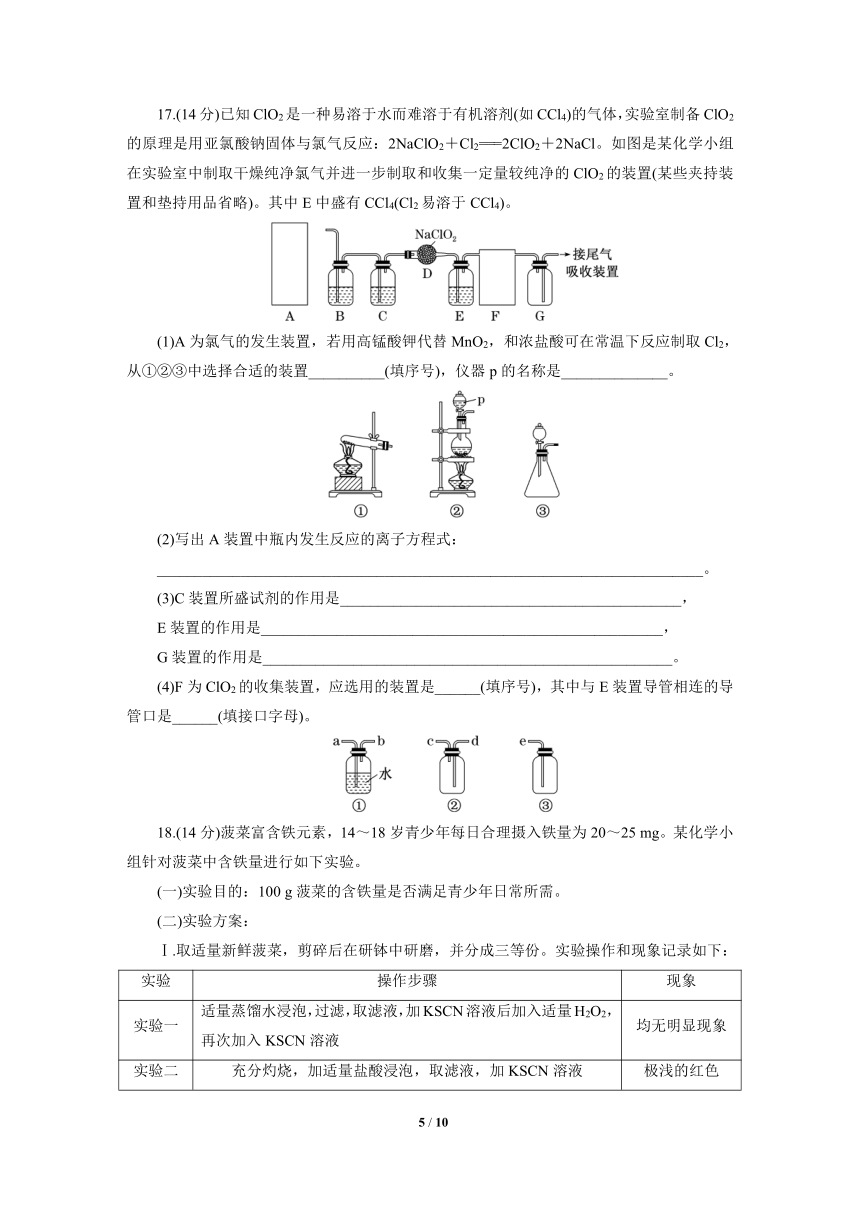
17.(14分)已知ClO2是一种易溶于水而难溶于有机溶剂(如CCl4)的气体,实验室制备ClO2的原理是用亚氯酸钠固体与氯气反应:2NaClO2+Cl2===2ClO2+2NaCl。如图是某化学小组在实验室中制取干燥纯净氯气并进一步制取和收集一定量较纯净的ClO2的装置(某些夹持装置和垫持用品省略)。其中E中盛有CCl4(Cl2易溶于CCl4)。
(1)A为氯气的发生装置,若用高锰酸钾代替MnO2,和浓盐酸可在常温下反应制取Cl2,从①②③中选择合适的装置__________(填序号),仪器p的名称是______________。
(2)写出A装置中瓶内发生反应的离子方程式:
________________________________________________________________________。
(3)C装置所盛试剂的作用是_____________________________________________,
E装置的作用是_____________________________________________________,
G装置的作用是______________________________________________________。
(4)F为ClO2的收集装置,应选用的装置是______(填序号),其中与E装置导管相连的导管口是______(填接口字母)。
18.(14分)菠菜富含铁元素,14~18岁青少年每日合理摄入铁量为20~25 mg。某化学小组针对菠菜中含铁量进行如下实验。
(一)实验目的:100 g菠菜的含铁量是否满足青少年日常所需。
(二)实验方案:
Ⅰ.取适量新鲜菠菜,剪碎后在研钵中研磨,并分成三等份。实验操作和现象记录如下:
实验 操作步骤 现象
实验一 适量蒸馏水浸泡,过滤,取滤液,加KSCN溶液后加入适量H2O2,再次加入KSCN溶液 均无明显现象
实验二 充分灼烧,加适量盐酸浸泡,取滤液,加KSCN溶液 极浅的红色
实验三 充分灼烧,加适量盐酸、H2O2浸泡,取滤液,加KSCN溶液 较深的红色
(1)灼烧菠菜时,不需要用到下列仪器中的________(填字母)。
A.蒸发皿 B.坩埚
C.酒精灯 D.坩埚钳
(2)H2O2的电子式为________________;实验三中H2O2参与的最主要反应的离子方程式为________________________________;可选用__________替换实验三中的H2O2和盐酸。
(3)实验中,KSCN溶液用来检测____________离子。
Ⅱ.菠菜中含铁量的测定,实验步骤如下:
①取10.0 g新鲜菠菜,充分灼烧,将灰分转移至干燥器中冷却。
②向灰分中加入10 mL 盐酸和H2O2,浸泡10 min,过滤并用少量盐酸洗涤烧杯和沉淀,滤液和洗涤液合并。
③将合并液定容成100 mL待测液,测得铁离子的浓度为5×10-5 mol·L-1。
(4)根据实验数据计算菠菜含铁量为__________ mg/100 g。100 g菠菜含铁量________(填“能”或“不能”)满足14~18岁青少年日常所需。
19.(14分)我国某现代化铜冶炼厂排放的废水中含有较多的Fe2+、Fe3+、Cu2+、SO和少量的Na+,为了减少污染并变废为宝,该铜冶炼厂以该废水为原料制备硫酸钠、硫酸亚铁晶体(FeSO4·7H2O)并回收金属铜,设计了如下流程(流程中加入的试剂均过量)。
已知:加入的试剂①为NaOH溶液。回答下列问题:
(1)操作a的名称为________________________,在实验室进行该操作时需要用到的玻璃仪器有______________________;溶液A中所含的溶质为_____________________________________________________________(填化学式)。
(2)加入的试剂③为______________________________________________(填试剂名称)。
(3)检验溶液D中的金属阳离子的具体操作及现象为________________________________________________________________________
________________________________________________________________________,
写出检验过程中属于氧化还原反应的离子方程式并用双线桥法标出电子转移的数目和方向:________________________________________________________________________
________________________________________________________________________。
(4)若取2 mL溶液D于试管中,然后滴加氢氧化钠溶液,可观察到的现象为________________________________________________________________________
________________________________________________________________________,
此现象中涉及的氧化还原反应的化学方程式为____________________________
________________________________________________________________________。
模块质量检测(二)
1.A
2.选C 煤油来源于石油的分馏,属于化石燃料,是不可再生能源,A错误;煤油属于混合物,B错误;20Ne的质量数为20,C正确;质子数相同、中子数不同的同一元素的不同核素互为同位素,3He、3H的质子数分别为2、1,二者质子数不同,不属于同种元素,不互为同位素,D错误。
3.选D HClO的电子式为H???,故A错误;硫的原子序数为16,最外层电子数为6,硫的原子结构示意图为,故B错误;H2O2为共价化合物,故C错误。
4.D
5.选C Fe(OH)3胶粒是多个分子集合体,用1 mol FeCl3制备Fe(OH)3胶体,所得胶粒的数目小于NA,A错误;n=cV,没有溶液体积,无法计算1 mol·L-1MgCl2中所含Cl-数,B错误;32 g O2和O3混合物中,含有的氧原子为=2 mol,氧原子个数为2NA,C正确;标准状况下,H2O是液态,22.4 L H2O不是1 mol,分子数不是NA,D错误。
6.选D 新切开钠的光亮表面很快变暗,钠与氧气反应生成氧化钠,属于氧化还原反应,A不符合题意;钠放入水中,与水反应生成氢气和氢氧化钠,属于氧化还原反应,B不符合题意;过氧化钠与水反应生成氢氧化钠和氧气,属于氧化还原反应,反应放热,棉花立刻燃烧,C不符合题意;碳酸钠溶液显碱性,能使酚酞溶液变红,不涉及氧化还原反应,D符合题意。
7.选B Fe与NaOH溶液不反应,Al能与NaOH溶液反应,加入足量的NaOH溶液,Al被溶解,主要物质被除去,故B错误。
8.选B 由实验Ⅰ可知钠能够在二氧化碳中燃烧,根据质量守恒定律,反应物中含有钠元素、氧元素、碳元素;由实验Ⅱ中黑色滤渣可燃可知,集气瓶底部的黑色固体为碳,由滤液能使酚酞溶液变红,滴加氯化钡溶液有白色沉淀生成可知,瓶壁上附有的白色固体为碳酸钠,则钠在二氧化碳气体中燃烧生成碳酸钠和碳单质,反应的化学方程式为4Na+3CO22Na2CO3+C。
9.选D 根据X3+与Ne的核外电子层结构相同,可知X应为13号元素Al,即X3+为Al3+,再结合X3+比Y2-少一个电子层,可知Y2-核外有3个电子层,则Y为S元素。
10.选A 根据题干中的化学方程式可知,I元素的化合价由0价升高到+5价,转移电子数为6×5×2=60,所以产生标准状况下22.4 L即1 mol氯气需消耗2 mol碘单质,转移20 mol e-,A说法错误;该反应中I2为还原剂,KClO3为氧化剂,故氧化剂和还原剂的物质的量之比为11∶6,B说法正确;工业上常用氯气和石灰乳反应制备漂白粉,C说法正确;酸性条件下,I-与IO反应生成I2,淀粉遇I2变蓝色,故可用酸化的淀粉碘化钾溶液检验IO的存在,D说法正确。
11.选B 焰色试验:用铂丝蘸取待测液并在酒精灯火焰上灼烧,火焰呈黄色,可以确认待测液中含有钠离子,玻璃中含有钠元素,不能用玻璃棒代替铂丝作焰色试验,选项A错误;向溶液中先滴加稀硝酸,然后滴入AgNO3溶液,生成白色沉淀为不溶于酸的氯化银,则原溶液中一定存在Cl-,选项B正确;向某溶液中加入盐酸,产生无色无味气体,该气体能使澄清石灰水变浑浊,则无色无味气体为二氧化碳,则原溶液中不一定存在CO,也可能含有HCO,选项C错误;向待测液中先加入氯水,再滴入KSCN溶液,溶液变红,可以确认此时溶液中含有Fe3+,但是不能确定是原来就存在的铁离子还是亚铁离子被氧化来的,无法判断亚铁离子是否存在,应先向某溶液中滴加几滴KSCN溶液,若溶液不变色,再滴加少量氯水,溶液变红色,才能确定原溶液含有亚铁离子,选项D错误。
12.选A A项,Na2CO3溶于水放热,温度升高,对;C项,加KSCN溶液变红,说明含Fe3+,错;D项,Ag+干扰,错。
13.选D X、Y、Z、P、Q为五种短周期元素,X、Q最外层只有一个电子,位于第ⅠA族;Y最外层有4个电子,位于第ⅣA族,Z原子最外层有5个电子,位于第ⅤA族,P最外层有6个电子,位于第ⅥA族;Q原子半径最大,为Na元素,X原子半径最小,为H元素;Y原子和Z原子半径接近、P原子半径大于Y而最外层电子数大于Y,所以Y是C、Z是N、P为S元素。Na的氧化物有氧化钠和过氧化钠两种,但不论是氧化钠还是过氧化钠,结构中均含离子键,但氧化钠中没有共价键,故A错误;元素的非金属性越强,其最高价含氧酸的酸性越强,非金属性Z>Y,所以其最高价含氧酸的酸性Z>Y,故B错误;P的氢化物为硫化氢,常温下为气体,故C错误;Y为碳元素,而C元素形成的有机物种类繁多,远多于无机物的种类,故D正确。
14.选D 浓盐酸易挥发,制备的氯气中含有HCl,可用饱和食盐水除去HCl,Cl2可用浓硫酸干燥,故A正确;氯气的密度大于空气,用向上排空气法收集,该装置能收集氯气,故B正确;湿润的红布条褪色,干燥的红布条不褪色,可验证干燥的氯气不具有漂白性,故C正确;氯气在水中的溶解度较小,应用NaOH溶液吸收尾气,故D错误。
15.选A 醋酸是弱酸,在离子方程式中不能拆开,B不正确;应按少量的Ba(OH)2的电离比例书写离子方程式:2HCO+Ba2++2OH-===BaCO3↓+CO+2H2O,D不正确。
16.解析:根据原子序数和化合价的关系图可判断①~⑧分别是H、C、N、O、Na、Al、S、Cl。(1)元素③是N,在周期表中的位置为第二周期第ⅤA族;(2)金属性Na>Al,则元素⑤⑥的最高价氧化物对应的水化物中,碱性较强的是NaOH;(3)同周期元素的原子半径从左至右逐渐减小,则⑥⑦⑧三种元素原子半径最大的是Al;(4)元素⑥和⑧的最高价氧化物对应的水化物分别是氢氧化铝和高氯酸,二者反应的离子方程式为Al(OH)3+3H+===Al3++3H2O;(5)由于非金属性越强,简单氢化物越稳定,非金属性Cl>S,则元素⑦⑧形成的简单氢化物中,稳定性较强的是HCl;(6)由①④元素组成的含有极性键和非极性键的一种常见化合物是双氧水,结构式为H—O—O—H;(7)⑤和⑦按2∶1的原子个数比形成的化合物是离子化合物硫化钠,用电子式表示其形成过程为。
答案:(1)第二周期第ⅤA族 (2)NaOH
(3)Al (4)Al(OH)3+3H+===Al3++3H2O
(5)HCl Cl的非金属性更强 (6)H—O—O—H
(7)
17.解析:(1)A为氯气的发生装置,若用高锰酸钾代替MnO2,和浓盐酸可在常温下反应制取Cl2,合适的装置为③,仪器p的名称是分液漏斗。(2)A装置中瓶内发生反应的离子方程式为2MnO+16H++10Cl-===2Mn2++5Cl2↑+8H2O。(3)由信息可知,ClO2易溶于水,则C装置所盛试剂为浓硫酸,浓硫酸具有吸水性,作用是干燥Cl2;由信息可知,ClO2难溶于CCl4,Cl2易溶于CCl4,则CCl4的作用是除去ClO2中的Cl2;G是安全瓶,作用是防倒吸。(4)F为ClO2的收集装置,从ClO2是一种易溶于水而难溶于有机溶剂的气体可知,不能用排水法收集,应选用的装置是②,ClO2的密度比空气的密度大,其中与E装置导管相连的导管口是d。
答案:(1)③ 分液漏斗 (2)2MnO+16H++10Cl-===2Mn2++5Cl2↑+8H2O
(3)干燥Cl2 除去ClO2中的Cl2 防倒吸 (4)② d
18.解析:本题为实验题,实验一中未在浸泡液中检测出亚铁离子、铁离子;实验二中菠菜用坩埚灼烧为灰烬,加入蒸馏水中充分溶解后过滤,检验滤液中铁离子含量很低,实验三中,灰分含二价铁,用氧化剂将二价铁氧化为三价铁,用硫氰化钾检验三价铁,现象明显,以此解题。(1)灼烧固体需要使用的仪器有酒精灯、三脚架和泥三角、坩埚,则灼烧菠菜时不需要用到蒸发皿。(2)H2O2为共价化合物,电子式为H???H;实验三中二价铁可以被过氧化氢氧化为三价铁,则H2O2参与的最主要反应的离子方程式为2Fe2++H2O2+2H+===2Fe3++2H2O。氯水也能把亚铁离子氧化为铁离子,故可选用氯水替换实验三中的H2O2和盐酸。(3)铁离子可以和KSCN反应生成红色溶液,则实验中,KSCN溶液用来检测Fe3+(或铁)离子。(4)根据实验数据:10.0 g新鲜菠菜中含铁量5×10-5 mol·L-1×0.100 L×56 g·mol-1=2.8×10-4 g,则新鲜菠菜中含铁量为2.8 mg/100 g。已知14~18岁青少年每日合理摄入铁量为20~25 mg,则100 g菠菜含铁量不能满足14~18岁青少年日常所需。
答案:(1)A (2) 2Fe2++H2O2+2H+===2Fe3++2H2O 氯水
(3)Fe3+(或铁) (4)2.8 不能
19.解析:结合图示可知废水中加入NaOH溶液,得到Fe(OH)2、Fe(OH)3和Cu(OH)2沉淀,经过滤得到的溶液A中所含溶质为Na2SO4、NaOH;向固体B中加入稀硫酸得到溶液C,向溶液C中加入②经过滤得到溶液D和固体E,结合实验目的可知②应为Fe粉,得到的固体E为Cu、Fe的混合物,溶液D为FeSO4溶液;向固体E中加入③经过滤得到溶液G和固体F,结合实验目的可知③应为稀硫酸,能将Fe溶解,得到的固体F为Cu,溶液G中含FeSO4,FeSO4溶液经蒸发浓缩、冷却结晶、过滤等可得到FeSO4·7H2O晶体。
答案:(1)过滤 烧杯、漏斗、玻璃棒 Na2SO4、NaOH (2)稀硫酸
(3)取少量溶液D于试管中,加入两滴KSCN溶液,无明显现象,再滴加少量新制氯水,溶液变红,证明有Fe2+
(4)先产生白色沉淀,后迅速变成灰绿色,最终变成红褐色
4Fe(OH)2+O2+2H2O===4Fe(OH)3
5 / 7
(本试卷满分100分)
一、选择题:本题共15小题,每小题3分,共45分。
1.下列说法正确的是( )
A.中科院天津化学研究所在世界上首次利用人工方法将CO2合成淀粉,可以实现利用空气“生产粮食”
B.以煤为原料的火力发电厂发生的化学反应不包含还原反应
C.天然气不充分燃烧的产物都是酸性氧化物
D.推进煤炭消费替代和转型升级,大力发展新能源不是实现碳达峰的途径之一
2.“天问一号”着陆火星,“嫦娥五号”采回月壤。腾飞中国离不开化学,长征系列运载火箭使用的燃料有液氢和煤油等化学品。下列有关说法正确的是( )
A.石油产品煤油是可再生能源
B.煤油属于纯净物
C.火星陨石中的20Ne质量数为20
D.月壤中的3He与地球上的3H互为同位素
3.下列化学用语表示正确的是( )
A.HClO的电子式:?
B.硫的原子结构示意图:
C.H2O2的电子式:
D.NH3的结构式:
4.下列物质中既含有共价键又含有离子键的是( )
A.NaCl B.CaCl2
C.Na2O D.Na2O2
5.设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.用1 mol FeCl3制备Fe(OH)3胶体,所得胶粒的数目为NA
B.1 mol·L-1 MgCl2中所含Cl-数为2NA
C.32 g O2和O3混合物中,含有的氧原子数目一定为2NA
D.标准状况下,22.4 L H2O含有的分子数为NA
6.下列实验现象与氧化还原反应无关的是( )
A.新切开钠的光亮表面很快变暗
B.将一块绿豆大的钠放入水中,钠块在水面四处游动
C.向包有Na2O2粉末的棉花上滴几滴水,棉花立刻燃烧
D.将Na2CO3固体投入滴有酚酞的水溶液中,溶液变红
7.除去下列各组物质中的杂质(括号内为杂质),采用的方法不正确的是( )
A.FeCl3溶液(FeCl2):通入适量Cl2
B.Al(Fe):加入足量的NaOH溶液,过滤
C.CO气体(CO2):通过NaOH溶液洗气后干燥
D.Cl2气体(HCl):通过饱和NaCl溶液洗气后干燥
8.某同学探究金属Na与CO2的反应,实验如下:
实验Ⅰ 实验Ⅱ
操作 将点燃的金属钠伸到盛有CO2的集气瓶中 将实验Ⅰ的集气瓶用水冲洗,过滤。取黑色滤渣灼烧;取滤液分别滴加酚酞和氯化钡溶液
现象 ①火焰呈黄色 ②底部有黑色固体,瓶壁上附有白色固体 ①黑色滤渣可燃 ②滤液能使酚酞溶液变红,滴加氯化钡溶液有白色沉淀生成
下列说法不正确的是( )
A.生成的黑色固体中含有C
B.白色固体是Na2O
C.实验说明CO2具有氧化性
D.金属Na着火不能用二氧化碳灭火器灭火
9.X、Y两种短周期元素可形成化合物X2Y3,X3+比Y2-少一个电子层,且X3+具有与Ne相同的核外电子层结构。下列说法正确的是( )
A.X2Y3是Al2O3
B.X是第二周期第ⅢA族的元素
C.Y是第二周期第ⅣA族的元素
D.Y2-与Y的核外电子层数相等
10.KIO3常用作食盐中的补碘剂,可用“氯酸钾氧化法”制备,该方法的第一步反应为6I2+11KClO3+3H2O6KH(IO3)2+5KCl+3Cl2↑。下列说法错误的是( )
A.产生22.4 L(标准状况)Cl2时,反应中转移10 mol e-
B.反应中氧化剂和还原剂的物质的量之比为11∶6
C.可用石灰乳吸收反应产生的Cl2制备漂白粉
D.可用酸化的淀粉碘化钾溶液检验食盐中IO的存在
11.根据下列实验内容得出的结论正确的是( )
选项 实验内容 结论
A 用洁净的玻璃棒蘸取待测液在酒精灯外焰上灼烧,火焰呈黄色 原溶液中一定存在Na+
B 向某溶液中滴入适量稀硝酸,然后滴入AgNO3溶液,生成白色沉淀 原溶液中一定存在Cl-
C 向某溶液中加入盐酸,产生无色无味气体,该气体能使澄清石灰水变浑浊 原溶液中一定存在CO
D 向某溶液中滴加少量氯水,再滴加几滴KSCN溶液,溶液变红色 原溶液中一定存在Fe2+
12.下列实验操作、现象及结论正确的是( )
选项 实验 操作、现象及结论
A 鉴别NaHCO3与Na2CO3 取少许两种物质,加入几滴水,插入温度计,温度升高的是Na2CO3
B 探究Na2O2与水反应 将2 mL水滴入盛有1 g过氧化钠试管中,立即把带火星的木条伸入试管,木条复燃,证明有氢气产生
C 检验Fe3+中是否含Fe2+ 向溶液中加入KSCN溶液,变红则含Fe2+
D 检验溶液中是否含SO 向某溶液中加入盐酸酸化的BaCl2溶液,有白色沉淀生成,说明含有SO
13.X、Y、Z、P、Q为五种短周期元素,其原子半径和最外层电子数之间的关系如下图所示。下列说法正确的是( )
A.Q的氧化物一定含有离子键和共价键
B.最高价含氧酸的酸性:Z
D.Y形成的化合物种类最多
14.实验室用MnO2和浓盐酸反应生成Cl2后,按照净化、收集、性质检验及尾气处理的顺序进行实验。下列装置(“→”表示气流方向)不能达到实验目的的是( )
15.下列离子方程式正确的是( )
A.Cl2通入冷的NaOH溶液:Cl2+2OH-===Cl-+ClO-+H2O
B.用醋酸和淀粉 KI溶液检验加碘盐中的IO:IO+5I-+6H+===3I2+3H2O
C.FeSO4溶液中加入H2O2产生沉淀:2Fe2++H2O2+4H2O===Fe(OH)3↓+4H+
D.NaHCO3溶液与少量的Ba(OH)2溶液混合:HCO+Ba2++OH-===BaCO3↓+H2O
二、非选择题:本题共4小题,共55分。
16.(13分)根据如图短周期主族元素的原子序数和化合价的关系推断元素种类,回答下列问题:
(1)写出元素③在周期表中的位置_____________________________________
________________________________________________________________________。
(2)元素⑤⑥的最高价氧化物对应的水化物中,碱性较强的是______________(填化学式)。
(3)⑥⑦⑧三种元素原子半径最大的是______________。
(4)元素⑥和⑧的最高价氧化物对应的水化物反应的离子方程式为________________________________________________________________________
________________________________________________________________________。
(5)元素⑦⑧形成的简单氢化物中,稳定性较强的是__________,原因是________________________________________________________________________
________________________________________________________________________。
(6)写出由①④元素组成的含有极性键和非极性键的一种常见化合物的结构式:________________________________________________________________________。
(7)用电子式表示⑤和⑦按2∶1的原子个数比形成化合物的过程:________________________________________________________________________
________________________________________________________________________。
17.(14分)已知ClO2是一种易溶于水而难溶于有机溶剂(如CCl4)的气体,实验室制备ClO2的原理是用亚氯酸钠固体与氯气反应:2NaClO2+Cl2===2ClO2+2NaCl。如图是某化学小组在实验室中制取干燥纯净氯气并进一步制取和收集一定量较纯净的ClO2的装置(某些夹持装置和垫持用品省略)。其中E中盛有CCl4(Cl2易溶于CCl4)。
(1)A为氯气的发生装置,若用高锰酸钾代替MnO2,和浓盐酸可在常温下反应制取Cl2,从①②③中选择合适的装置__________(填序号),仪器p的名称是______________。
(2)写出A装置中瓶内发生反应的离子方程式:
________________________________________________________________________。
(3)C装置所盛试剂的作用是_____________________________________________,
E装置的作用是_____________________________________________________,
G装置的作用是______________________________________________________。
(4)F为ClO2的收集装置,应选用的装置是______(填序号),其中与E装置导管相连的导管口是______(填接口字母)。
18.(14分)菠菜富含铁元素,14~18岁青少年每日合理摄入铁量为20~25 mg。某化学小组针对菠菜中含铁量进行如下实验。
(一)实验目的:100 g菠菜的含铁量是否满足青少年日常所需。
(二)实验方案:
Ⅰ.取适量新鲜菠菜,剪碎后在研钵中研磨,并分成三等份。实验操作和现象记录如下:
实验 操作步骤 现象
实验一 适量蒸馏水浸泡,过滤,取滤液,加KSCN溶液后加入适量H2O2,再次加入KSCN溶液 均无明显现象
实验二 充分灼烧,加适量盐酸浸泡,取滤液,加KSCN溶液 极浅的红色
实验三 充分灼烧,加适量盐酸、H2O2浸泡,取滤液,加KSCN溶液 较深的红色
(1)灼烧菠菜时,不需要用到下列仪器中的________(填字母)。
A.蒸发皿 B.坩埚
C.酒精灯 D.坩埚钳
(2)H2O2的电子式为________________;实验三中H2O2参与的最主要反应的离子方程式为________________________________;可选用__________替换实验三中的H2O2和盐酸。
(3)实验中,KSCN溶液用来检测____________离子。
Ⅱ.菠菜中含铁量的测定,实验步骤如下:
①取10.0 g新鲜菠菜,充分灼烧,将灰分转移至干燥器中冷却。
②向灰分中加入10 mL 盐酸和H2O2,浸泡10 min,过滤并用少量盐酸洗涤烧杯和沉淀,滤液和洗涤液合并。
③将合并液定容成100 mL待测液,测得铁离子的浓度为5×10-5 mol·L-1。
(4)根据实验数据计算菠菜含铁量为__________ mg/100 g。100 g菠菜含铁量________(填“能”或“不能”)满足14~18岁青少年日常所需。
19.(14分)我国某现代化铜冶炼厂排放的废水中含有较多的Fe2+、Fe3+、Cu2+、SO和少量的Na+,为了减少污染并变废为宝,该铜冶炼厂以该废水为原料制备硫酸钠、硫酸亚铁晶体(FeSO4·7H2O)并回收金属铜,设计了如下流程(流程中加入的试剂均过量)。
已知:加入的试剂①为NaOH溶液。回答下列问题:
(1)操作a的名称为________________________,在实验室进行该操作时需要用到的玻璃仪器有______________________;溶液A中所含的溶质为_____________________________________________________________(填化学式)。
(2)加入的试剂③为______________________________________________(填试剂名称)。
(3)检验溶液D中的金属阳离子的具体操作及现象为________________________________________________________________________
________________________________________________________________________,
写出检验过程中属于氧化还原反应的离子方程式并用双线桥法标出电子转移的数目和方向:________________________________________________________________________
________________________________________________________________________。
(4)若取2 mL溶液D于试管中,然后滴加氢氧化钠溶液,可观察到的现象为________________________________________________________________________
________________________________________________________________________,
此现象中涉及的氧化还原反应的化学方程式为____________________________
________________________________________________________________________。
模块质量检测(二)
1.A
2.选C 煤油来源于石油的分馏,属于化石燃料,是不可再生能源,A错误;煤油属于混合物,B错误;20Ne的质量数为20,C正确;质子数相同、中子数不同的同一元素的不同核素互为同位素,3He、3H的质子数分别为2、1,二者质子数不同,不属于同种元素,不互为同位素,D错误。
3.选D HClO的电子式为H???,故A错误;硫的原子序数为16,最外层电子数为6,硫的原子结构示意图为,故B错误;H2O2为共价化合物,故C错误。
4.D
5.选C Fe(OH)3胶粒是多个分子集合体,用1 mol FeCl3制备Fe(OH)3胶体,所得胶粒的数目小于NA,A错误;n=cV,没有溶液体积,无法计算1 mol·L-1MgCl2中所含Cl-数,B错误;32 g O2和O3混合物中,含有的氧原子为=2 mol,氧原子个数为2NA,C正确;标准状况下,H2O是液态,22.4 L H2O不是1 mol,分子数不是NA,D错误。
6.选D 新切开钠的光亮表面很快变暗,钠与氧气反应生成氧化钠,属于氧化还原反应,A不符合题意;钠放入水中,与水反应生成氢气和氢氧化钠,属于氧化还原反应,B不符合题意;过氧化钠与水反应生成氢氧化钠和氧气,属于氧化还原反应,反应放热,棉花立刻燃烧,C不符合题意;碳酸钠溶液显碱性,能使酚酞溶液变红,不涉及氧化还原反应,D符合题意。
7.选B Fe与NaOH溶液不反应,Al能与NaOH溶液反应,加入足量的NaOH溶液,Al被溶解,主要物质被除去,故B错误。
8.选B 由实验Ⅰ可知钠能够在二氧化碳中燃烧,根据质量守恒定律,反应物中含有钠元素、氧元素、碳元素;由实验Ⅱ中黑色滤渣可燃可知,集气瓶底部的黑色固体为碳,由滤液能使酚酞溶液变红,滴加氯化钡溶液有白色沉淀生成可知,瓶壁上附有的白色固体为碳酸钠,则钠在二氧化碳气体中燃烧生成碳酸钠和碳单质,反应的化学方程式为4Na+3CO22Na2CO3+C。
9.选D 根据X3+与Ne的核外电子层结构相同,可知X应为13号元素Al,即X3+为Al3+,再结合X3+比Y2-少一个电子层,可知Y2-核外有3个电子层,则Y为S元素。
10.选A 根据题干中的化学方程式可知,I元素的化合价由0价升高到+5价,转移电子数为6×5×2=60,所以产生标准状况下22.4 L即1 mol氯气需消耗2 mol碘单质,转移20 mol e-,A说法错误;该反应中I2为还原剂,KClO3为氧化剂,故氧化剂和还原剂的物质的量之比为11∶6,B说法正确;工业上常用氯气和石灰乳反应制备漂白粉,C说法正确;酸性条件下,I-与IO反应生成I2,淀粉遇I2变蓝色,故可用酸化的淀粉碘化钾溶液检验IO的存在,D说法正确。
11.选B 焰色试验:用铂丝蘸取待测液并在酒精灯火焰上灼烧,火焰呈黄色,可以确认待测液中含有钠离子,玻璃中含有钠元素,不能用玻璃棒代替铂丝作焰色试验,选项A错误;向溶液中先滴加稀硝酸,然后滴入AgNO3溶液,生成白色沉淀为不溶于酸的氯化银,则原溶液中一定存在Cl-,选项B正确;向某溶液中加入盐酸,产生无色无味气体,该气体能使澄清石灰水变浑浊,则无色无味气体为二氧化碳,则原溶液中不一定存在CO,也可能含有HCO,选项C错误;向待测液中先加入氯水,再滴入KSCN溶液,溶液变红,可以确认此时溶液中含有Fe3+,但是不能确定是原来就存在的铁离子还是亚铁离子被氧化来的,无法判断亚铁离子是否存在,应先向某溶液中滴加几滴KSCN溶液,若溶液不变色,再滴加少量氯水,溶液变红色,才能确定原溶液含有亚铁离子,选项D错误。
12.选A A项,Na2CO3溶于水放热,温度升高,对;C项,加KSCN溶液变红,说明含Fe3+,错;D项,Ag+干扰,错。
13.选D X、Y、Z、P、Q为五种短周期元素,X、Q最外层只有一个电子,位于第ⅠA族;Y最外层有4个电子,位于第ⅣA族,Z原子最外层有5个电子,位于第ⅤA族,P最外层有6个电子,位于第ⅥA族;Q原子半径最大,为Na元素,X原子半径最小,为H元素;Y原子和Z原子半径接近、P原子半径大于Y而最外层电子数大于Y,所以Y是C、Z是N、P为S元素。Na的氧化物有氧化钠和过氧化钠两种,但不论是氧化钠还是过氧化钠,结构中均含离子键,但氧化钠中没有共价键,故A错误;元素的非金属性越强,其最高价含氧酸的酸性越强,非金属性Z>Y,所以其最高价含氧酸的酸性Z>Y,故B错误;P的氢化物为硫化氢,常温下为气体,故C错误;Y为碳元素,而C元素形成的有机物种类繁多,远多于无机物的种类,故D正确。
14.选D 浓盐酸易挥发,制备的氯气中含有HCl,可用饱和食盐水除去HCl,Cl2可用浓硫酸干燥,故A正确;氯气的密度大于空气,用向上排空气法收集,该装置能收集氯气,故B正确;湿润的红布条褪色,干燥的红布条不褪色,可验证干燥的氯气不具有漂白性,故C正确;氯气在水中的溶解度较小,应用NaOH溶液吸收尾气,故D错误。
15.选A 醋酸是弱酸,在离子方程式中不能拆开,B不正确;应按少量的Ba(OH)2的电离比例书写离子方程式:2HCO+Ba2++2OH-===BaCO3↓+CO+2H2O,D不正确。
16.解析:根据原子序数和化合价的关系图可判断①~⑧分别是H、C、N、O、Na、Al、S、Cl。(1)元素③是N,在周期表中的位置为第二周期第ⅤA族;(2)金属性Na>Al,则元素⑤⑥的最高价氧化物对应的水化物中,碱性较强的是NaOH;(3)同周期元素的原子半径从左至右逐渐减小,则⑥⑦⑧三种元素原子半径最大的是Al;(4)元素⑥和⑧的最高价氧化物对应的水化物分别是氢氧化铝和高氯酸,二者反应的离子方程式为Al(OH)3+3H+===Al3++3H2O;(5)由于非金属性越强,简单氢化物越稳定,非金属性Cl>S,则元素⑦⑧形成的简单氢化物中,稳定性较强的是HCl;(6)由①④元素组成的含有极性键和非极性键的一种常见化合物是双氧水,结构式为H—O—O—H;(7)⑤和⑦按2∶1的原子个数比形成的化合物是离子化合物硫化钠,用电子式表示其形成过程为。
答案:(1)第二周期第ⅤA族 (2)NaOH
(3)Al (4)Al(OH)3+3H+===Al3++3H2O
(5)HCl Cl的非金属性更强 (6)H—O—O—H
(7)
17.解析:(1)A为氯气的发生装置,若用高锰酸钾代替MnO2,和浓盐酸可在常温下反应制取Cl2,合适的装置为③,仪器p的名称是分液漏斗。(2)A装置中瓶内发生反应的离子方程式为2MnO+16H++10Cl-===2Mn2++5Cl2↑+8H2O。(3)由信息可知,ClO2易溶于水,则C装置所盛试剂为浓硫酸,浓硫酸具有吸水性,作用是干燥Cl2;由信息可知,ClO2难溶于CCl4,Cl2易溶于CCl4,则CCl4的作用是除去ClO2中的Cl2;G是安全瓶,作用是防倒吸。(4)F为ClO2的收集装置,从ClO2是一种易溶于水而难溶于有机溶剂的气体可知,不能用排水法收集,应选用的装置是②,ClO2的密度比空气的密度大,其中与E装置导管相连的导管口是d。
答案:(1)③ 分液漏斗 (2)2MnO+16H++10Cl-===2Mn2++5Cl2↑+8H2O
(3)干燥Cl2 除去ClO2中的Cl2 防倒吸 (4)② d
18.解析:本题为实验题,实验一中未在浸泡液中检测出亚铁离子、铁离子;实验二中菠菜用坩埚灼烧为灰烬,加入蒸馏水中充分溶解后过滤,检验滤液中铁离子含量很低,实验三中,灰分含二价铁,用氧化剂将二价铁氧化为三价铁,用硫氰化钾检验三价铁,现象明显,以此解题。(1)灼烧固体需要使用的仪器有酒精灯、三脚架和泥三角、坩埚,则灼烧菠菜时不需要用到蒸发皿。(2)H2O2为共价化合物,电子式为H???H;实验三中二价铁可以被过氧化氢氧化为三价铁,则H2O2参与的最主要反应的离子方程式为2Fe2++H2O2+2H+===2Fe3++2H2O。氯水也能把亚铁离子氧化为铁离子,故可选用氯水替换实验三中的H2O2和盐酸。(3)铁离子可以和KSCN反应生成红色溶液,则实验中,KSCN溶液用来检测Fe3+(或铁)离子。(4)根据实验数据:10.0 g新鲜菠菜中含铁量5×10-5 mol·L-1×0.100 L×56 g·mol-1=2.8×10-4 g,则新鲜菠菜中含铁量为2.8 mg/100 g。已知14~18岁青少年每日合理摄入铁量为20~25 mg,则100 g菠菜含铁量不能满足14~18岁青少年日常所需。
答案:(1)A (2) 2Fe2++H2O2+2H+===2Fe3++2H2O 氯水
(3)Fe3+(或铁) (4)2.8 不能
19.解析:结合图示可知废水中加入NaOH溶液,得到Fe(OH)2、Fe(OH)3和Cu(OH)2沉淀,经过滤得到的溶液A中所含溶质为Na2SO4、NaOH;向固体B中加入稀硫酸得到溶液C,向溶液C中加入②经过滤得到溶液D和固体E,结合实验目的可知②应为Fe粉,得到的固体E为Cu、Fe的混合物,溶液D为FeSO4溶液;向固体E中加入③经过滤得到溶液G和固体F,结合实验目的可知③应为稀硫酸,能将Fe溶解,得到的固体F为Cu,溶液G中含FeSO4,FeSO4溶液经蒸发浓缩、冷却结晶、过滤等可得到FeSO4·7H2O晶体。
答案:(1)过滤 烧杯、漏斗、玻璃棒 Na2SO4、NaOH (2)稀硫酸
(3)取少量溶液D于试管中,加入两滴KSCN溶液,无明显现象,再滴加少量新制氯水,溶液变红,证明有Fe2+
(4)先产生白色沉淀,后迅速变成灰绿色,最终变成红褐色
4Fe(OH)2+O2+2H2O===4Fe(OH)3
5 / 7
