2.1 课时3外界条件对化学反应速率影响的理论探究 同步学案(含答案)2025-2026学年高二化学人教版(2019)选择性必修第一册
文档属性
| 名称 | 2.1 课时3外界条件对化学反应速率影响的理论探究 同步学案(含答案)2025-2026学年高二化学人教版(2019)选择性必修第一册 |

|
|
| 格式 | docx | ||
| 文件大小 | 517.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-14 00:00:00 | ||
图片预览

文档简介
课时3 外界条件对化学反应速率影响的理论探究
学习目标
1. 知道活化分子、有效碰撞、活化能的涵义及其对化学反应速率的影响。
2. 能用有效碰撞理论解释外界条件对化学反应速率的影响。
活动方案
阅读下列资料,回答有关问题。
有效碰撞理论:研究发现,大多数化学反应并不是经过简单碰撞就能完成的,而是往往经过多个反应步骤才能实现。例如,2HI===H2+I2实际上是经过下列两步反应完成的:
①2HI―→H2+2I·(I·是自由基,是指带单电子的原子或原子团);②2I·―→I2。
每一步反应都称为基元反应,这两个先后进行的基元反应反映了2HI===H2+I2的反应历程(又称反应机理)。
(1) 基元反应发生的先决条件是反应物分子间必须发生碰撞,分子间碰撞的频率越高,则反应速率越大。(2) 反应物分子间并非每次碰撞都会导致反应的发生,只有少数碰撞会导致反应的发生,多数分子间的碰撞并不发生反应,能发生反应的碰撞称为有效碰撞。(3) 发生有效碰撞的分子必须具有足够的能量,这种分子叫作活化分子。(4) 发生有效碰撞的分子一定是活化分子,但活化分子只有在合适取向时发生的碰撞才称为有效碰撞。
右图是HI分解反应中HI分子之间的几种碰撞示意图。
1. 其中属于有效碰撞的是“A”“B”或“C”中的哪一幅?
2. 另外两种没有发生有效碰撞的原因可能是什么?(解释时必须使用“活化分子”“碰撞取向”等术语,下同)
3. 发生有效碰撞要具备的条件是什么?
4. 研究发现,H2(g)+I2(g)===2HI(g)的两步基元反应快慢如下:
①I2 I·+I·(快) ②H2+2I·―→2HI (慢)
上述两个基元反应中决定H2(g)+I2(g)===2HI(g)反应速率的是哪一步反应?
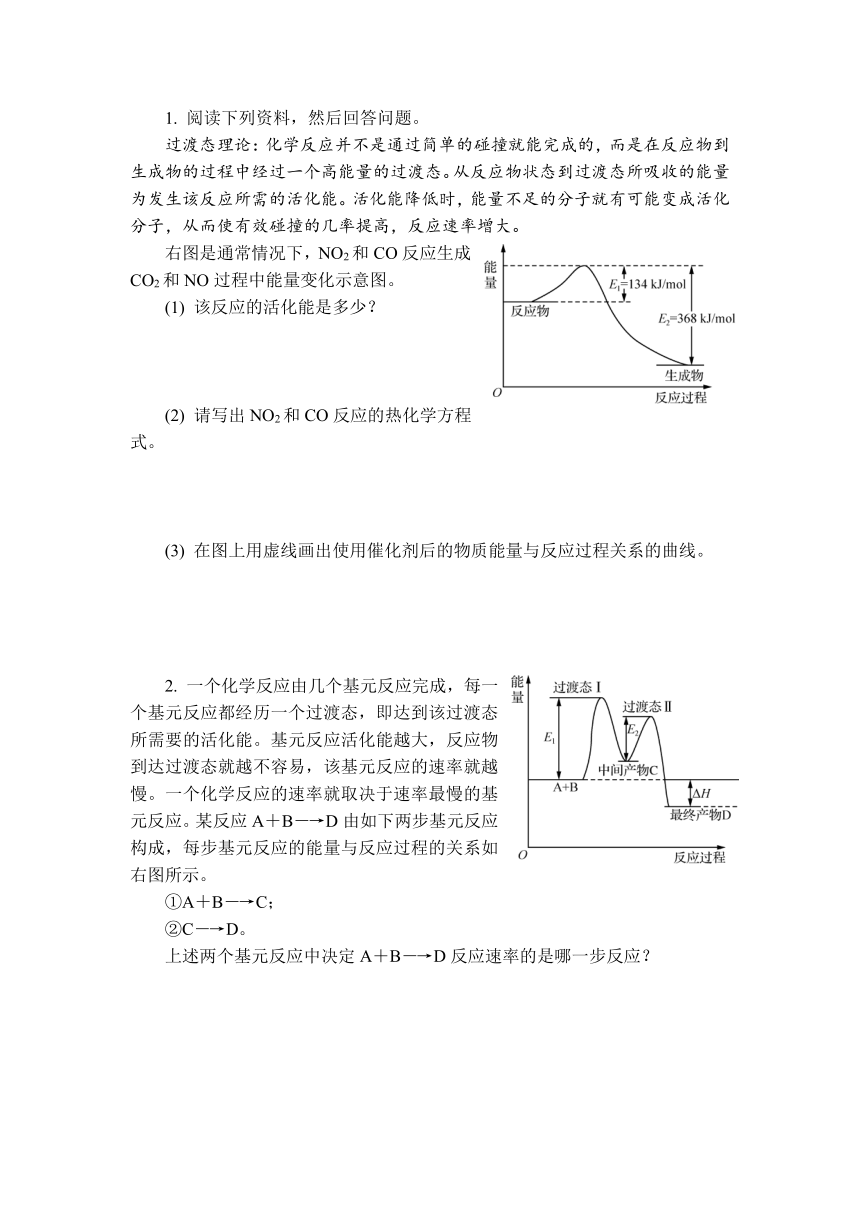
1. 阅读下列资料,然后回答问题。
过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。从反应物状态到过渡态所吸收的能量为发生该反应所需的活化能。活化能降低时,能量不足的分子就有可能变成活化分子,从而使有效碰撞的几率提高,反应速率增大。
右图是通常情况下,NO2和CO反应生成CO2和NO过程中能量变化示意图。
(1) 该反应的活化能是多少?
(2) 请写出NO2和CO反应的热化学方程式。
(3) 在图上用虚线画出使用催化剂后的物质能量与反应过程关系的曲线。
2. 一个化学反应由几个基元反应完成,每一个基元反应都经历一个过渡态,即达到该过渡态所需要的活化能。基元反应活化能越大,反应物到达过渡态就越不容易,该基元反应的速率就越慢。一个化学反应的速率就取决于速率最慢的基元反应。某反应A+B―→D由如下两步基元反应构成,每步基元反应的能量与反应过程的关系如右图所示。
①A+B―→C;
②C―→D。
上述两个基元反应中决定A+B―→D反应速率的是哪一步反应?
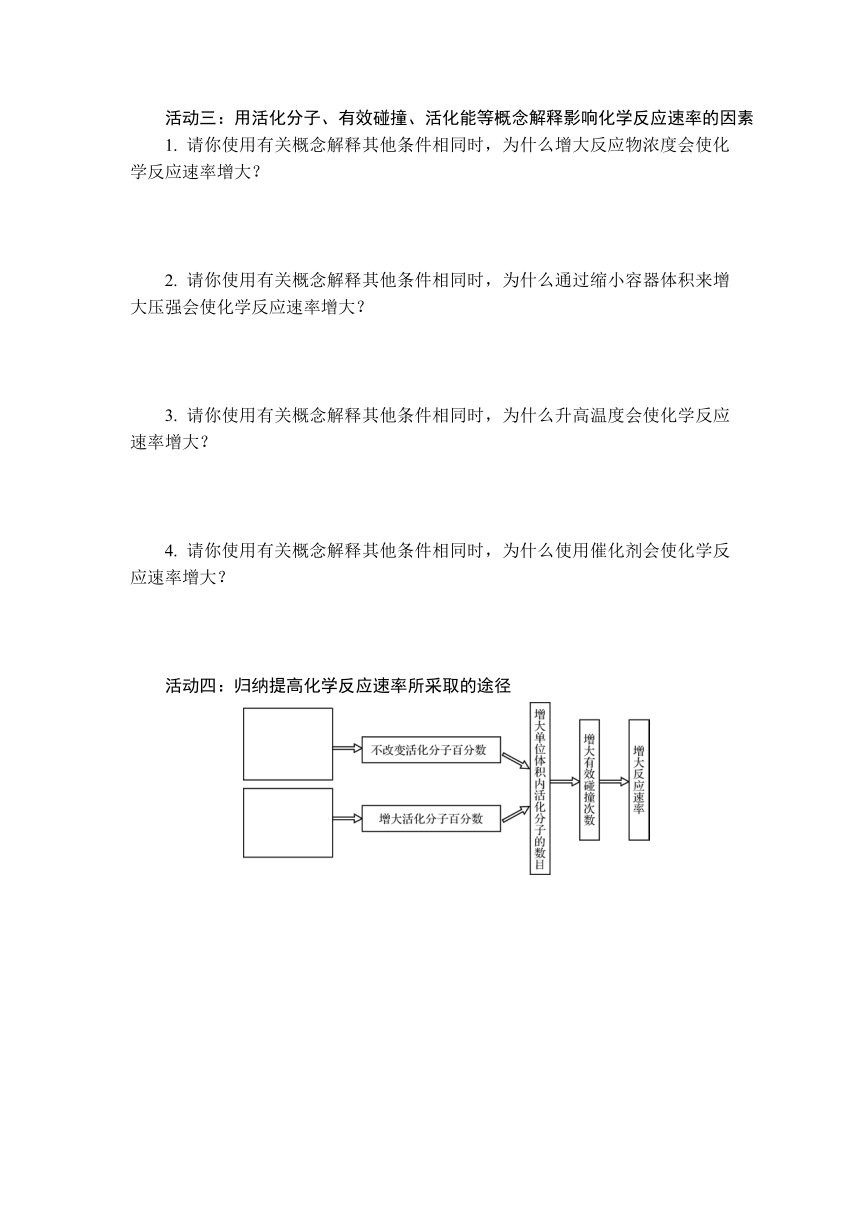
1. 请你使用有关概念解释其他条件相同时,为什么增大反应物浓度会使化学反应速率增大?
2. 请你使用有关概念解释其他条件相同时,为什么通过缩小容器体积来增大压强会使化学反应速率增大?
3. 请你使用有关概念解释其他条件相同时,为什么升高温度会使化学反应速率增大?
4. 请你使用有关概念解释其他条件相同时,为什么使用催化剂会使化学反应速率增大?
1. 已知:CO(g)+2H2(g)===CH3OH(g) ΔH,反应过程中生成 1 mol CH3OH(g)的能量变化如图所示。曲线Ⅰ、Ⅱ分别表示有或无催化剂两种情况。下列判断正确的是( )
A. 加入催化剂,ΔH变小
B. ΔH=+91 kJ/mol
C. 正、逆反应的活化能相等
D. 曲线Ⅱ表示加入了催化剂
2. 下列说法不正确的是( )
A. 活化分子一定能发生有效碰撞 B. 升高温度增大了活化分子百分数
C. 催化剂能够改变化学反应途径 D. 增大压强能提高活化分子的浓度
3. 下列说法正确的是( )
A. 增大反应物浓度,可增大单位体积内活化分子的百分数,从而增加有效碰撞次数,增大反应速率
B. 对于有气体参加的化学反应,若增大压强,可增大活化分子的百分数,从而使反应速率增大
C. 改变温度能使化学反应速率改变的主要原因是改变了反应的焓变
D. 催化剂能降低分子活化时所需能量,使单位体积内活化分子百分数大大增加
4. 已知:①2SO2(g)+O2(g) 2SO3(g) ΔH=-196 kJ/mol(慢)。研究表明,在含有少量NO的情况下,上述反应的机理如下:
②2NO(g)+O2(g) 2NO2(g)(快);
③NO2(g)+SO2(g) NO(g)+SO3(g)(快)。
下列有关说法正确的是( )
A. NO是反应①的催化剂 B. 反应①的活化能为196 kJ/mol
C. 反应速率与NO的浓度无关 D. 开始时加入NO2不能增大反应①的速率
5. [鲁科版教材习题]某研究人员通过研究得到以下两组数据(Ea为反应的活化能)。
第1组:
反应 Ea(kJ/mol) T1→T2/K v(318 K)/v(298 K)
A 100 298→318 14.0
第2组:
反应 Ea(kJ/mol) v(A)/v(B)
A 100 3 205
B 120
结合第1组和第2组数据,你认为他所研究的问题是______________________
_________________________________________________。
6. 科学家结合实验和计算机模拟结果,研究了在贵重金属催化剂表面上的气态体系中,CO(g)还原NO(g)得到1 mol N2(g)和2 mol CO2(g)的能量变化与反应过程的关系如图所示。
(1) 写出该反应的热化学方程式。
(2) 决定该反应快慢的是哪一步反应过程?
课时3 外界条件对化学反应速率影响的理论探究
【活动方案】
活动一:
1 C
2 A中分子碰撞取向好,但分子能量较低,不是活化分子;B中的分子尽管可能是活化分子,但分子的碰撞取向不好。
3 活化分子只有在合适的碰撞取向时发生的碰撞,才是有效碰撞。
4 反应②
活动二:
1 (1) 134 kJ/mol
(2) NO2(g)+CO(g)===CO2(g)+NO(g)
ΔH=-234 kJ/mol
(3)
2 反应①
活动三:
1 其他条件相同时,反应物浓度增大,单位体积内活化分子数增多,单位时间内有效碰撞的次数增加,化学反应速率增大。
2 其他条件相同时,缩小容器体积,压强增大,单位体积内活化分子数增多,单位时间内有效碰撞几率增加,化学反应速率增大。
3 其他条件相同时,升高温度,一方面反应物分子的能量增加,使一部分原来能量较低的分子变成活化分子,反应物分子中活化分子百分数提高(这是反应速率增大的主要原因);另一方面,升高温度,分子的运动加快,单位时间内反应物分子间的有效碰撞的次数增加。这两方面原因都使分子间有效碰撞的次数增加,化学反应速率增大。
4 在其他条件相同时,使用催化剂,使发生反应所需的活化能降低,反应体系中活化分子的百分数提高,有效碰撞几率提高,化学反应速率增大。
活动四:
增大反应物浓度、增大压强、增大固体接触面积
升高温度、使用合适的催化剂
【课堂反馈】
1 D 2 A 3 D 4 A
5 温度、活化能对反应速率的影响程度大小比较
6 (1) 2NO(g)+2CO(g)===2CO2(g)+N2(g) ΔH=(Ed-Ea)kJ/mol
(2) 过程①
学习目标
1. 知道活化分子、有效碰撞、活化能的涵义及其对化学反应速率的影响。
2. 能用有效碰撞理论解释外界条件对化学反应速率的影响。
活动方案
阅读下列资料,回答有关问题。
有效碰撞理论:研究发现,大多数化学反应并不是经过简单碰撞就能完成的,而是往往经过多个反应步骤才能实现。例如,2HI===H2+I2实际上是经过下列两步反应完成的:
①2HI―→H2+2I·(I·是自由基,是指带单电子的原子或原子团);②2I·―→I2。
每一步反应都称为基元反应,这两个先后进行的基元反应反映了2HI===H2+I2的反应历程(又称反应机理)。
(1) 基元反应发生的先决条件是反应物分子间必须发生碰撞,分子间碰撞的频率越高,则反应速率越大。(2) 反应物分子间并非每次碰撞都会导致反应的发生,只有少数碰撞会导致反应的发生,多数分子间的碰撞并不发生反应,能发生反应的碰撞称为有效碰撞。(3) 发生有效碰撞的分子必须具有足够的能量,这种分子叫作活化分子。(4) 发生有效碰撞的分子一定是活化分子,但活化分子只有在合适取向时发生的碰撞才称为有效碰撞。
右图是HI分解反应中HI分子之间的几种碰撞示意图。
1. 其中属于有效碰撞的是“A”“B”或“C”中的哪一幅?
2. 另外两种没有发生有效碰撞的原因可能是什么?(解释时必须使用“活化分子”“碰撞取向”等术语,下同)
3. 发生有效碰撞要具备的条件是什么?
4. 研究发现,H2(g)+I2(g)===2HI(g)的两步基元反应快慢如下:
①I2 I·+I·(快) ②H2+2I·―→2HI (慢)
上述两个基元反应中决定H2(g)+I2(g)===2HI(g)反应速率的是哪一步反应?
1. 阅读下列资料,然后回答问题。
过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。从反应物状态到过渡态所吸收的能量为发生该反应所需的活化能。活化能降低时,能量不足的分子就有可能变成活化分子,从而使有效碰撞的几率提高,反应速率增大。
右图是通常情况下,NO2和CO反应生成CO2和NO过程中能量变化示意图。
(1) 该反应的活化能是多少?
(2) 请写出NO2和CO反应的热化学方程式。
(3) 在图上用虚线画出使用催化剂后的物质能量与反应过程关系的曲线。
2. 一个化学反应由几个基元反应完成,每一个基元反应都经历一个过渡态,即达到该过渡态所需要的活化能。基元反应活化能越大,反应物到达过渡态就越不容易,该基元反应的速率就越慢。一个化学反应的速率就取决于速率最慢的基元反应。某反应A+B―→D由如下两步基元反应构成,每步基元反应的能量与反应过程的关系如右图所示。
①A+B―→C;
②C―→D。
上述两个基元反应中决定A+B―→D反应速率的是哪一步反应?
1. 请你使用有关概念解释其他条件相同时,为什么增大反应物浓度会使化学反应速率增大?
2. 请你使用有关概念解释其他条件相同时,为什么通过缩小容器体积来增大压强会使化学反应速率增大?
3. 请你使用有关概念解释其他条件相同时,为什么升高温度会使化学反应速率增大?
4. 请你使用有关概念解释其他条件相同时,为什么使用催化剂会使化学反应速率增大?
1. 已知:CO(g)+2H2(g)===CH3OH(g) ΔH,反应过程中生成 1 mol CH3OH(g)的能量变化如图所示。曲线Ⅰ、Ⅱ分别表示有或无催化剂两种情况。下列判断正确的是( )
A. 加入催化剂,ΔH变小
B. ΔH=+91 kJ/mol
C. 正、逆反应的活化能相等
D. 曲线Ⅱ表示加入了催化剂
2. 下列说法不正确的是( )
A. 活化分子一定能发生有效碰撞 B. 升高温度增大了活化分子百分数
C. 催化剂能够改变化学反应途径 D. 增大压强能提高活化分子的浓度
3. 下列说法正确的是( )
A. 增大反应物浓度,可增大单位体积内活化分子的百分数,从而增加有效碰撞次数,增大反应速率
B. 对于有气体参加的化学反应,若增大压强,可增大活化分子的百分数,从而使反应速率增大
C. 改变温度能使化学反应速率改变的主要原因是改变了反应的焓变
D. 催化剂能降低分子活化时所需能量,使单位体积内活化分子百分数大大增加
4. 已知:①2SO2(g)+O2(g) 2SO3(g) ΔH=-196 kJ/mol(慢)。研究表明,在含有少量NO的情况下,上述反应的机理如下:
②2NO(g)+O2(g) 2NO2(g)(快);
③NO2(g)+SO2(g) NO(g)+SO3(g)(快)。
下列有关说法正确的是( )
A. NO是反应①的催化剂 B. 反应①的活化能为196 kJ/mol
C. 反应速率与NO的浓度无关 D. 开始时加入NO2不能增大反应①的速率
5. [鲁科版教材习题]某研究人员通过研究得到以下两组数据(Ea为反应的活化能)。
第1组:
反应 Ea(kJ/mol) T1→T2/K v(318 K)/v(298 K)
A 100 298→318 14.0
第2组:
反应 Ea(kJ/mol) v(A)/v(B)
A 100 3 205
B 120
结合第1组和第2组数据,你认为他所研究的问题是______________________
_________________________________________________。
6. 科学家结合实验和计算机模拟结果,研究了在贵重金属催化剂表面上的气态体系中,CO(g)还原NO(g)得到1 mol N2(g)和2 mol CO2(g)的能量变化与反应过程的关系如图所示。
(1) 写出该反应的热化学方程式。
(2) 决定该反应快慢的是哪一步反应过程?
课时3 外界条件对化学反应速率影响的理论探究
【活动方案】
活动一:
1 C
2 A中分子碰撞取向好,但分子能量较低,不是活化分子;B中的分子尽管可能是活化分子,但分子的碰撞取向不好。
3 活化分子只有在合适的碰撞取向时发生的碰撞,才是有效碰撞。
4 反应②
活动二:
1 (1) 134 kJ/mol
(2) NO2(g)+CO(g)===CO2(g)+NO(g)
ΔH=-234 kJ/mol
(3)
2 反应①
活动三:
1 其他条件相同时,反应物浓度增大,单位体积内活化分子数增多,单位时间内有效碰撞的次数增加,化学反应速率增大。
2 其他条件相同时,缩小容器体积,压强增大,单位体积内活化分子数增多,单位时间内有效碰撞几率增加,化学反应速率增大。
3 其他条件相同时,升高温度,一方面反应物分子的能量增加,使一部分原来能量较低的分子变成活化分子,反应物分子中活化分子百分数提高(这是反应速率增大的主要原因);另一方面,升高温度,分子的运动加快,单位时间内反应物分子间的有效碰撞的次数增加。这两方面原因都使分子间有效碰撞的次数增加,化学反应速率增大。
4 在其他条件相同时,使用催化剂,使发生反应所需的活化能降低,反应体系中活化分子的百分数提高,有效碰撞几率提高,化学反应速率增大。
活动四:
增大反应物浓度、增大压强、增大固体接触面积
升高温度、使用合适的催化剂
【课堂反馈】
1 D 2 A 3 D 4 A
5 温度、活化能对反应速率的影响程度大小比较
6 (1) 2NO(g)+2CO(g)===2CO2(g)+N2(g) ΔH=(Ed-Ea)kJ/mol
(2) 过程①
