2.3 化学反应的方向 同步学案(含答案)2025-2026学年高二化学人教版(2019)选择性必修第一册
文档属性
| 名称 | 2.3 化学反应的方向 同步学案(含答案)2025-2026学年高二化学人教版(2019)选择性必修第一册 |

|
|
| 格式 | docx | ||
| 文件大小 | 436.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-14 11:13:22 | ||
图片预览


文档简介
第三节 化学反应的方向
学习目标
1. 知道熵变的含义。
2. 能初步利用焓变和熵变说明化学反应的方向。
活动方案
1. 日常生活中一些自发过程的能量变化规律。
在一定温度和压强下,无需外界帮助就能自动进行的过程,称为自发过程。
(1) 高山流水是一个自发进行的自然过程。一定量的水,位于高处时和位于低处时,哪一个的能量更高?
(2) 请你再举出一些生活中常见的自发过程的实例,其中物质(或物体)的能量变化与“高山流水”相同。
(3) 从能量变化的角度看,上述自然界中的自发过程有何规律?
2. 一些自发的化学反应中能量变化规律。
(1) 下面是我们熟悉的在一定条件下可以自发进行的化学反应实例,这些反应的热效应有什么共同点?
①白磷的缓慢氧化 ②酸碱中和反应 ③金属与酸反应
(2) 请你再举几例在一定条件下可以自发进行的反应,其热效应与上述反应相同。
(3) 从体系能量变化的角度看,什么样的反应具有自发进行的倾向?
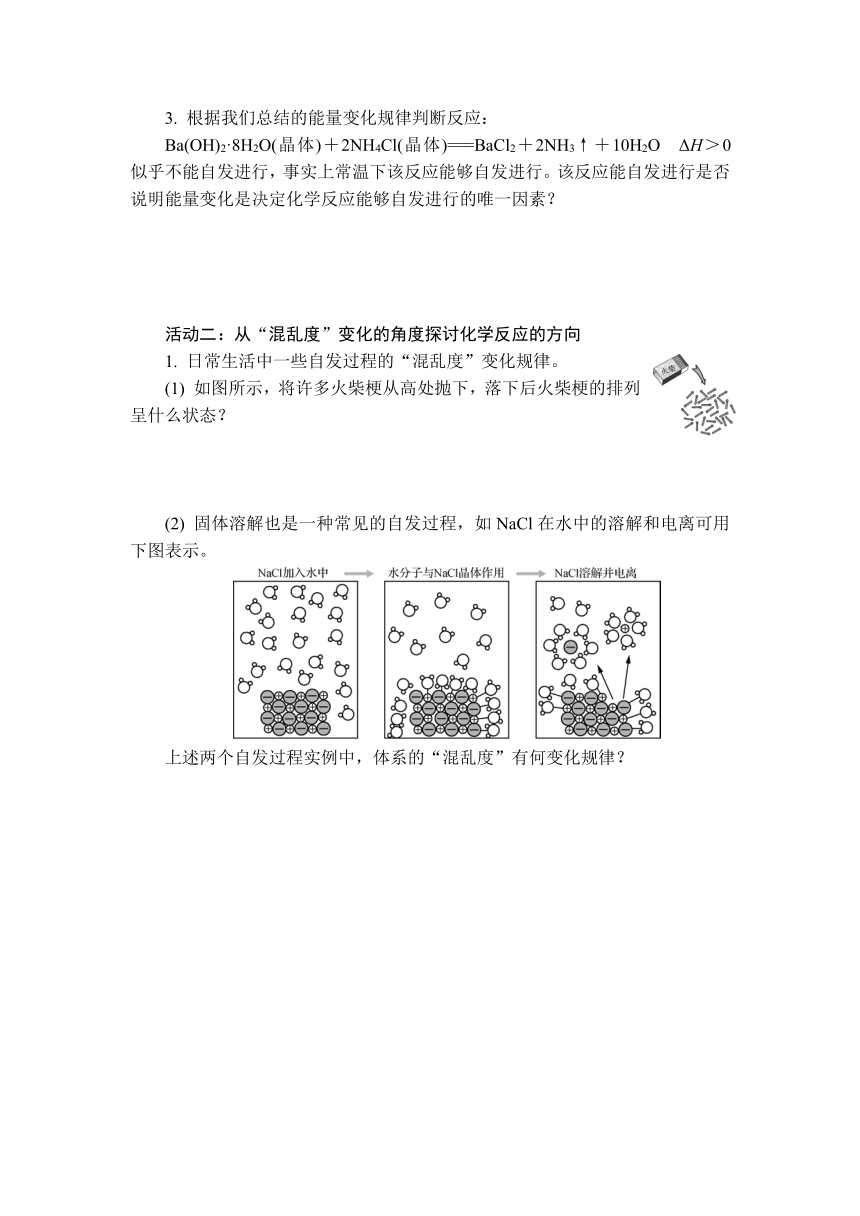
3. 根据我们总结的能量变化规律判断反应:
Ba(OH)2·8H2O(晶体)+2NH4Cl(晶体)===BaCl2+2NH3↑+10H2O ΔH>0似乎不能自发进行,事实上常温下该反应能够自发进行。该反应能自发进行是否说明能量变化是决定化学反应能够自发进行的唯一因素?
1. 日常生活中一些自发过程的“混乱度”变化规律。
(1) 如图所示,将许多火柴梗从高处抛下,落下后火柴梗的排列呈什么状态?
(2) 固体溶解也是一种常见的自发过程,如NaCl在水中的溶解和电离可用下图表示。
上述两个自发过程实例中,体系的“混乱度”有何变化规律?
2. 认识衡量体系“混乱度”的物理量——熵(S)。
衡量一个体系混乱度的物理量叫作熵,用符号S表示。在一个由大量微粒(分子、原子、离子)构成的体系中,微粒之间无规则排列的程度越大,体系的熵越大。反应前后体系熵的变化叫作熵变,可用ΔS表示。如果发生变化后体系的“混乱度”增大,该过程的ΔS>0;反之,ΔS<0。
(1) 下图表示水的不同聚集状态的混乱程度。
①根据图示分析:同一物质在不同状态时熵值大小的一般规律。
②一般来说,体系中气体的物质的量越大,体系的熵值越________(填“大”或“小”)。
(2) 判断下列反应中熵值的变化。
①N2+3H22NH3
②(NH4)2CO3===NH4HCO3+NH3↑
3. 一些自发的化学反应中混乱度(熵值)变化规律。
(1) 下列反应在一定条件下均可自发进行,请说出这些反应的熵值变化有什么共同点?
①氢氧化钡晶体与氯化铵反应 ②碳酸钙的分解 ③CO2与碳反应生成CO
(2) 从体系熵值变化的角度看,什么样的反应具有自发进行的倾向?
阅读下列材料,回答有关问题。
焓判据:焓减的反应(ΔH<0),体系能量降低,具有自发进行的倾向,一定条件下能自发进行。
熵判据:反应熵变ΔS=生成物总熵-反应物总熵,熵增(ΔS>0)的反应具有自发进行的倾向。
1. 观察下列反应的进行规律,用“一定能”“一定不能”或“一定条件下能”填写下表。
①C3H8(g)+5O2(g)===3CO2(g)+4H2O(g) ΔH<0 一定能自发
②4Fe(s)+3O2(g)===2Fe2O3(s) ΔH<0 一定条件下能自发
③(NH4)2CO3(s)===NH4HCO3(s)+NH3(g) ΔH>0 一定条件下能自发
④2Na2O2 (s)+2H2O(l)===4NaOH(aq)+O2(g) ΔH<0 一定能自发
序号 焓判据 熵判据 能否自发进行
(1) ΔH<0 ΔS>0
(2) ΔH>0 ΔS<0
(3) ΔH<0 ΔS<0
(4) ΔH>0 ΔS>0
2. 合成氨工业原理:N2(g)+3H2(g)2NH3(g),推测该反应能自发进行的动力是什么?
3. 有人曾提出可通过“2CO(g)===2C(s)+O2(g)”反应消除CO对空气的污染,你认为这一建议可行吗?说明理由。
1. 下列有关说法正确的是( )
A. 燃烧反应是能量增大的反应
B. 自由落体是势能减小的过程
C. 放热反应都是自发的,吸热反应都是非自发的
D. 熵增反应都是自发的,熵减反应都是非自发的
2. 下列关于冰融化为水的过程判断正确的是( )
A. ΔH>0,ΔS<0 B. ΔH<0,ΔS>0
C. ΔH>0,ΔS>0 D. ΔH<0,ΔS<0
3. 下列组合中在任何温度下反应均能自发进行的是( )
A. ΔH>0,ΔS>0 B. ΔH<0,ΔS<0
C. ΔH>0,ΔS<0 D. ΔH<0,ΔS>0
4. 在25 ℃、1.01×105Pa时,反应2N2O5(g)===4NO2(g)+O2(g) ΔH=+56.7 kJ/mol,该反应能自发进行的原因是( )
A. 是吸热反应 B. 是放热反应 C. 是熵减反应 D. 是熵增反应
5. 下列过程属于熵增加的是( )
A. 一定条件下,水由气态变成液态
B. 2CO(g)+O2(g)===2CO2(g)
C. NH4HCO3(s)===H2O(l)+CO2(g)+NH3(g)
D. 降温时硫酸铜饱和溶液中析出晶体
6. [苏教版教材习题]下列变化过程中,ΔS<0的是( )
A. NaCl溶于水中
B. NH3(g)与HCl(g)反应生成NH4Cl(s)
C. 干冰[CO2(s)]升华
D. CaCO3(s)分解为CaO(s)和CO2(g)
7. 下列反应中熵值显著增大的是( )
A. CaO(s)+CO2(g)===CaCO3(s)
B. CuO(s)+CO(g)===Cu(s)+CO2(g)
C. Ba(OH)2·8H2O+2NH4Cl===BaCl2+2NH3↑+10H2O
D. 4Fe(OH)2(s)+O2(g)+2H2O(l)===4Fe(OH)3(s)
8. 实验证明,多数能自发进行的反应都是放热反应。对此说法的理解正确的是( )
A. 所有的放热反应都是自发进行的
B. 所有的自发反应都是放热的
C. 焓变是影响反应是否具有自发性的一种重要因素
D. 焓变是决定反应是否具有自发性的唯一判据
9. 下列有关说法正确的是( )
A. 2NO(g)+2CO(g)===N2(g)+2CO2(g)在常温下能自发进行,则该反应的ΔH>0
B. NH3(g)+HCl(g)===NH4Cl(s)在室温下可自发进行,则该反应的ΔH<0
C. CaCO3(s)===CaO(s)+CO2(g)室温下不能自发进行,说明该反应的ΔH<0
D. 一定温度下,2NaCl(s)===2Na(s)+Cl2(g) ΔH<0,ΔS>0
10. 下列有关说法不正确的是( )
A. 一定温度下,2Mg(s)+CO2(g)===2MgO(s)+C(s)能自发进行,则该反应的ΔH<0
B. 室温下,Ag+(aq)+Cl-(aq)===AgCl(s)可自发进行,则该反应的ΔH<0
C. 室温下,SiO2(s)+3C(s)===SiC(s)+2CO(g)不能自发进行,则该反应的ΔH<0
D. 室温下,CO2(g)+C(s)===2CO(g)不能自发进行,则该反应的ΔH>0
第三节 化学反应的方向
【活动方案】
活动一:
1 (1) 位于高处的水能量高。
(2) 自由落体。电流总是从电位高的地方向电位低的地方流动等。
(3) 自然界中的自发过程能量有趋于“最低”的倾向。
2 (1) 都是放热反应。
(2) 钠与水反应、燃烧反应等。
(3) 能量降低的放热反应。
3 不是。
活动二:
1 (1) 散落无序 (2) 混乱度增大
2 (1) ①同一物质熵值:固体<液体<气体 ②大
(2) 反应①熵值减小 反应②熵值增大
3 (1) 熵值都增大。
(2) 混乱度增大的反应具有自发进行的倾向。
活动三:
1 (1) 一定能 (2) 一定不能
(3) 一定条件下能 (4) 一定条件下能
2 该反应放热(ΔH<0)。
3 不可行,该反应是一个焓增、熵减的反应,任何情况下均不能自发进行。
【课堂反馈】
1 B 2 C 3 D 4 D 5 C 6 B 7 C 8 C 9 B 10 C
学习目标
1. 知道熵变的含义。
2. 能初步利用焓变和熵变说明化学反应的方向。
活动方案
1. 日常生活中一些自发过程的能量变化规律。
在一定温度和压强下,无需外界帮助就能自动进行的过程,称为自发过程。
(1) 高山流水是一个自发进行的自然过程。一定量的水,位于高处时和位于低处时,哪一个的能量更高?
(2) 请你再举出一些生活中常见的自发过程的实例,其中物质(或物体)的能量变化与“高山流水”相同。
(3) 从能量变化的角度看,上述自然界中的自发过程有何规律?
2. 一些自发的化学反应中能量变化规律。
(1) 下面是我们熟悉的在一定条件下可以自发进行的化学反应实例,这些反应的热效应有什么共同点?
①白磷的缓慢氧化 ②酸碱中和反应 ③金属与酸反应
(2) 请你再举几例在一定条件下可以自发进行的反应,其热效应与上述反应相同。
(3) 从体系能量变化的角度看,什么样的反应具有自发进行的倾向?
3. 根据我们总结的能量变化规律判断反应:
Ba(OH)2·8H2O(晶体)+2NH4Cl(晶体)===BaCl2+2NH3↑+10H2O ΔH>0似乎不能自发进行,事实上常温下该反应能够自发进行。该反应能自发进行是否说明能量变化是决定化学反应能够自发进行的唯一因素?
1. 日常生活中一些自发过程的“混乱度”变化规律。
(1) 如图所示,将许多火柴梗从高处抛下,落下后火柴梗的排列呈什么状态?
(2) 固体溶解也是一种常见的自发过程,如NaCl在水中的溶解和电离可用下图表示。
上述两个自发过程实例中,体系的“混乱度”有何变化规律?
2. 认识衡量体系“混乱度”的物理量——熵(S)。
衡量一个体系混乱度的物理量叫作熵,用符号S表示。在一个由大量微粒(分子、原子、离子)构成的体系中,微粒之间无规则排列的程度越大,体系的熵越大。反应前后体系熵的变化叫作熵变,可用ΔS表示。如果发生变化后体系的“混乱度”增大,该过程的ΔS>0;反之,ΔS<0。
(1) 下图表示水的不同聚集状态的混乱程度。
①根据图示分析:同一物质在不同状态时熵值大小的一般规律。
②一般来说,体系中气体的物质的量越大,体系的熵值越________(填“大”或“小”)。
(2) 判断下列反应中熵值的变化。
①N2+3H22NH3
②(NH4)2CO3===NH4HCO3+NH3↑
3. 一些自发的化学反应中混乱度(熵值)变化规律。
(1) 下列反应在一定条件下均可自发进行,请说出这些反应的熵值变化有什么共同点?
①氢氧化钡晶体与氯化铵反应 ②碳酸钙的分解 ③CO2与碳反应生成CO
(2) 从体系熵值变化的角度看,什么样的反应具有自发进行的倾向?
阅读下列材料,回答有关问题。
焓判据:焓减的反应(ΔH<0),体系能量降低,具有自发进行的倾向,一定条件下能自发进行。
熵判据:反应熵变ΔS=生成物总熵-反应物总熵,熵增(ΔS>0)的反应具有自发进行的倾向。
1. 观察下列反应的进行规律,用“一定能”“一定不能”或“一定条件下能”填写下表。
①C3H8(g)+5O2(g)===3CO2(g)+4H2O(g) ΔH<0 一定能自发
②4Fe(s)+3O2(g)===2Fe2O3(s) ΔH<0 一定条件下能自发
③(NH4)2CO3(s)===NH4HCO3(s)+NH3(g) ΔH>0 一定条件下能自发
④2Na2O2 (s)+2H2O(l)===4NaOH(aq)+O2(g) ΔH<0 一定能自发
序号 焓判据 熵判据 能否自发进行
(1) ΔH<0 ΔS>0
(2) ΔH>0 ΔS<0
(3) ΔH<0 ΔS<0
(4) ΔH>0 ΔS>0
2. 合成氨工业原理:N2(g)+3H2(g)2NH3(g),推测该反应能自发进行的动力是什么?
3. 有人曾提出可通过“2CO(g)===2C(s)+O2(g)”反应消除CO对空气的污染,你认为这一建议可行吗?说明理由。
1. 下列有关说法正确的是( )
A. 燃烧反应是能量增大的反应
B. 自由落体是势能减小的过程
C. 放热反应都是自发的,吸热反应都是非自发的
D. 熵增反应都是自发的,熵减反应都是非自发的
2. 下列关于冰融化为水的过程判断正确的是( )
A. ΔH>0,ΔS<0 B. ΔH<0,ΔS>0
C. ΔH>0,ΔS>0 D. ΔH<0,ΔS<0
3. 下列组合中在任何温度下反应均能自发进行的是( )
A. ΔH>0,ΔS>0 B. ΔH<0,ΔS<0
C. ΔH>0,ΔS<0 D. ΔH<0,ΔS>0
4. 在25 ℃、1.01×105Pa时,反应2N2O5(g)===4NO2(g)+O2(g) ΔH=+56.7 kJ/mol,该反应能自发进行的原因是( )
A. 是吸热反应 B. 是放热反应 C. 是熵减反应 D. 是熵增反应
5. 下列过程属于熵增加的是( )
A. 一定条件下,水由气态变成液态
B. 2CO(g)+O2(g)===2CO2(g)
C. NH4HCO3(s)===H2O(l)+CO2(g)+NH3(g)
D. 降温时硫酸铜饱和溶液中析出晶体
6. [苏教版教材习题]下列变化过程中,ΔS<0的是( )
A. NaCl溶于水中
B. NH3(g)与HCl(g)反应生成NH4Cl(s)
C. 干冰[CO2(s)]升华
D. CaCO3(s)分解为CaO(s)和CO2(g)
7. 下列反应中熵值显著增大的是( )
A. CaO(s)+CO2(g)===CaCO3(s)
B. CuO(s)+CO(g)===Cu(s)+CO2(g)
C. Ba(OH)2·8H2O+2NH4Cl===BaCl2+2NH3↑+10H2O
D. 4Fe(OH)2(s)+O2(g)+2H2O(l)===4Fe(OH)3(s)
8. 实验证明,多数能自发进行的反应都是放热反应。对此说法的理解正确的是( )
A. 所有的放热反应都是自发进行的
B. 所有的自发反应都是放热的
C. 焓变是影响反应是否具有自发性的一种重要因素
D. 焓变是决定反应是否具有自发性的唯一判据
9. 下列有关说法正确的是( )
A. 2NO(g)+2CO(g)===N2(g)+2CO2(g)在常温下能自发进行,则该反应的ΔH>0
B. NH3(g)+HCl(g)===NH4Cl(s)在室温下可自发进行,则该反应的ΔH<0
C. CaCO3(s)===CaO(s)+CO2(g)室温下不能自发进行,说明该反应的ΔH<0
D. 一定温度下,2NaCl(s)===2Na(s)+Cl2(g) ΔH<0,ΔS>0
10. 下列有关说法不正确的是( )
A. 一定温度下,2Mg(s)+CO2(g)===2MgO(s)+C(s)能自发进行,则该反应的ΔH<0
B. 室温下,Ag+(aq)+Cl-(aq)===AgCl(s)可自发进行,则该反应的ΔH<0
C. 室温下,SiO2(s)+3C(s)===SiC(s)+2CO(g)不能自发进行,则该反应的ΔH<0
D. 室温下,CO2(g)+C(s)===2CO(g)不能自发进行,则该反应的ΔH>0
第三节 化学反应的方向
【活动方案】
活动一:
1 (1) 位于高处的水能量高。
(2) 自由落体。电流总是从电位高的地方向电位低的地方流动等。
(3) 自然界中的自发过程能量有趋于“最低”的倾向。
2 (1) 都是放热反应。
(2) 钠与水反应、燃烧反应等。
(3) 能量降低的放热反应。
3 不是。
活动二:
1 (1) 散落无序 (2) 混乱度增大
2 (1) ①同一物质熵值:固体<液体<气体 ②大
(2) 反应①熵值减小 反应②熵值增大
3 (1) 熵值都增大。
(2) 混乱度增大的反应具有自发进行的倾向。
活动三:
1 (1) 一定能 (2) 一定不能
(3) 一定条件下能 (4) 一定条件下能
2 该反应放热(ΔH<0)。
3 不可行,该反应是一个焓增、熵减的反应,任何情况下均不能自发进行。
【课堂反馈】
1 B 2 C 3 D 4 D 5 C 6 B 7 C 8 C 9 B 10 C
