专题3 微粒间作用力与物质性质综合拔高练
文档属性
| 名称 | 专题3 微粒间作用力与物质性质综合拔高练 |  | |
| 格式 | docx | ||
| 文件大小 | 540.0KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-10-28 18:08:23 | ||
图片预览




文档简介
综合拔高练
高考真题练
考点1 共价键的类型及数目判断
1.(2024全国甲,35节选)CaC2俗称电石,该化合物中不存在的化学键类型为 (填标号)。
a.离子键 b.极性共价键
c.非极性共价键 d.配位键
2.[2022湖南,18(2)①]富马酸亚铁(FeC4H2O4)是一种补铁剂。富马酸分子的结构模型如图所示:
富马酸分子中σ键与π键的数目比为 。
3.[2021全国甲,35(2)]CO2分子中存在 个σ键和 个π键。
考点2 各种晶体的结构与性质
4.(2023山东,5)石墨与F2在450℃反应,石墨层间插入F得到层状结构化合物(CF)x,该物质仍具润滑性,其单层局部结构如图所示。下列关于该化合物的说法正确的是( )
A.与石墨相比,(CF)x导电性增强
B.与石墨相比,(CF)x抗氧化性增强
C.(CF)x中C—C的键长比C—F短
D.1mol(CF)x中含有2xmol共价单键
5.(1)(2024全国甲,35节选)早在青铜器时代,人类就认识了锡。锡的卤化物熔点数据如下表,结合变化规律说明原因: 。
物质 SnF4 SnCl4 SnBr4 SnI4
熔点/℃ 442 -34 29 143
(2)(2024山东,16节选)Mn的某种氧化物MnOx的四方晶胞及其在xy平面的投影如图所示,该氧化物化学式为 。
当MnOx晶体有O原子脱出时,出现O空位,Mn的化合价 (填“升高”“降低”或“不变”),O空位的产生使晶体具有半导体性质。下列氧化物晶体难以通过该方式获有半导体性质的是 (填标号)。
A.CaO B.V2O5 C.Fe2O3 D.CuO
6.(2023全国乙,35节选)(2)已知一些物质的熔点数据如下表:
物质 NaCl SiCl4 GeCl4 SnCl4
熔点/℃ 800.7 -68.8 -51.5 -34.1
Na与Si均为第三周期元素,NaCl熔点明显高于SiCl4,原因是 。分析同族元素的氯化物SiCl4、GeCl4、SnCl4熔点变化趋势及其原因 。
7.[2022全国乙,35(3)]卤化物CsICl2受热发生非氧化还原反应,生成无色晶体X和红棕色液体Y。X为 。解释X的熔点比Y高的原因 。
考点3 均摊法的应用
8.(2024湖北,11)黄金按质量分数分级,纯金为24K。Au-Cu合金的三种晶胞结构如图,Ⅰ、Ⅱ和Ⅲ是立方晶胞。下列说法错误的是( )
A.Ⅰ为18K金
B.Ⅱ中Au的配位数是12
C.Ⅲ中最小核间距Au—CuD.Ⅰ、Ⅱ、Ⅲ中,Au与Cu原子个数比依次为1∶1、1∶3、3∶1
9.(2024黑吉辽,14)某锂离子电池电极材料结构如图。结构1是钴硫化物晶胞的一部分,可代表其组成和结构;晶胞2是充电后的晶胞结构;所有晶胞均为立方晶胞。下列说法错误的是 ( )
A.结构1钴硫化物的化学式为Co9S8
B.晶胞2中S与S的最短距离为a
C.晶胞2中距Li最近的S有4个
D.晶胞2和晶胞3表示同一晶体
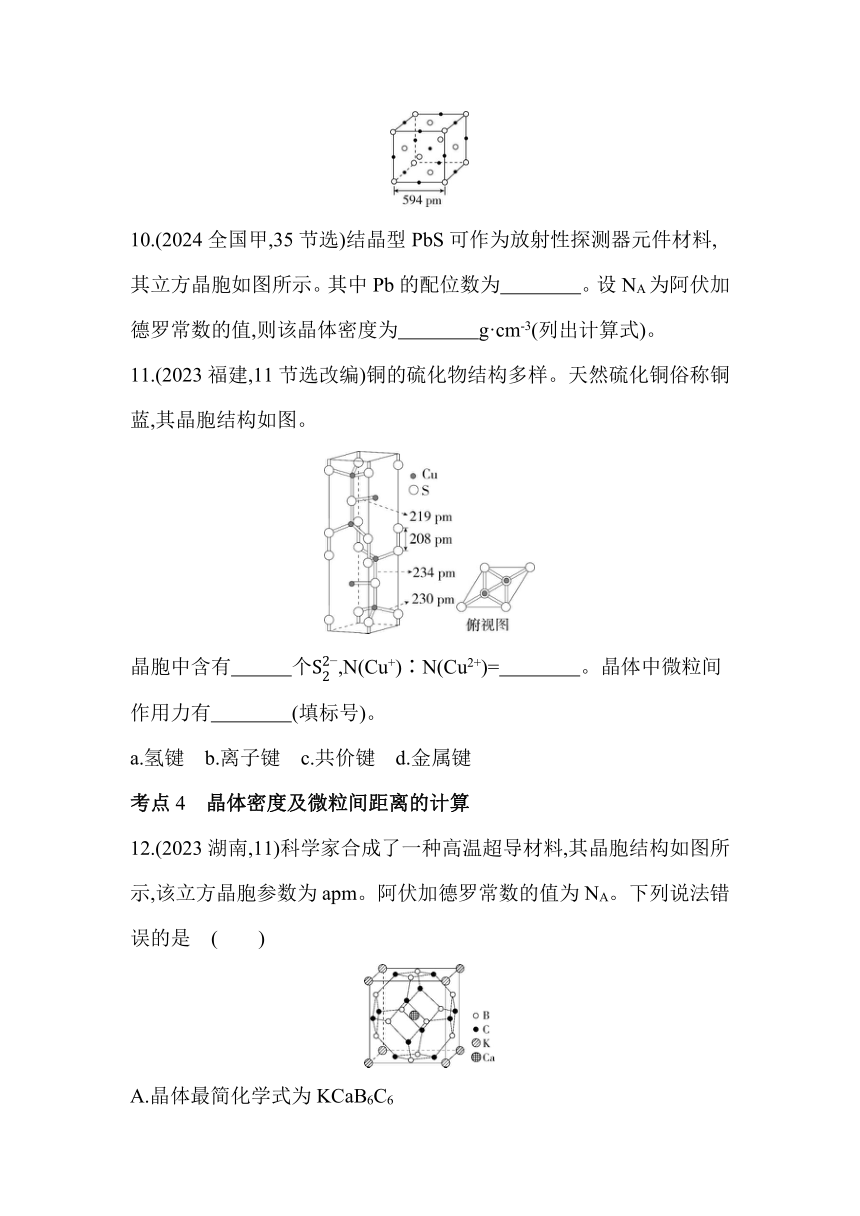
10.(2024全国甲,35节选)结晶型PbS可作为放射性探测器元件材料,其立方晶胞如图所示。其中Pb的配位数为 。设NA为阿伏加德罗常数的值,则该晶体密度为 g·cm-3(列出计算式)。
11.(2023福建,11节选改编)铜的硫化物结构多样。天然硫化铜俗称铜蓝,其晶胞结构如图。
晶胞中含有 个,N(Cu+)∶N(Cu2+)= 。晶体中微粒间作用力有 (填标号)。
a.氢键 b.离子键 c.共价键 d.金属键
考点4 晶体密度及微粒间距离的计算
12.(2023湖南,11)科学家合成了一种高温超导材料,其晶胞结构如图所示,该立方晶胞参数为apm。阿伏加德罗常数的值为NA。下列说法错误的是 ( )
A.晶体最简化学式为KCaB6C6
B.晶体中与K+最近且距离相等的Ca2+有8个
C.晶胞中B和C原子构成的多面体有12个面
D.晶体的密度为g·cm-3
13.(2023辽宁,14)晶体结构的缺陷美与对称美同样受关注。某富锂超离子导体的晶胞是立方体(图1),进行镁离子取代及卤素共掺杂后,可获得高性能固体电解质材料(图2)。下列说法错误的是( )
A.图1晶体密度为72.5/(NA×a3×10-30)g·cm-3
B.图1中O原子的配位数为6
C.图2表示的化学式为LiMg2OClxBr1-x
D.Mg2+取代产生的空位有利于Li+传导
14.(2023河北,11)锆(Zr)是重要的战略金属,可从其氧化物中提取。下图是某种锆的氧化物晶体的立方晶胞,NA为阿伏加德罗常数的值。下列说法错误的是( )
A.该氧化物的化学式为ZrO2
B.该氧化物的密度为g·cm-3
C.Zr原子之间的最短距离为apm
D.若坐标取向不变,将p点Zr原子平移至原点,则q点Zr原子位于晶胞xy面的面心
15.(2023全国乙,35节选)(3)一种硼镁化合物具有超导性能,晶体结构属于六方晶系,其晶体结构、晶胞沿c轴的投影图如下所示,晶胞中含有 个Mg。该物质化学式为 ,B-B最近距离为 。
16.(2023全国甲,35节选)AlF3的熔点为1090℃,远高于AlCl3的192℃,由此可以判断铝氟之间的化学键为 键。AlF3结构属立方晶系,晶胞如图所示,F-的配位数为 。若晶胞参数为apm,晶体密度ρ= g·cm-3(列出计算式,阿伏加德罗常数的值为NA)。
17.[2022全国甲,35(5)]萤石(CaF2)是自然界中常见的含氟矿物,其晶胞结构如图所示,X代表的离子是 ;若该立方晶胞参数为apm,正负离子的核间距最小为 pm。
高考模拟练
应用实践
1.我国科学家首次合成了化合物[K(2,2,2-crypt)]5[K@Au12Sb20]。其阴离子[K@Au12Sb20]5-为全金属富勒烯(结构如图),具有与富勒烯C60相似的高对称性。 下列说法错误的是( )
A.富勒烯C60是分子晶体
B.图示中的K+位于Au形成的二十面体笼内
C.全金属富勒烯和富勒烯C60互为同素异形体
D.锑(Sb)位于第五周期第ⅤA族,则其基态原子价层电子排布式是5s25p3
2.磷及其化合物在电池、催化等领域有重要应用。黑磷与石墨类似,也具有层状结构(如图1)。为大幅度提高锂电池的充电速率,科学家最近研发了黑磷—石墨复合材料,其单层结构俯视图如图2所示。
下列说法正确的是( )
A.黑磷中P—P键的键能完全相等
B.黑磷与石墨都属于混合型晶体
C.由石墨与黑磷制备该复合材料的过程,没有发生化学反应
D.复合材料单层中,P原子与C原子之间的作用力属范德华力
3.某水性钠离子电池电极材料由Na+、Fe2+、Fe3+、CN-组成,其立方晶胞嵌入和嵌出Na+过程中,Fe2+与Fe3+含量发生变化,物质颜色依次为格林绿、普鲁士蓝、普鲁士白,其过程如图所示。下列说法错误的是( )
A.普鲁士蓝中Fe2+与Fe3+个数比为1∶2
B.格林绿晶体中Fe3+周围等距且最近的Fe3+数为6
C.基态Fe原子的价电子排布式为3d64s2,失去4s电子转化为Fe2+
D.若普鲁士白的晶胞棱长为apm,则其晶体的密度为×1030g·cm-3
4.氢能作为一种新型的能量密度高的绿色能源,正引起世界各国的重视。储存技术是氢能利用的关键,储氢材料是当今研究的重点课题之一,金属镍与镧(La)形成的合金是一种良好的储氢材料。
(1)Ni原子的核外电子排布式为 。
(2)NiO、FeO、MgO的晶体结构类型均与氯化钠相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点:NiO (填“<”或“>”)FeO;某同学画出的MgO晶胞结构示意图如图所示,请改正图中的错误: 。
(3)NiO晶胞中Ni和O的配位数分别为 、 。
(4)金属镍与镧(La)形成的晶体的晶胞结构示意图如图所示。该合金的化学式为 。
迁移创新
5.Ⅰ.氮化镓(GaN)、碳化硅(SiC)材料是最成熟的第三代半导体的代表,GaN通常以GaCl3为镓源,NH3为氮源制备,具有出色的抗击穿能力,能耐受更高的电子密度。
(1)请写出基态Ga原子的核外电子排布式: 。Ga、N和O的第一电离能由小到大的顺序为 。
(2)GaCl3的熔点为77.9℃,GaCl3(g)在270℃左右以二聚物存在,GaF3的熔点为1000℃,GaCl3的熔点低于GaF3的原因为 。
(3)GaN可采用金属有机物化学气相淀积技术制得,以合成的Ga(CH3)3为原料,使其与NH3发生系列反应得到GaN和另一种产物,该过程的化学方程式为 。
(4)氮化镓的晶胞如图所示,Ga原子与N原子半径分别为apm和bpm,阿伏加德罗常数的值为NA,晶体密度为cg/cm3,则该晶胞的空间利用率为 (已知空间利用率为晶胞内原子体积占晶胞体积的百分数)。
Ⅱ.(5)与镓处于同一主族的B具有缺电子性。四硼酸钠的化学式为Na2B4O7·10H2O,实际上该离子晶体中存在由两个H3BO3和两个[B(OH)4]-缩合而成的双六元环,该物质的化学式写成Na2[B4O5(OH)4]·8H2O比较合理,[B4O5(OH)4]2-的结构如图所示,则该离子中存在的作用力有 (填标号)。
A.离子键
B.极性键
C.氢键
D.范德华力
E.配位键
答案与分层梯度式解析
综合拔高练
高考真题练
1.答案 bd
解析 CaC2的电子式为Ca2+[×·C……C×·]2-,存在离子键和非极性共价键,不存在极性共价键和配位键,故选b、d。
2.答案 11∶3
解析 由富马酸的结构模型可知,白球代表H原子、黑球代表O原子、灰球代表C原子,故其结构式为,σ键与π键的数目比为11∶3。
3.答案 2 2
解析 CO2的结构式为OCO,故1个CO2分子中含有2个σ键和2个π键。
4.B 石墨中的碳原子为sp2杂化,平面内存在大π键,导电性强,插入F后,碳原子为sp3杂化,层状结构改变,且破坏了大π键,导电性减弱,A错误;相比石墨中的大π键,(CF)x中C原子只形成σ键,键能更大,更难与O2反应,B正确;碳原子的半径大于氟原子的半径,因此C—C的键长比C—F长,C错误;每个碳原子与3个碳原子和1个氟原子相连,则1mol(CF)x中含有xmolC—F与xmolC—C,共含有xmol共价单键,D错误。
5.答案 (1)SnF4为离子晶体,SnCl4、SnBr4、SnI4均为分子晶体,一般离子晶体的熔点大于分子晶体;对于组成和结构相似的分子晶体,相对分子质量越大,范德华力越大,熔点越高
(2)MnO2 降低 A
解析 (2)由晶胞图和投影图知Mn位于顶点和体心,其个数为8×+1=2,O位于面上和体内,其个数为4×+2=4,则该氧化物化学式为MnO2。根据化合物中各元素正、负化合价的代数和为0,脱氧时,锰元素化合价降低。主族元素Ca的金属性强,CaO难以脱氧,所以不能产生O空位。
6.答案 (2)NaCl为离子晶体,SiCl4为分子晶体,离子键比分子间作用力强 SiCl4、GeCl4、SnCl4的相对分子质量依次增大,分子间作用力依次增强,则熔点依次升高
解析 (2)NaCl为离子晶体,SiCl4为分子晶体,离子晶体熔化时克服离子键,分子晶体熔化时克服分子间作用力,离子键比分子间作用力强;SiCl4、GeCl4、SnCl4都是分子晶体,相对分子质量SnCl4>GeCl4>SiCl4,相对分子质量越大,分子间作用力越强,熔点越高。
7.答案 CsCl CsCl是离子晶体,熔化时需要克服Cs+和Cl-之间的离子键,而ICl是分子晶体,熔化时只需要克服范德华力
解析 由CsICl2受热发生非氧化还原反应知,CsICl2受热分解生成CsCl和ICl,故无色晶体X为CsCl,红棕色液体Y为ICl;由于CsCl是离子晶体,熔化时需要克服Cs+和Cl-之间的离子键,而ICl是分子晶体,熔化时只需要克服范德华力,离子键比范德华力强得多,故CsCl的熔点高于ICl。
8.C 24K金的质量分数为100%,则18K金的质量分数为×100%=75%;Ⅰ中,Au位于体心,个数为1,Cu位于顶点,个数为8×=1,Ⅰ中Au与Cu的个数比为1∶1,其中Au的质量分数为×100%≈75%,故Ⅰ为18K金,A正确。Ⅱ中,与Au距离最近且相等的Cu位于相邻面心上,个数为3×8×=12,故Au的配位数为12,B正确。Ⅲ中Au—Cu的最小核间距为面对角线长度的,Au—Au的最小核间距也为面对角线长度的,故最小核间距Au—Cu=Au—Au,C错误。由A项分析可知,Ⅰ中Au与Cu的个数比为1∶1;Ⅱ中Au位于顶点,个数为8×=1,Cu位于面心,个数为6×=3,Au与Cu的个数比为1∶3;Ⅲ中Cu位于顶点,个数为8×=1,Au位于面心,个数为6×=3,Au与Cu的个数比为3∶1,D正确。
9.B 根据均摊法,结构1中S的个数为12×+1=4,Co的个数为4×+4=4.5,则结构1钴硫化物的化学式为Co9S8,A正确;晶胞2中S与S的最短距离为面对角线长度的一半,为a,B错误;晶胞2中Li的个数为8,S的个数为12×+1=4,化学式为Li2S,距S最近的Li的个数为8,则距Li最近的S的个数为4,C正确;将晶胞2的体心放置在面心可以得到晶胞3,故晶胞2和晶胞3表示同一晶体,D正确。
10.答案 6
解析 由题给晶胞图可知,晶胞中含有Pb、S的个数均为4,晶体的密度为g·cm-3。
11.答案 2 2∶1 bc
解析 由题图可知,S原子位于棱上和体内,其中位于棱上的为,晶胞中含有=2,位于体内的为S2-,个数为2,Cu个数为6;设其中Cu+为x个,则Cu2+为6-x个,化合物中正、负化合价代数和为0,则(-2)×2+(-2)×2+x+(6-x)×2=0,解得x=4,则N(Cu+)∶N(Cu2+)=2∶1;晶体中微粒间作用力有离子键及共价键。
12.C 1个晶胞中的K原子数为8×=1,Ca原子数为1,B原子数为12×=6,C原子数为12×=6,故晶体最简化学式为KCaB6C6,A项正确;K+位于顶点,Ca2+位于体心,与K+最近且距离相等的Ca2+位于共用1个顶点的8个立方晶胞的体心,B项正确;晶胞中B和C原子构成的多面体有14个面,6个位于晶胞的面上,8个位于晶胞内部,垂直于体对角线,C项错误;由A项分析可知1个晶胞中有1个“KCaB6C6”,晶胞的体积为(a×10-10)3cm3,质量为(×1)g,晶体密度为g·cm-3,即g·cm-3,D项正确。
13.C 根据均摊法计算,图1晶胞中含有1个Cl,1个O,3个Li,密度ρ=g·cm-3=g·cm-3,A项正确;图1中与氧原子距离最近(pm)的Li有6个,则O原子的配位数为6,B项正确;根据均摊法计算,图2晶胞中含有1个Li,Mg或空位共2个,1个O,Cl或Br共1个,根据化合物中各元素正负化合价代数和为0,得Mg有1个,所以化学式为LiMgOClxBr1-x,C项错误;Mg2+取代Li+后,产生的空位可供Li+移动传导电荷,增强导电性,D项正确。
方法点津 求晶体密度时,一般先确定该晶胞中所含各微粒数,再计算晶体密度。易错点是单位换算,注意晶胞的棱长一般是以pm或nm为单位,但是密度的单位一般是g·cm-3,需要转换单位。
14.B 根据“均摊法”,晶胞中含8×+1=8个O,4个Zr,则该锆的氧化物的化学式为ZrO2,A正确;晶体密度为g·cm-3=g·cm-3,B错误;Zr原子之间的最短距离为面对角线长的一半,即apm,C正确;根据题图中所示坐标系,假设p点坐标为(),则q点坐标为(),若将p点Zr原子平移至原点,晶胞中各点坐标均由(x,y,z)变为(x-),则q点坐标变为(,0),即q点Zr原子位于晶胞xy面的面心,D正确。
15.答案 (3)1 MgB2 a
解析 (3)根据均摊法,结合晶胞沿c轴的投影可知,1个晶胞中,Mg原子数为4×=1;B原子数为2,则化学式为MgB2;B-B最近距离为投影图中两个正三角形中心的距离,
在投影图中作辅助线,如图所示,d=a,B-B最近距离为a。
16.答案 离子 2
解析 AlCl3的熔点(192℃)较低,为分子晶体,AlF3的熔点(1090℃)较高,为离子晶体,故铝氟之间的化学键为离子键。由题图可知,1个该晶胞中顶点处粒子的数目为8×=1,棱心处粒子的数目为12×=3,故顶点处粒子为Al3+,棱心处粒子为F-,F-最邻近的Al3+的数目为2,故F-的配位数为2。晶胞质量m=g,晶胞体积V=(a×10-10)3cm3,晶体密度ρ=g·cm-3。
17.答案 Ca2+ a
解析 X离子位于顶点和面心,根据均摊法知,X离子数目为8×=4,Y离子位于体内,故Y离子数目为8,结合CaF2的化学式知,X代表的离子是Ca2+;根据晶胞结构图知,Ca2+与F-的最小核间距为立方体体对角线长度的,即正负离子的核间距最小为apm。
高考模拟练
1.C 富勒烯是由C60分子构成的,属于分子晶体,A正确;由题图知,K+位于体心,Au可形成二十面体笼,K+位于该二十面体笼内,B正确;同素异形体是指由同种元素形成的性质不同的单质,但全金属富勒烯是一种阴离子,C错误;锑与氮属于同主族元素,锑位于第五周期第ⅤA族,其基态原子价层电子排布式为5s25p3,D正确。
2.B 黑磷中P—P键的键长不完全相等,则黑磷中P—P键的键能不完全相同,A错误;黑磷与石墨都属于混合型晶体,B正确;由石墨与黑磷制备该复合材料的过程,有P—P键和C—C键的断裂及P—C键的形成,则发生了化学反应,C错误;复合材料单层中,P原子与C原子之间的作用力属共价键,D错误。
3.A 根据均摊法,普鲁士蓝晶胞中含Fe数为8×+1=8、CN-数为24×+6=24、Na+数为4,根据化合物中各元素化合价代数和等于0,可知Fe2+与Fe3+个数比为1∶1,故A错误;根据晶胞图,格林绿晶体中Fe3+周围等距且最近的Fe3+个数为6,故B正确;Fe是26号元素,基态Fe原子的价电子排布式为3d64s2,失去4s电子转化为Fe2+,故C正确;根据均摊法,普鲁士白晶胞中含Fe的数目为8×+1=8,含CN-的个数为24×+6=24,含Na+的个数为8,若普鲁士白的晶胞棱长为apm,则其晶体的密度为g·cm-3=×1030g·cm-3,故D正确。
4.答案 (1)1s22s22p63s23p63d84s2或[Ar]3d84s2
(2)> 8处应为灰色球(或8处应为Mg2+)
(3)6 6
(4)LaNi5
解析 (1)Ni是28号元素,核外电子排布式为1s22s22p63s23p63d84s2或[Ar]3d84s2。(2)其他因素相同时,离子半径越大,离子晶体熔点越低。(3)由信息可知NiO与氯化钠的晶胞结构相似,所以Ni和O的配位数均为6。(4)La原子在8个顶点上,所以晶胞单独占有的La原子数为1;Ni原子有4个位于前、后、左、右四个面的面心,有1个位于体心,有4个在上、下两个面上,所以晶胞单独占有的Ni原子数为(4+4)×+1=5,La与Ni的原子个数之比为1∶5,则化学式为LaNi5。
5.答案 Ⅰ.(1)[Ar]3d104s24p1 Ga(2)GaCl3为分子晶体,熔化时破坏分子间作用力,GaF3为离子晶体,熔化时破坏离子键,离子键强于分子间作用力
(3)Ga(CH3)3+NH3GaN+3CH4
(4)×100%
Ⅱ.(5)BE
解析 Ⅰ.(1)Ga是31号元素,其核外电子排布式为[Ar]3d104s24p1。同主族从上到下元素的第一电离能逐渐减小,同周期从左到右主族元素的第一电离能呈增大趋势,但第ⅡA族和第ⅤA族元素的第一电离能大于同周期相邻元素,即第一电离能:GaⅡ.(5)根据的结构可知[B4O5(OH)4]2-中存在的作用力有极性共价键和配位键,应选BE。
高考真题练
考点1 共价键的类型及数目判断
1.(2024全国甲,35节选)CaC2俗称电石,该化合物中不存在的化学键类型为 (填标号)。
a.离子键 b.极性共价键
c.非极性共价键 d.配位键
2.[2022湖南,18(2)①]富马酸亚铁(FeC4H2O4)是一种补铁剂。富马酸分子的结构模型如图所示:
富马酸分子中σ键与π键的数目比为 。
3.[2021全国甲,35(2)]CO2分子中存在 个σ键和 个π键。
考点2 各种晶体的结构与性质
4.(2023山东,5)石墨与F2在450℃反应,石墨层间插入F得到层状结构化合物(CF)x,该物质仍具润滑性,其单层局部结构如图所示。下列关于该化合物的说法正确的是( )
A.与石墨相比,(CF)x导电性增强
B.与石墨相比,(CF)x抗氧化性增强
C.(CF)x中C—C的键长比C—F短
D.1mol(CF)x中含有2xmol共价单键
5.(1)(2024全国甲,35节选)早在青铜器时代,人类就认识了锡。锡的卤化物熔点数据如下表,结合变化规律说明原因: 。
物质 SnF4 SnCl4 SnBr4 SnI4
熔点/℃ 442 -34 29 143
(2)(2024山东,16节选)Mn的某种氧化物MnOx的四方晶胞及其在xy平面的投影如图所示,该氧化物化学式为 。
当MnOx晶体有O原子脱出时,出现O空位,Mn的化合价 (填“升高”“降低”或“不变”),O空位的产生使晶体具有半导体性质。下列氧化物晶体难以通过该方式获有半导体性质的是 (填标号)。
A.CaO B.V2O5 C.Fe2O3 D.CuO
6.(2023全国乙,35节选)(2)已知一些物质的熔点数据如下表:
物质 NaCl SiCl4 GeCl4 SnCl4
熔点/℃ 800.7 -68.8 -51.5 -34.1
Na与Si均为第三周期元素,NaCl熔点明显高于SiCl4,原因是 。分析同族元素的氯化物SiCl4、GeCl4、SnCl4熔点变化趋势及其原因 。
7.[2022全国乙,35(3)]卤化物CsICl2受热发生非氧化还原反应,生成无色晶体X和红棕色液体Y。X为 。解释X的熔点比Y高的原因 。
考点3 均摊法的应用
8.(2024湖北,11)黄金按质量分数分级,纯金为24K。Au-Cu合金的三种晶胞结构如图,Ⅰ、Ⅱ和Ⅲ是立方晶胞。下列说法错误的是( )
A.Ⅰ为18K金
B.Ⅱ中Au的配位数是12
C.Ⅲ中最小核间距Au—Cu
9.(2024黑吉辽,14)某锂离子电池电极材料结构如图。结构1是钴硫化物晶胞的一部分,可代表其组成和结构;晶胞2是充电后的晶胞结构;所有晶胞均为立方晶胞。下列说法错误的是 ( )
A.结构1钴硫化物的化学式为Co9S8
B.晶胞2中S与S的最短距离为a
C.晶胞2中距Li最近的S有4个
D.晶胞2和晶胞3表示同一晶体
10.(2024全国甲,35节选)结晶型PbS可作为放射性探测器元件材料,其立方晶胞如图所示。其中Pb的配位数为 。设NA为阿伏加德罗常数的值,则该晶体密度为 g·cm-3(列出计算式)。
11.(2023福建,11节选改编)铜的硫化物结构多样。天然硫化铜俗称铜蓝,其晶胞结构如图。
晶胞中含有 个,N(Cu+)∶N(Cu2+)= 。晶体中微粒间作用力有 (填标号)。
a.氢键 b.离子键 c.共价键 d.金属键
考点4 晶体密度及微粒间距离的计算
12.(2023湖南,11)科学家合成了一种高温超导材料,其晶胞结构如图所示,该立方晶胞参数为apm。阿伏加德罗常数的值为NA。下列说法错误的是 ( )
A.晶体最简化学式为KCaB6C6
B.晶体中与K+最近且距离相等的Ca2+有8个
C.晶胞中B和C原子构成的多面体有12个面
D.晶体的密度为g·cm-3
13.(2023辽宁,14)晶体结构的缺陷美与对称美同样受关注。某富锂超离子导体的晶胞是立方体(图1),进行镁离子取代及卤素共掺杂后,可获得高性能固体电解质材料(图2)。下列说法错误的是( )
A.图1晶体密度为72.5/(NA×a3×10-30)g·cm-3
B.图1中O原子的配位数为6
C.图2表示的化学式为LiMg2OClxBr1-x
D.Mg2+取代产生的空位有利于Li+传导
14.(2023河北,11)锆(Zr)是重要的战略金属,可从其氧化物中提取。下图是某种锆的氧化物晶体的立方晶胞,NA为阿伏加德罗常数的值。下列说法错误的是( )
A.该氧化物的化学式为ZrO2
B.该氧化物的密度为g·cm-3
C.Zr原子之间的最短距离为apm
D.若坐标取向不变,将p点Zr原子平移至原点,则q点Zr原子位于晶胞xy面的面心
15.(2023全国乙,35节选)(3)一种硼镁化合物具有超导性能,晶体结构属于六方晶系,其晶体结构、晶胞沿c轴的投影图如下所示,晶胞中含有 个Mg。该物质化学式为 ,B-B最近距离为 。
16.(2023全国甲,35节选)AlF3的熔点为1090℃,远高于AlCl3的192℃,由此可以判断铝氟之间的化学键为 键。AlF3结构属立方晶系,晶胞如图所示,F-的配位数为 。若晶胞参数为apm,晶体密度ρ= g·cm-3(列出计算式,阿伏加德罗常数的值为NA)。
17.[2022全国甲,35(5)]萤石(CaF2)是自然界中常见的含氟矿物,其晶胞结构如图所示,X代表的离子是 ;若该立方晶胞参数为apm,正负离子的核间距最小为 pm。
高考模拟练
应用实践
1.我国科学家首次合成了化合物[K(2,2,2-crypt)]5[K@Au12Sb20]。其阴离子[K@Au12Sb20]5-为全金属富勒烯(结构如图),具有与富勒烯C60相似的高对称性。 下列说法错误的是( )
A.富勒烯C60是分子晶体
B.图示中的K+位于Au形成的二十面体笼内
C.全金属富勒烯和富勒烯C60互为同素异形体
D.锑(Sb)位于第五周期第ⅤA族,则其基态原子价层电子排布式是5s25p3
2.磷及其化合物在电池、催化等领域有重要应用。黑磷与石墨类似,也具有层状结构(如图1)。为大幅度提高锂电池的充电速率,科学家最近研发了黑磷—石墨复合材料,其单层结构俯视图如图2所示。
下列说法正确的是( )
A.黑磷中P—P键的键能完全相等
B.黑磷与石墨都属于混合型晶体
C.由石墨与黑磷制备该复合材料的过程,没有发生化学反应
D.复合材料单层中,P原子与C原子之间的作用力属范德华力
3.某水性钠离子电池电极材料由Na+、Fe2+、Fe3+、CN-组成,其立方晶胞嵌入和嵌出Na+过程中,Fe2+与Fe3+含量发生变化,物质颜色依次为格林绿、普鲁士蓝、普鲁士白,其过程如图所示。下列说法错误的是( )
A.普鲁士蓝中Fe2+与Fe3+个数比为1∶2
B.格林绿晶体中Fe3+周围等距且最近的Fe3+数为6
C.基态Fe原子的价电子排布式为3d64s2,失去4s电子转化为Fe2+
D.若普鲁士白的晶胞棱长为apm,则其晶体的密度为×1030g·cm-3
4.氢能作为一种新型的能量密度高的绿色能源,正引起世界各国的重视。储存技术是氢能利用的关键,储氢材料是当今研究的重点课题之一,金属镍与镧(La)形成的合金是一种良好的储氢材料。
(1)Ni原子的核外电子排布式为 。
(2)NiO、FeO、MgO的晶体结构类型均与氯化钠相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点:NiO (填“<”或“>”)FeO;某同学画出的MgO晶胞结构示意图如图所示,请改正图中的错误: 。
(3)NiO晶胞中Ni和O的配位数分别为 、 。
(4)金属镍与镧(La)形成的晶体的晶胞结构示意图如图所示。该合金的化学式为 。
迁移创新
5.Ⅰ.氮化镓(GaN)、碳化硅(SiC)材料是最成熟的第三代半导体的代表,GaN通常以GaCl3为镓源,NH3为氮源制备,具有出色的抗击穿能力,能耐受更高的电子密度。
(1)请写出基态Ga原子的核外电子排布式: 。Ga、N和O的第一电离能由小到大的顺序为 。
(2)GaCl3的熔点为77.9℃,GaCl3(g)在270℃左右以二聚物存在,GaF3的熔点为1000℃,GaCl3的熔点低于GaF3的原因为 。
(3)GaN可采用金属有机物化学气相淀积技术制得,以合成的Ga(CH3)3为原料,使其与NH3发生系列反应得到GaN和另一种产物,该过程的化学方程式为 。
(4)氮化镓的晶胞如图所示,Ga原子与N原子半径分别为apm和bpm,阿伏加德罗常数的值为NA,晶体密度为cg/cm3,则该晶胞的空间利用率为 (已知空间利用率为晶胞内原子体积占晶胞体积的百分数)。
Ⅱ.(5)与镓处于同一主族的B具有缺电子性。四硼酸钠的化学式为Na2B4O7·10H2O,实际上该离子晶体中存在由两个H3BO3和两个[B(OH)4]-缩合而成的双六元环,该物质的化学式写成Na2[B4O5(OH)4]·8H2O比较合理,[B4O5(OH)4]2-的结构如图所示,则该离子中存在的作用力有 (填标号)。
A.离子键
B.极性键
C.氢键
D.范德华力
E.配位键
答案与分层梯度式解析
综合拔高练
高考真题练
1.答案 bd
解析 CaC2的电子式为Ca2+[×·C……C×·]2-,存在离子键和非极性共价键,不存在极性共价键和配位键,故选b、d。
2.答案 11∶3
解析 由富马酸的结构模型可知,白球代表H原子、黑球代表O原子、灰球代表C原子,故其结构式为,σ键与π键的数目比为11∶3。
3.答案 2 2
解析 CO2的结构式为OCO,故1个CO2分子中含有2个σ键和2个π键。
4.B 石墨中的碳原子为sp2杂化,平面内存在大π键,导电性强,插入F后,碳原子为sp3杂化,层状结构改变,且破坏了大π键,导电性减弱,A错误;相比石墨中的大π键,(CF)x中C原子只形成σ键,键能更大,更难与O2反应,B正确;碳原子的半径大于氟原子的半径,因此C—C的键长比C—F长,C错误;每个碳原子与3个碳原子和1个氟原子相连,则1mol(CF)x中含有xmolC—F与xmolC—C,共含有xmol共价单键,D错误。
5.答案 (1)SnF4为离子晶体,SnCl4、SnBr4、SnI4均为分子晶体,一般离子晶体的熔点大于分子晶体;对于组成和结构相似的分子晶体,相对分子质量越大,范德华力越大,熔点越高
(2)MnO2 降低 A
解析 (2)由晶胞图和投影图知Mn位于顶点和体心,其个数为8×+1=2,O位于面上和体内,其个数为4×+2=4,则该氧化物化学式为MnO2。根据化合物中各元素正、负化合价的代数和为0,脱氧时,锰元素化合价降低。主族元素Ca的金属性强,CaO难以脱氧,所以不能产生O空位。
6.答案 (2)NaCl为离子晶体,SiCl4为分子晶体,离子键比分子间作用力强 SiCl4、GeCl4、SnCl4的相对分子质量依次增大,分子间作用力依次增强,则熔点依次升高
解析 (2)NaCl为离子晶体,SiCl4为分子晶体,离子晶体熔化时克服离子键,分子晶体熔化时克服分子间作用力,离子键比分子间作用力强;SiCl4、GeCl4、SnCl4都是分子晶体,相对分子质量SnCl4>GeCl4>SiCl4,相对分子质量越大,分子间作用力越强,熔点越高。
7.答案 CsCl CsCl是离子晶体,熔化时需要克服Cs+和Cl-之间的离子键,而ICl是分子晶体,熔化时只需要克服范德华力
解析 由CsICl2受热发生非氧化还原反应知,CsICl2受热分解生成CsCl和ICl,故无色晶体X为CsCl,红棕色液体Y为ICl;由于CsCl是离子晶体,熔化时需要克服Cs+和Cl-之间的离子键,而ICl是分子晶体,熔化时只需要克服范德华力,离子键比范德华力强得多,故CsCl的熔点高于ICl。
8.C 24K金的质量分数为100%,则18K金的质量分数为×100%=75%;Ⅰ中,Au位于体心,个数为1,Cu位于顶点,个数为8×=1,Ⅰ中Au与Cu的个数比为1∶1,其中Au的质量分数为×100%≈75%,故Ⅰ为18K金,A正确。Ⅱ中,与Au距离最近且相等的Cu位于相邻面心上,个数为3×8×=12,故Au的配位数为12,B正确。Ⅲ中Au—Cu的最小核间距为面对角线长度的,Au—Au的最小核间距也为面对角线长度的,故最小核间距Au—Cu=Au—Au,C错误。由A项分析可知,Ⅰ中Au与Cu的个数比为1∶1;Ⅱ中Au位于顶点,个数为8×=1,Cu位于面心,个数为6×=3,Au与Cu的个数比为1∶3;Ⅲ中Cu位于顶点,个数为8×=1,Au位于面心,个数为6×=3,Au与Cu的个数比为3∶1,D正确。
9.B 根据均摊法,结构1中S的个数为12×+1=4,Co的个数为4×+4=4.5,则结构1钴硫化物的化学式为Co9S8,A正确;晶胞2中S与S的最短距离为面对角线长度的一半,为a,B错误;晶胞2中Li的个数为8,S的个数为12×+1=4,化学式为Li2S,距S最近的Li的个数为8,则距Li最近的S的个数为4,C正确;将晶胞2的体心放置在面心可以得到晶胞3,故晶胞2和晶胞3表示同一晶体,D正确。
10.答案 6
解析 由题给晶胞图可知,晶胞中含有Pb、S的个数均为4,晶体的密度为g·cm-3。
11.答案 2 2∶1 bc
解析 由题图可知,S原子位于棱上和体内,其中位于棱上的为,晶胞中含有=2,位于体内的为S2-,个数为2,Cu个数为6;设其中Cu+为x个,则Cu2+为6-x个,化合物中正、负化合价代数和为0,则(-2)×2+(-2)×2+x+(6-x)×2=0,解得x=4,则N(Cu+)∶N(Cu2+)=2∶1;晶体中微粒间作用力有离子键及共价键。
12.C 1个晶胞中的K原子数为8×=1,Ca原子数为1,B原子数为12×=6,C原子数为12×=6,故晶体最简化学式为KCaB6C6,A项正确;K+位于顶点,Ca2+位于体心,与K+最近且距离相等的Ca2+位于共用1个顶点的8个立方晶胞的体心,B项正确;晶胞中B和C原子构成的多面体有14个面,6个位于晶胞的面上,8个位于晶胞内部,垂直于体对角线,C项错误;由A项分析可知1个晶胞中有1个“KCaB6C6”,晶胞的体积为(a×10-10)3cm3,质量为(×1)g,晶体密度为g·cm-3,即g·cm-3,D项正确。
13.C 根据均摊法计算,图1晶胞中含有1个Cl,1个O,3个Li,密度ρ=g·cm-3=g·cm-3,A项正确;图1中与氧原子距离最近(pm)的Li有6个,则O原子的配位数为6,B项正确;根据均摊法计算,图2晶胞中含有1个Li,Mg或空位共2个,1个O,Cl或Br共1个,根据化合物中各元素正负化合价代数和为0,得Mg有1个,所以化学式为LiMgOClxBr1-x,C项错误;Mg2+取代Li+后,产生的空位可供Li+移动传导电荷,增强导电性,D项正确。
方法点津 求晶体密度时,一般先确定该晶胞中所含各微粒数,再计算晶体密度。易错点是单位换算,注意晶胞的棱长一般是以pm或nm为单位,但是密度的单位一般是g·cm-3,需要转换单位。
14.B 根据“均摊法”,晶胞中含8×+1=8个O,4个Zr,则该锆的氧化物的化学式为ZrO2,A正确;晶体密度为g·cm-3=g·cm-3,B错误;Zr原子之间的最短距离为面对角线长的一半,即apm,C正确;根据题图中所示坐标系,假设p点坐标为(),则q点坐标为(),若将p点Zr原子平移至原点,晶胞中各点坐标均由(x,y,z)变为(x-),则q点坐标变为(,0),即q点Zr原子位于晶胞xy面的面心,D正确。
15.答案 (3)1 MgB2 a
解析 (3)根据均摊法,结合晶胞沿c轴的投影可知,1个晶胞中,Mg原子数为4×=1;B原子数为2,则化学式为MgB2;B-B最近距离为投影图中两个正三角形中心的距离,
在投影图中作辅助线,如图所示,d=a,B-B最近距离为a。
16.答案 离子 2
解析 AlCl3的熔点(192℃)较低,为分子晶体,AlF3的熔点(1090℃)较高,为离子晶体,故铝氟之间的化学键为离子键。由题图可知,1个该晶胞中顶点处粒子的数目为8×=1,棱心处粒子的数目为12×=3,故顶点处粒子为Al3+,棱心处粒子为F-,F-最邻近的Al3+的数目为2,故F-的配位数为2。晶胞质量m=g,晶胞体积V=(a×10-10)3cm3,晶体密度ρ=g·cm-3。
17.答案 Ca2+ a
解析 X离子位于顶点和面心,根据均摊法知,X离子数目为8×=4,Y离子位于体内,故Y离子数目为8,结合CaF2的化学式知,X代表的离子是Ca2+;根据晶胞结构图知,Ca2+与F-的最小核间距为立方体体对角线长度的,即正负离子的核间距最小为apm。
高考模拟练
1.C 富勒烯是由C60分子构成的,属于分子晶体,A正确;由题图知,K+位于体心,Au可形成二十面体笼,K+位于该二十面体笼内,B正确;同素异形体是指由同种元素形成的性质不同的单质,但全金属富勒烯是一种阴离子,C错误;锑与氮属于同主族元素,锑位于第五周期第ⅤA族,其基态原子价层电子排布式为5s25p3,D正确。
2.B 黑磷中P—P键的键长不完全相等,则黑磷中P—P键的键能不完全相同,A错误;黑磷与石墨都属于混合型晶体,B正确;由石墨与黑磷制备该复合材料的过程,有P—P键和C—C键的断裂及P—C键的形成,则发生了化学反应,C错误;复合材料单层中,P原子与C原子之间的作用力属共价键,D错误。
3.A 根据均摊法,普鲁士蓝晶胞中含Fe数为8×+1=8、CN-数为24×+6=24、Na+数为4,根据化合物中各元素化合价代数和等于0,可知Fe2+与Fe3+个数比为1∶1,故A错误;根据晶胞图,格林绿晶体中Fe3+周围等距且最近的Fe3+个数为6,故B正确;Fe是26号元素,基态Fe原子的价电子排布式为3d64s2,失去4s电子转化为Fe2+,故C正确;根据均摊法,普鲁士白晶胞中含Fe的数目为8×+1=8,含CN-的个数为24×+6=24,含Na+的个数为8,若普鲁士白的晶胞棱长为apm,则其晶体的密度为g·cm-3=×1030g·cm-3,故D正确。
4.答案 (1)1s22s22p63s23p63d84s2或[Ar]3d84s2
(2)> 8处应为灰色球(或8处应为Mg2+)
(3)6 6
(4)LaNi5
解析 (1)Ni是28号元素,核外电子排布式为1s22s22p63s23p63d84s2或[Ar]3d84s2。(2)其他因素相同时,离子半径越大,离子晶体熔点越低。(3)由信息可知NiO与氯化钠的晶胞结构相似,所以Ni和O的配位数均为6。(4)La原子在8个顶点上,所以晶胞单独占有的La原子数为1;Ni原子有4个位于前、后、左、右四个面的面心,有1个位于体心,有4个在上、下两个面上,所以晶胞单独占有的Ni原子数为(4+4)×+1=5,La与Ni的原子个数之比为1∶5,则化学式为LaNi5。
5.答案 Ⅰ.(1)[Ar]3d104s24p1 Ga
(3)Ga(CH3)3+NH3GaN+3CH4
(4)×100%
Ⅱ.(5)BE
解析 Ⅰ.(1)Ga是31号元素,其核外电子排布式为[Ar]3d104s24p1。同主族从上到下元素的第一电离能逐渐减小,同周期从左到右主族元素的第一电离能呈增大趋势,但第ⅡA族和第ⅤA族元素的第一电离能大于同周期相邻元素,即第一电离能:Ga
