第1章 化学反应与能量转化复习提升
文档属性
| 名称 | 第1章 化学反应与能量转化复习提升 |  | |
| 格式 | docx | ||
| 文件大小 | 274.4KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-14 10:04:43 | ||
图片预览


文档简介
本章复习提升
易混易错练
易错点1 比较焓变大小时忽视焓变的正、负号
1.下列各组热化学方程式中,化学反应的ΔH前者大于后者的是 ( )
A.C(s)+O2(g) CO2(g) ΔH1;C(s)+O2(g) CO(g) ΔH2
B.S(s)+O2(g) SO2(g) ΔH3;S(g)+O2(g) SO2(g) ΔH4
C.2H2(g)+O2(g) 2H2O(l) ΔH5;H2(g)+O2(g) H2O(l) ΔH6
D.2KOH(aq)+H2SO4(浓,aq) K2SO4(aq)+2H2O(l) ΔH7;2KOH(aq)+H2SO4(aq) K2SO4(aq)+2H2O(l) ΔH8
2.已知:
HCl(aq)+NaOH(aq) NaCl(aq)+H2O(l) ΔH1
CH3COOH(aq)+NaOH(aq) H2O(l)+CH3COONa(aq) ΔH2
H2SO4(aq)+Ba(OH)2(aq) BaSO4(s)+2H2O(l) ΔH3
则ΔH的大小顺序分别为 ( )
A.ΔH2>ΔH3>ΔH1 B.ΔH2<ΔH1<ΔH3
C.ΔH2>ΔH1>ΔH3 D.ΔH2<ΔH1<ΔH3
易错点2 不能正确理解电池的工作原理
3.金属钠可溶于水银形成合金“钠汞齐”(Na·nHg),利用这一性质可通过电解饱和食盐水得到金属钠,实验装置如图所示,洗气瓶中有白烟产生,下列说法不正确的是 ( )
A.A为电源正极,铁丝只起到导电的作用
B.生成钠的电极反应式为Na++e-+nHg Na·nHg
C.白烟产生的原因用化学方程式表示为8NH3+3Cl2 6NH4Cl+N2
D.设NA为阿伏加德罗常数的值,当外电路转移电子数为2NA时,过程中一定能生成2 mol Na
4.某AgNO3浓差电池的装置如图所示,该电池使用前先将K与M连接一段时间,K再与N连接,当正负电极室中溶液的浓度相等时,电池将停止放电。下列说法错误的是 ( )
A.K与M连接,当电路中转移0.1 mol电子时,乙室溶液质量减少17 g
B.K与N连接,甲室的电极反应式为Ag-e- Ag+
C.若换成阳离子交换膜,电池将不能正常使用
D.K分别与M、N连接时,N在电解质溶液中的移动方向相反
思想方法练
守恒思想突破电化学计算题
方法概述
电化学试题的特点是把考查的知识点以语言叙述或图像的形式呈现出来,由于两电极涉及的电极反应为离子反应和氧化还原反应,所以可以利用守恒法解决电化学计算问题。守恒法的特点是抓住有关变化的始态和终态,忽略中间过程,利用其中某种不变量建立关系式,从而简化思路,快速解题。守恒思想在电化学中的应用主要表现为得失电子守恒、电荷守恒、原子守恒等。
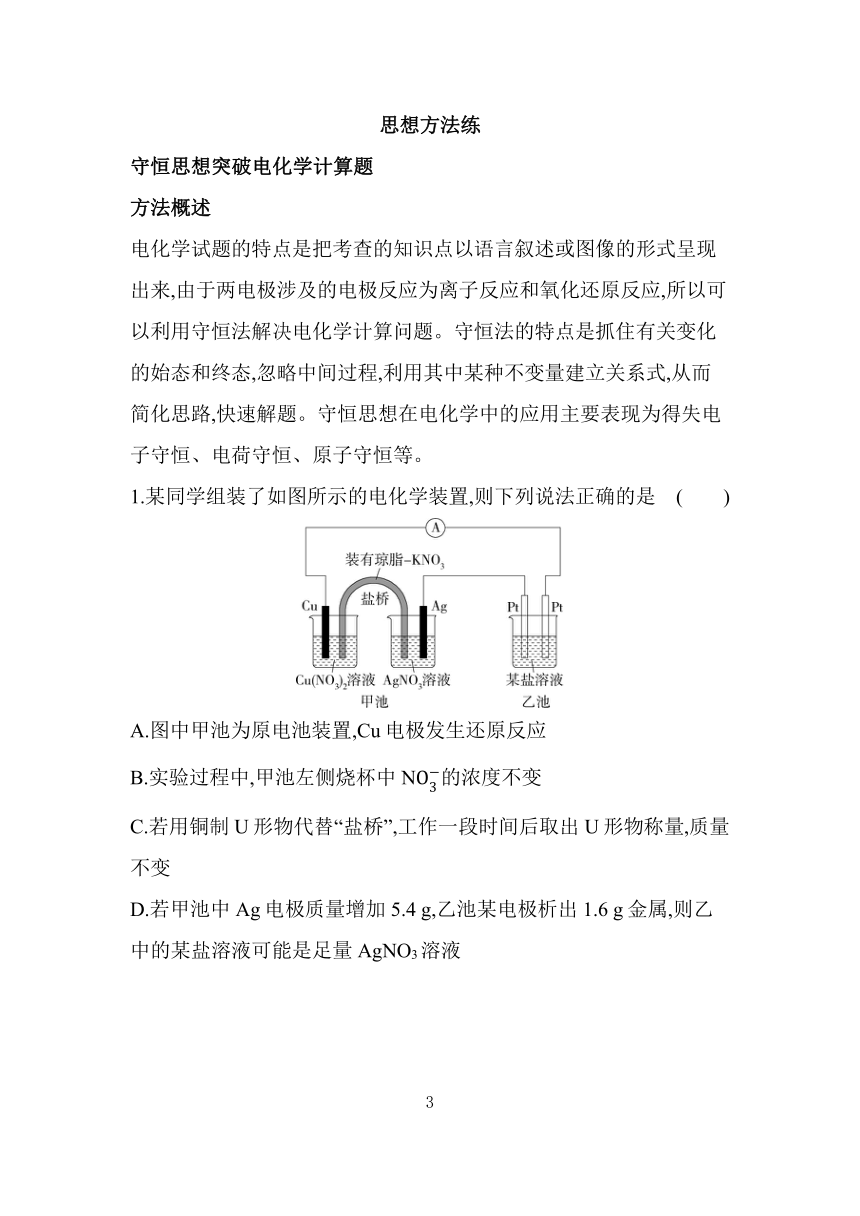
1.某同学组装了如图所示的电化学装置,则下列说法正确的是 ( )
A.图中甲池为原电池装置,Cu电极发生还原反应
B.实验过程中,甲池左侧烧杯中N的浓度不变
C.若用铜制U形物代替“盐桥”,工作一段时间后取出U形物称量,质量不变
D.若甲池中Ag电极质量增加5.4 g,乙池某电极析出1.6 g金属,则乙中的某盐溶液可能是足量AgNO3溶液
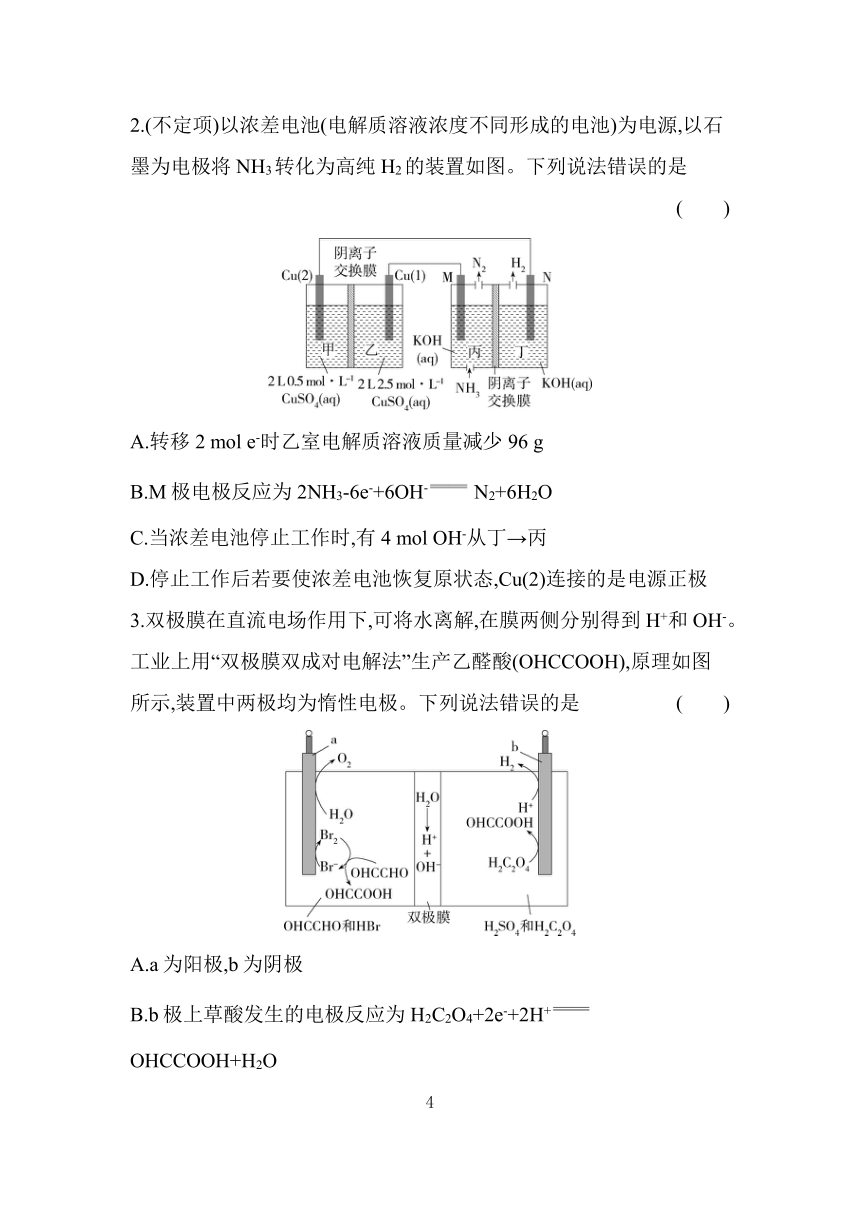
2.(不定项)以浓差电池(电解质溶液浓度不同形成的电池)为电源,以石墨为电极将NH3转化为高纯H2的装置如图。下列说法错误的是 ( )
A.转移2 mol e-时乙室电解质溶液质量减少96 g
B.M极电极反应为2NH3-6e-+6OH- N2+6H2O
C.当浓差电池停止工作时,有4 mol OH-从丁→丙
D.停止工作后若要使浓差电池恢复原状态,Cu(2)连接的是电源正极
3.双极膜在直流电场作用下,可将水离解,在膜两侧分别得到H+和OH-。工业上用“双极膜双成对电解法”生产乙醛酸(OHCCOOH),原理如图所示,装置中两极均为惰性电极。下列说法错误的是 ( )
A.a为阳极,b为阴极
B.b极上草酸发生的电极反应为H2C2O4+2e-+2H+ OHCCOOH+H2O
C.HBr的作用是增强阳极室电解液的导电能力和充当间接电氧化的媒介
D.两极均产生2.24 L(标准状况)气体时,理论上可得到乙醛酸7.4 g
答案与分层梯度式解析
易混易错练
1.B 2.C 3.D 4.B
1.B 前者是碳的完全燃烧,后者是碳的不完全燃烧,相同质量的碳完全燃烧放出的热量多,化学反应的ΔH前者小于后者,A项错误;固体硫变为气态硫需要吸收热量,所以化学反应的ΔH前者大于后者,B项正确;1 mol氢气完全燃烧放出的热量小于2 mol氢气完全燃烧放出的热量,由于放热反应的ΔH<0,所以化学反应的ΔH前者小于后者,C项错误;中和反应为放热反应,焓变是负值,放出的热量越多,焓变越小,浓硫酸与KOH反应放出的热量多,所以化学反应的ΔH前者小于后者,D项错误。
易错分析
本题主要考查ΔH的大小比较。解答本题时易误认为放热越多ΔH越大,而实际上ΔH比较大小时,需带本身的符号比较,放热反应的ΔH<0,放出的热量越多,焓变越小。本题中相同质量的碳完全燃烧放出的热量多,ΔH反而小。
2.C CH3COOH为弱酸,其电离过程是一个吸热过程,反应CH3COOH(aq)+NaOH(aq) CH3COONa(aq)+H2O(l)放出的热量比反应HCl(aq)+NaOH(aq) NaCl(aq)+H2O(l)少,即ΔH1<ΔH2,而反应H2SO4(aq)+Ba(OH)2(aq) BaSO4(s)+2H2O(l)生成2 mol H2O,且S和Ba2+结合成BaSO4沉淀是放热过程,则该反应放出的热量最多,ΔH3最小,C正确。
3.D 金属钠可溶于水银形成合金“钠汞齐”,说明在水银处有Na析出,发生还原反应,则水银为阴极,铁丝只起导电作用,石墨棒为阳极,A为电源正极,A正确;阴极电极反应式为Na++e-+nHg Na·nHg,B正确;石墨棒为阳极,Cl-放电产生Cl2,进入洗气瓶中,与挥发的NH3反应生成NH4Cl小颗粒,有白烟产生,则发生的反应为8NH3+3Cl2 6NH4Cl+N2,C正确;水银表面可能会发生副反应2H2O+2e- H2↑+2OH-,当外电路转移电子数为2NA时,不一定能生成2 mol Na,D错误。
易错分析
本题以电解饱和食盐水为情境,但是电解原理与氯碱工业不同,装置打破常规认知,阴极主要是Na+放电生成Na,进而与水银形成“钠汞齐”,还可能发生副反应2H2O+2e- H2↑+2OH-。本题易因为不能正确理解电解时的工作原理而陷入做题困境。
4.B 装置剖析:
K与M连接时为电解池,阳极电极反应为Ag-e- Ag+,阴极电极反应为Ag++e- Ag,当电路中转移1 mol e-时,有1 mol N透过阴离子交换膜移向甲室,乙室溶液质量减少(108+62)g=170 g,则当电路中转移0.1 mol电子时,乙室溶液质量减少17 g,A正确;由图分析可知,B错误;若换成阳离子交换膜,形成电解池时,电路中有1 mol电子转移时,阳极有1 mol Ag溶解、阴极析出1 mol Ag,1 mol Ag+透过阳离子交换膜进入乙室,则两池中AgNO3溶液浓度相同,K与N相连时,不会形成浓差电池,电池将不能正常使用,C正确;由图分析可知,D正确。
易错分析
解答本题时易因不能正确理解浓差电池的工作原理而出错。浓差电池是利用两极电势差实现两个半反应,电解质溶液浓度较小的一极是负极,负极材料失去电子形成离子进入溶液,电解质溶液浓度较大的一极是正极,电解质溶液中的阳离子在正极得电子,最终使两池电解质溶液浓度相等而停止放电。
思想方法练
1.C 2.AD 3.D
1.C 图中甲池为原电池装置,Cu电极为负极,发生氧化反应,A错误;实验过程中,甲池铜放电生成铜离子,盐桥中的硝酸根离子向左边移动,所以左侧烧杯中硝酸根离子的浓度变大,B错误;用铜制U形物代替“盐桥”,中间烧杯构成原电池,最左侧烧杯构成电解池,中间烧杯中U形物铜作负极,电极反应为Cu-2e- Cu2+,质量减少,而最左侧烧杯中U形物铜作阴极,电极反应为Cu2++2e- Cu,质量增加,整个电路转移电子数相等,所以减少的质量与增加的质量相等,U形物的质量不变,C正确;若甲池中Ag电极质量增加5.4 g,即生成银5.4 g,物质的量为=0.05 mol,所以整个电路转移0.05 mol电子,假设乙中某盐溶液是硝酸银溶液且硝酸银足量,应析出5.4 g银,而乙池某电极析出1.6 g金属,假设不符,D错误。
方法点津
本题综合考查了原电池和电解池的工作原理和应用。解答该题时,先根据两池的结构特点和题目所给的信息判断哪个是原电池、哪个是电解池,然后根据电化学原理和电解质溶液判断各电极发生的电极反应,再结合得失电子守恒进行相关计算。
2.AD 由题意知,右池为电解池,左池为原电池,右池电极M上NH3失电子被氧化为N2,故M为阳极,N为阴极,Cu(2)为负极,发生反应:Cu-2e- Cu2+,Cu(1)为正极,发生反应:Cu2++2e- Cu,转移2 mol电子时,Cu(1)极析出64 g铜,同时为了维持溶液呈电中性,有1 mol(即96 g)S从乙室进入甲室,乙室电解质溶液质量共减少64 g+96 g=160 g,A错误;电极M上NH3失电子被氧化为N2,电解质溶液为强碱溶液,电极反应为2NH3-6e-+6OH- N2+6H2O,B正确;甲室中n(Cu2+)=2 L×0.5 mol·L-1=1 mol,乙室中n(Cu2+)=2 L×2.5 mol·L-1=5 mol,当甲、乙室Cu2+浓度相等时停止放电,即甲、乙室n(Cu2+)=3 mol时停止放电,乙室有2 mol Cu2+放电,则此时电路中转移4 mol e-,故有4 mol OH-从丁→丙,C正确;要使浓差电池恢复原状态,Cu(2)电极和电源负极相连,D错误。
方法点津
本题综合考查了浓差电池和电解池的工作原理和应用。浓差电池是原电池,本质是利用电解质溶液浓度差放电。利用溶液中的电荷守恒计算乙室电解质溶液减少的质量,根据得失电子守恒和电荷守恒分析OH-从丁迁移到丙的物质的量。
3.D 根据题图可知,a极上发生氧化反应,a为阳极;b极上发生还原反应,b为阴极,A正确;阴极电极反应有:H2C2O4+2e-+2H+ OHCCOOH+H2O、2H++2e- H2↑,B正确;HBr的作用是增强阳极室电解液的导电能力,Br-在阳极发生失电子的氧化反应生成Br2,Br2将OHC—CHO氧化为OHC—COOH,HBr充当间接电氧化的媒介,C正确;当阳极生成标准状况下2.24 L O2,转移电子的物质的量为0.4 mol,设生成乙醛酸a mol(OHC—CHO~OHC—COOH~Br2~2e-~2Br-),当阴极(b极)生成标准状况下2.24 L H2,转移电子的物质的量为0.2 mol,设生成乙醛酸b mol(H2C2O4~OHCCOOH~2e-),根据得失电子守恒,有0.4+2a=0.2+2b,解得b-a=0.1,理论上可得到乙醛酸的质量一定大于0.1 mol×74 g/mol=7.4 g,D错误。
39
易混易错练
易错点1 比较焓变大小时忽视焓变的正、负号
1.下列各组热化学方程式中,化学反应的ΔH前者大于后者的是 ( )
A.C(s)+O2(g) CO2(g) ΔH1;C(s)+O2(g) CO(g) ΔH2
B.S(s)+O2(g) SO2(g) ΔH3;S(g)+O2(g) SO2(g) ΔH4
C.2H2(g)+O2(g) 2H2O(l) ΔH5;H2(g)+O2(g) H2O(l) ΔH6
D.2KOH(aq)+H2SO4(浓,aq) K2SO4(aq)+2H2O(l) ΔH7;2KOH(aq)+H2SO4(aq) K2SO4(aq)+2H2O(l) ΔH8
2.已知:
HCl(aq)+NaOH(aq) NaCl(aq)+H2O(l) ΔH1
CH3COOH(aq)+NaOH(aq) H2O(l)+CH3COONa(aq) ΔH2
H2SO4(aq)+Ba(OH)2(aq) BaSO4(s)+2H2O(l) ΔH3
则ΔH的大小顺序分别为 ( )
A.ΔH2>ΔH3>ΔH1 B.ΔH2<ΔH1<ΔH3
C.ΔH2>ΔH1>ΔH3 D.ΔH2<ΔH1<ΔH3
易错点2 不能正确理解电池的工作原理
3.金属钠可溶于水银形成合金“钠汞齐”(Na·nHg),利用这一性质可通过电解饱和食盐水得到金属钠,实验装置如图所示,洗气瓶中有白烟产生,下列说法不正确的是 ( )
A.A为电源正极,铁丝只起到导电的作用
B.生成钠的电极反应式为Na++e-+nHg Na·nHg
C.白烟产生的原因用化学方程式表示为8NH3+3Cl2 6NH4Cl+N2
D.设NA为阿伏加德罗常数的值,当外电路转移电子数为2NA时,过程中一定能生成2 mol Na
4.某AgNO3浓差电池的装置如图所示,该电池使用前先将K与M连接一段时间,K再与N连接,当正负电极室中溶液的浓度相等时,电池将停止放电。下列说法错误的是 ( )
A.K与M连接,当电路中转移0.1 mol电子时,乙室溶液质量减少17 g
B.K与N连接,甲室的电极反应式为Ag-e- Ag+
C.若换成阳离子交换膜,电池将不能正常使用
D.K分别与M、N连接时,N在电解质溶液中的移动方向相反
思想方法练
守恒思想突破电化学计算题
方法概述
电化学试题的特点是把考查的知识点以语言叙述或图像的形式呈现出来,由于两电极涉及的电极反应为离子反应和氧化还原反应,所以可以利用守恒法解决电化学计算问题。守恒法的特点是抓住有关变化的始态和终态,忽略中间过程,利用其中某种不变量建立关系式,从而简化思路,快速解题。守恒思想在电化学中的应用主要表现为得失电子守恒、电荷守恒、原子守恒等。
1.某同学组装了如图所示的电化学装置,则下列说法正确的是 ( )
A.图中甲池为原电池装置,Cu电极发生还原反应
B.实验过程中,甲池左侧烧杯中N的浓度不变
C.若用铜制U形物代替“盐桥”,工作一段时间后取出U形物称量,质量不变
D.若甲池中Ag电极质量增加5.4 g,乙池某电极析出1.6 g金属,则乙中的某盐溶液可能是足量AgNO3溶液
2.(不定项)以浓差电池(电解质溶液浓度不同形成的电池)为电源,以石墨为电极将NH3转化为高纯H2的装置如图。下列说法错误的是 ( )
A.转移2 mol e-时乙室电解质溶液质量减少96 g
B.M极电极反应为2NH3-6e-+6OH- N2+6H2O
C.当浓差电池停止工作时,有4 mol OH-从丁→丙
D.停止工作后若要使浓差电池恢复原状态,Cu(2)连接的是电源正极
3.双极膜在直流电场作用下,可将水离解,在膜两侧分别得到H+和OH-。工业上用“双极膜双成对电解法”生产乙醛酸(OHCCOOH),原理如图所示,装置中两极均为惰性电极。下列说法错误的是 ( )
A.a为阳极,b为阴极
B.b极上草酸发生的电极反应为H2C2O4+2e-+2H+ OHCCOOH+H2O
C.HBr的作用是增强阳极室电解液的导电能力和充当间接电氧化的媒介
D.两极均产生2.24 L(标准状况)气体时,理论上可得到乙醛酸7.4 g
答案与分层梯度式解析
易混易错练
1.B 2.C 3.D 4.B
1.B 前者是碳的完全燃烧,后者是碳的不完全燃烧,相同质量的碳完全燃烧放出的热量多,化学反应的ΔH前者小于后者,A项错误;固体硫变为气态硫需要吸收热量,所以化学反应的ΔH前者大于后者,B项正确;1 mol氢气完全燃烧放出的热量小于2 mol氢气完全燃烧放出的热量,由于放热反应的ΔH<0,所以化学反应的ΔH前者小于后者,C项错误;中和反应为放热反应,焓变是负值,放出的热量越多,焓变越小,浓硫酸与KOH反应放出的热量多,所以化学反应的ΔH前者小于后者,D项错误。
易错分析
本题主要考查ΔH的大小比较。解答本题时易误认为放热越多ΔH越大,而实际上ΔH比较大小时,需带本身的符号比较,放热反应的ΔH<0,放出的热量越多,焓变越小。本题中相同质量的碳完全燃烧放出的热量多,ΔH反而小。
2.C CH3COOH为弱酸,其电离过程是一个吸热过程,反应CH3COOH(aq)+NaOH(aq) CH3COONa(aq)+H2O(l)放出的热量比反应HCl(aq)+NaOH(aq) NaCl(aq)+H2O(l)少,即ΔH1<ΔH2,而反应H2SO4(aq)+Ba(OH)2(aq) BaSO4(s)+2H2O(l)生成2 mol H2O,且S和Ba2+结合成BaSO4沉淀是放热过程,则该反应放出的热量最多,ΔH3最小,C正确。
3.D 金属钠可溶于水银形成合金“钠汞齐”,说明在水银处有Na析出,发生还原反应,则水银为阴极,铁丝只起导电作用,石墨棒为阳极,A为电源正极,A正确;阴极电极反应式为Na++e-+nHg Na·nHg,B正确;石墨棒为阳极,Cl-放电产生Cl2,进入洗气瓶中,与挥发的NH3反应生成NH4Cl小颗粒,有白烟产生,则发生的反应为8NH3+3Cl2 6NH4Cl+N2,C正确;水银表面可能会发生副反应2H2O+2e- H2↑+2OH-,当外电路转移电子数为2NA时,不一定能生成2 mol Na,D错误。
易错分析
本题以电解饱和食盐水为情境,但是电解原理与氯碱工业不同,装置打破常规认知,阴极主要是Na+放电生成Na,进而与水银形成“钠汞齐”,还可能发生副反应2H2O+2e- H2↑+2OH-。本题易因为不能正确理解电解时的工作原理而陷入做题困境。
4.B 装置剖析:
K与M连接时为电解池,阳极电极反应为Ag-e- Ag+,阴极电极反应为Ag++e- Ag,当电路中转移1 mol e-时,有1 mol N透过阴离子交换膜移向甲室,乙室溶液质量减少(108+62)g=170 g,则当电路中转移0.1 mol电子时,乙室溶液质量减少17 g,A正确;由图分析可知,B错误;若换成阳离子交换膜,形成电解池时,电路中有1 mol电子转移时,阳极有1 mol Ag溶解、阴极析出1 mol Ag,1 mol Ag+透过阳离子交换膜进入乙室,则两池中AgNO3溶液浓度相同,K与N相连时,不会形成浓差电池,电池将不能正常使用,C正确;由图分析可知,D正确。
易错分析
解答本题时易因不能正确理解浓差电池的工作原理而出错。浓差电池是利用两极电势差实现两个半反应,电解质溶液浓度较小的一极是负极,负极材料失去电子形成离子进入溶液,电解质溶液浓度较大的一极是正极,电解质溶液中的阳离子在正极得电子,最终使两池电解质溶液浓度相等而停止放电。
思想方法练
1.C 2.AD 3.D
1.C 图中甲池为原电池装置,Cu电极为负极,发生氧化反应,A错误;实验过程中,甲池铜放电生成铜离子,盐桥中的硝酸根离子向左边移动,所以左侧烧杯中硝酸根离子的浓度变大,B错误;用铜制U形物代替“盐桥”,中间烧杯构成原电池,最左侧烧杯构成电解池,中间烧杯中U形物铜作负极,电极反应为Cu-2e- Cu2+,质量减少,而最左侧烧杯中U形物铜作阴极,电极反应为Cu2++2e- Cu,质量增加,整个电路转移电子数相等,所以减少的质量与增加的质量相等,U形物的质量不变,C正确;若甲池中Ag电极质量增加5.4 g,即生成银5.4 g,物质的量为=0.05 mol,所以整个电路转移0.05 mol电子,假设乙中某盐溶液是硝酸银溶液且硝酸银足量,应析出5.4 g银,而乙池某电极析出1.6 g金属,假设不符,D错误。
方法点津
本题综合考查了原电池和电解池的工作原理和应用。解答该题时,先根据两池的结构特点和题目所给的信息判断哪个是原电池、哪个是电解池,然后根据电化学原理和电解质溶液判断各电极发生的电极反应,再结合得失电子守恒进行相关计算。
2.AD 由题意知,右池为电解池,左池为原电池,右池电极M上NH3失电子被氧化为N2,故M为阳极,N为阴极,Cu(2)为负极,发生反应:Cu-2e- Cu2+,Cu(1)为正极,发生反应:Cu2++2e- Cu,转移2 mol电子时,Cu(1)极析出64 g铜,同时为了维持溶液呈电中性,有1 mol(即96 g)S从乙室进入甲室,乙室电解质溶液质量共减少64 g+96 g=160 g,A错误;电极M上NH3失电子被氧化为N2,电解质溶液为强碱溶液,电极反应为2NH3-6e-+6OH- N2+6H2O,B正确;甲室中n(Cu2+)=2 L×0.5 mol·L-1=1 mol,乙室中n(Cu2+)=2 L×2.5 mol·L-1=5 mol,当甲、乙室Cu2+浓度相等时停止放电,即甲、乙室n(Cu2+)=3 mol时停止放电,乙室有2 mol Cu2+放电,则此时电路中转移4 mol e-,故有4 mol OH-从丁→丙,C正确;要使浓差电池恢复原状态,Cu(2)电极和电源负极相连,D错误。
方法点津
本题综合考查了浓差电池和电解池的工作原理和应用。浓差电池是原电池,本质是利用电解质溶液浓度差放电。利用溶液中的电荷守恒计算乙室电解质溶液减少的质量,根据得失电子守恒和电荷守恒分析OH-从丁迁移到丙的物质的量。
3.D 根据题图可知,a极上发生氧化反应,a为阳极;b极上发生还原反应,b为阴极,A正确;阴极电极反应有:H2C2O4+2e-+2H+ OHCCOOH+H2O、2H++2e- H2↑,B正确;HBr的作用是增强阳极室电解液的导电能力,Br-在阳极发生失电子的氧化反应生成Br2,Br2将OHC—CHO氧化为OHC—COOH,HBr充当间接电氧化的媒介,C正确;当阳极生成标准状况下2.24 L O2,转移电子的物质的量为0.4 mol,设生成乙醛酸a mol(OHC—CHO~OHC—COOH~Br2~2e-~2Br-),当阴极(b极)生成标准状况下2.24 L H2,转移电子的物质的量为0.2 mol,设生成乙醛酸b mol(H2C2O4~OHCCOOH~2e-),根据得失电子守恒,有0.4+2a=0.2+2b,解得b-a=0.1,理论上可得到乙醛酸的质量一定大于0.1 mol×74 g/mol=7.4 g,D错误。
39
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
