第2章 题型整合练 利用速率和平衡理论突破主观简答题
文档属性
| 名称 | 第2章 题型整合练 利用速率和平衡理论突破主观简答题 |  | |
| 格式 | docx | ||
| 文件大小 | 528.7KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-10-20 09:04:23 | ||
图片预览


文档简介
题型整合练 利用速率和平衡理论突破主观简答题
题型一 利用速率和平衡理论解释曲线变化趋势
1.甲醇在化学工业、农业生产等领域都有广泛的应用。请回答:
常温下,将一定量甲醇放入真空的恒容密闭容器中,发生:CH3OH(l) CH3OH(g) ΔH=+1 109 kJ·mol-1。
甲醇达到液气平衡状态时的压强,称为甲醇在该温度下的饱和蒸气压(p),p与温度关系如图所示。请分析B点饱和蒸气压大于A点饱和蒸气压的原因: 。
2.将甲醇(CH3OH)转化耦合到丁烯(C4H8)裂解过程中生产丙烯(C3H6),主要涉及下列反应:
①2C4H8(g) 2C3H6(g)+C2H4(g) ΔH>0
②2CH3OH(g) C2H4(g)+2H2O(g) ΔH<0
③C2H4(g)+C4H8(g) 2C3H6(g) ΔH<0
某压强下,将甲醇(CH3OH)和丁烯(C4H8)按一定的物质的量之比投料,反应达到平衡时丙烯(C3H6)的体积分数随温度的变化曲线如图所示。由图可知平衡时C3H6的体积分数随温度的升高呈现先升高后降低的趋势,其原因可能是 。
3.CO2资源化利用对缓解碳减排压力具有重要意义,使用镍氢催化剂可使CO2转化为CH4。反应体系中主要反应的热化学方程式为:
反应Ⅰ:CO2(g)+4H2(g) CH4(g)+2H2O(g) ΔH1<0
反应Ⅱ:2CO2(g)+6H2(g) C2H4(g)+4H2O(g) ΔH2<0
(1)相同投料比时,体系内CO2的平衡转化率与温度T和压强p的关系如图,温度从高到低的顺序为 。
(2)镍氢催化剂活性会因为甲烷分解产生积碳而降低,同时二氧化碳可与碳发生消碳反应:
积碳反应:CH4(g) C(s)+2H2(g) ΔH3=+75 kJ/mol
消碳反应:C(s)+CO2(g) 2CO(g) ΔH4=+173 kJ/mol
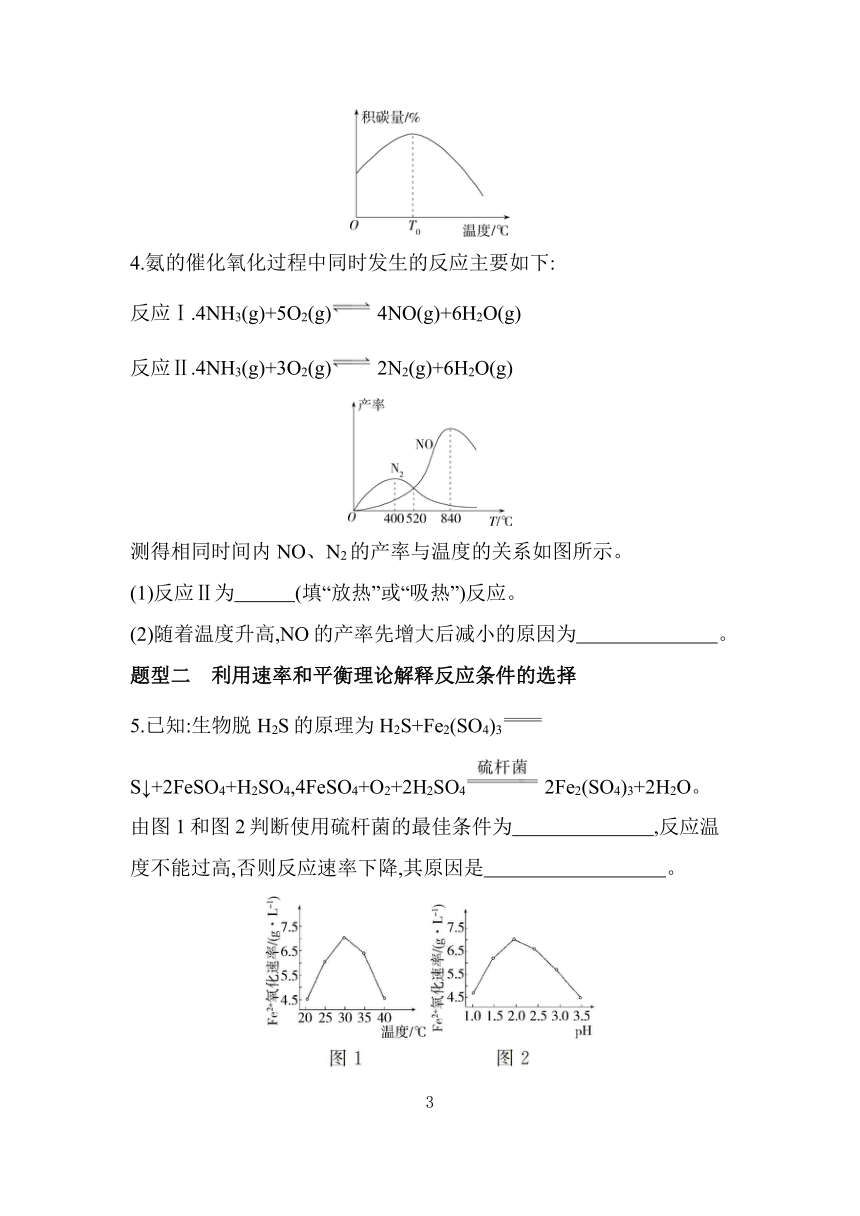
其他条件相同时,催化剂表面积碳量与温度的关系如图所示,T0 ℃之后,温度升高积碳量减小的主要原因是 。
4.氨的催化氧化过程中同时发生的反应主要如下:
反应Ⅰ.4NH3(g)+5O2(g) 4NO(g)+6H2O(g)
反应Ⅱ.4NH3(g)+3O2(g) 2N2(g)+6H2O(g)
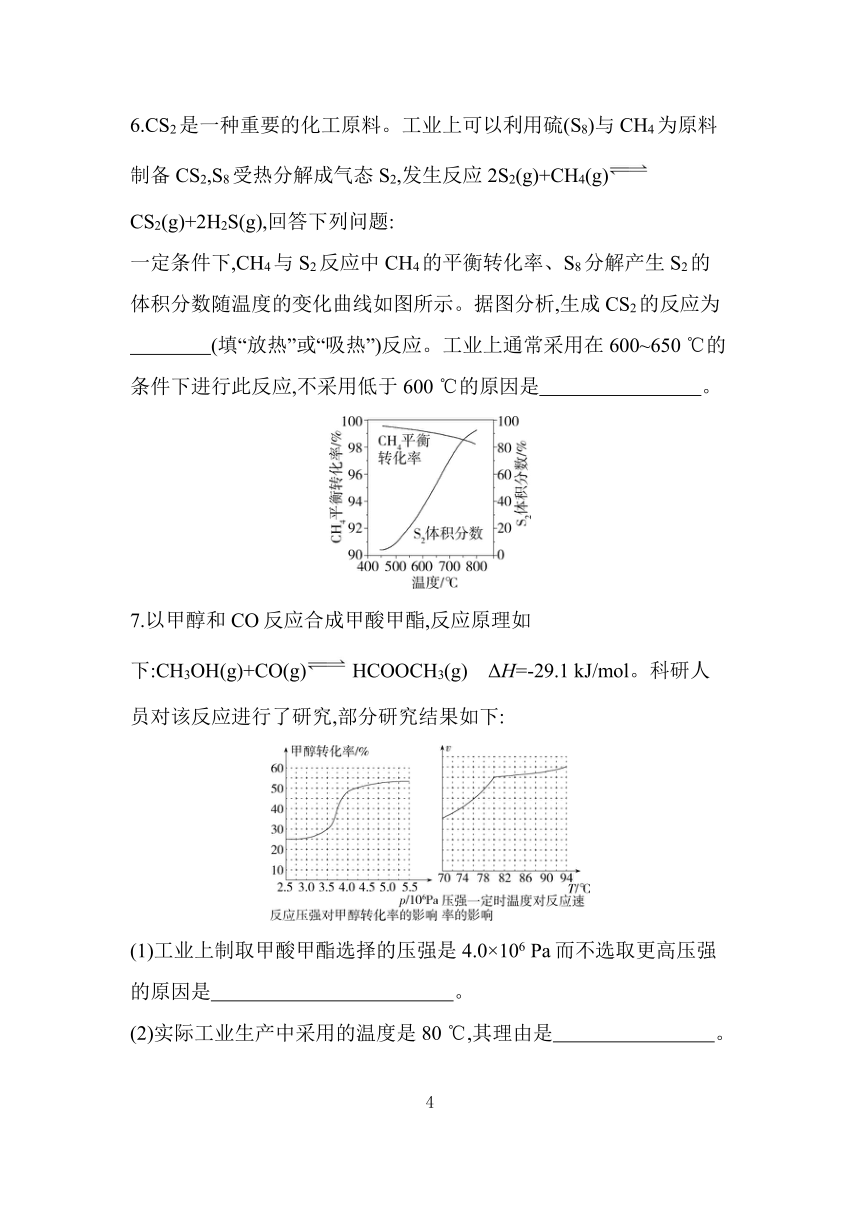
测得相同时间内NO、N2的产率与温度的关系如图所示。
(1)反应Ⅱ为 (填“放热”或“吸热”)反应。
(2)随着温度升高,NO的产率先增大后减小的原因为 。
题型二 利用速率和平衡理论解释反应条件的选择
5.已知:生物脱H2S的原理为H2S+Fe2(SO4)3 S↓+2FeSO4+H2SO4,4FeSO4+O2+2H2SO4 2Fe2(SO4)3+2H2O。由图1和图2判断使用硫杆菌的最佳条件为 ,反应温度不能过高,否则反应速率下降,其原因是 。
6.CS2是一种重要的化工原料。工业上可以利用硫(S8)与CH4为原料制备CS2,S8受热分解成气态S2,发生反应2S2(g)+CH4(g) CS2(g)+2H2S(g),回答下列问题:
一定条件下,CH4与S2反应中CH4的平衡转化率、S8分解产生S2的体积分数随温度的变化曲线如图所示。据图分析,生成CS2的反应为
(填“放热”或“吸热”)反应。工业上通常采用在600~650 ℃的条件下进行此反应,不采用低于600 ℃的原因是 。
7.以甲醇和CO反应合成甲酸甲酯,反应原理如下:CH3OH(g)+CO(g) HCOOCH3(g) ΔH=-29.1 kJ/mol。科研人员对该反应进行了研究,部分研究结果如下:
(1)工业上制取甲酸甲酯选择的压强是4.0×106 Pa而不选取更高压强的原因是 。
(2)实际工业生产中采用的温度是80 ℃,其理由是 。
8.二氧化碳的资源化是目前的热门研究领域,在催化剂的作用下二氧化碳可以和氢气发生反应生成甲烷和低级烯烃CnH2n(n=2~4)。其他条件一定时,反应温度对CO2转化率、CH4选择性、CnH2n选择性的影响如图所示,从生产低级烯烃的角度考虑,最合适的反应温度是 ,理由是 。资料显示原料气中>1时,随着的增大,低级烯烃的选择性会逐渐降低,但氢气的总转化率不发生明显变化,原因可能是 。
答案与分层梯度式解析
1.答案 甲醇汽化吸热,升高温度,平衡右移,气体分子数增多,压强增大
解析 注意题目信息,由“ΔH=+1 109 kJ·mol-1”可知,升高温度,平衡右移,气体分子数增多,压强增大。
2.答案 300~500 ℃时,反应①为主要反应,升高温度,平衡正向移动,使C3H6的体积分数增大;温度高于500 ℃时,反应②③为主要反应,升高温度,两平衡逆向移动,使C3H6的体积分数减小
解析 300~500 ℃时,丁烯裂解(反应①)为主要反应,是吸热反应,升高温度,平衡正向移动,使C3H6的体积分数增大;温度高于500 ℃时,反应②③为主要反应,是放热反应,升高温度,平衡逆向移动,使C3H6的体积分数减小。
3.答案 (1)T3>T2>T1
(2)T0 ℃之后,温度升高,消碳反应速率增大的程度大于积碳反应速率增大的程度
解析 (1)作等压辅助线,讨论CO2的平衡转化率与温度T的关系。
4.答案 (1)放热 (2)低于840 ℃时,反应Ⅰ未达到平衡状态,随着反应进行,NO的产率增大;温度为840 ℃时,反应达到平衡状态,反应Ⅰ是放热反应,温度升高,平衡逆向移动,NO的产率减小
解析 解答本题的关键在于确定“平衡点”,在达到平衡之前反应一直正向进行;“平衡点”之后,曲线上的点均处于平衡状态,可以利用平衡移动原理解释“平衡点”后曲线的变化趋势。
名师点睛
曲线变化趋势原因解释类题目的答题方向
这类题目一般都是多因素影响,需要多角度分析原因。
(1)如果是产率(或转化率)—温度(或压强)图像,一般依据平衡移动原理分析图像中曲线变化的原因,需考虑温度或压强对平衡移动的影响;有的还要分析是否为平衡时的产率或转化率,如果不是平衡状态,要考虑温度对催化剂活性的影响、温度和催化剂共同作用对反应速率的影响等。
(2)如果是体积分数—温度(或压强)图像,一般是多重反应体系,需考虑不同反应在不同条件下的选择性。
5.答案 30 ℃、pH=2.0 硫杆菌失去活性
解析 根据图1可判断30 ℃时亚铁离子的氧化速率最大,根据图2可判断pH=2.0时亚铁离子的氧化速率最大,所以使用硫杆菌的最佳条件为30 ℃、pH=2.0;反应温度过高时硫杆菌会失活,所以反应速率会下降。
6.答案 放热 600 ℃时甲烷平衡转化率高达99%,低于600 ℃时,S2体积分数明显偏小,且反应速率慢
解析
7.答案 (1)4.0×106 Pa时甲醇转化率较高,且再增大压强,甲醇转化率变化不大,但对设备要求较高
(2)80 ℃时反应速率较大,且高于80 ℃时,升高温度反应速率变化较小;反应放热,升高温度平衡逆向移动,甲醇的转化率降低,故温度不能太高
解析 (1)由题图可知,4.0×106 Pa时甲醇转化率较高,再增大压强,甲醇转化率变化不大,但对设备要求较高,会提高生产成本。
(2)从反应速率角度分析:温度为80 ℃时反应速率较大,且高于80 ℃时,升高温度反应速率变化较小;从平衡移动角度分析:反应放热,升高温度时平衡逆向移动,甲醇的转化率降低,故温度不能太高。
8.答案 240 ℃ 240 ℃时,二氧化碳转化率和低级烯烃选择性最高,甲烷选择性最低 低级烯烃与氢气发生加成反应生成烷烃
解析 由题图可知,240 ℃时,二氧化碳转化率和低级烯烃选择性最高,甲烷选择性最低,因此应选择240 ℃;>1时,随着的增大,低级烯烃的选择性逐渐降低,说明生成的低级烯烃比例减少,氢气的总转化率不发生明显变化说明氢气发生了其他反应,可能是低级烯烃与氢气发生加成反应生成了烷烃。
名师点睛
反应条件选择类题目的答题方向
最佳条件的选择或控制就是为了又“快”又“好”地生产,即主要是从化学反应速率与转化率、产率(化学平衡)两个角度来分析。“快”就是提高化学反应速率,“好”主要是提高转化率、产率。如针对平衡转化率、产率时,可运用平衡移动原理解释,一般表述为“其他条件不变的情况下,改变××条件,可逆反应平衡向××方向移动,导致发生××变化”;还要考虑生产效益,可从原料成本及来源、能源消耗、设备要求、环保等角度分析。
9
题型一 利用速率和平衡理论解释曲线变化趋势
1.甲醇在化学工业、农业生产等领域都有广泛的应用。请回答:
常温下,将一定量甲醇放入真空的恒容密闭容器中,发生:CH3OH(l) CH3OH(g) ΔH=+1 109 kJ·mol-1。
甲醇达到液气平衡状态时的压强,称为甲醇在该温度下的饱和蒸气压(p),p与温度关系如图所示。请分析B点饱和蒸气压大于A点饱和蒸气压的原因: 。
2.将甲醇(CH3OH)转化耦合到丁烯(C4H8)裂解过程中生产丙烯(C3H6),主要涉及下列反应:
①2C4H8(g) 2C3H6(g)+C2H4(g) ΔH>0
②2CH3OH(g) C2H4(g)+2H2O(g) ΔH<0
③C2H4(g)+C4H8(g) 2C3H6(g) ΔH<0
某压强下,将甲醇(CH3OH)和丁烯(C4H8)按一定的物质的量之比投料,反应达到平衡时丙烯(C3H6)的体积分数随温度的变化曲线如图所示。由图可知平衡时C3H6的体积分数随温度的升高呈现先升高后降低的趋势,其原因可能是 。
3.CO2资源化利用对缓解碳减排压力具有重要意义,使用镍氢催化剂可使CO2转化为CH4。反应体系中主要反应的热化学方程式为:
反应Ⅰ:CO2(g)+4H2(g) CH4(g)+2H2O(g) ΔH1<0
反应Ⅱ:2CO2(g)+6H2(g) C2H4(g)+4H2O(g) ΔH2<0
(1)相同投料比时,体系内CO2的平衡转化率与温度T和压强p的关系如图,温度从高到低的顺序为 。
(2)镍氢催化剂活性会因为甲烷分解产生积碳而降低,同时二氧化碳可与碳发生消碳反应:
积碳反应:CH4(g) C(s)+2H2(g) ΔH3=+75 kJ/mol
消碳反应:C(s)+CO2(g) 2CO(g) ΔH4=+173 kJ/mol
其他条件相同时,催化剂表面积碳量与温度的关系如图所示,T0 ℃之后,温度升高积碳量减小的主要原因是 。
4.氨的催化氧化过程中同时发生的反应主要如下:
反应Ⅰ.4NH3(g)+5O2(g) 4NO(g)+6H2O(g)
反应Ⅱ.4NH3(g)+3O2(g) 2N2(g)+6H2O(g)
测得相同时间内NO、N2的产率与温度的关系如图所示。
(1)反应Ⅱ为 (填“放热”或“吸热”)反应。
(2)随着温度升高,NO的产率先增大后减小的原因为 。
题型二 利用速率和平衡理论解释反应条件的选择
5.已知:生物脱H2S的原理为H2S+Fe2(SO4)3 S↓+2FeSO4+H2SO4,4FeSO4+O2+2H2SO4 2Fe2(SO4)3+2H2O。由图1和图2判断使用硫杆菌的最佳条件为 ,反应温度不能过高,否则反应速率下降,其原因是 。
6.CS2是一种重要的化工原料。工业上可以利用硫(S8)与CH4为原料制备CS2,S8受热分解成气态S2,发生反应2S2(g)+CH4(g) CS2(g)+2H2S(g),回答下列问题:
一定条件下,CH4与S2反应中CH4的平衡转化率、S8分解产生S2的体积分数随温度的变化曲线如图所示。据图分析,生成CS2的反应为
(填“放热”或“吸热”)反应。工业上通常采用在600~650 ℃的条件下进行此反应,不采用低于600 ℃的原因是 。
7.以甲醇和CO反应合成甲酸甲酯,反应原理如下:CH3OH(g)+CO(g) HCOOCH3(g) ΔH=-29.1 kJ/mol。科研人员对该反应进行了研究,部分研究结果如下:
(1)工业上制取甲酸甲酯选择的压强是4.0×106 Pa而不选取更高压强的原因是 。
(2)实际工业生产中采用的温度是80 ℃,其理由是 。
8.二氧化碳的资源化是目前的热门研究领域,在催化剂的作用下二氧化碳可以和氢气发生反应生成甲烷和低级烯烃CnH2n(n=2~4)。其他条件一定时,反应温度对CO2转化率、CH4选择性、CnH2n选择性的影响如图所示,从生产低级烯烃的角度考虑,最合适的反应温度是 ,理由是 。资料显示原料气中>1时,随着的增大,低级烯烃的选择性会逐渐降低,但氢气的总转化率不发生明显变化,原因可能是 。
答案与分层梯度式解析
1.答案 甲醇汽化吸热,升高温度,平衡右移,气体分子数增多,压强增大
解析 注意题目信息,由“ΔH=+1 109 kJ·mol-1”可知,升高温度,平衡右移,气体分子数增多,压强增大。
2.答案 300~500 ℃时,反应①为主要反应,升高温度,平衡正向移动,使C3H6的体积分数增大;温度高于500 ℃时,反应②③为主要反应,升高温度,两平衡逆向移动,使C3H6的体积分数减小
解析 300~500 ℃时,丁烯裂解(反应①)为主要反应,是吸热反应,升高温度,平衡正向移动,使C3H6的体积分数增大;温度高于500 ℃时,反应②③为主要反应,是放热反应,升高温度,平衡逆向移动,使C3H6的体积分数减小。
3.答案 (1)T3>T2>T1
(2)T0 ℃之后,温度升高,消碳反应速率增大的程度大于积碳反应速率增大的程度
解析 (1)作等压辅助线,讨论CO2的平衡转化率与温度T的关系。
4.答案 (1)放热 (2)低于840 ℃时,反应Ⅰ未达到平衡状态,随着反应进行,NO的产率增大;温度为840 ℃时,反应达到平衡状态,反应Ⅰ是放热反应,温度升高,平衡逆向移动,NO的产率减小
解析 解答本题的关键在于确定“平衡点”,在达到平衡之前反应一直正向进行;“平衡点”之后,曲线上的点均处于平衡状态,可以利用平衡移动原理解释“平衡点”后曲线的变化趋势。
名师点睛
曲线变化趋势原因解释类题目的答题方向
这类题目一般都是多因素影响,需要多角度分析原因。
(1)如果是产率(或转化率)—温度(或压强)图像,一般依据平衡移动原理分析图像中曲线变化的原因,需考虑温度或压强对平衡移动的影响;有的还要分析是否为平衡时的产率或转化率,如果不是平衡状态,要考虑温度对催化剂活性的影响、温度和催化剂共同作用对反应速率的影响等。
(2)如果是体积分数—温度(或压强)图像,一般是多重反应体系,需考虑不同反应在不同条件下的选择性。
5.答案 30 ℃、pH=2.0 硫杆菌失去活性
解析 根据图1可判断30 ℃时亚铁离子的氧化速率最大,根据图2可判断pH=2.0时亚铁离子的氧化速率最大,所以使用硫杆菌的最佳条件为30 ℃、pH=2.0;反应温度过高时硫杆菌会失活,所以反应速率会下降。
6.答案 放热 600 ℃时甲烷平衡转化率高达99%,低于600 ℃时,S2体积分数明显偏小,且反应速率慢
解析
7.答案 (1)4.0×106 Pa时甲醇转化率较高,且再增大压强,甲醇转化率变化不大,但对设备要求较高
(2)80 ℃时反应速率较大,且高于80 ℃时,升高温度反应速率变化较小;反应放热,升高温度平衡逆向移动,甲醇的转化率降低,故温度不能太高
解析 (1)由题图可知,4.0×106 Pa时甲醇转化率较高,再增大压强,甲醇转化率变化不大,但对设备要求较高,会提高生产成本。
(2)从反应速率角度分析:温度为80 ℃时反应速率较大,且高于80 ℃时,升高温度反应速率变化较小;从平衡移动角度分析:反应放热,升高温度时平衡逆向移动,甲醇的转化率降低,故温度不能太高。
8.答案 240 ℃ 240 ℃时,二氧化碳转化率和低级烯烃选择性最高,甲烷选择性最低 低级烯烃与氢气发生加成反应生成烷烃
解析 由题图可知,240 ℃时,二氧化碳转化率和低级烯烃选择性最高,甲烷选择性最低,因此应选择240 ℃;>1时,随着的增大,低级烯烃的选择性逐渐降低,说明生成的低级烯烃比例减少,氢气的总转化率不发生明显变化说明氢气发生了其他反应,可能是低级烯烃与氢气发生加成反应生成了烷烃。
名师点睛
反应条件选择类题目的答题方向
最佳条件的选择或控制就是为了又“快”又“好”地生产,即主要是从化学反应速率与转化率、产率(化学平衡)两个角度来分析。“快”就是提高化学反应速率,“好”主要是提高转化率、产率。如针对平衡转化率、产率时,可运用平衡移动原理解释,一般表述为“其他条件不变的情况下,改变××条件,可逆反应平衡向××方向移动,导致发生××变化”;还要考虑生产效益,可从原料成本及来源、能源消耗、设备要求、环保等角度分析。
9
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
