第2章 题型整合练 微粒间的相互作用
文档属性
| 名称 | 第2章 题型整合练 微粒间的相互作用 |  | |
| 格式 | docx | ||
| 文件大小 | 193.8KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-14 10:04:50 | ||
图片预览



文档简介
题型整合练 微粒间的相互作用
题型一 化学键、范德华力、氢键的判断
1.BF3与一定量的水形成(H2O)2·BF3晶体Q,Q在一定条件下可转化为R:
反应过程中新形成的化学键中无( )
A.离子键 B.配位键
C.非极性共价键 D.氢键
2.下列说法正确的是( )
A.NaHSO4固体溶于水时,既破坏了离子键也破坏了共价键
B.CO2和SiO2均为共价化合物,其固体熔化时,均破坏了分子间作用力
C.BF3分子和PCl3分子中,每个原子的最外层都达到8电子稳定结构
D.CaO2和CaCl2中含有的化学键类型完全相同
3.二氯异氰尿酸钠是中国疾控中心研发的“-18 ℃低温消毒剂”主要成分之一,其合成方法如图所示。下列说法错误的是( )
A.尿素和氯化铵中N原子的杂化方式不同
B.二氯异氰尿酸钠所含元素中电负性最大的是氧元素
C.二氯异氰尿酸钠晶体中存在离子键、共价键和配位键
D.三聚氰酸具有与苯环类似的结构,可推知三聚氰酸分子中存在大π键
4.(不定项)(易错题)胆矾(CuSO4·5H2O)结构如图所示。下列说法正确的是( )
A.S中S是sp3杂化,H2O中O也是sp3杂化,因此,两者的空间结构一样
B.Cu2+的价电子排布式为3d84s1
C.氧原子参与形成离子键、共价键、配位键和氢键共四种化学键
D.由结构图可知,胆矾化学式应写成[Cu(H2O)4]SO4·H2O
题型二 微粒间的相互作用与物质的性质
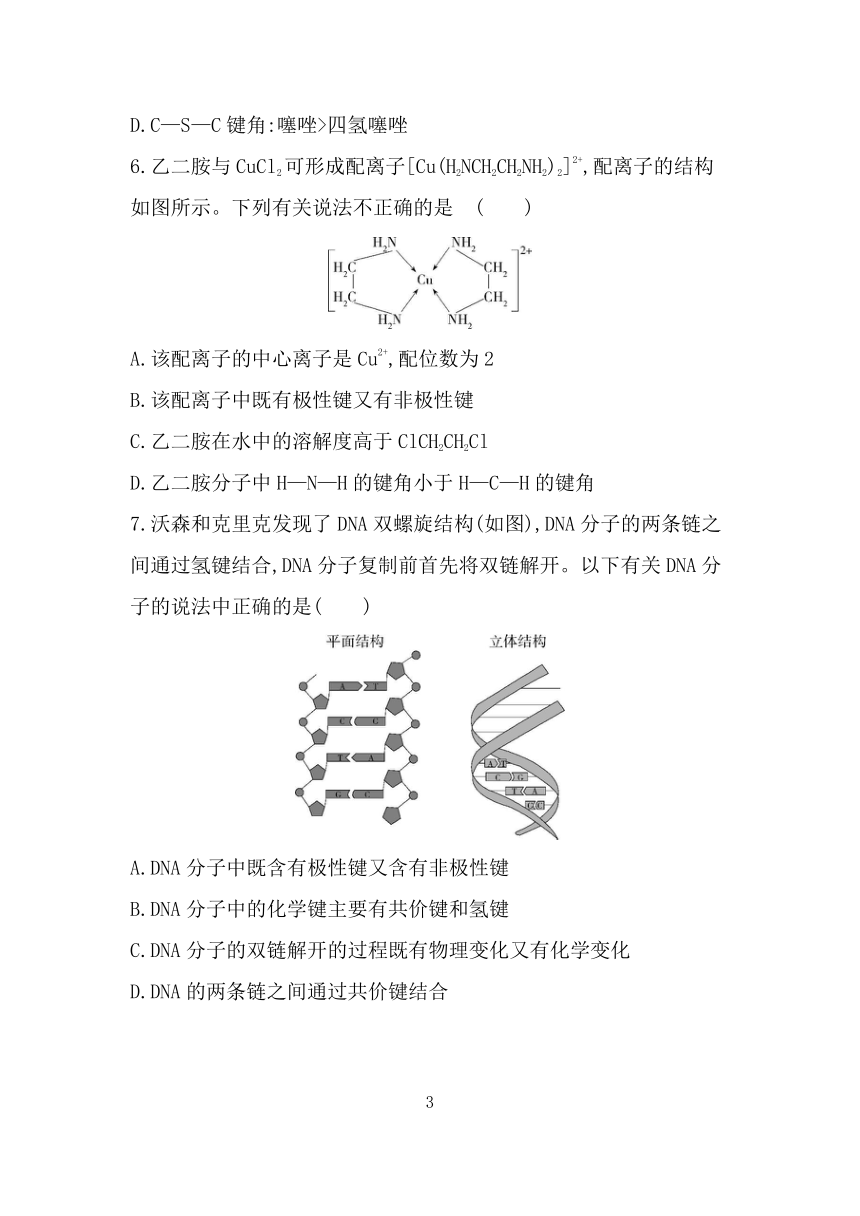
5.噻唑()中所有原子在同一平面上,能与H2反应生成四氢噻唑()。下列说法错误的是( )
A.在水中的溶解度:四氢噻唑>噻唑
B.噻唑中S原子提供2个电子参与形成大π键
C.四氢噻唑的熔点主要取决于范德华力
D.C—S—C键角:噻唑>四氢噻唑
6.乙二胺与CuCl2可形成配离子[Cu(H2NCH2CH2NH2)2]2+,配离子的结构如图所示。下列有关说法不正确的是 ( )
A.该配离子的中心离子是Cu2+,配位数为2
B.该配离子中既有极性键又有非极性键
C.乙二胺在水中的溶解度高于ClCH2CH2Cl
D.乙二胺分子中H—N—H的键角小于H—C—H的键角
7.沃森和克里克发现了DNA双螺旋结构(如图),DNA分子的两条链之间通过氢键结合,DNA分子复制前首先将双链解开。以下有关DNA分子的说法中正确的是( )
A.DNA分子中既含有极性键又含有非极性键
B.DNA分子中的化学键主要有共价键和氢键
C.DNA分子的双链解开的过程既有物理变化又有化学变化
D.DNA的两条链之间通过共价键结合
8.维生素B1可作为辅酶参与糖的代谢,并有保护神经系统的作用,该物质的结构简式如图所示:
(1)以下关于维生素B1的说法正确的是 。
a.只含σ键和π键
b.既有共价键又有离子键
c.该物质的碳原子存在三种杂化方式
d.既含有极性键又含有非极性键
(2)维生素B1燃烧可生成N2、NH3、CO2、SO2、H2O、HCl,这些物质中属于非极性分子的化合物为 。氨气极易溶于水,其原因是
。
液氨常被用作制冷剂,若不断地升高温度,实现“液氨氨气氮气和氢气氮原子和氢原子”的变化,在变化的各阶段被破坏的粒子间的相互作用分别是① ;②极性键;
③ 。
题型三 元素推断中微粒的结构与性质
9.(不定项)短周期元素R、X、Y、Z、W原子序数依次增大。其中基态X原子有两个未成对电子,且R、X符合核反应:RHe Xn,Z是短周期元素中原子半径最大的元素,基态W原子的价电子排布式为nsn-1npn+1,且Y、W同主族。下列说法错误的是( )
A.基态X原子的价电子轨道表示式:
B.Z2Y中的化学键具有方向性和饱和性
C.W不同单质的熔、沸点因范德华力不同而不同
D.简单氢化物沸点:X10.M、N、Z、Y、X、T是原子半径依次增大的前10号元素,基态N原子核外电子有5种空间运动状态,并有1个未成对电子,这六种元素形成的一种化合物的结构如图所示。下列说法正确的是( )
A.与Z同周期且第一电离能大于Z的元素有2种
B.该化合物中只含有离子键、共价键,不存在配位键
C.六种元素中,X的最高价含氧酸的酸性最强
D.最简单氢化物的沸点:X答案与分层梯度式解析
题型整合练 微粒间的相互作用
1.C Q在一定条件下可转化为R,由题图可知,晶体Q中O—H键断裂,而R中存在离子键和[H3O]+中H与O间的配位键,则新形成的化学键有离子键和配位键,无非极性共价键,氢键为分子间作用力;故选C。
2.A NaHSO4固体溶于水时完全电离,产生Na+、H+和S,既破坏了离子键也破坏了共价键,A正确;CO2和SiO2均为共价化合物,CO2固体熔化时,破坏了分子间作用力,SiO2固体熔化时,破坏了共价键,B错误;BF3分子中B原子最外层有6个电子,未达到8电子稳定结构,C错误;CaO2中含离子键和共价键,CaCl2中只含离子键,D错误。
3.C N中N原子的价电子对数为4+=4,N原子的杂化方式为sp3,尿素中N原子的杂化方式为sp2,N原子的杂化方式不同,故A正确;同周期主族元素从左到右电负性逐渐增大,同主族元素由上到下电负性逐渐减小,所以二氯异氰尿酸钠所含元素中电负性最大的是氧元素,故B正确;由结构可知,二氯异氰尿酸钠晶体中存在离子键、共价键,不存在配位键,故C错误;三聚氰酸具有与苯环类似的结构,具有一个六元环,可推知三聚氰酸分子中存在大π键,故D正确。
4.D S中S没有孤电子对,空间结构是正四面体形,H2O中O有2对孤电子对,空间结构是V形,空间结构不一样,故A错误;Cu2+的价电子排布式为3d9,故B错误;氢键不属于化学键,故C错误;胆矾的化学式为CuSO4·5H2O,其中1个Cu2+与4个H2O分子通过配位键形成[Cu(H2O)4]2+,[Cu(H2O)4]2+与S通过离子键结合,则胆矾的化学式可以表示为[Cu(H2O)4]SO4·H2O,故D正确。
5.C 四氢噻唑能与水分子形成氢键,增大其在水中的溶解度,噻唑不能与水分子形成氢键,所以在水中的溶解度:四氢噻唑>噻唑,A正确;噻唑中S原子有2对孤电子对,S提供2个电子,C、N各提供1个电子形成大π键,B正确;四氢噻唑存在分子间氢键,四氢噻唑的熔点主要取决于分子间氢键,C错误;噻唑中与S相连的C为sp2杂化,S的一对孤电子对参与形成大π键,四氢噻唑中与S相连的C为sp3杂化,所以C—S—C键角:噻唑>四氢噻唑,D正确。
6.A 该配离子的中心离子为Cu2+,由配离子的结构可知,Cu2+的配位数为4,故A不正确;该配离子中既有N—H、C—N、C—H极性键,又有C—C非极性键,故B正确;乙二胺能与水分子形成分子间氢键,所以其在水中的溶解度高于ClCH2CH2Cl,故C正确;乙二胺分子中,
H—N—H中N有一对孤电子对,H—C—H中C没有孤电子对,孤电子对之间的斥力>孤电子对与成键电子对之间的斥力>成键电子对之间的斥力,则H—N—H的键角小于H—C—H的键角,故D正确。
7.A 在DNA分子中,C—C键是非极性键,分子中还含有C—H键等极性键,A正确;氢键是一种分子间作用力,不属于化学键,B错误;DNA双链在解开的过程中仅破坏了氢键,故属于物理变化,C错误;DNA两条链之间通过氢键结合,氢键不属于共价键,D错误。
8.答案 (1)bd
(2)CO2 氨气分子为极性分子,易溶于极性溶剂水中,氨气分子与水分子间易形成氢键,氨气可与水反应
(3)氢键和范德华力 非极性键
解析 (1)由结构简式可知,维生素B1中含有Cl-及另一种有机离子,存在离子键,其他原子之间形成共价键,a错误,b正确;—CH3上的C原子是sp3杂化,双键上的C原子是sp2杂化,该物质的碳原子存在两种杂化方式,c错误;维生素B1中碳碳键为非极性键,氮氢键、氧氢键、碳氢键等为极性键,d正确。
(2)N2为单质,另外五种化合物中属于非极性分子的是CO2。NH3极易溶于水,是因为NH3和H2O均为极性分子,NH3溶于水后,NH3与水分子之间可形成氢键,NH3可与水反应。
(3)液氨汽化破坏了氢键和范德华力;氨气分解生成N2和H2,破坏了氮氢极性键;N2形成氮原子、H2形成氢原子破坏了非极性键。
9.BD 短周期元素R、X、Y、Z、W原子序数依次增大;Z是短周期元素中原子半径最大的元素,则Z为Na;基态W原子的价电子排布式为nsn-1npn+1,n=3,即基态W原子的价电子排布式为3s23p4,则W为S;Y、W同主族,则Y为O;基态X原子有两个未成对电子,原子序数小于O,X为C;R、X符合核反应RHe Xn,则R为Be。基态C原子的价电子轨道表示式:,A正确;Z2Y为Na2O,为离子化合物,离子键没有方向性和饱和性,B错误;不同硫单质的熔、沸点因范德华力不同而不同,C正确;X、Y、W的简单氢化物分别为CH4、H2O、H2S,水分子间存在氢键,其沸点最高,H2S的相对分子质量大于CH4,H2S的范德华力大于CH4,沸点高于CH4,故沸点:H2O>H2S>CH4,D错误。
10.D 基态N原子核外电子有5种空间运动状态,并有1个未成对电子,N为F元素;结合物质的结构图可知M只能形成一个共价键且原子半径比F小,M为H元素;Z、X分别形成2、4个共价键且原子半径:X>Y>Z>F,则Z为O元素,Y为N元素,X为C元素;T与N形成T,T为B元素。Z为O,同周期主族元素从左到右,第一电离能呈增大趋势,但一般ⅤA族元素第一电离能大于ⅥA族元素,则第2周期中第一电离能大于O的元素为Ne、F、N,A错误;该化合物的阴离子中存在配位键,B错误;最高价含氧酸的酸性强弱可以通过元素的非金属性强弱来比较,但是氟元素没有正价,氧元素没有最高正价,所以六种元素中氮元素的最高价含氧酸酸性最强,C错误;常温下,H2O为液态,HF为气态,则水的沸点高于HF,HF分子间能形成氢键,则HF的沸点高于CH4,故D正确。
2
题型一 化学键、范德华力、氢键的判断
1.BF3与一定量的水形成(H2O)2·BF3晶体Q,Q在一定条件下可转化为R:
反应过程中新形成的化学键中无( )
A.离子键 B.配位键
C.非极性共价键 D.氢键
2.下列说法正确的是( )
A.NaHSO4固体溶于水时,既破坏了离子键也破坏了共价键
B.CO2和SiO2均为共价化合物,其固体熔化时,均破坏了分子间作用力
C.BF3分子和PCl3分子中,每个原子的最外层都达到8电子稳定结构
D.CaO2和CaCl2中含有的化学键类型完全相同
3.二氯异氰尿酸钠是中国疾控中心研发的“-18 ℃低温消毒剂”主要成分之一,其合成方法如图所示。下列说法错误的是( )
A.尿素和氯化铵中N原子的杂化方式不同
B.二氯异氰尿酸钠所含元素中电负性最大的是氧元素
C.二氯异氰尿酸钠晶体中存在离子键、共价键和配位键
D.三聚氰酸具有与苯环类似的结构,可推知三聚氰酸分子中存在大π键
4.(不定项)(易错题)胆矾(CuSO4·5H2O)结构如图所示。下列说法正确的是( )
A.S中S是sp3杂化,H2O中O也是sp3杂化,因此,两者的空间结构一样
B.Cu2+的价电子排布式为3d84s1
C.氧原子参与形成离子键、共价键、配位键和氢键共四种化学键
D.由结构图可知,胆矾化学式应写成[Cu(H2O)4]SO4·H2O
题型二 微粒间的相互作用与物质的性质
5.噻唑()中所有原子在同一平面上,能与H2反应生成四氢噻唑()。下列说法错误的是( )
A.在水中的溶解度:四氢噻唑>噻唑
B.噻唑中S原子提供2个电子参与形成大π键
C.四氢噻唑的熔点主要取决于范德华力
D.C—S—C键角:噻唑>四氢噻唑
6.乙二胺与CuCl2可形成配离子[Cu(H2NCH2CH2NH2)2]2+,配离子的结构如图所示。下列有关说法不正确的是 ( )
A.该配离子的中心离子是Cu2+,配位数为2
B.该配离子中既有极性键又有非极性键
C.乙二胺在水中的溶解度高于ClCH2CH2Cl
D.乙二胺分子中H—N—H的键角小于H—C—H的键角
7.沃森和克里克发现了DNA双螺旋结构(如图),DNA分子的两条链之间通过氢键结合,DNA分子复制前首先将双链解开。以下有关DNA分子的说法中正确的是( )
A.DNA分子中既含有极性键又含有非极性键
B.DNA分子中的化学键主要有共价键和氢键
C.DNA分子的双链解开的过程既有物理变化又有化学变化
D.DNA的两条链之间通过共价键结合
8.维生素B1可作为辅酶参与糖的代谢,并有保护神经系统的作用,该物质的结构简式如图所示:
(1)以下关于维生素B1的说法正确的是 。
a.只含σ键和π键
b.既有共价键又有离子键
c.该物质的碳原子存在三种杂化方式
d.既含有极性键又含有非极性键
(2)维生素B1燃烧可生成N2、NH3、CO2、SO2、H2O、HCl,这些物质中属于非极性分子的化合物为 。氨气极易溶于水,其原因是
。
液氨常被用作制冷剂,若不断地升高温度,实现“液氨氨气氮气和氢气氮原子和氢原子”的变化,在变化的各阶段被破坏的粒子间的相互作用分别是① ;②极性键;
③ 。
题型三 元素推断中微粒的结构与性质
9.(不定项)短周期元素R、X、Y、Z、W原子序数依次增大。其中基态X原子有两个未成对电子,且R、X符合核反应:RHe Xn,Z是短周期元素中原子半径最大的元素,基态W原子的价电子排布式为nsn-1npn+1,且Y、W同主族。下列说法错误的是( )
A.基态X原子的价电子轨道表示式:
B.Z2Y中的化学键具有方向性和饱和性
C.W不同单质的熔、沸点因范德华力不同而不同
D.简单氢化物沸点:X
A.与Z同周期且第一电离能大于Z的元素有2种
B.该化合物中只含有离子键、共价键,不存在配位键
C.六种元素中,X的最高价含氧酸的酸性最强
D.最简单氢化物的沸点:X
题型整合练 微粒间的相互作用
1.C Q在一定条件下可转化为R,由题图可知,晶体Q中O—H键断裂,而R中存在离子键和[H3O]+中H与O间的配位键,则新形成的化学键有离子键和配位键,无非极性共价键,氢键为分子间作用力;故选C。
2.A NaHSO4固体溶于水时完全电离,产生Na+、H+和S,既破坏了离子键也破坏了共价键,A正确;CO2和SiO2均为共价化合物,CO2固体熔化时,破坏了分子间作用力,SiO2固体熔化时,破坏了共价键,B错误;BF3分子中B原子最外层有6个电子,未达到8电子稳定结构,C错误;CaO2中含离子键和共价键,CaCl2中只含离子键,D错误。
3.C N中N原子的价电子对数为4+=4,N原子的杂化方式为sp3,尿素中N原子的杂化方式为sp2,N原子的杂化方式不同,故A正确;同周期主族元素从左到右电负性逐渐增大,同主族元素由上到下电负性逐渐减小,所以二氯异氰尿酸钠所含元素中电负性最大的是氧元素,故B正确;由结构可知,二氯异氰尿酸钠晶体中存在离子键、共价键,不存在配位键,故C错误;三聚氰酸具有与苯环类似的结构,具有一个六元环,可推知三聚氰酸分子中存在大π键,故D正确。
4.D S中S没有孤电子对,空间结构是正四面体形,H2O中O有2对孤电子对,空间结构是V形,空间结构不一样,故A错误;Cu2+的价电子排布式为3d9,故B错误;氢键不属于化学键,故C错误;胆矾的化学式为CuSO4·5H2O,其中1个Cu2+与4个H2O分子通过配位键形成[Cu(H2O)4]2+,[Cu(H2O)4]2+与S通过离子键结合,则胆矾的化学式可以表示为[Cu(H2O)4]SO4·H2O,故D正确。
5.C 四氢噻唑能与水分子形成氢键,增大其在水中的溶解度,噻唑不能与水分子形成氢键,所以在水中的溶解度:四氢噻唑>噻唑,A正确;噻唑中S原子有2对孤电子对,S提供2个电子,C、N各提供1个电子形成大π键,B正确;四氢噻唑存在分子间氢键,四氢噻唑的熔点主要取决于分子间氢键,C错误;噻唑中与S相连的C为sp2杂化,S的一对孤电子对参与形成大π键,四氢噻唑中与S相连的C为sp3杂化,所以C—S—C键角:噻唑>四氢噻唑,D正确。
6.A 该配离子的中心离子为Cu2+,由配离子的结构可知,Cu2+的配位数为4,故A不正确;该配离子中既有N—H、C—N、C—H极性键,又有C—C非极性键,故B正确;乙二胺能与水分子形成分子间氢键,所以其在水中的溶解度高于ClCH2CH2Cl,故C正确;乙二胺分子中,
H—N—H中N有一对孤电子对,H—C—H中C没有孤电子对,孤电子对之间的斥力>孤电子对与成键电子对之间的斥力>成键电子对之间的斥力,则H—N—H的键角小于H—C—H的键角,故D正确。
7.A 在DNA分子中,C—C键是非极性键,分子中还含有C—H键等极性键,A正确;氢键是一种分子间作用力,不属于化学键,B错误;DNA双链在解开的过程中仅破坏了氢键,故属于物理变化,C错误;DNA两条链之间通过氢键结合,氢键不属于共价键,D错误。
8.答案 (1)bd
(2)CO2 氨气分子为极性分子,易溶于极性溶剂水中,氨气分子与水分子间易形成氢键,氨气可与水反应
(3)氢键和范德华力 非极性键
解析 (1)由结构简式可知,维生素B1中含有Cl-及另一种有机离子,存在离子键,其他原子之间形成共价键,a错误,b正确;—CH3上的C原子是sp3杂化,双键上的C原子是sp2杂化,该物质的碳原子存在两种杂化方式,c错误;维生素B1中碳碳键为非极性键,氮氢键、氧氢键、碳氢键等为极性键,d正确。
(2)N2为单质,另外五种化合物中属于非极性分子的是CO2。NH3极易溶于水,是因为NH3和H2O均为极性分子,NH3溶于水后,NH3与水分子之间可形成氢键,NH3可与水反应。
(3)液氨汽化破坏了氢键和范德华力;氨气分解生成N2和H2,破坏了氮氢极性键;N2形成氮原子、H2形成氢原子破坏了非极性键。
9.BD 短周期元素R、X、Y、Z、W原子序数依次增大;Z是短周期元素中原子半径最大的元素,则Z为Na;基态W原子的价电子排布式为nsn-1npn+1,n=3,即基态W原子的价电子排布式为3s23p4,则W为S;Y、W同主族,则Y为O;基态X原子有两个未成对电子,原子序数小于O,X为C;R、X符合核反应RHe Xn,则R为Be。基态C原子的价电子轨道表示式:,A正确;Z2Y为Na2O,为离子化合物,离子键没有方向性和饱和性,B错误;不同硫单质的熔、沸点因范德华力不同而不同,C正确;X、Y、W的简单氢化物分别为CH4、H2O、H2S,水分子间存在氢键,其沸点最高,H2S的相对分子质量大于CH4,H2S的范德华力大于CH4,沸点高于CH4,故沸点:H2O>H2S>CH4,D错误。
10.D 基态N原子核外电子有5种空间运动状态,并有1个未成对电子,N为F元素;结合物质的结构图可知M只能形成一个共价键且原子半径比F小,M为H元素;Z、X分别形成2、4个共价键且原子半径:X>Y>Z>F,则Z为O元素,Y为N元素,X为C元素;T与N形成T,T为B元素。Z为O,同周期主族元素从左到右,第一电离能呈增大趋势,但一般ⅤA族元素第一电离能大于ⅥA族元素,则第2周期中第一电离能大于O的元素为Ne、F、N,A错误;该化合物的阴离子中存在配位键,B错误;最高价含氧酸的酸性强弱可以通过元素的非金属性强弱来比较,但是氟元素没有正价,氧元素没有最高正价,所以六种元素中氮元素的最高价含氧酸酸性最强,C错误;常温下,H2O为液态,HF为气态,则水的沸点高于HF,HF分子间能形成氢键,则HF的沸点高于CH4,故D正确。
2
