第3章 不同聚集状态的物质与性质复习提升
文档属性
| 名称 | 第3章 不同聚集状态的物质与性质复习提升 |

|
|
| 格式 | docx | ||
| 文件大小 | 335.0KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-10-28 18:08:36 | ||
图片预览




文档简介
本章复习提升
易混易错练
易错点1 晶体类型判断错误导致比较晶体的
性质时出错
1.下列物质性质递变规律正确的是( )
A.Na、K、Cs的熔点依次升高
B.HCl、H2S、PH3的稳定性依次减弱
C.H2CO3、H2SiO3、H2SO4的酸性依次增强
D.单晶硅、CsCl、干冰的熔点依次升高
2.下列比较正确的是( )
A.化学键的键能由大到小:金刚石>碳化硅>硅
B.熔、沸点由高到低:氯化钠>氧化镁>金刚石>二氧化碳
C.硬度由大到小:C60>碳化硅>铁>氯化钠
D.共价键的极性由强到弱:H—I>H—Br>H—Cl
易错点2 晶体结构判断错误导致计算出错
3.TiO2通过氮掺杂得到TiO2-aNb,结构如图所示。已知原子1、2的分数坐标分别为(0,0,)、(1,0,0),设NA为阿伏加德罗常数的值。下列说法错误的是 ( )
A.原子3的分数坐标为(1,1,)
B.TiO2的密度为 g/cm3
C.TiO2-aNb晶体中a=
D.TiO2-aNb晶体中b=
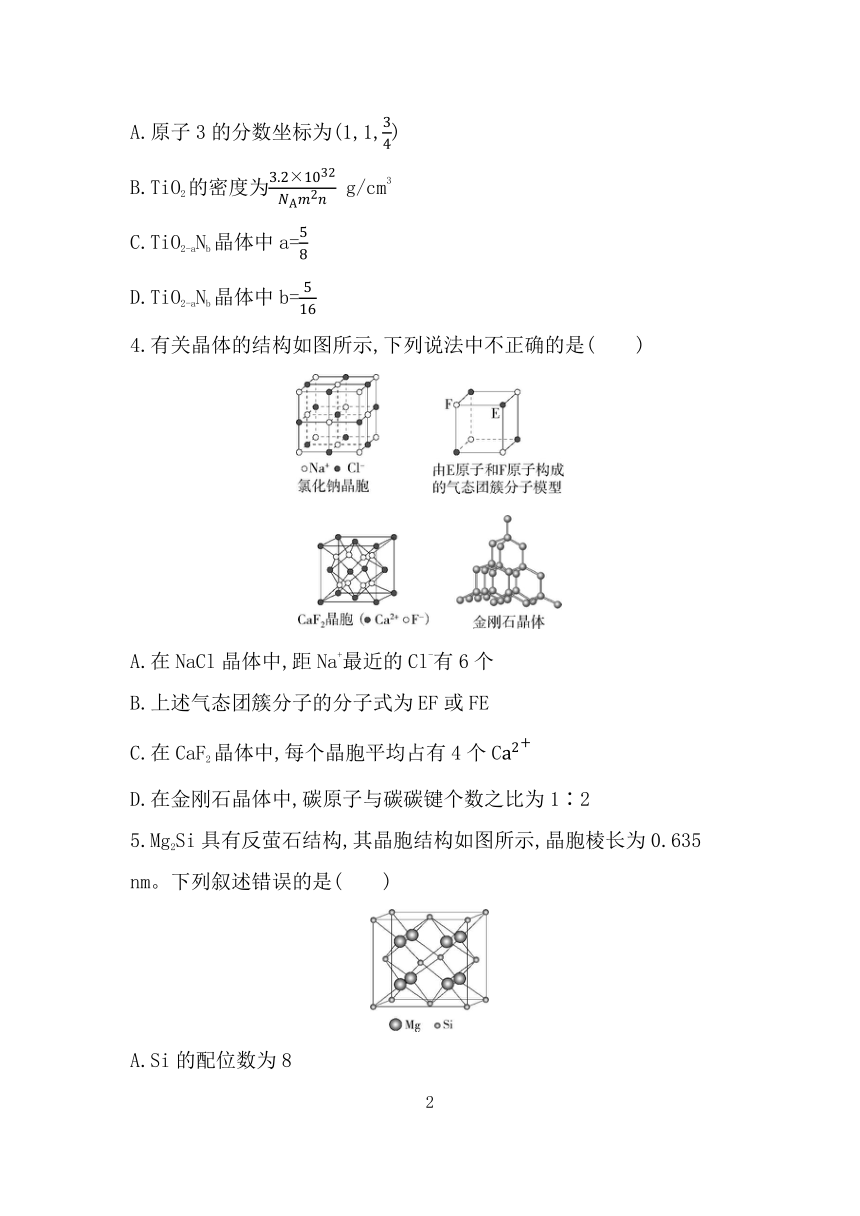
4.有关晶体的结构如图所示,下列说法中不正确的是( )
A.在NaCl晶体中,距Na+最近的Cl-有6个
B.上述气态团簇分子的分子式为EF或FE
C.在CaF2晶体中,每个晶胞平均占有4个C
D.在金刚石晶体中,碳原子与碳碳键个数之比为1∶2
5.Mg2Si具有反萤石结构,其晶胞结构如图所示,晶胞棱长为0.635 nm。下列叙述错误的是( )
A.Si的配位数为8
B.紧邻的两个Mg原子的距离为 nm
C.紧邻的两个Si原子间的距离为 nm
D.Mg2Si晶体的密度为 g·cm-3
思想方法练
利用建模思想解答晶胞中的相关计算问题
方法概述
有关晶胞计算类试题,可以将晶胞中原子“质点”化,构成立体模型,根据模型确定晶胞结构,推算物质化学式,再进一步计算密度、微粒间的距离等。此类试题中常见的计算:
(1)化学式:利用“切割法”计算一个晶胞中所含组成微粒的个数。
(2)晶体的密度:ρ=。式中ρ为晶体的密度,V为一个晶胞的体积,M为构成晶胞微粒的摩尔质量,N为晶胞所含微粒个数,NA为阿伏加德罗常数。
(3)微粒间的距离:分析晶胞构成及晶胞几何构型中各线性关系求算,若立方体晶胞的边长是a,则面对角线长是a,体对角线长是a。
1.高压不仅会引发物质的相变,还会导致新类型化学键的形成。如图所示,M、N、P为Na与FeCl2在50 GPa~300
GPa的高压下反应生成的不同晶体晶胞,下列说法错误的是( )
A.M、N、P晶体的化学式分别为NaCl3、Na2Cl、Na3Cl
B.晶胞M、N、P中所含Cl原子的个数之比为3∶1∶1
C.晶体M中与Na原子距离最近且等距的Cl原子有12个
D.1号原子的分数坐标为(,,)
2.(不定项)常见的铜的硫化物有CuS和Cu2S两种。已知晶胞中S2-的位置如图1所示,Cu2+、Cu+位于硫离子所构成的四面体中心,它们的晶胞具有相同的侧视图,如图2所示。Cu2S的晶胞参数为a pm,阿伏加德罗常数的值为NA。下列说法正确的是( )
图1 图2
A.S2-是面心立方最密堆积
B.Cu2S晶胞中,Cu+填充了晶胞中一半四面体空隙
C.CuS晶胞中S2-的配位数为8
D.Cu2S晶体的密度为 g·cm-3
3.铁与镁组成的储氢合金的立方晶胞结构如图所示。铁原子位于顶点和面心的位置,镁原子位于将晶胞平分为8个立方单位的体心位置。下列说法正确的是( )
A.铁原子的配位数为4
B.a位置原子的分数坐标为(0.25,0.75,0.75)
C.铁原子与镁原子间最短距离为b nm
D.晶体储氢时,H2在晶胞的体心和棱的中心位置。若储氢后化学式为FeMg2H,则储氢率为100%
4.Li、Fe、Se可形成新型超导材料,晶胞如图所示(Fe原子均位于面上)。晶胞棱边夹角均为90°,X的原子分数坐标为(0,1,),Y的原子分数坐标为(,,),设NA为阿伏加德罗常数的值。下列说法正确的是( )
已知:以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。
A.基态Fe原子的核外电子排布式为[Ar]3d54s2
B.原子分数坐标为(,1,)的是Li原子
C.Se原子X与Se原子Y之间的距离为 nm
D.该晶体的密度为 g·cm-3
5.(不定项)(易错题)氮与锂形成的一种晶体,是由LixN平面层(如图所示)和非密置层的Li交替排列形成的,LixN平面层的Li排列如石墨层中的C,N处于六元环的中心,非密置层的Li位于上下两层的N连线的中点,且连线与平面层垂直。已知平面层Li与Li之间的距离为a nm,平面层之间的距离为b nm,a略小于0.5b,下列说法错误的是( )
A.每个N周围等距且紧邻的Li有8个
B.平面层LixN,x=2
C.可用X射线衍射测定晶体的结构
D.晶体的密度为×1022 g·cm-3
6.Cu是生活中常见的金属元素,在材料、农业、医药等领域具有广泛应用。回答下列问题:
(1)Cu位于周期表的 区;从结构角度分析,比较Cu+与Cu2+的稳定性并说明原因 。
(2)某氨基吡啶衍生物铜配合物X的结构简式如图所示。
X中Cu2+的配位数是 ,两种配体分别为 。
CuFeS2晶体属四方晶系,晶胞(如图A)棱边夹角均为90°。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。M点、N点原子的分数坐标分别为(0,0,0)、(,,)。图B所示结构单元不能作为CuFeS2晶胞的原因是
,X点硫原子的分数坐标为
,晶胞中四面体空隙的占有率为 ,晶胞中硫原子间的最短距离为 pm。
答案与分层梯度式解析
本章复习提升
易混易错练
1.B 碱金属的熔点随着电子层数的增多而降低,所以Na、K、Cs的熔点依次降低,A不正确;元素非金属性越强,其简单氢化物越稳定,所以HCl、H2S、PH3的稳定性依次减弱,B正确;元素非金属性越强,其最高价氧化物对应水化物的酸性越强,所以H2SiO3、H2CO3、H2SO4的酸性依次增强,C不正确;一般来说,晶体的熔点:共价晶体>离子晶体>分子晶体,则单晶硅、CsCl、干冰的熔点依次降低,D不正确。
2.A 原子半径:C碳化硅>硅,A正确;金刚石是共价晶体,氯化钠和氧化镁是离子晶体,二氧化碳是分子晶体,则熔、沸点由高到低:金刚石>氧化镁>氯化钠>二氧化碳,B错误;碳化硅是共价晶体,铁是金属晶体,氯化钠是离子晶体,C60是分子晶体,则硬度由大到小:碳化硅>铁>氯化钠>C60,C错误;非金属性:IH—Br>H—I,D错误。
易错分析 离子晶体、共价晶体、金属晶体的熔点均与所含化学键强弱有关;分子晶体的熔点与分子间作用力的大小有关。一般来说,晶体的熔点:共价晶体>离子晶体>分子晶体。
D 原子1、2的分数坐标分别为(0,0,)和(1,0,0),由TiO2的晶胞结构可知,原子3的分数坐标为(1,1,),A正确;TiO2晶胞中,Ti原子在晶胞的顶点、面上和体心,Ti原子的个数为4,O原子在棱上、面上和体内,O原子个数为8,则一个TiO2晶胞的质量为 g,体积为m2n×10-30 cm3,则TiO2晶体的密度为 g/cm3=
g/cm3,B正确;由TiO2-aNb晶体结构可知,氮掺杂后晶胞中出现3处氧空穴,O原子在棱上、面上和体内,O原子个数为6×+6×+1=
,N原子在棱上、面上,N原子个数为1×+1×=,Ti原子在顶点、面上、体内,Ti原子个数为8×+4×+1=4,Ti、O、N个数比为4∶∶=1∶∶,则TiO2-aNb晶体中2-a=,a=,b=,C正确,D错误。
易错分析 (1)晶体结构分析不到位,造成晶胞中粒子个数计算错误。
pm、 nm与cm之间的单位换算错误造成结果错误。1pm=
10-12 m=10-10 cm,1 nm=10-9 m=10-7 cm。
4.B 在氯化钠晶体中,距Na+最近的Cl-有6个,故A正确;1个题述气态团簇分子中含有4个E原子和4个F原子,则该气态团簇分子的分子式为E4F4或F4E4,故B错误;Ca2+位于晶胞的顶点和面心,数目为8×+6×=4,即每个晶胞平均占有4个Ca2+,故C正确;金刚石晶体中碳碳键被两个碳原子共有,每个碳原子形成4个共价键,即平均1mol
C原子形成2 mol C—C键,碳原子与碳碳键个数之比为1∶2,故D正确。
易错分析 离子晶体、共价晶体、分子晶体等按照“切割法”计算晶胞中微粒个数;气态团簇分子按照组成分子的原子的个数书写分子
式。
5.D 一个硅原子周围距离最近且相等的镁原子有8个,硅原子的配位数为8,A正确;紧邻的两个镁原子的距离等于晶胞棱长的一半,为 nm,B正确;紧邻的两个硅原子间的距离等于面对角线长的一半,为 nm,C正确;该晶体的密度为 g·cm-3,D错误。
思想方法练
B 晶胞M中,Na位于顶点、体心,个数为8×+1=2,Cl位于面上,个数为2×6×=6,晶体的化学式为NaCl3;晶胞N中,Na位于棱心、体内、面心,个数为4×+2+2×=4,Cl位于棱上,个数为8×=2,晶体的化学式为Na2Cl;晶胞P中,Na位于棱心、体内,个数为4×+2
=3,Cl位于顶点,个数为8×=1,晶体的化学式为Na3Cl,A正确。由A项分析可知,M、N、P所含Cl原子的个数比为6∶2∶1,B错误。以体心Na原子为例,距离最近且等距的Cl原子位于6个面上,且每个面上都有2个,共有12个,C正确。由题图可知,1号原子的分数坐标为(,,),D正确。
2.AD 根据题图1可知,S2-位于立方体的顶点和面心,为面心立方最密堆积,故A正确;一个晶胞中S2-的个数为6×+8×=4,化学式为Cu2S,则一个晶胞中Cu+的个数为8,所以Cu+占据了8个四面体空隙,即全部的四面体空隙,故B错误;CuS晶胞中Cu2+位于四面体空隙中,Cu2+的配位数为4,所以S2-的配位数为4,故C错误;Cu2S晶胞的质量为 g= g,晶胞的体积为a3 pm3=a3×10-30 cm3,所以密度为 g·cm-3,故D正确。
3.B 由晶胞结构可知,与铁原子距离最近且等距的镁原子有8个,则铁原子的配位数为8,A错误;将晶胞均分为8个小立方体,a位置镁原子位于左上后侧的小立方体的体心,原子的分数坐标为(0.25,
0.75,0.75),B正确;由晶胞结构可知,位于顶点的铁原子与镁原子间的最短距离为体对角线长度的,则铁原子与镁原子间最短距离为
b nm,C错误;晶胞中铁原子个数为8×+6×=4,镁原子个数为8,若储氢率为100%,则H2个数为12×+1=4,化学式为FeMg2H2,故D错误。
方法点津 晶胞中原子的空间坐标确定方法
(1)明确坐标原点位置及三维空间坐标方向。
(2)确定待求坐标的原子与坐标原点的空间位置。
(3)按(x,y,z)顺序写出待求原子坐标。
4.C Fe为26号元素,基态Fe原子的核外电子排布式为[Ar]3d64s2,A错误;由晶胞结构可知,原子分数坐标为(,1,)的原子是晶胞上部前方的Fe原子,B错误;Se原子X与Se原子Y间,沿x轴方向的距离为 nm,沿y轴方向的距离为 nm,沿z轴方向的距离为
nm,则X与Y原子间的距离为 nm,C正确;该晶胞中,Li原
子有8个位于顶点,1个位于体心,个数为8×+1=2,Fe有8个位于面上,个数为8×=4,Se原子有8个位于棱上,2个位于体内,个数为8×+2=4,晶胞的质量为 g= g,晶胞体积为a2b×
10-21 cm3,密度为 g·cm-3,D错误。
5.AD 平面层Li与Li之间的距离为a nm,N处于六元环中心,则平面层的6个Li到N的距离相等,距离为a nm,非密置层的Li位于上下两层的N连线的中点,a略小于0.5b,则每个N周围等距且紧邻的Li有6个,A错误;LixN平面层的Li排列如石墨层中C,N处于六元环的中心,则N、Li的个数比为1∶2,即x=2,故B正确;可用X射线衍射测定晶体的结构,C正确;在Li形成的四棱柱单元中,N原子位于侧棱心,个数为1,Li位于体内和顶点,个数为1+2=3,晶体密度为 g·cm-3=×1022 g·cm-3,D错误。
6.答案 (1)ds 稳定性:Cu+>Cu2+,Cu+的3d轨道为全充满状态,更稳定
(2)5 、CH3COO-
(3)不能采用“无隙并置”在晶体中重复出现 (,,) 50% a
解析 (1)基态Cu原子的价电子排布式为3d104s1,位于周期表的ds区;基态铜原子失去1个电子形成Cu+,价电子排布式为3d10,3d轨道为稳定的全充满结构,不易失去电子。
(2)由X的结构简式可知,1个Cu2+与4个O和1个N形成配位键,Cu2+的配位数是5,两种配体分别为、CH3COO-。
(3)N点位于晶胞体心,X点S原子位于题图A上半个晶胞体对角线的的位置,根据M点、N点原子的分数坐标分别为(0,0,0)、(,,)可知,X点硫原子的分数坐标为(,,);根据晶胞结构可知,该晶胞中Cu和Fe形成了16个四面体空隙,其中8个四面体空隙填充了S,即晶胞中四面体空隙的占有率为50%;晶胞中硫原子间的最短距离为晶胞底面对角线长度的一半,为 pm=a pm。
2
易混易错练
易错点1 晶体类型判断错误导致比较晶体的
性质时出错
1.下列物质性质递变规律正确的是( )
A.Na、K、Cs的熔点依次升高
B.HCl、H2S、PH3的稳定性依次减弱
C.H2CO3、H2SiO3、H2SO4的酸性依次增强
D.单晶硅、CsCl、干冰的熔点依次升高
2.下列比较正确的是( )
A.化学键的键能由大到小:金刚石>碳化硅>硅
B.熔、沸点由高到低:氯化钠>氧化镁>金刚石>二氧化碳
C.硬度由大到小:C60>碳化硅>铁>氯化钠
D.共价键的极性由强到弱:H—I>H—Br>H—Cl
易错点2 晶体结构判断错误导致计算出错
3.TiO2通过氮掺杂得到TiO2-aNb,结构如图所示。已知原子1、2的分数坐标分别为(0,0,)、(1,0,0),设NA为阿伏加德罗常数的值。下列说法错误的是 ( )
A.原子3的分数坐标为(1,1,)
B.TiO2的密度为 g/cm3
C.TiO2-aNb晶体中a=
D.TiO2-aNb晶体中b=
4.有关晶体的结构如图所示,下列说法中不正确的是( )
A.在NaCl晶体中,距Na+最近的Cl-有6个
B.上述气态团簇分子的分子式为EF或FE
C.在CaF2晶体中,每个晶胞平均占有4个C
D.在金刚石晶体中,碳原子与碳碳键个数之比为1∶2
5.Mg2Si具有反萤石结构,其晶胞结构如图所示,晶胞棱长为0.635 nm。下列叙述错误的是( )
A.Si的配位数为8
B.紧邻的两个Mg原子的距离为 nm
C.紧邻的两个Si原子间的距离为 nm
D.Mg2Si晶体的密度为 g·cm-3
思想方法练
利用建模思想解答晶胞中的相关计算问题
方法概述
有关晶胞计算类试题,可以将晶胞中原子“质点”化,构成立体模型,根据模型确定晶胞结构,推算物质化学式,再进一步计算密度、微粒间的距离等。此类试题中常见的计算:
(1)化学式:利用“切割法”计算一个晶胞中所含组成微粒的个数。
(2)晶体的密度:ρ=。式中ρ为晶体的密度,V为一个晶胞的体积,M为构成晶胞微粒的摩尔质量,N为晶胞所含微粒个数,NA为阿伏加德罗常数。
(3)微粒间的距离:分析晶胞构成及晶胞几何构型中各线性关系求算,若立方体晶胞的边长是a,则面对角线长是a,体对角线长是a。
1.高压不仅会引发物质的相变,还会导致新类型化学键的形成。如图所示,M、N、P为Na与FeCl2在50 GPa~300
GPa的高压下反应生成的不同晶体晶胞,下列说法错误的是( )
A.M、N、P晶体的化学式分别为NaCl3、Na2Cl、Na3Cl
B.晶胞M、N、P中所含Cl原子的个数之比为3∶1∶1
C.晶体M中与Na原子距离最近且等距的Cl原子有12个
D.1号原子的分数坐标为(,,)
2.(不定项)常见的铜的硫化物有CuS和Cu2S两种。已知晶胞中S2-的位置如图1所示,Cu2+、Cu+位于硫离子所构成的四面体中心,它们的晶胞具有相同的侧视图,如图2所示。Cu2S的晶胞参数为a pm,阿伏加德罗常数的值为NA。下列说法正确的是( )
图1 图2
A.S2-是面心立方最密堆积
B.Cu2S晶胞中,Cu+填充了晶胞中一半四面体空隙
C.CuS晶胞中S2-的配位数为8
D.Cu2S晶体的密度为 g·cm-3
3.铁与镁组成的储氢合金的立方晶胞结构如图所示。铁原子位于顶点和面心的位置,镁原子位于将晶胞平分为8个立方单位的体心位置。下列说法正确的是( )
A.铁原子的配位数为4
B.a位置原子的分数坐标为(0.25,0.75,0.75)
C.铁原子与镁原子间最短距离为b nm
D.晶体储氢时,H2在晶胞的体心和棱的中心位置。若储氢后化学式为FeMg2H,则储氢率为100%
4.Li、Fe、Se可形成新型超导材料,晶胞如图所示(Fe原子均位于面上)。晶胞棱边夹角均为90°,X的原子分数坐标为(0,1,),Y的原子分数坐标为(,,),设NA为阿伏加德罗常数的值。下列说法正确的是( )
已知:以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。
A.基态Fe原子的核外电子排布式为[Ar]3d54s2
B.原子分数坐标为(,1,)的是Li原子
C.Se原子X与Se原子Y之间的距离为 nm
D.该晶体的密度为 g·cm-3
5.(不定项)(易错题)氮与锂形成的一种晶体,是由LixN平面层(如图所示)和非密置层的Li交替排列形成的,LixN平面层的Li排列如石墨层中的C,N处于六元环的中心,非密置层的Li位于上下两层的N连线的中点,且连线与平面层垂直。已知平面层Li与Li之间的距离为a nm,平面层之间的距离为b nm,a略小于0.5b,下列说法错误的是( )
A.每个N周围等距且紧邻的Li有8个
B.平面层LixN,x=2
C.可用X射线衍射测定晶体的结构
D.晶体的密度为×1022 g·cm-3
6.Cu是生活中常见的金属元素,在材料、农业、医药等领域具有广泛应用。回答下列问题:
(1)Cu位于周期表的 区;从结构角度分析,比较Cu+与Cu2+的稳定性并说明原因 。
(2)某氨基吡啶衍生物铜配合物X的结构简式如图所示。
X中Cu2+的配位数是 ,两种配体分别为 。
CuFeS2晶体属四方晶系,晶胞(如图A)棱边夹角均为90°。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。M点、N点原子的分数坐标分别为(0,0,0)、(,,)。图B所示结构单元不能作为CuFeS2晶胞的原因是
,X点硫原子的分数坐标为
,晶胞中四面体空隙的占有率为 ,晶胞中硫原子间的最短距离为 pm。
答案与分层梯度式解析
本章复习提升
易混易错练
1.B 碱金属的熔点随着电子层数的增多而降低,所以Na、K、Cs的熔点依次降低,A不正确;元素非金属性越强,其简单氢化物越稳定,所以HCl、H2S、PH3的稳定性依次减弱,B正确;元素非金属性越强,其最高价氧化物对应水化物的酸性越强,所以H2SiO3、H2CO3、H2SO4的酸性依次增强,C不正确;一般来说,晶体的熔点:共价晶体>离子晶体>分子晶体,则单晶硅、CsCl、干冰的熔点依次降低,D不正确。
2.A 原子半径:C
易错分析 离子晶体、共价晶体、金属晶体的熔点均与所含化学键强弱有关;分子晶体的熔点与分子间作用力的大小有关。一般来说,晶体的熔点:共价晶体>离子晶体>分子晶体。
D 原子1、2的分数坐标分别为(0,0,)和(1,0,0),由TiO2的晶胞结构可知,原子3的分数坐标为(1,1,),A正确;TiO2晶胞中,Ti原子在晶胞的顶点、面上和体心,Ti原子的个数为4,O原子在棱上、面上和体内,O原子个数为8,则一个TiO2晶胞的质量为 g,体积为m2n×10-30 cm3,则TiO2晶体的密度为 g/cm3=
g/cm3,B正确;由TiO2-aNb晶体结构可知,氮掺杂后晶胞中出现3处氧空穴,O原子在棱上、面上和体内,O原子个数为6×+6×+1=
,N原子在棱上、面上,N原子个数为1×+1×=,Ti原子在顶点、面上、体内,Ti原子个数为8×+4×+1=4,Ti、O、N个数比为4∶∶=1∶∶,则TiO2-aNb晶体中2-a=,a=,b=,C正确,D错误。
易错分析 (1)晶体结构分析不到位,造成晶胞中粒子个数计算错误。
pm、 nm与cm之间的单位换算错误造成结果错误。1pm=
10-12 m=10-10 cm,1 nm=10-9 m=10-7 cm。
4.B 在氯化钠晶体中,距Na+最近的Cl-有6个,故A正确;1个题述气态团簇分子中含有4个E原子和4个F原子,则该气态团簇分子的分子式为E4F4或F4E4,故B错误;Ca2+位于晶胞的顶点和面心,数目为8×+6×=4,即每个晶胞平均占有4个Ca2+,故C正确;金刚石晶体中碳碳键被两个碳原子共有,每个碳原子形成4个共价键,即平均1mol
C原子形成2 mol C—C键,碳原子与碳碳键个数之比为1∶2,故D正确。
易错分析 离子晶体、共价晶体、分子晶体等按照“切割法”计算晶胞中微粒个数;气态团簇分子按照组成分子的原子的个数书写分子
式。
5.D 一个硅原子周围距离最近且相等的镁原子有8个,硅原子的配位数为8,A正确;紧邻的两个镁原子的距离等于晶胞棱长的一半,为 nm,B正确;紧邻的两个硅原子间的距离等于面对角线长的一半,为 nm,C正确;该晶体的密度为 g·cm-3,D错误。
思想方法练
B 晶胞M中,Na位于顶点、体心,个数为8×+1=2,Cl位于面上,个数为2×6×=6,晶体的化学式为NaCl3;晶胞N中,Na位于棱心、体内、面心,个数为4×+2+2×=4,Cl位于棱上,个数为8×=2,晶体的化学式为Na2Cl;晶胞P中,Na位于棱心、体内,个数为4×+2
=3,Cl位于顶点,个数为8×=1,晶体的化学式为Na3Cl,A正确。由A项分析可知,M、N、P所含Cl原子的个数比为6∶2∶1,B错误。以体心Na原子为例,距离最近且等距的Cl原子位于6个面上,且每个面上都有2个,共有12个,C正确。由题图可知,1号原子的分数坐标为(,,),D正确。
2.AD 根据题图1可知,S2-位于立方体的顶点和面心,为面心立方最密堆积,故A正确;一个晶胞中S2-的个数为6×+8×=4,化学式为Cu2S,则一个晶胞中Cu+的个数为8,所以Cu+占据了8个四面体空隙,即全部的四面体空隙,故B错误;CuS晶胞中Cu2+位于四面体空隙中,Cu2+的配位数为4,所以S2-的配位数为4,故C错误;Cu2S晶胞的质量为 g= g,晶胞的体积为a3 pm3=a3×10-30 cm3,所以密度为 g·cm-3,故D正确。
3.B 由晶胞结构可知,与铁原子距离最近且等距的镁原子有8个,则铁原子的配位数为8,A错误;将晶胞均分为8个小立方体,a位置镁原子位于左上后侧的小立方体的体心,原子的分数坐标为(0.25,
0.75,0.75),B正确;由晶胞结构可知,位于顶点的铁原子与镁原子间的最短距离为体对角线长度的,则铁原子与镁原子间最短距离为
b nm,C错误;晶胞中铁原子个数为8×+6×=4,镁原子个数为8,若储氢率为100%,则H2个数为12×+1=4,化学式为FeMg2H2,故D错误。
方法点津 晶胞中原子的空间坐标确定方法
(1)明确坐标原点位置及三维空间坐标方向。
(2)确定待求坐标的原子与坐标原点的空间位置。
(3)按(x,y,z)顺序写出待求原子坐标。
4.C Fe为26号元素,基态Fe原子的核外电子排布式为[Ar]3d64s2,A错误;由晶胞结构可知,原子分数坐标为(,1,)的原子是晶胞上部前方的Fe原子,B错误;Se原子X与Se原子Y间,沿x轴方向的距离为 nm,沿y轴方向的距离为 nm,沿z轴方向的距离为
nm,则X与Y原子间的距离为 nm,C正确;该晶胞中,Li原
子有8个位于顶点,1个位于体心,个数为8×+1=2,Fe有8个位于面上,个数为8×=4,Se原子有8个位于棱上,2个位于体内,个数为8×+2=4,晶胞的质量为 g= g,晶胞体积为a2b×
10-21 cm3,密度为 g·cm-3,D错误。
5.AD 平面层Li与Li之间的距离为a nm,N处于六元环中心,则平面层的6个Li到N的距离相等,距离为a nm,非密置层的Li位于上下两层的N连线的中点,a略小于0.5b,则每个N周围等距且紧邻的Li有6个,A错误;LixN平面层的Li排列如石墨层中C,N处于六元环的中心,则N、Li的个数比为1∶2,即x=2,故B正确;可用X射线衍射测定晶体的结构,C正确;在Li形成的四棱柱单元中,N原子位于侧棱心,个数为1,Li位于体内和顶点,个数为1+2=3,晶体密度为 g·cm-3=×1022 g·cm-3,D错误。
6.答案 (1)ds 稳定性:Cu+>Cu2+,Cu+的3d轨道为全充满状态,更稳定
(2)5 、CH3COO-
(3)不能采用“无隙并置”在晶体中重复出现 (,,) 50% a
解析 (1)基态Cu原子的价电子排布式为3d104s1,位于周期表的ds区;基态铜原子失去1个电子形成Cu+,价电子排布式为3d10,3d轨道为稳定的全充满结构,不易失去电子。
(2)由X的结构简式可知,1个Cu2+与4个O和1个N形成配位键,Cu2+的配位数是5,两种配体分别为、CH3COO-。
(3)N点位于晶胞体心,X点S原子位于题图A上半个晶胞体对角线的的位置,根据M点、N点原子的分数坐标分别为(0,0,0)、(,,)可知,X点硫原子的分数坐标为(,,);根据晶胞结构可知,该晶胞中Cu和Fe形成了16个四面体空隙,其中8个四面体空隙填充了S,即晶胞中四面体空隙的占有率为50%;晶胞中硫原子间的最短距离为晶胞底面对角线长度的一半,为 pm=a pm。
2
