第3章 不同聚集状态的物质与性质综合拔高练
文档属性
| 名称 | 第3章 不同聚集状态的物质与性质综合拔高练 |

|
|
| 格式 | docx | ||
| 文件大小 | 783.8KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-10-28 18:08:36 | ||
图片预览



文档简介
综合拔高练
高考真题练
考点1 晶体的类型及性质
1.(2024山东,4)下列物质均为共价晶体且成键结构相似,其中熔点最低的是( )
A.金刚石(C)
B.单晶硅(Si)
C.金刚砂(SiC)
D.氮化硼(BN,立方相)
2.(高考组合)回答下列问题:
(1)(2023浙江1月选考,17节选)Si与P形成的某化合物晶体的晶胞如图。该晶体类型是 ,该化合物的化学式为 。
(2)(2023全国甲,35节选)如图所示的几种碳单质,它们互为 ,其中属于原子晶体的是 ,C60间的作用力是 。
(3)(2023山东,16节选)卤素可形成许多结构和性质特殊的化合物。-40 ℃时,F2与冰反应生成HOF和HF。常温常压下,HOF为无色气体,固态HOF的晶体类型为 。
考点2 晶体的结构及相关计算
3.(2024湖北,11)黄金按质量分数分级,纯金为24K。Au-Cu合金的三种晶胞结构如图,Ⅰ、Ⅱ和Ⅲ是立方晶胞。下列说法错误的是( )
A.Ⅰ为18K金
B.Ⅱ中Au的配位数是12
C.Ⅲ中最小核间距Au—CuD.Ⅰ、Ⅱ、Ⅲ中,Au与Cu原子个数比依次为1∶1、1∶3、3∶1
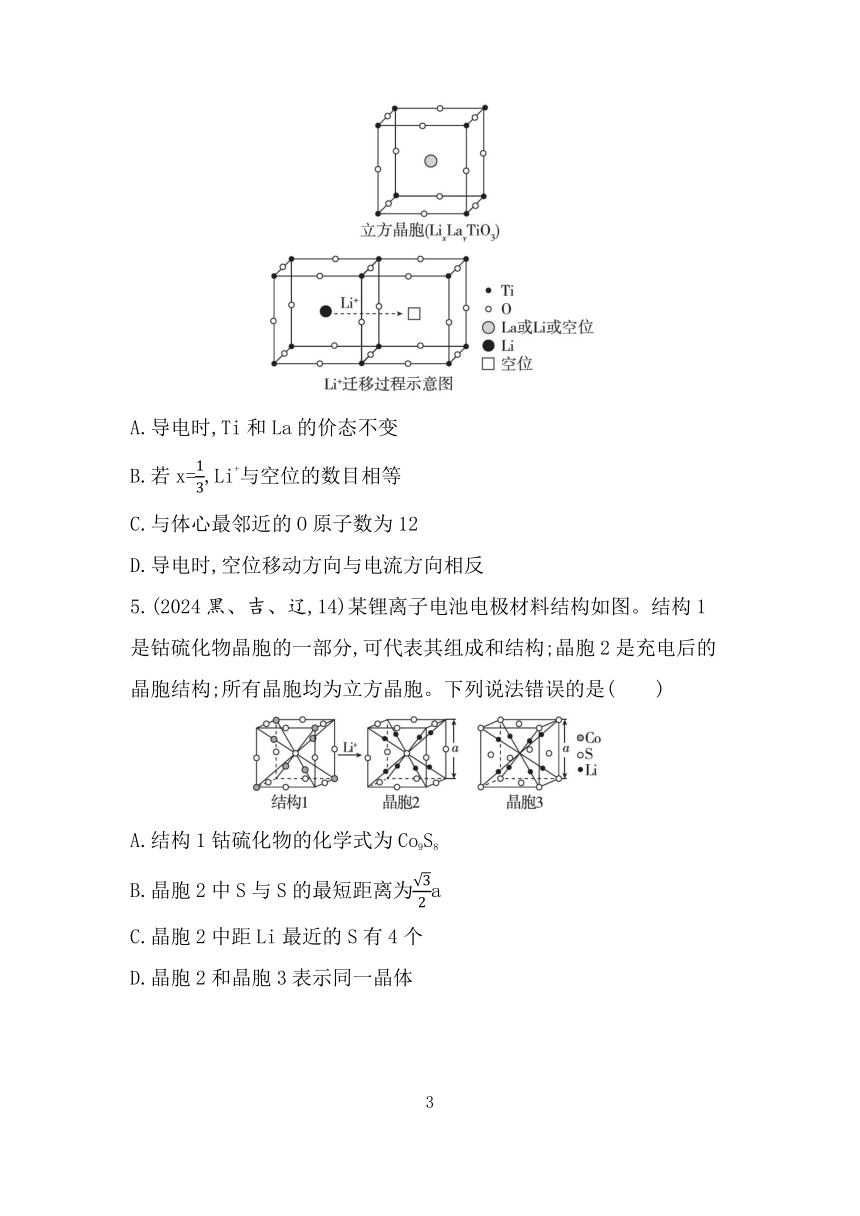
4.(2024安徽,14)研究人员制备了一种具有锂离子通道的导电氧化物(LixLayTiO3),其立方晶胞和导电时Li+迁移过程如图所示。已知该氧化物中Ti为+4价,La为+3价。下列说法错误的是( )
A.导电时,Ti和La的价态不变
B.若x=,Li+与空位的数目相等
C.与体心最邻近的O原子数为12
D.导电时,空位移动方向与电流方向相反
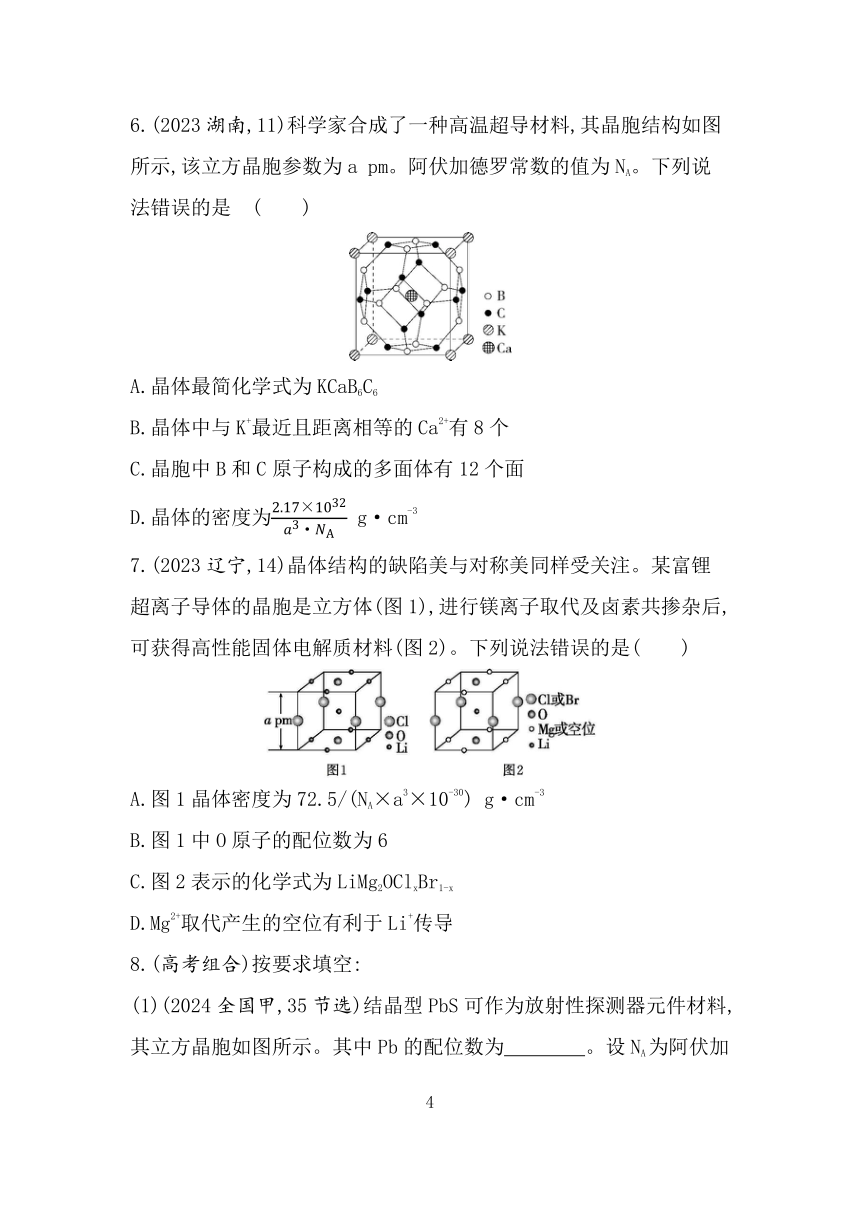
5.(2024黑、吉、辽,14)某锂离子电池电极材料结构如图。结构1是钴硫化物晶胞的一部分,可代表其组成和结构;晶胞2是充电后的晶胞结构;所有晶胞均为立方晶胞。下列说法错误的是( )
A.结构1钴硫化物的化学式为Co9S8
B.晶胞2中S与S的最短距离为a
C.晶胞2中距Li最近的S有4个
D.晶胞2和晶胞3表示同一晶体
6.(2023湖南,11)科学家合成了一种高温超导材料,其晶胞结构如图所示,该立方晶胞参数为a pm。阿伏加德罗常数的值为NA。下列说法错误的是 ( )
A.晶体最简化学式为KCaB6C6
B.晶体中与K+最近且距离相等的Ca2+有8个
C.晶胞中B和C原子构成的多面体有12个面
D.晶体的密度为 g·cm-3
7.(2023辽宁,14)晶体结构的缺陷美与对称美同样受关注。某富锂超离子导体的晶胞是立方体(图1),进行镁离子取代及卤素共掺杂后,可获得高性能固体电解质材料(图2)。下列说法错误的是( )
A.图1晶体密度为72.5/(NA×a3×10-30) g·cm-3
B.图1中O原子的配位数为6
C.图2表示的化学式为LiMg2OClxBr1-x
D.Mg2+取代产生的空位有利于Li+传导
8.(高考组合)按要求填空:
(1)(2024全国甲,35节选)结晶型PbS可作为放射性探测器元件材料,其立方晶胞如图所示。其中Pb的配位数为 。设NA为阿伏加
德罗常数的值,则该晶体密度为 g·cm-3(列出计算式)。
(2)(2024黑、吉、辽,18节选)负载在TiO2上的RuO2催化活性高,稳定性强。TiO2和RuO2的晶体结构均可用如图表示,二者晶胞体积近似相等,RuO2与TiO2的密度比为1.66,则Ru的相对原子质量为 (精确至1,已知:Ti的相对原子质量为48)。
9.(高考组合)回答下列问题:
(1)(2023全国乙,35节选)一种硼镁化合物具有超导性能,晶体结构属于六方晶系,其晶体结构、晶胞沿c轴的投影图如图所示,晶胞中含有 个Mg。该物质化学式为 ,B-B最近距离为 。
(2)(2023新课标,29节选)合成氨催化剂前驱体(主要成分为Fe3O4)使用前经H2还原,生成α-Fe包裹的Fe3O4。已知α-Fe属于立方晶系,晶胞参数a=287 pm,密度为7.8 g·cm-3。则α-Fe晶胞中含有Fe的原子数为 (列出计算式,阿伏加德罗常数的值为NA)。
(3)(2023全国甲,35节选)AlF3结构属立方晶系,晶胞如图所示,F-的配位数为 。若晶胞参数为a pm,晶体密度ρ= g·cm-3(列出计算式,阿伏加德罗常数的值为NA)。
(4)(2023山东,16节选)一定条件下,CuCl2、K和F2反应生成KCl和化合物X。已知X属于四方晶系,晶胞结构如图所示(晶胞参数a=b≠c,α=β=γ=90°),其中Cu化合价为+2。上述反应的化学方程式为 。若阿伏加德罗常数的值为NA,化合物X的密度ρ= g·cm-3(用含NA的代数式表示)。
考点3 超分子
10.(2024湖北,15)科学家合成了一种如图所示的纳米“分子客车”,能装载多种稠环芳香烃。三种芳烃与“分子客车”的结合常数(值越大越稳定)见表。下列说法错误的是( )
芳烃 芘 并四苯 蒄
结构
结合常数 385 3 764 176 000
A.芳烃与“分子客车”可通过分子间相互作用形成超分子
B.并四苯直立装载与平躺装载的稳定性基本相同
C.从分子大小适配看“分子客车”可装载2个芘
D.芳烃π电子数越多越有利于和“分子客车”的结合
11.(2024黑、吉、辽,9)环六糊精(D-吡喃葡萄糖缩合物)具有空腔结构,腔内极性较小,腔外极性较大,可包合某些分子形成超分子。图1、图2和图3分别表示环六糊精结构、超分子示意图及相关应用。下列说法错误的是( )
A.环六糊精属于寡糖
B.非极性分子均可被环六糊精包合形成超分子
C.图2中甲氧基对位暴露在反应环境中
D.可用萃取法分离环六糊精和氯代苯甲醚
高考模拟练
应用实践
1.C3N4和Si3N4晶体结构相似,是新型的非金属高温陶瓷材料。下列说法正确的是( )
A.C3N4和Si3N4晶体中N的化合价均为+3
B.C3N4熔、沸点小于Si3N4
C.C3N4晶体的硬度比Si3N4晶体的硬度大
D.C3N4和Si3N4晶体均为分子晶体
2.新型二维共价晶体材料在光电、催化、新能源以及生物医学等领域中的应用具有重要意义,硒和钒形成的晶体就是其中的一种,晶体中硒原子和钒原子是分层排布的,如图是该晶体微观结构的透视图。
下列有关说法正确的是( )
A.基态硒原子的价电子排布式为3d104s24p4
B.该晶体应该具有较高的熔点
C.假设俯视图中菱形的面积为s m2,则该晶体单位面积质量为
g/m2
D.该晶体的化学式为VSe
3.氧化铈(CeO2)是一种重要的光催化材料,光催化过程中立方晶胞的组成变化如图所示。假设CeO2晶胞边长为a pm,下列说法不正确的是( )
A.基态O原子的价电子排布式为2s22p4
B.CeO2晶体结构中每个Ce4+周围距离最近且相等的Ce4+有12个
C.CeO2晶胞中Ce4+与距离最近的O2-的核间距为a pm
D.每个CeO2-x晶胞中Ce4+个数为1-2x
4.(不定项)氟化镁的一种晶胞具有典型的四方晶系结构(如图所示),已知以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,晶胞中B原子分数坐标为(0.81,0.19,0.5),晶胞有对称中心。下列说法正确的是 ( )
A.白球表示镁原子
B.与氟化钙晶胞结构相同
C.C原子分数坐标为(0.19,0.81,0.5)
D.晶胞中B、C两原子之间的核间距为0.62a pm
5.现有几组物质的熔点(℃)数据:
A组 B组 C组 D组
金刚石:3 550 Li:181 HF:-83 NaCl
硅晶体:1 410 Na:98 HCl:-115 KCl
硼晶体:2 300 K:64 HBr:-89 RbCl
二氧化硅:1 732 Rb:39 HI:-51 CsCl
(1)A组中硅晶体的熔点低于金刚石,原因是
。
(2)C组中HF相对分子质量小于HCl,但熔点却高于HCl,是由于 。
(3)D组晶体中NaCl、KCl、RbCl、CsCl的熔点由高到低的顺序为 。
(4)FeS2晶体的晶胞如图1所示,与NaCl的晶胞结构相似。若将由顶点转换成体心,则Fe2+的位置转换为 。
CaF2的晶胞如图2所示,密度为ρ g/cm3,相邻的两个Ca2+的最近核间距为a nm,则CaF2的摩尔质量为 g/mol(列出代数式,
设NA为阿伏加德罗常数的值)。
迁移创新
6.某水性钠离子电池电极材料由Na+、Fe2+、Fe3+、CN-组成,随着立方晶胞嵌入和嵌出Na+,Fe2+与Fe3+的含量发生变化,依次变为格林绿、普鲁士蓝、普鲁士白三种物质,其过程如图。下列说法不正确的是( )
A.基态Fe原子的价电子排布式为3d64s2,失去4s电子转化为Fe2+
B.普鲁士蓝的导电能力小于普鲁士白
C.普鲁士蓝中Fe2+与Fe3+的个数比为1∶2
D.普鲁士白的化学式可表示为NaFe(CN)3
7.富勒烯是一类完全由碳组成的中空分子,在催化、光电等很多领域都有重要作用。
Ⅰ.C60以其完美的球烯受到科学家重视,其结构如图所示。60个碳原子是等同的,均为近似sp2杂化,但却有两种不同类型的碳碳键。其中一种为138 pm,另一种为145 pm。
(1)C60在水中溶解度 (填“>”“<”或“≈”)C60在苯中溶解度。
(2)石墨、C60互为同素异形体,但相同条件下,石墨的熔点比C60高得多,原因是
。
Ⅱ.C60常态下是紫色固体,不导电,但给富勒烯掺杂金属后(用金属原子把富勒烯分子连起来或者把金属原子放进富勒烯“笼子”里),其在一定条件下甚至可以成为超导体。
(3)C60晶体结构中存在四面体空隙(如图中1、3、6、7围成的空隙)和八面体空隙(如图中3、6、7、8、9、12围成的空隙),所有空隙均填充一个金属M原子,可获得某条件下的超导材料,则该超导材料中,平均一个C60晶胞需掺杂 个M原子。
(4)C60、石墨、金刚石互为同素异形体。石墨晶体结构及晶胞如图1、图2所示。则石墨晶胞中含碳原子个数为 。已知石墨的密度为ρ g·cm-3,C—C键键长为r cm,阿伏加德罗常数的值为NA,计算石墨晶体的层间距d为 cm。
答案与分层梯度式解析
综合拔高练
高考真题练
1.B 一般结构相似的共价晶体,原子半径越小,形成的共价键键长越短,键能越大,晶体熔点越高。原子半径:Si>B>C>N,单晶硅(Si)中Si—Si键键长最长,键能最小,晶体熔点最低,故选B。
2.答案 (1)共价晶体 SiP2 (2)同素异形体 金刚石 范德华力 (3)分子晶体
解析 (1)由题中晶胞图可知,该晶体为空间网状结构,属于共价晶体;从晶胞图中原子的分布可知,Si在晶胞的顶点与面心,因此1个晶胞中Si的个数为8×+6×=4,P都在晶胞内部,共8个,所以Si、P原子个数比为1∶2,该化合物的化学式为SiP2。(2)题图中的四种物质为碳元素的不同单质,它们互为同素异形体。这四种物质中金刚石属于原子晶体(共价晶体),石墨属于混合型晶体,碳纳米管是一种管状的纳米级石墨晶体,C60属于分子晶体。C60属于分子晶体,故C60间的作用力是范德华力。(3)常温常压下 HOF为无色气体,说明其沸点低,可推知固态HOF为分子晶体。
C 24K金的质量分数为100%,则18K金的质量分数为×100%
=75%;Ⅰ中,Au位于体心,个数为1,Cu位于顶点,个数为8×=1,Ⅰ中Au与Cu的个数比为1∶1,其中Au的质量分数为×100%≈75%,故Ⅰ为18K金,A正确。Ⅱ中,与Au距离最近且相等的Cu位于相邻面心上,个数为3×8×=12,故Au的配位数为12,B正确。Ⅲ中Au—Cu的最小核间距为面对角线长度的,Au—Au的最小核间距也为面对角线长度的,故最小核间距Au—Cu=Au—Au,C错误。由A项分析可知,Ⅰ中Au与Cu的个数比为1∶1;Ⅱ中Au位于顶点,个数为8×=
1,Cu位于面心,个数为6×=3,Au与Cu的个数比为1∶3;Ⅲ中Cu位于顶点,个数为8×=1,Au位于面心,个数为6×=3,Au与Cu的个数比为3∶1,D正确。
B 导电时,Li+迁移至空位,Li+的价态不变,则Ti和La的价态也不变,A正确;该导电氧化物(LixLayTiO3)中Ti为+4价,La为+3价,若x=,依据化合物中各元素正、负化合价代数和为0,可得×(+1)+
y×(+3)+4+3×(-2)=0,y=,由立方晶胞(LixLayTiO3)图可知,晶胞中含O2-数为12×=3,Ti4+数为8×=1,La3+、Li+、空位共同占据体心,总数为1,则空位数=1--=,与Li+数目不相等,B错误;与体心最邻近的O原子在晶胞的棱心上,数目为12,C正确;导电时,Li+迁移至空位,电流移动方向与Li+迁移方向相同,则与空位移动方向相反,D正确。
B 根据“切割法”,结构1中S的个数为12×+1=4,Co的个数为4×+4=4.5,则结构1钴硫化物的化学式为Co9S8,A正确;晶胞2中S与S的最短距离为面对角线长度的一半,为a,B错误;如图:
,以图中圆圈圈起来的Li为例,与其最近的S共4个,C正确;如图:,当2个晶胞2放在一起时,图中蓝框截取的部分就是晶胞3,晶胞2和晶胞3表示同一晶体,D正确。
6.C 1个晶胞中的K原子数为8×=1,Ca原子数为1,B原子数为12×=6,C原子数为12×=6,故晶体最简化学式为KCaB6C6,A项正确;K+位于顶点,Ca2+位于体心,与K+最近且距离相等的Ca2+位于共用1个顶点的8个立方晶胞的体心,B项正确;晶胞中B和C原子构成的多面体有14个面,6个位于晶胞的面上,8个位于晶胞内部,垂直于体对角线,C项错误;由A项分析可知1个晶胞中有1个“KCaB6C6”,晶胞的体积为(a×10-10)3 cm3,质量为(×1)g,晶体密度为 g·cm-3,即 g·cm-3,D项正确。
7.C 根据“切割法”计算,图1晶胞中含有1个Cl,1个O,3个Li,密度ρ= g·cm-3= g·cm-3,A项正确;图1中与氧原子距离最近( pm)的Li有6个,则O原子的配位数为6,B项正确;图2晶胞中含有1个Li,Mg或空位共2个,1个O,Cl或Br共1个,根据化合物中各元素正、负化合价代数和为0,得Mg有1个,所以化学式为LiMgOClxBr1-x,C项错误;Mg2+取代Li+后,产生的空位可供
Li+移动传导电荷,增强导电性,D项正确。
8.答案 (1)6 (2)101
解析 (1)与Pb原子距离最近且距离相等的S原子的个数为6,则Pb的配位数为6;PbS晶胞中含有4个Pb和4个S,该晶体的密度为 g·cm-3。(2)TiO2和RuO2的晶体结构相同,晶胞体积近似相等,其密度之比等于相对分子质量之比,又TiO2的相对分子质量为80,则RuO2的相对分子质量=80×1.66≈133,Ru的相对原子质量为133-32=101。
9.答案 (1)1 MgB2 a
(2)
(3)2
(4)CuCl2+4K+2F2 K2CuF4+2KCl
解析 (1)Mg原子占据晶胞8个顶点,故1个晶胞中含有Mg原子数目为4×+4×=1,根据c轴投影图可知,1个晶胞内部有2个B原子,故Mg、B原子个数之比为1∶2,其化学式为MgB2;题给c轴投影图中B原子占据等边三角形的中心,如图所示,B—B键键长为B原子中心到O点的距离的两倍,易求得B原子中心到O点的距离为a,则两个B原子间最近距离为a。(2)设晶胞中含Fe原子数为N,则密度ρ= g·cm-3=7.8 g·cm-3,得出N=。(3)由题图可知,1个该晶胞中顶点处粒子的数目为8×=1,棱心处粒子的数目为12×=3,故顶点处粒子为Al3+,棱心处粒子为F-,距F-最近且等距离的Al3+的数目为2,故F-的配位数为2。晶胞质量为 g= g,晶胞体积为(a×10-10)3 cm3,晶体密度为 g·cm-3。(4)由题给晶胞结构可知,1个晶胞中,“”有8×+2×1=4个,“”有16×+2×1+4×=8个,“”有8×+1=2个,故化合物X中含有3种原子,且原子最简整数比为2∶4∶1,根据原子守恒,化合物X中一定含有Cu和F,且Cu为+2价,故化合物X中还含有K,其化学式为K2CuF4,反应的化学方程式为CuCl2+4K+2F2
K2CuF4+2KCl。依据ρ=,得ρ= g·
cm-3= g·cm-3。
B “分子客车”能装载多种稠环芳香烃,芳烃与“分子客车”通过分子间相互作用形成超分子,A项正确;“分子客车”的长为
2.2 nm、高为0.7 nm,平躺装载时更稳定,B项错误;2个芘分子与“分子客车”长度大小适配,故“分子客车”可装载2个芘,C项正确;芘、并四苯、蒄中π电子数逐渐增多,与“分子客车”的结合常数逐渐增大,而结合常数越大越稳定,故芳烃π电子数越多越有利于和“分子客车”结合,D项正确。
11.B 1 mol糖水解后能产生2~10 mol单糖的称为寡糖,由环六糊精结构可知,环六糊精属于寡糖,A正确;非极性分子与环六糊精形成超分子时,分子直径大小应与环六糊精空腔大小接近,B错误;根据题图3可知,在环六糊精中,与HOCl反应主要生成,说明题图2中甲氧基的对位暴露在反应环境中,C正确;环六糊精含多个羟基,可与水形成分子间氢键,故环六糊精能溶于水中,而氯代苯甲醚不溶于水,可用水作萃取剂分离环六糊精和氯代苯甲醚,D正确。
高考模拟练
1.C N元素的电负性大于C元素和Si元素,在C3N4和Si3N4中,N元素显-3价,A错误;C3N4和Si3N4均为新型的非金属高温陶瓷材料,都是共价晶体,C原子半径小于Si原子半径,则键长C—NSi—N,故C3N4晶体的硬度以及熔、沸点均比Si3N4晶体的大,C正确,B、D错误。
素养解读 能从微观层面判断晶体的构成微粒以及微粒间的作用力,明确影响晶体性质的因素,能从宏观和微观相结合的视角分析与解决实际问题,体现了宏观辨识与微观探析的化学学科核心素养。
2.B 一般主族元素的价电子只包括最外层电子,硒在周期表中的位置是第4周期ⅥA族,基态Se原子的价电子排布式为4s24p4,A错误;该共价晶体中Se原子与V原子以共价键连在一起,熔化时需克服共价键,具有较高的熔点,B正确;菱形中Se原子个数为2,V原子个数为1,则该晶体单位面积质量为 g/m2= g/m2,C错误;根据C项分析,可知该晶体的化学式为VSe2,D错误。
3.D 基态O原子的价电子排布式为2s22p4,故A正确;由晶胞结构可知,以任一顶点的Ce4+为研究对象,距离其最近的Ce4+位于该顶点所在的三个面的面心,一个顶点被8个晶胞共用,则每个Ce4+周围距离最近且相等的Ce4+的个数为=12,故B正确;CeO2晶胞中Ce4+与距离最近的O2-的核间距为晶胞体对角线长度的,即a pm,故C正确;假设CeO2-x中的Ce4+和Ce3+的个数分别为m、n,m+n=1,由化合物中元素正、负化合价代数和为0可得4m+3n=4-2x,解得m=1-2x,由晶胞结构可知,位于顶点和面心的Ce4+、Ce3+共有8×+6×=4个,所以每个晶胞中Ce4+的个数为4-8x,故D不正确。
4.CD 题给晶胞中白球的数目为2+4×=4,黑球的数目为1+8×=2,即黑球与白球的个数比为1∶2,由氟化镁的化学式MgF2可知,白球表示氟原子,故A错误;氟化钙的晶胞结构为,与氟化镁的晶胞结构不同,故B错误;根据晶胞中B原子分数坐标为(0.81,
0.19,0.5),晶胞含对称中心,可知C原子分数坐标为(0.19,0.81,
0.5),故C正确;由B、C原子分数坐标可知,B、C两原子之间的核间距为a pm-×0.19a pm×2=0.62a pm,故D正确。
5.答案 (1)二者均为共价晶体,原子半径Si大于C,键长Si—Si键大于C—C键,故键能Si—Si键小于C—C键
(2)HF分子间能形成氢键,其熔化时需要的能量更多
(3)NaCl>KCl>RbCl>CsCl
(4)顶点、面心
(5)ρa3×10-21NA
解析 (3)NaCl、KCl、RbCl、CsCl中金属阳离子所带电荷数相同,半径逐渐增大,晶格能逐渐降低,因此熔点:NaCl>KCl>RbCl>CsCl。
(4)由题图可知,Fe2+位于晶胞的体心和棱心,位于晶胞的顶点和面心,若将由顶点转换成体心,则Fe2+与位置互换,Fe2+的位置转换为顶点、面心。
(5)CaF2晶胞中相邻的两个Ca2+的最近核间距是面对角线长度的一半,晶胞面对角线长度为2a nm,则晶胞棱长是a nm,设CaF2的摩尔质量为M g/mol,则ρ=,M=ρa3×10-21NA。
6.C 基态Fe原子的价电子排布式为3d64s2,失去2个电子后,转化为Fe2+,故A正确;Na+嵌入越多,导电性越好,根据晶胞结构可知,1个普鲁士蓝晶胞中含有4个Na+,1个普鲁士白晶胞中含有8个Na+,所以普鲁士蓝的导电能力小于普鲁士白,故B正确;1个普鲁士蓝晶胞中含有CN-的个数为24×+24×+6=24,Fe2+和Fe3+的总个数为8×+6×+12×+1=8,Na+的个数为4,则化学式为NaFe2(CN)6,其中CN-的化合价为-1价,Na+的化合价为+1价,Fe元素的平均化合价为+2.5价,则Fe2+与Fe3+的个数比为1∶1,故C不正确;1个普鲁士白晶胞中含有Na+的个数为8,Fe2+和Fe3+的总个数为8×+6×+12×
+1=8,CN-的个数为24×+24×+6=24,则普鲁士白的化学式可表示为NaFe(CN)3,故D正确。
7.答案 (1)< (2)C60是分子晶体,熔化时只要克服分子间作用力,石墨是混合型晶体,熔化时除要克服很强的共价键之外,还要克服分子间作用力 (3)12
(4)4
解析 (1)C60、苯是非极性分子,H2O是极性分子,则C60在水中溶解度小于C60在苯中溶解度。
(3)由晶胞结构可知,晶体中正四面体空隙有8个,正八面体空隙有4个,则该超导材料中,平均一个C60晶胞需掺杂12个M原子。
(4)根据“切割法”,石墨晶胞中碳原子分别位于顶点(8个)、棱心(4个)、面心(2个)和体内(1个),碳原子个数为4;石墨晶胞质量为 g,设晶胞底面边长为a cm,晶胞底面如图:,则有=r×sin 60°,可得a=r,底面菱形的高为a cm=r cm,底面积为r cm×r cm=r2 cm2,设晶胞的高为2b cm,所以晶胞体积为r2×2b cm3=3r2b cm3,晶体密度为ρ g·cm-3=,解得b=。
5
高考真题练
考点1 晶体的类型及性质
1.(2024山东,4)下列物质均为共价晶体且成键结构相似,其中熔点最低的是( )
A.金刚石(C)
B.单晶硅(Si)
C.金刚砂(SiC)
D.氮化硼(BN,立方相)
2.(高考组合)回答下列问题:
(1)(2023浙江1月选考,17节选)Si与P形成的某化合物晶体的晶胞如图。该晶体类型是 ,该化合物的化学式为 。
(2)(2023全国甲,35节选)如图所示的几种碳单质,它们互为 ,其中属于原子晶体的是 ,C60间的作用力是 。
(3)(2023山东,16节选)卤素可形成许多结构和性质特殊的化合物。-40 ℃时,F2与冰反应生成HOF和HF。常温常压下,HOF为无色气体,固态HOF的晶体类型为 。
考点2 晶体的结构及相关计算
3.(2024湖北,11)黄金按质量分数分级,纯金为24K。Au-Cu合金的三种晶胞结构如图,Ⅰ、Ⅱ和Ⅲ是立方晶胞。下列说法错误的是( )
A.Ⅰ为18K金
B.Ⅱ中Au的配位数是12
C.Ⅲ中最小核间距Au—Cu
4.(2024安徽,14)研究人员制备了一种具有锂离子通道的导电氧化物(LixLayTiO3),其立方晶胞和导电时Li+迁移过程如图所示。已知该氧化物中Ti为+4价,La为+3价。下列说法错误的是( )
A.导电时,Ti和La的价态不变
B.若x=,Li+与空位的数目相等
C.与体心最邻近的O原子数为12
D.导电时,空位移动方向与电流方向相反
5.(2024黑、吉、辽,14)某锂离子电池电极材料结构如图。结构1是钴硫化物晶胞的一部分,可代表其组成和结构;晶胞2是充电后的晶胞结构;所有晶胞均为立方晶胞。下列说法错误的是( )
A.结构1钴硫化物的化学式为Co9S8
B.晶胞2中S与S的最短距离为a
C.晶胞2中距Li最近的S有4个
D.晶胞2和晶胞3表示同一晶体
6.(2023湖南,11)科学家合成了一种高温超导材料,其晶胞结构如图所示,该立方晶胞参数为a pm。阿伏加德罗常数的值为NA。下列说法错误的是 ( )
A.晶体最简化学式为KCaB6C6
B.晶体中与K+最近且距离相等的Ca2+有8个
C.晶胞中B和C原子构成的多面体有12个面
D.晶体的密度为 g·cm-3
7.(2023辽宁,14)晶体结构的缺陷美与对称美同样受关注。某富锂超离子导体的晶胞是立方体(图1),进行镁离子取代及卤素共掺杂后,可获得高性能固体电解质材料(图2)。下列说法错误的是( )
A.图1晶体密度为72.5/(NA×a3×10-30) g·cm-3
B.图1中O原子的配位数为6
C.图2表示的化学式为LiMg2OClxBr1-x
D.Mg2+取代产生的空位有利于Li+传导
8.(高考组合)按要求填空:
(1)(2024全国甲,35节选)结晶型PbS可作为放射性探测器元件材料,其立方晶胞如图所示。其中Pb的配位数为 。设NA为阿伏加
德罗常数的值,则该晶体密度为 g·cm-3(列出计算式)。
(2)(2024黑、吉、辽,18节选)负载在TiO2上的RuO2催化活性高,稳定性强。TiO2和RuO2的晶体结构均可用如图表示,二者晶胞体积近似相等,RuO2与TiO2的密度比为1.66,则Ru的相对原子质量为 (精确至1,已知:Ti的相对原子质量为48)。
9.(高考组合)回答下列问题:
(1)(2023全国乙,35节选)一种硼镁化合物具有超导性能,晶体结构属于六方晶系,其晶体结构、晶胞沿c轴的投影图如图所示,晶胞中含有 个Mg。该物质化学式为 ,B-B最近距离为 。
(2)(2023新课标,29节选)合成氨催化剂前驱体(主要成分为Fe3O4)使用前经H2还原,生成α-Fe包裹的Fe3O4。已知α-Fe属于立方晶系,晶胞参数a=287 pm,密度为7.8 g·cm-3。则α-Fe晶胞中含有Fe的原子数为 (列出计算式,阿伏加德罗常数的值为NA)。
(3)(2023全国甲,35节选)AlF3结构属立方晶系,晶胞如图所示,F-的配位数为 。若晶胞参数为a pm,晶体密度ρ= g·cm-3(列出计算式,阿伏加德罗常数的值为NA)。
(4)(2023山东,16节选)一定条件下,CuCl2、K和F2反应生成KCl和化合物X。已知X属于四方晶系,晶胞结构如图所示(晶胞参数a=b≠c,α=β=γ=90°),其中Cu化合价为+2。上述反应的化学方程式为 。若阿伏加德罗常数的值为NA,化合物X的密度ρ= g·cm-3(用含NA的代数式表示)。
考点3 超分子
10.(2024湖北,15)科学家合成了一种如图所示的纳米“分子客车”,能装载多种稠环芳香烃。三种芳烃与“分子客车”的结合常数(值越大越稳定)见表。下列说法错误的是( )
芳烃 芘 并四苯 蒄
结构
结合常数 385 3 764 176 000
A.芳烃与“分子客车”可通过分子间相互作用形成超分子
B.并四苯直立装载与平躺装载的稳定性基本相同
C.从分子大小适配看“分子客车”可装载2个芘
D.芳烃π电子数越多越有利于和“分子客车”的结合
11.(2024黑、吉、辽,9)环六糊精(D-吡喃葡萄糖缩合物)具有空腔结构,腔内极性较小,腔外极性较大,可包合某些分子形成超分子。图1、图2和图3分别表示环六糊精结构、超分子示意图及相关应用。下列说法错误的是( )
A.环六糊精属于寡糖
B.非极性分子均可被环六糊精包合形成超分子
C.图2中甲氧基对位暴露在反应环境中
D.可用萃取法分离环六糊精和氯代苯甲醚
高考模拟练
应用实践
1.C3N4和Si3N4晶体结构相似,是新型的非金属高温陶瓷材料。下列说法正确的是( )
A.C3N4和Si3N4晶体中N的化合价均为+3
B.C3N4熔、沸点小于Si3N4
C.C3N4晶体的硬度比Si3N4晶体的硬度大
D.C3N4和Si3N4晶体均为分子晶体
2.新型二维共价晶体材料在光电、催化、新能源以及生物医学等领域中的应用具有重要意义,硒和钒形成的晶体就是其中的一种,晶体中硒原子和钒原子是分层排布的,如图是该晶体微观结构的透视图。
下列有关说法正确的是( )
A.基态硒原子的价电子排布式为3d104s24p4
B.该晶体应该具有较高的熔点
C.假设俯视图中菱形的面积为s m2,则该晶体单位面积质量为
g/m2
D.该晶体的化学式为VSe
3.氧化铈(CeO2)是一种重要的光催化材料,光催化过程中立方晶胞的组成变化如图所示。假设CeO2晶胞边长为a pm,下列说法不正确的是( )
A.基态O原子的价电子排布式为2s22p4
B.CeO2晶体结构中每个Ce4+周围距离最近且相等的Ce4+有12个
C.CeO2晶胞中Ce4+与距离最近的O2-的核间距为a pm
D.每个CeO2-x晶胞中Ce4+个数为1-2x
4.(不定项)氟化镁的一种晶胞具有典型的四方晶系结构(如图所示),已知以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,晶胞中B原子分数坐标为(0.81,0.19,0.5),晶胞有对称中心。下列说法正确的是 ( )
A.白球表示镁原子
B.与氟化钙晶胞结构相同
C.C原子分数坐标为(0.19,0.81,0.5)
D.晶胞中B、C两原子之间的核间距为0.62a pm
5.现有几组物质的熔点(℃)数据:
A组 B组 C组 D组
金刚石:3 550 Li:181 HF:-83 NaCl
硅晶体:1 410 Na:98 HCl:-115 KCl
硼晶体:2 300 K:64 HBr:-89 RbCl
二氧化硅:1 732 Rb:39 HI:-51 CsCl
(1)A组中硅晶体的熔点低于金刚石,原因是
。
(2)C组中HF相对分子质量小于HCl,但熔点却高于HCl,是由于 。
(3)D组晶体中NaCl、KCl、RbCl、CsCl的熔点由高到低的顺序为 。
(4)FeS2晶体的晶胞如图1所示,与NaCl的晶胞结构相似。若将由顶点转换成体心,则Fe2+的位置转换为 。
CaF2的晶胞如图2所示,密度为ρ g/cm3,相邻的两个Ca2+的最近核间距为a nm,则CaF2的摩尔质量为 g/mol(列出代数式,
设NA为阿伏加德罗常数的值)。
迁移创新
6.某水性钠离子电池电极材料由Na+、Fe2+、Fe3+、CN-组成,随着立方晶胞嵌入和嵌出Na+,Fe2+与Fe3+的含量发生变化,依次变为格林绿、普鲁士蓝、普鲁士白三种物质,其过程如图。下列说法不正确的是( )
A.基态Fe原子的价电子排布式为3d64s2,失去4s电子转化为Fe2+
B.普鲁士蓝的导电能力小于普鲁士白
C.普鲁士蓝中Fe2+与Fe3+的个数比为1∶2
D.普鲁士白的化学式可表示为NaFe(CN)3
7.富勒烯是一类完全由碳组成的中空分子,在催化、光电等很多领域都有重要作用。
Ⅰ.C60以其完美的球烯受到科学家重视,其结构如图所示。60个碳原子是等同的,均为近似sp2杂化,但却有两种不同类型的碳碳键。其中一种为138 pm,另一种为145 pm。
(1)C60在水中溶解度 (填“>”“<”或“≈”)C60在苯中溶解度。
(2)石墨、C60互为同素异形体,但相同条件下,石墨的熔点比C60高得多,原因是
。
Ⅱ.C60常态下是紫色固体,不导电,但给富勒烯掺杂金属后(用金属原子把富勒烯分子连起来或者把金属原子放进富勒烯“笼子”里),其在一定条件下甚至可以成为超导体。
(3)C60晶体结构中存在四面体空隙(如图中1、3、6、7围成的空隙)和八面体空隙(如图中3、6、7、8、9、12围成的空隙),所有空隙均填充一个金属M原子,可获得某条件下的超导材料,则该超导材料中,平均一个C60晶胞需掺杂 个M原子。
(4)C60、石墨、金刚石互为同素异形体。石墨晶体结构及晶胞如图1、图2所示。则石墨晶胞中含碳原子个数为 。已知石墨的密度为ρ g·cm-3,C—C键键长为r cm,阿伏加德罗常数的值为NA,计算石墨晶体的层间距d为 cm。
答案与分层梯度式解析
综合拔高练
高考真题练
1.B 一般结构相似的共价晶体,原子半径越小,形成的共价键键长越短,键能越大,晶体熔点越高。原子半径:Si>B>C>N,单晶硅(Si)中Si—Si键键长最长,键能最小,晶体熔点最低,故选B。
2.答案 (1)共价晶体 SiP2 (2)同素异形体 金刚石 范德华力 (3)分子晶体
解析 (1)由题中晶胞图可知,该晶体为空间网状结构,属于共价晶体;从晶胞图中原子的分布可知,Si在晶胞的顶点与面心,因此1个晶胞中Si的个数为8×+6×=4,P都在晶胞内部,共8个,所以Si、P原子个数比为1∶2,该化合物的化学式为SiP2。(2)题图中的四种物质为碳元素的不同单质,它们互为同素异形体。这四种物质中金刚石属于原子晶体(共价晶体),石墨属于混合型晶体,碳纳米管是一种管状的纳米级石墨晶体,C60属于分子晶体。C60属于分子晶体,故C60间的作用力是范德华力。(3)常温常压下 HOF为无色气体,说明其沸点低,可推知固态HOF为分子晶体。
C 24K金的质量分数为100%,则18K金的质量分数为×100%
=75%;Ⅰ中,Au位于体心,个数为1,Cu位于顶点,个数为8×=1,Ⅰ中Au与Cu的个数比为1∶1,其中Au的质量分数为×100%≈75%,故Ⅰ为18K金,A正确。Ⅱ中,与Au距离最近且相等的Cu位于相邻面心上,个数为3×8×=12,故Au的配位数为12,B正确。Ⅲ中Au—Cu的最小核间距为面对角线长度的,Au—Au的最小核间距也为面对角线长度的,故最小核间距Au—Cu=Au—Au,C错误。由A项分析可知,Ⅰ中Au与Cu的个数比为1∶1;Ⅱ中Au位于顶点,个数为8×=
1,Cu位于面心,个数为6×=3,Au与Cu的个数比为1∶3;Ⅲ中Cu位于顶点,个数为8×=1,Au位于面心,个数为6×=3,Au与Cu的个数比为3∶1,D正确。
B 导电时,Li+迁移至空位,Li+的价态不变,则Ti和La的价态也不变,A正确;该导电氧化物(LixLayTiO3)中Ti为+4价,La为+3价,若x=,依据化合物中各元素正、负化合价代数和为0,可得×(+1)+
y×(+3)+4+3×(-2)=0,y=,由立方晶胞(LixLayTiO3)图可知,晶胞中含O2-数为12×=3,Ti4+数为8×=1,La3+、Li+、空位共同占据体心,总数为1,则空位数=1--=,与Li+数目不相等,B错误;与体心最邻近的O原子在晶胞的棱心上,数目为12,C正确;导电时,Li+迁移至空位,电流移动方向与Li+迁移方向相同,则与空位移动方向相反,D正确。
B 根据“切割法”,结构1中S的个数为12×+1=4,Co的个数为4×+4=4.5,则结构1钴硫化物的化学式为Co9S8,A正确;晶胞2中S与S的最短距离为面对角线长度的一半,为a,B错误;如图:
,以图中圆圈圈起来的Li为例,与其最近的S共4个,C正确;如图:,当2个晶胞2放在一起时,图中蓝框截取的部分就是晶胞3,晶胞2和晶胞3表示同一晶体,D正确。
6.C 1个晶胞中的K原子数为8×=1,Ca原子数为1,B原子数为12×=6,C原子数为12×=6,故晶体最简化学式为KCaB6C6,A项正确;K+位于顶点,Ca2+位于体心,与K+最近且距离相等的Ca2+位于共用1个顶点的8个立方晶胞的体心,B项正确;晶胞中B和C原子构成的多面体有14个面,6个位于晶胞的面上,8个位于晶胞内部,垂直于体对角线,C项错误;由A项分析可知1个晶胞中有1个“KCaB6C6”,晶胞的体积为(a×10-10)3 cm3,质量为(×1)g,晶体密度为 g·cm-3,即 g·cm-3,D项正确。
7.C 根据“切割法”计算,图1晶胞中含有1个Cl,1个O,3个Li,密度ρ= g·cm-3= g·cm-3,A项正确;图1中与氧原子距离最近( pm)的Li有6个,则O原子的配位数为6,B项正确;图2晶胞中含有1个Li,Mg或空位共2个,1个O,Cl或Br共1个,根据化合物中各元素正、负化合价代数和为0,得Mg有1个,所以化学式为LiMgOClxBr1-x,C项错误;Mg2+取代Li+后,产生的空位可供
Li+移动传导电荷,增强导电性,D项正确。
8.答案 (1)6 (2)101
解析 (1)与Pb原子距离最近且距离相等的S原子的个数为6,则Pb的配位数为6;PbS晶胞中含有4个Pb和4个S,该晶体的密度为 g·cm-3。(2)TiO2和RuO2的晶体结构相同,晶胞体积近似相等,其密度之比等于相对分子质量之比,又TiO2的相对分子质量为80,则RuO2的相对分子质量=80×1.66≈133,Ru的相对原子质量为133-32=101。
9.答案 (1)1 MgB2 a
(2)
(3)2
(4)CuCl2+4K+2F2 K2CuF4+2KCl
解析 (1)Mg原子占据晶胞8个顶点,故1个晶胞中含有Mg原子数目为4×+4×=1,根据c轴投影图可知,1个晶胞内部有2个B原子,故Mg、B原子个数之比为1∶2,其化学式为MgB2;题给c轴投影图中B原子占据等边三角形的中心,如图所示,B—B键键长为B原子中心到O点的距离的两倍,易求得B原子中心到O点的距离为a,则两个B原子间最近距离为a。(2)设晶胞中含Fe原子数为N,则密度ρ= g·cm-3=7.8 g·cm-3,得出N=。(3)由题图可知,1个该晶胞中顶点处粒子的数目为8×=1,棱心处粒子的数目为12×=3,故顶点处粒子为Al3+,棱心处粒子为F-,距F-最近且等距离的Al3+的数目为2,故F-的配位数为2。晶胞质量为 g= g,晶胞体积为(a×10-10)3 cm3,晶体密度为 g·cm-3。(4)由题给晶胞结构可知,1个晶胞中,“”有8×+2×1=4个,“”有16×+2×1+4×=8个,“”有8×+1=2个,故化合物X中含有3种原子,且原子最简整数比为2∶4∶1,根据原子守恒,化合物X中一定含有Cu和F,且Cu为+2价,故化合物X中还含有K,其化学式为K2CuF4,反应的化学方程式为CuCl2+4K+2F2
K2CuF4+2KCl。依据ρ=,得ρ= g·
cm-3= g·cm-3。
B “分子客车”能装载多种稠环芳香烃,芳烃与“分子客车”通过分子间相互作用形成超分子,A项正确;“分子客车”的长为
2.2 nm、高为0.7 nm,平躺装载时更稳定,B项错误;2个芘分子与“分子客车”长度大小适配,故“分子客车”可装载2个芘,C项正确;芘、并四苯、蒄中π电子数逐渐增多,与“分子客车”的结合常数逐渐增大,而结合常数越大越稳定,故芳烃π电子数越多越有利于和“分子客车”结合,D项正确。
11.B 1 mol糖水解后能产生2~10 mol单糖的称为寡糖,由环六糊精结构可知,环六糊精属于寡糖,A正确;非极性分子与环六糊精形成超分子时,分子直径大小应与环六糊精空腔大小接近,B错误;根据题图3可知,在环六糊精中,与HOCl反应主要生成,说明题图2中甲氧基的对位暴露在反应环境中,C正确;环六糊精含多个羟基,可与水形成分子间氢键,故环六糊精能溶于水中,而氯代苯甲醚不溶于水,可用水作萃取剂分离环六糊精和氯代苯甲醚,D正确。
高考模拟练
1.C N元素的电负性大于C元素和Si元素,在C3N4和Si3N4中,N元素显-3价,A错误;C3N4和Si3N4均为新型的非金属高温陶瓷材料,都是共价晶体,C原子半径小于Si原子半径,则键长C—N
素养解读 能从微观层面判断晶体的构成微粒以及微粒间的作用力,明确影响晶体性质的因素,能从宏观和微观相结合的视角分析与解决实际问题,体现了宏观辨识与微观探析的化学学科核心素养。
2.B 一般主族元素的价电子只包括最外层电子,硒在周期表中的位置是第4周期ⅥA族,基态Se原子的价电子排布式为4s24p4,A错误;该共价晶体中Se原子与V原子以共价键连在一起,熔化时需克服共价键,具有较高的熔点,B正确;菱形中Se原子个数为2,V原子个数为1,则该晶体单位面积质量为 g/m2= g/m2,C错误;根据C项分析,可知该晶体的化学式为VSe2,D错误。
3.D 基态O原子的价电子排布式为2s22p4,故A正确;由晶胞结构可知,以任一顶点的Ce4+为研究对象,距离其最近的Ce4+位于该顶点所在的三个面的面心,一个顶点被8个晶胞共用,则每个Ce4+周围距离最近且相等的Ce4+的个数为=12,故B正确;CeO2晶胞中Ce4+与距离最近的O2-的核间距为晶胞体对角线长度的,即a pm,故C正确;假设CeO2-x中的Ce4+和Ce3+的个数分别为m、n,m+n=1,由化合物中元素正、负化合价代数和为0可得4m+3n=4-2x,解得m=1-2x,由晶胞结构可知,位于顶点和面心的Ce4+、Ce3+共有8×+6×=4个,所以每个晶胞中Ce4+的个数为4-8x,故D不正确。
4.CD 题给晶胞中白球的数目为2+4×=4,黑球的数目为1+8×=2,即黑球与白球的个数比为1∶2,由氟化镁的化学式MgF2可知,白球表示氟原子,故A错误;氟化钙的晶胞结构为,与氟化镁的晶胞结构不同,故B错误;根据晶胞中B原子分数坐标为(0.81,
0.19,0.5),晶胞含对称中心,可知C原子分数坐标为(0.19,0.81,
0.5),故C正确;由B、C原子分数坐标可知,B、C两原子之间的核间距为a pm-×0.19a pm×2=0.62a pm,故D正确。
5.答案 (1)二者均为共价晶体,原子半径Si大于C,键长Si—Si键大于C—C键,故键能Si—Si键小于C—C键
(2)HF分子间能形成氢键,其熔化时需要的能量更多
(3)NaCl>KCl>RbCl>CsCl
(4)顶点、面心
(5)ρa3×10-21NA
解析 (3)NaCl、KCl、RbCl、CsCl中金属阳离子所带电荷数相同,半径逐渐增大,晶格能逐渐降低,因此熔点:NaCl>KCl>RbCl>CsCl。
(4)由题图可知,Fe2+位于晶胞的体心和棱心,位于晶胞的顶点和面心,若将由顶点转换成体心,则Fe2+与位置互换,Fe2+的位置转换为顶点、面心。
(5)CaF2晶胞中相邻的两个Ca2+的最近核间距是面对角线长度的一半,晶胞面对角线长度为2a nm,则晶胞棱长是a nm,设CaF2的摩尔质量为M g/mol,则ρ=,M=ρa3×10-21NA。
6.C 基态Fe原子的价电子排布式为3d64s2,失去2个电子后,转化为Fe2+,故A正确;Na+嵌入越多,导电性越好,根据晶胞结构可知,1个普鲁士蓝晶胞中含有4个Na+,1个普鲁士白晶胞中含有8个Na+,所以普鲁士蓝的导电能力小于普鲁士白,故B正确;1个普鲁士蓝晶胞中含有CN-的个数为24×+24×+6=24,Fe2+和Fe3+的总个数为8×+6×+12×+1=8,Na+的个数为4,则化学式为NaFe2(CN)6,其中CN-的化合价为-1价,Na+的化合价为+1价,Fe元素的平均化合价为+2.5价,则Fe2+与Fe3+的个数比为1∶1,故C不正确;1个普鲁士白晶胞中含有Na+的个数为8,Fe2+和Fe3+的总个数为8×+6×+12×
+1=8,CN-的个数为24×+24×+6=24,则普鲁士白的化学式可表示为NaFe(CN)3,故D正确。
7.答案 (1)< (2)C60是分子晶体,熔化时只要克服分子间作用力,石墨是混合型晶体,熔化时除要克服很强的共价键之外,还要克服分子间作用力 (3)12
(4)4
解析 (1)C60、苯是非极性分子,H2O是极性分子,则C60在水中溶解度小于C60在苯中溶解度。
(3)由晶胞结构可知,晶体中正四面体空隙有8个,正八面体空隙有4个,则该超导材料中,平均一个C60晶胞需掺杂12个M原子。
(4)根据“切割法”,石墨晶胞中碳原子分别位于顶点(8个)、棱心(4个)、面心(2个)和体内(1个),碳原子个数为4;石墨晶胞质量为 g,设晶胞底面边长为a cm,晶胞底面如图:,则有=r×sin 60°,可得a=r,底面菱形的高为a cm=r cm,底面积为r cm×r cm=r2 cm2,设晶胞的高为2b cm,所以晶胞体积为r2×2b cm3=3r2b cm3,晶体密度为ρ g·cm-3=,解得b=。
5
