第3章 专题强化练4 晶体类型判断与晶体性质
文档属性
| 名称 | 第3章 专题强化练4 晶体类型判断与晶体性质 |

|
|
| 格式 | docx | ||
| 文件大小 | 94.8KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-10-28 18:08:36 | ||
图片预览

文档简介
专题强化练4 晶体类型判断与晶体性质
1.下列有关晶体的说法中一定正确的是( )
①共价晶体中只存在非极性共价键 ②稀有气体形成的晶体属于共价晶体 ③干冰晶体升华时,分子内共价键会发生断裂 ④金属元素和非金属元素形成的化合物一定是离子化合物 ⑤分子晶体的堆积方式均为分子密堆积 ⑥离子晶体和金属晶体中均存在阳离子,但金属晶体中不存在离子键 ⑦金属晶体和离子晶体都能导电
A.①③⑦ B.只有⑥ C.②④⑤⑦ D.⑤⑥
2.具有下列原子序数的各组元素,能形成化学式为AB2型化合物,并且该化合物在固态时为共价晶体的是( )
A.6和8 B.20和17
C.14和6 D.14和8
3.卤化钠(NaX)和四卤化钛(TiX4)的熔点如图所示,下列判断不正确的是( )
A.TiF4的熔点反常升高是由于其键能较大
B.NaX均为离子晶体
C.随X半径的增大,NaX的晶格能减小,熔点逐渐降低
D.TiCl4、TiBr4、TiI4的相对分子质量依次增大,范德华力逐渐增大,熔点逐渐升高
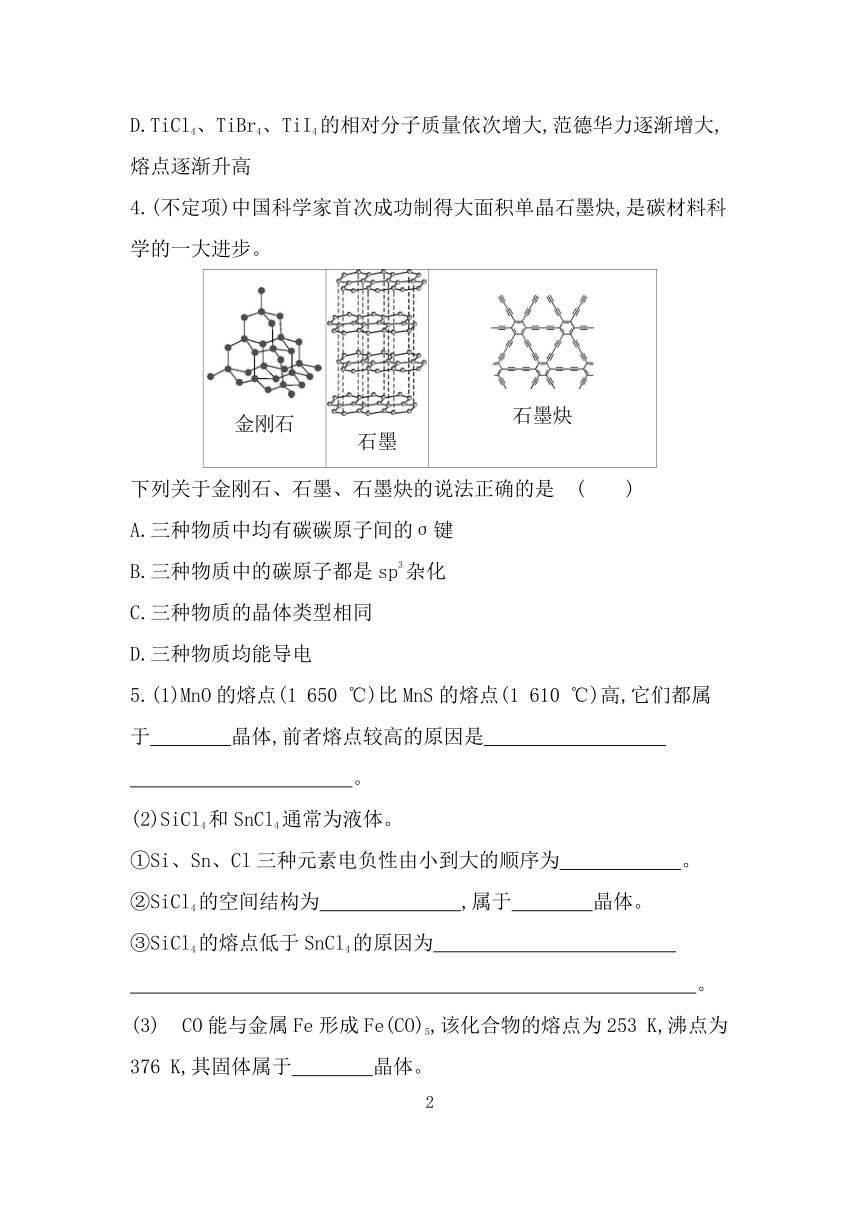
4.(不定项)中国科学家首次成功制得大面积单晶石墨炔,是碳材料科学的一大进步。
金刚石 石墨 石墨炔
下列关于金刚石、石墨、石墨炔的说法正确的是 ( )
A.三种物质中均有碳碳原子间的σ键
B.三种物质中的碳原子都是sp3杂化
C.三种物质的晶体类型相同
D.三种物质均能导电
5.(1)MnO的熔点(1 650 ℃)比MnS的熔点(1 610 ℃)高,它们都属于 晶体,前者熔点较高的原因是
。
(2)SiCl4和SnCl4通常为液体。
①Si、Sn、Cl三种元素电负性由小到大的顺序为 。
②SiCl4的空间结构为 ,属于 晶体。
③SiCl4的熔点低于SnCl4的原因为
。
CO能与金属Fe形成Fe(CO)5,该化合物的熔点为253 K,沸点为
376 K,其固体属于 晶体。
(4)NF3可由NH3和F2在Cu催化作用下反应直接得到:4NH3+3F2 NF3+3NH4F。上述化学反应涉及的五种物质所属的晶体类型有 (填字母)。
a.离子晶体 b.分子晶体
c.共价晶体 d.金属晶体
答案与分层梯度式解析
专题强化练4 晶体类型判断与晶体性质
1.B 共价晶体中也可能存在极性键,如SiO2,①错误;稀有气体分子属于单原子分子,形成的晶体属于分子晶体,②错误;干冰属于分子晶体,升华时破坏的是范德华力,不是共价键,③错误;金属元素与非金属元素形成的化合物不一定是离子化合物,如AlCl3是共价化合物,④错误;分子晶体的堆积方式不一定均为分子密堆积,如冰,每个水分子与周围4个水分子结合,不是分子密堆积,⑤错误;离子晶体是由阴、阳离子通过离子键形成的晶体,金属晶体是金属原子通过金属键形成的晶体,所以金属晶体中不存在离子键,⑥正确;离子晶体中没有自由移动的离子,不能导电,金属晶体能导电,⑦错误。
2.D
原子序数 元素 AB2型化合物 晶体类型
A 6 C CO2 分子晶体
8 O
B 20 Ca CaCl2 离子晶体
17 Cl
C 14 Si 不能形成AB2型化合物
6 C
D 14 Si SiO2 共价晶体
8 O
3.A 非金属性F>Cl>Br>I,TiF4属于离子晶体,而TiCl4、TiBr4、TiI4属于分子晶体,一般离子晶体的熔点高于分子晶体,A错误;NaX中只含有离子键,均为离子晶体,B正确;NaX是离子晶体,随X半径的增大,NaX的晶格能减小,熔点逐渐降低,C正确;TiCl4、TiBr4、TiI4均为分子晶体,故随着相对分子质量依次增大,范德华力逐渐增大,熔点逐渐升高,D正确。
4.A 三种物质中均存在碳碳原子间的σ键,A项正确;金刚石中所有碳原子均采用sp3杂化,石墨中所有碳原子均采用sp2杂化,石墨炔中苯环上的碳原子采用sp2杂化,碳碳三键上的碳原子采用sp杂化,B项错误;金刚石为共价晶体,石墨为混合型晶体,C项错误;金刚石中没有自由移动的电子,不能导电,D项错误。
5.答案 (1)离子 O2-半径小于S2-半径,MnO中所含的离子键强 (2)①Sn解析 (1)MnO、MnS的熔点都非常高,都属于离子晶体。(2)①一般,元素的非金属性越强,电负性越大,所以Si、Sn、Cl三种元素电负性由小到大的顺序为Sn2
1.下列有关晶体的说法中一定正确的是( )
①共价晶体中只存在非极性共价键 ②稀有气体形成的晶体属于共价晶体 ③干冰晶体升华时,分子内共价键会发生断裂 ④金属元素和非金属元素形成的化合物一定是离子化合物 ⑤分子晶体的堆积方式均为分子密堆积 ⑥离子晶体和金属晶体中均存在阳离子,但金属晶体中不存在离子键 ⑦金属晶体和离子晶体都能导电
A.①③⑦ B.只有⑥ C.②④⑤⑦ D.⑤⑥
2.具有下列原子序数的各组元素,能形成化学式为AB2型化合物,并且该化合物在固态时为共价晶体的是( )
A.6和8 B.20和17
C.14和6 D.14和8
3.卤化钠(NaX)和四卤化钛(TiX4)的熔点如图所示,下列判断不正确的是( )
A.TiF4的熔点反常升高是由于其键能较大
B.NaX均为离子晶体
C.随X半径的增大,NaX的晶格能减小,熔点逐渐降低
D.TiCl4、TiBr4、TiI4的相对分子质量依次增大,范德华力逐渐增大,熔点逐渐升高
4.(不定项)中国科学家首次成功制得大面积单晶石墨炔,是碳材料科学的一大进步。
金刚石 石墨 石墨炔
下列关于金刚石、石墨、石墨炔的说法正确的是 ( )
A.三种物质中均有碳碳原子间的σ键
B.三种物质中的碳原子都是sp3杂化
C.三种物质的晶体类型相同
D.三种物质均能导电
5.(1)MnO的熔点(1 650 ℃)比MnS的熔点(1 610 ℃)高,它们都属于 晶体,前者熔点较高的原因是
。
(2)SiCl4和SnCl4通常为液体。
①Si、Sn、Cl三种元素电负性由小到大的顺序为 。
②SiCl4的空间结构为 ,属于 晶体。
③SiCl4的熔点低于SnCl4的原因为
。
CO能与金属Fe形成Fe(CO)5,该化合物的熔点为253 K,沸点为
376 K,其固体属于 晶体。
(4)NF3可由NH3和F2在Cu催化作用下反应直接得到:4NH3+3F2 NF3+3NH4F。上述化学反应涉及的五种物质所属的晶体类型有 (填字母)。
a.离子晶体 b.分子晶体
c.共价晶体 d.金属晶体
答案与分层梯度式解析
专题强化练4 晶体类型判断与晶体性质
1.B 共价晶体中也可能存在极性键,如SiO2,①错误;稀有气体分子属于单原子分子,形成的晶体属于分子晶体,②错误;干冰属于分子晶体,升华时破坏的是范德华力,不是共价键,③错误;金属元素与非金属元素形成的化合物不一定是离子化合物,如AlCl3是共价化合物,④错误;分子晶体的堆积方式不一定均为分子密堆积,如冰,每个水分子与周围4个水分子结合,不是分子密堆积,⑤错误;离子晶体是由阴、阳离子通过离子键形成的晶体,金属晶体是金属原子通过金属键形成的晶体,所以金属晶体中不存在离子键,⑥正确;离子晶体中没有自由移动的离子,不能导电,金属晶体能导电,⑦错误。
2.D
原子序数 元素 AB2型化合物 晶体类型
A 6 C CO2 分子晶体
8 O
B 20 Ca CaCl2 离子晶体
17 Cl
C 14 Si 不能形成AB2型化合物
6 C
D 14 Si SiO2 共价晶体
8 O
3.A 非金属性F>Cl>Br>I,TiF4属于离子晶体,而TiCl4、TiBr4、TiI4属于分子晶体,一般离子晶体的熔点高于分子晶体,A错误;NaX中只含有离子键,均为离子晶体,B正确;NaX是离子晶体,随X半径的增大,NaX的晶格能减小,熔点逐渐降低,C正确;TiCl4、TiBr4、TiI4均为分子晶体,故随着相对分子质量依次增大,范德华力逐渐增大,熔点逐渐升高,D正确。
4.A 三种物质中均存在碳碳原子间的σ键,A项正确;金刚石中所有碳原子均采用sp3杂化,石墨中所有碳原子均采用sp2杂化,石墨炔中苯环上的碳原子采用sp2杂化,碳碳三键上的碳原子采用sp杂化,B项错误;金刚石为共价晶体,石墨为混合型晶体,C项错误;金刚石中没有自由移动的电子,不能导电,D项错误。
5.答案 (1)离子 O2-半径小于S2-半径,MnO中所含的离子键强 (2)①Sn
